Recientemente se publicó el artículo "Características de los pacientes con cáncer de pulmón (CP) de célula no pequeña en el Instituto Nacional de Cancerología (INC)", un estudio descriptivo de corte transversal donde se describieron diversas variables clínicas, histopatológicas y de biología molecular en una cohorte de 392 pacientes. En general, el 54% tenía antecedente de exposición al tabaco y el 40% no los refirió. En este subgrupo, el 86% tuvo adenocarcinomas (ACPs) y la mayoría fueron mujeres (=65%) 1. Estos datos son consistentes con diversos estudios que han revelado que el CP en personas nunca fumadoras representa entre el 25 y 40% 2. Lo anterior se debe principalmente a la baja prevalencia de exposición en las mujeres asiáticas (5.2-25%) versus las caucásicas europeas y norteamericanas, donde esta relación supera el 53% y 91%, respectivamente 2-5. En paralelo, la proporción de pacientes con CP de células no pequeñas (CPCNP) nunca fumadores ha aumentado significativamente durante los últimos 30 años, siendo del 16% en 1970 y del 33% en el año 2000 5.
La tendencia creciente para el aumento del CPCNP entre los no fumadores podría ser atribuible a la exposición al humo de segunda mano 6, debido al humo por combustión de leña 7,8, por susceptibilidad genética 9-11, exposición ocupacional y ambiental 12, por diversos inductores hormonales 13, la presencia de enfermedad pulmonar preexistente 14 , e incluso, la infección por tuberculosis 15 y por el virus del papiloma humano 16. Por otra parte, numerosos estudios de epidemiología molecular han demostrado que el ACP en nunca fumadores está asociado con múltiples alteraciones oncogénicas potencialmente modulables 17-19. En Asia se ha encontrado que =90% de los pacientes con este fenotipo albergan mutaciones especificas, cifra que en Europa puede alcanzar el 60% 20.
En contraposición, el CPCNP derivado del consumo de tabaco presenta una mayor carga mutacional, variaciones somáticas de un solo nucleótido (SNVs) y una mayor frecuencia de transversiones 21. En la serie del INC, Alarcón y colaboradores encontraron una población real de pacientes EGFR positivos del 35.7%, dato superior al encontrado por nuestro grupo tras el análisis de 5.038 pacientes (21.5%, IC95% 20.4-22.6%) 22. En igual dirección, Alarcón reportó una frecuencia real de traslocaciones en ALK del 35.7%, cifra extrema considerando el global obtenido en América Latina (6.8%) 23. Nuestra información actualizada (N = 1.612) evidenció una frecuencia para dicha traslocación del 9.9% (IC95% 8.5-11.4%) 22 (Figura 1), similar a la descrita en México, Costa Rica, Chile y Perú 23.
Recientemente, Howlader y colaboradores informaron una notable mejora en la supervivencia del CP, que pasó del 26% en los hombres y mujeres que se diagnosticaron en 2001 a 35% entre aquellos diagnosticados en 2014 24. La transformación histórica de la enfermedad parece atribuible a la inclusión de las terapias dirigidas y de la inmunoterapia 24. En Colombia, los inhibidores de PD-1 se introdujeron en 2016, específicamente como parte del tratamiento de 2a línea. El estudio de Alarcón informó que solo el 9% fue estudiado para PD-L1, lo que permite suponer una lenta introducción de la biomarcación y de la inmunoterapia como parte del tratamiento. Este valor es lejano al índice de penetración estimado para el sistema sanitario local (=40%) o regional 25. De forma similar, Velcheti estimó, a partir del análisis de 12.574 pacientes de Estados Unidos, que la evaluación de PD-L1 aumentó del 18% en 2015 al 71% en 2017 26. También Gelatti y colaboradores 25 reportaron que el 56.5% tenía un TPS para PD-L1 <1%, mientras el 25.6% y 17.8% estuvieron entre el 1-49% y >50%, respectivamente. En consonancia, el estudio EXPRESS encontró una prevalencia global de TPS >50% del 26%, cifra ligeramente inferior para las muestras obtenidas de Argentina, Canadá y Colombia (21.7%) 27. En nuestro caso y a partir del análisis de 1.450 muestras se encontró una positividad global del 57.9% (IC95% 55.4-60.5%) 22 (Figura 1).
Una de las mayores limitaciones del estudio del INC es la calidad de los datos. Ciento veintidós pacientes fueron excluidos y el 47.6% de las variables demográficas no tuvieron información. Dentro de los registros de vida real es importante contar con información confiable que refleje la supervivencia más allá de los caracteres epidemiológicos básicos 28. En nuestro caso, el análisis de 556 pacientes con CPCNP encontró una mediana para la supervivencia global (SG) de 14.9 meses (IC95%16.1-19.2) entre aquellos tratados antes de 2016, mientras la población intervenida después de ese año tuvo una SG de 33.0 meses (IC95% 27.4-38.6; P = 0.0001) (Figura 2) En igual dimensión, el anealisis estratificado según la presencia o no de alteraciones en EGFR/ALK, un estado de PD-L1 >50% o ninguno de los dos, arrojó diferencias estadísticamente significativas a favor de los portadores de las alteraciones genómicas modulables o de los sujetos con mayor susceptibilidad terapéutica a la inmunoterapia. La SG para los pacientes con alteraciones oncogénicas tratados en 1a línea con inhibidores de tirosin-quinasa fue de 49.9 meses (IC95% 43.2-56.5), para aquellos con PD-L1 >50% tratados en 1a o 2a línea con inhibidores de PD-1 fue de 33.5 meses (IC95% 29.5-37.4), y para los que no cumplieron ninguna de estas dos condiciones fue de 17.3 meses (IC95% 16.2-18.5; P=0.0001) (Figura 3). Estos hallazgos explican la considerable transición en el diagnóstico y tratamiento del CPCNP, revelando el impacto de la genotipificación sobre la SG.
Una vez comprendida la paradoja del cáncer de pulmón entre los hispanos, etnia con diagnósticos más tardíos y mejor SG 29, parece relativamente sencillo asimilar la ancestría de la enfermedad. Recientemente, Carrot-Zhang y colaboradores realizaron el análisis genómico y de la ascendencia de 1.153 pacientes con CPCNP de México y Colombia, encontrando asociaciones entre la ancestría nativo-americana (NAT) y el marco de las alteraciones somáticas, incluyendo la carga mutacional (TMB) y el compromiso de EGFR, KRAS y STK11 30. Un análisis adicional demostró que la ascendencia NAT se asoció con mutaciones en EGFR, pero no con múltiples mutaciones pasajeras, hallazgo que sugiere la presencia de un mecanismo subyacente que influyó sobre la aptitud biológica del tumor en lugar de una amplia mutagénesis (Figura 4). Esta información valida la necesidad de la biomarcación y explica en parte los orígenes de los ACPs de pulmón entre los latinos no fumadores.
Aunque Colombia no disponga de la mayoría de los avances biotecnológicos que han modificado la historia del CPCNP, el primer paso para demostrar la necesidad de cambio en la conciencia de acceso radica en conocer las características de nuestra población. Recientemente, Mascarenhas y colaboradores realizaron un análisis extensivo de 513 pacientes de Brasil, con CPCNP y evaluación poligénica exhaustiva (usando un panel comercial de NGS), 457 (89.1%) en tejido tumoral y 56 (10.9%) en ctDNA obtenido de plasma 31. En esta población, la mediana del número de genes mutados fue tres (0-14), la afectación molecular más frecuente fueron las SNVs (81%), seguido de las variaciones en el número de copias (CNVs, 48%), mutaciones con cambio en el marco de lectura (31.4%), indels (19.3%), mutaciones en el sitio de empalme (19.1%), y genes de fusión (12.5%). Globalmente, se identificaron mutaciones en TP53 (54%), KRAS (24%), EGFR (22.5%), STK11 (11.6%), PI3KCA (8.8%), reordenamientos de ALK en el 5.4%, y en menor proporción (<5%) alteraciones en BRAF, ERBB2, MET, RET, ROS1 y NTRK 31. Estos hallazgos son reproducibles en nuestro entorno, donde la validez y versatilidad de la NGS ya se demostró para el CPCNP 32.
La mayor enseñanza que pueden dejar nuestros nacientes intentos por generar información local valida y constructiva radica en la importancia de integrar los datos de forma unificada, para obtener registros de seguimiento que alberguen la heterogeneidad propia del entorno sanitario colombiano. Felicitamos a los autores de la casuística recopilada en el INC por aportar un poco más a la investigación clínica y de transferencia en cáncer de pulmón en Colombia.
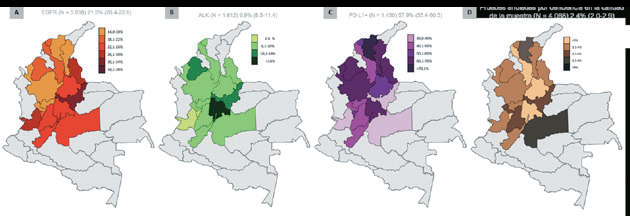
Figura 1 Epidemiología molecular de las mutaciones de EGFR (A), traslocaciones de ALK (B) y expresión de PD-L1 (C) en una serie de muestras representativas de la población colombiana (patologías seleccionadas del biobanco de la Fundación para la Investigación Clínica y Molecular Aplicada del Cáncer - FICMAC entre 2010 y 2019). La Figura 1D muestra la distribución de pruebas anuladas por deficiencia en la calidad de las muestras (manipulación preanalítica) que no excede el 2.4% a partir del análisis de 4.088 casos.
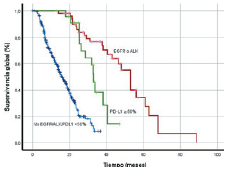
Figura 2 Supervivencia global (N = 456) discriminada por el año de diagnóstico (antes o después de 2016) en una cohorte de pacientes con CPCNP diagnosticados y tratados en Bogotá, Colombia (muestra correspondiente al registro monográfico de seguimiento de la Fundación para la Investigación Clínica y Molecular Aplicada del Cáncer - FICMAC). Las curvas se incluyen para ilustrar el impacto progresivo de la introducción de nuevos modelos de tratamiento basados en oncología de precisión.

Figura 3 Supervivencia global (N = 456) discriminada por el diagnóstico molecular (pacientes EGFR/ALK positivos, pacientes con TPS PD-L1 >50% y pacientes no EGFR/ALK y con PD-L1 <50%) y secuencia de intervención considerando particularmente la 1 a línea en una cohorte de pacientes con CPCNP diagnosticados y tratados en Bogotá, Colombia (muestra correspondiente al registro monográfico de seguimiento de la Fundación para la Investigación Clínica y Molecular Aplicada del Cáncer - FICMAC). Nótese el impacto significativo (P=0.0001) de las alteraciones genómicas en EGFR y ALK, al igual que la sobre expresión de PD-L1 sobre el desenlace hallazgo, que demuestra la importancia de la biomarcación y correcta selección terapéutica al momento del diagnóstico.
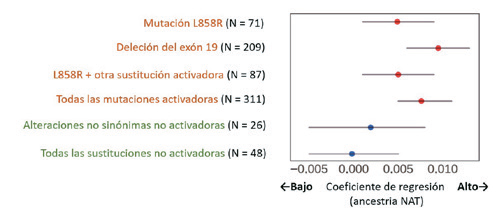
Figura 4 Mutaciones de EGFR en asociación con ascendencia NAT. Se utilizó un modelo de regresión logística, codificando los casos mutados de EGFR como "1" y otros casos con diversas alteraciones oncogénicas como "0", considerando las muestras originarias de Colombia (incluidos en el estudio inicial, ref. 30). Los coeficientes de regresión logística se indican con puntos y los IC95% se indican con líneas. Los puntos rojos representan las correlaciones con valores de P inferiores a 0.05. Se indica el tamaño de la muestra (n) para cada grupo de mutación de EGFR y su grado de asociación














