Introducción
El progreso en el diagnóstico y tratamiento de los niños con cáncer en las últimas décadas se considera como uno de los grandes logros de la medicina moderna; la mayoría de los pacientes alcanza la curación de su enfermedad maligna. En efecto, antes de los años setenta, eran pocas las esperanzas de curación 1, pero desde entonces la supervivencia ha aumentado notablemente, siendo mayor del 80% a 5 años en países afluentes 2-4. Consecuentemente, el número de supervivientes de cáncer infantil ha crecido de manera importante. En Europa, se estima que de 300.000 a 500.000 adultos son supervivientes de cáncer infantil 3 y que alrededor de 1 de cada 640 adultos jóvenes en ese continente es superviviente 3. El sistema de vigilancia epidemiológica y resultados finales -SEER-de Estados Unidos, proyecta para el 2020 alrededor de 500.000 personas con el antecedente de cáncer infantil 5.
Si bien para Colombia, y en general para Latinoamérica, no existen estimaciones de la prevalencia de supervivientes de cáncer infantil, la probabilidad de supervivencia de cáncer infantil también ha aumentado progresivamente. En Colombia, durante los períodos entre 1995-1999 y 2010-2014, la supervivencia neta a cinco años aumentó en un 10% para los niños con leucemia linfoide aguda, pasando de 52.3% (95% IC 43.5-61.2) a 68.9% (95% IC 51.6-86.3) 6, gracias a la universalización del sistema de salud, mayor disponibilidad de tecnología diagnóstica, mayor disponibilidad de medicamentos (permitiendo la implementación de regímenes multimodales y más intensivos), mejores cuidados de soporte y banco de sangre, y también al aumento del recurso humano capacitado 7-9.
Junto con las mejoras en la supervivencia, se manifiestan los eventos adversos tardíos asociados al tratamiento 10. Se estima que dos tercios de estos supervivientes de cáncer infantil van a experimentar un evento adverso crónico en salud 11, frecuentemente asociado a morbilidad considerable e incluso riesgo de muerte prematura 12. El reconocimiento de las consecuencias médicas y no médicas de estos tratamientos ha llevado a hacer ajustes terapéuticos con el fin de disminuir secuelas y discapacidades a largo plazo 13.
En los años ochenta y noventa, varios centros especializados en cáncer y hospitales pediátricos iniciaron programas de seguimiento a largo plazo para describir mejor las secuelas relacionadas con el tratamiento y así brindar mejor atención a los supervivientes de cáncer infantil. En 2006, el Instituto de Medicina de Estados Unidos publicó el reporte "From cancer patient to cancer survivor: Lost in transition"14, en donde destacan los desafíos a largo plazo, las necesidades y las brechas en la atención que enfrentan los supervivientes de cáncer. La principal recomendación del informe fue que los supervivientes deben tener un plan de atención de seguimiento a largo plazo. Este plan de seguimiento incluye consultas médicas, pruebas de tamizaje periódicas, tratamiento de las secuelas, educación, orientación e investigación continua; todo orientado al bienestar del adulto superviviente 15.
Aunque se han venido implementando estrategias de seguimiento a supervivientes de cáncer infantil en países de altos ingresos, en Colombia se han realizado pocos esfuerzos para la implementación de estas estrategias. Varios factores contribuyen a esto, entre ellos, cuatro son de gran peso:
La baja probabilidad de supervivencia de estos pacientes, que hasta mediados de la década del noventa era <35%. Por ejemplo, en Cali (según el Registro Poblacional de Cáncer de la ciudad), la sobrevida global a 5 años de la cohorte de pacientes de 1991 a 1996 fue del 31.6 ± 3.2% 9.
La escasez de recurso humano capacitado. Si bien para el seguimiento de supervivientes no es necesario exclusivamente que los oncólogos pediatras estén a cargo de la consulta médica, estos especialistas resultan imprescindibles en el impacto de la supervivencia de estos pacientes. Hasta hace 10 años, los especialistas en oncología pediátrica no pasaban de 50 en todo el territorio nacional 16,17.
La transición temprana entre el cuidado en la adolescencia de los pacientes, a la medicina de adultos, aumenta la probabilidad de pérdidas en el seguimiento. Esto debido a que la definición del alcance de la oncología pediátrica hasta los 15 años de edad fue la norma hasta el 2010, cuando se expide la Ley 1388 de "Cáncer infantil" 18.
Finalmente, la información sobre los efectos tardíos de los tratamientos es relativamente reciente. Esto debido a que estos efectos han sido progresivamente documentados luego del seguimiento por más de 10 años de grandes cohortes de pacientes de países afluentes 15.
Estos factores hacen que los esfuerzos se concentren en mejorar la efectividad de los tratamientos y optimizar el uso del recurso humano para lograr llegar a una curación; por lo que el seguimiento a largo plazo se ha considerado menos prioritario. En Colombia, la práctica común en la mayoría de los centros de tratamiento consiste en dar de alta al niño que cumple 5 años de seguimiento oncológico, sin instrucciones precisas para el seguimiento.
El objetivo del presente trabajo es argumentar sobre la necesidad de diseñar e implementar estrategias de seguimiento para supervivientes de cáncer infantil en el contexto colombiano. Para alcanzar ese propósito, este artículo se divide en tres partes. Primero, un apartado donde se hace una revisión teórica acerca de los efectos adversos tardíos que pueden llegar a desarrollar los supervivientes de cáncer infantil. En un segundo apartado se revisan las principales estrategias de seguimiento que se han implementado a nivel mundial, con especial énfasis en los países europeos y en Norte América. Finalmente, se analizan los retos que habrá que enfrentar al intentar un programa de seguimiento en el país. Se concluye afirmando la importancia de considerar que, en Colombia, cada vez son más los niños con cáncer que se curan y, por tanto, ameritan recibir un seguimiento a largo plazo para mejorar su calidad de vida.
I. Supervivientes de cáncer infantil: ¿qué viene después de la cura?
Una característica especial de los supervivientes de cáncer infantil es que la aparición y el tratamiento de la enfermedad ocurren durante la etapa de crecimiento y desarrollo de los niños y/o adolescentes. Es este periodo de rápida expansión celular, que hace que los tejidos sanos del niño sean más susceptibles al efecto de los diferentes medicamentos utilizados para el cáncer, se produce una mayor probabilidad de aparición de efectos adversos tardíos asociados al tratamiento. Se reconoce que los diferentes tipos de tratamientos utilizados para el cáncer, especialmente los citostáticos y la radioterapia, tienen efectos adversos con tiempos de latencia largos, de tal modo que se presentan tardíamente; inclusive >10 años después de haber sido aplicados. Los niños, al tener la posibilidad de alcanzar una mayor expectativa de vida luego de ser expuestos a estos agentes, pueden experimentar efectos adversos con periodos de latencia extensos que puedan manifestarse clínicamente. Además de lo anterior, la mayor expectativa de vida de estos pacientes hace que, una vez manifestado clínicamente el efecto adverso, el superviviente tendrá que vivir más tiempo con la alteración de la calidad de vida que este efecto produzca. Esto, a diferencia de los cánceres en adultos, que en general se diagnostican a partir de la quinta década de vida, implica que los supervivientes tendrán 20 a 30 años de periodo de riesgo para desarrollar algún evento adverso tardío. Eventos tardíos que ocurrirán a edades avanzadas, cuando coexistan con comorbilidades, entre otras, como la enfermedad cardiovascular, la diabetes y la obesidad.
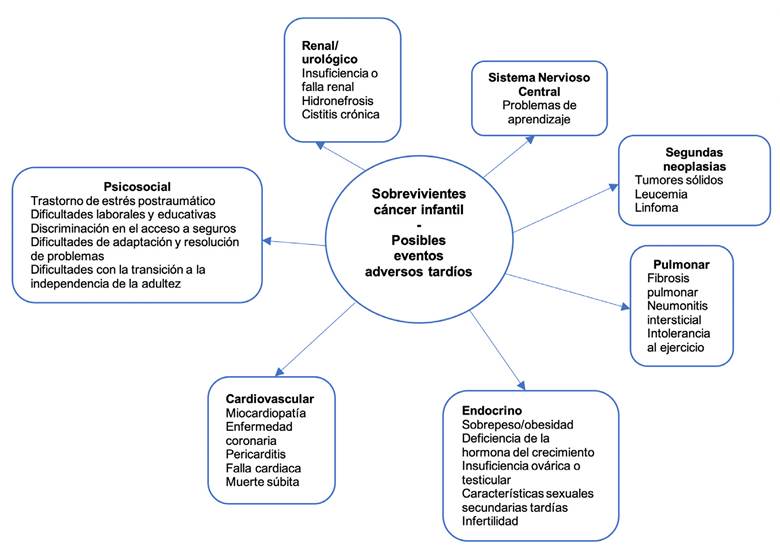
El rango de eventos adversos para los supervivientes de cáncer infantil es muy amplio, afectando casi cualquier órgano, sistema, tejido o función, con una etiología variable, tiempo de presentación, severidad y complejidad relativos 11. La aparición de estos efectos tardíos surge varios años después y depende del tipo de tratamiento recibido. Algunos de estos eventos adversos tardíos pueden llegar a ser tan graves que pueden disminuir la expectativa de vida de los supervivientes (por ejemplo: segundas neoplasias, cardiomiopatía, síndrome metabólico, falla renal crónica), otros pueden afectar la calidad de vida y la adaptación social del superviviente (por ejemplo: alteraciones cognitivas, alteraciones del comportamiento, ceguera, sordera, esterilidad, osteonecrosis, talla baja, hipotiroidismo) 11,19-22 (ver Figura 1). Estas consideraciones continúan siendo relevantes, teniendo en cuenta que la mayor parte de los tratamientos actuales en cáncer infantil continúan utilizando combinaciones de medicamentos desarrollados entre las décadas de los años cincuenta a los setenta. Esto ocurre a diferencia del tratamiento en adultos, donde los esquemas de tratamiento se han desarrollado con mayor celeridad. Se ha intentado ajustar los protocolos del tratamiento oncológico pediátrico buscando disminuir la toxicidad sin perder la efectividad 23. De los avances más importantes en este sentido han sido, entre otros: la exclusión de la radioterapia de muchos protocolos, mejoría en las técnicas y el uso de dosis más bajas de radioterapia 24,25, limitar las dosis acumuladas de antraciclinas y de agentes alquilantes, la exclusión del etopósido en la mayoría de los protocolos 26, el cambio de cisplatino por otros derivados del platino menos ototóxicos, mejoría en las técnicas de aplicación local de quimioterapia para preservar la visión 27 y mejoría en técnicas quirúrgicas para evitar la amputación de miembro afectado 28. Todo esto disminuirá la ocurrencia de algunos de estos efectos adversos tardíos, pero no los eliminará completamente. De todas formas, al incluir progresivamente nuevos medicamentos a los esquemas de tratamiento, se puede suponer la ocurrencia de efectos a largo plazo en el momento insospechados, que frecuentemente no son detectados en los estudios pivote realizados en adultos. Por todo lo anterior, el seguimiento de los supervivientes continúa siendo relevante para el superviviente, para los pacientes tratados en el momento y para la sociedad en general.
Por otra parte, los eventos adversos tardíos también pueden abarcar problemas psicológicos y sociales que incluyen trastornos de estrés postraumático, depresión y dificultades para conseguir trabajo. En efecto, en niños y adolescentes el diagnóstico y tratamiento del cáncer es un reto psicosocial único. La enfermedad ocurre justo en el momento del desarrollo de una identidad autónoma, de consolidar relaciones sociales y de escoger una carrera para lograr una independencia financiera 29. Confrontarse prematuramente con la muerte, con cambios en la apariencia física, con interrupciones en la vida social y escolar debido al tratamiento, así como las preocupaciones relacionadas con la salud en el futuro, hacen que se trate de una experiencia angustiante en un momento clave para el desarrollo psicosocial 30,31. Los supervivientes de cáncer infantil presentan más comúnmente depresión, ansiedad, síntomas de estrés postraumático y miedo a la recurrencia de un segundo cáncer 29. Debido a que la enfermedad mental a menudo se inicia por primera vez durante la adolescencia 32, los supervivientes de cáncer infantil pueden ser vulnerables al trauma de su experiencia de cáncer y al impacto de la terapia en su salud mental 33.
Vale la pena aclarar que, en Colombia, hasta la fecha no se ha realizado ningún estudio para evaluar los eventos adversos tardíos en supervivientes de cáncer infantil. Asumimos que, de acuerdo con los estudios realizados en Estados Unidos o en algunos países europeos como Países Bajos, Reino Unido y Francia 34 -donde se han implementado grandes cohortes de seguimiento a supervivientes de cáncer infantil-, los diferentes tipos de eventos adversos descritos en esa población no serán muy diferentes a los eventos adversos en la población colombiana. Esto debido a que los protocolos de tratamiento para el cáncer infantil empleados en el país están basados en las recomendaciones de los grupos grandes de oncología pediátrica a nivel mundial, como los diferentes grupos europeos: alemán, italiano, español, y el grupo americano Children's Oncology Group, quienes ya tienen resultados aprobados para ser utilizados. Incluso, el grupo europeo en algunas patologías, tiene guías establecidas para países en vías de desarrollo (por ejemplo, el protocolo de la Société Internationale d'Oncologie Pédiatrique -SIOP, para neuroblastoma en países en vías de desarrollo) 35. De esta manera, es posible encontrar en nuestra población a supervivientes de cáncer infantil con ceguera después de la enucleación por un retinoblastoma, con amputación de una pierna por un osteosarcoma, con una falla cardiaca por haber recibido altas dosis de antraciclinas, con cáncer de seno como segunda neoplasia por la radioterapia recibida durante el tratamiento por un linfoma de Hodgkin, entre otros.
El hecho de que todavía no se hayan caracterizado los eventos adversos en la población de supervivientes de cáncer infantil colombianos, no significa que no existan. De ahí la necesidad de empezar a pensar en crear clínicas de seguimiento para esta población.
II. Estrategias de seguimiento para supervivientes de cáncer infantil
Existe un reconocimiento de que todos los supervivientes de cáncer infantil deben recibir un seguimiento de por vida 15,36,37. Sin embargo, sigue habiendo una falta de consenso sobre el entorno óptimo y la mejor estrategia para hacerlo. Con el fin de ayudar a los médicos a realizar este seguimiento a corto, mediano y largo plazo, se han venido desarrollando e implementando varias guías de práctica clínica, particularmente en países de altos ingresos. Entre los grupos que han desarrollado guías se encuentran: el Grupo de Oncología Infantil (Children's Oncology Group -COG-) 38, la Red Escocesa de Directrices Intercolegiales (Scotish Intercollegiate Guidelines Network -SIGN-) 39, el Grupo de Efectos Tardíos del Grupo de Cáncer y Leucemia Infantil del Reino Unido (Late Effects Group of the United Kingdom Children's Cancer and Leukaemia Group -UKCCLG-) 40 y el Grupo Holandés de Oncología Infantil (Dutch Childhood Oncology Group -DCOG-) 41. Estos esfuerzos han convergido en la creación del Grupo Internacional de Armonización de Guías sobre los efectos tardíos del cáncer infantil (International Late Effects of Childhood Cancer Guideline Harmonization Group -IGHG-). Esta es una iniciativa a nivel mundial que busca estandarizar la atención del seguimiento en este grupo de alto riesgo 42. La colaboración del IGHG realiza revisiones sistemáticas de la literatura, desarrolla resúmenes basados en evidencia, evalúa la evidencia mediante el uso de métodos establecidos por el Grupo Cochrane de Cáncer Infantil y formula recomendaciones para cada tema de la guía. Es así como el IGHG ha finalizado y publicado pautas relacionadas con la vigilancia de cáncer de seno, cardiomiopatía, insuficiencia ovárica prematura y toxicidad gonadal masculina, entre otros 43-46. El objetivo común de todos estos grupos es mejorar la salud y el bienestar a largo plazo de los supervivientes de cáncer infantil, adolescente y de adultos jóvenes optimizando su atención médica 47.
Existen varios modelos para llevar a cabo este seguimiento e implementar estas guías, la mayoría de los cuales se han adaptado de los modelos existentes para los supervivientes adultos de cáncer. Hasta la fecha, la mayoría del seguimiento a largo plazo de personas que han sobrevivido a enfermedades malignas cuando eran niños, en el Reino Unido y los Estados Unidos, ha sido realizado por oncólogos pediatras13. Aunque hay que advertir que los supervivientes de cáncer infantil no necesariamente deben ser vistos por un especialista en hematooncología para sus consultas de seguimiento. Lo que sí necesitan es ser vistos por un profesional en salud (médicos familiares, internistas, enfermeras, etc.) que entiendan su tratamiento anterior y los riesgos que pueden aparecer a raíz del tipo de cáncer y de tratamiento que recibieron los supervivientes. El método de seguimiento más común en el Reino Unido parece ser un enfoque basado en un centro oncológico con un fuerte énfasis en la oncología pediátrica. Otros modelos potenciales incluyen:
1). Modelos de estratificación del riesgo y de riesgo compartido: en este modelo, los pacientes se estratifican en riesgo bajo, moderado o alto según el tipo de quimioterapia que recibieron, si fueron tratados o no con radioterapia y si tuvieron trasplante de médula ósea o de células madre 48. Adicionalmente, en este modelo el seguimiento de los supervivientes se comparte entre diferentes profesionales de la salud. 2. Modelos de transición para la transferencia de la atención a un médico especialista más apropiado para la edad adulta de los supervivientes. 3). Atención comunitaria basada en entornos de atención primaria. 4). Atención oncológica para adultos en clínicas hospitalarias; y 5). Seguimiento dirigido por el paciente (mediante el cual el superviviente es responsable de buscar atención médica cuando se presentan síntomas particulares) 47.
Tal vez uno de los modelos más apropiados para llevar a cabo el seguimiento de supervivientes de cáncer infantil es el de riesgo estratificado y cuidado compartido, ya que en este modelo la atención a pacientes con antecedente de cáncer se brinda en cualquier momento a lo largo de la vida, por diferentes profesionales de la salud en función de la categoría de riesgo del paciente y sus preferencias 48. En el contexto de supervivientes de cáncer infantil, este es un aspecto importante a tener en cuenta ya que no todos los supervivientes van a necesitar seguimiento médico por el resto de la vida. En efecto, las recomendaciones generales se dan para llevar a cabo un seguimiento durante los 10 primeros años después del tratamiento. Dentro de las indicaciones para realizar seguimiento de por vida a supervivientes de cáncer infantil se encuentran: 1). Que el paciente tenga el antecedente de una anomalía genética. 2). Que presente masas no malignas posteriores a la aplicación de la quimioterapia. 3). Que el diagnóstico del cáncer haya ocurrido antes de los dos años de edad. 4). El tipo de tumor primario que haya tenido el paciente; y 5). Que haya sido expuesto a radioterapia 49.
Es importante recalcar que en América Latina no se han identificado, a la fecha, programas estandarizados de seguimiento o vigilancia a supervivientes de cáncer infantil. En efecto, de acuerdo con los hallazgos provenientes del diálogo deliberativo "Placing Childhood Cancer on the Global Child Health Agenda" (Suiza -2015) 50, que buscaba identificar problemas centrales, posibles soluciones y consideraciones clave en la implementación de estrategias nacionales de cáncer infantil en América Latina, hacen falta datos sobre la prevalencia de eventos adversos tardíos en pacientes supervivientes de cáncer infantil en países de medianos y bajos ingresos. Además, hay un débil consenso sobre la asignación de recursos para la atención de supervivientes de cáncer infantil en esta región. Por otra parte, la rigidez en los límites de edad en la atención médica pediátrica hace más difícil el seguimiento médico una vez el paciente cumple la mayoría de edad 50. Además, estos hallazgos son apoyados por los resultados de una revisión narrativa realizada por Paula Carolina Guzmán et al en 2020, donde se ratifica la ausencia de esos programas en la región 51. Generalmente, en estos casos, los supervivientes buscan atención médica cuando presentan los síntomas, y realmente no hay claridad dentro de los sistemas de salud sobre a qué pruebas de diagnóstico y a cuáles tratamientos tienen derecho los supervivientes de cáncer infantil 51.
III - Retos en la implementación del seguimiento para supervivientes de cáncer infantil
Uno de los grandes retos para brindar atención a largo plazo a los supervivientes de cáncer infantil es la pérdida en el seguimiento. En efecto, muchos pacientes dejan de recibir atención en centros médicos especializados. Un estudio retrospectivo, que evaluó los patrones en las pérdidas del seguimiento de supervivientes de cáncer infantil realizado en el Rosswell Park Cancer Institute en los Estados Unidos, mostró que la probabilidad de seguimiento de 1 a 5 años después del tratamiento era del 91,2% (89,7% -92,5%) pero se redujo al 68,5% (66,2% -70,8%) durante los siguientes 6 a 10 años; luego a 47,7% (45,0% -50,3%) durante los siguientes 11 a 15 años, porcentaje que continuó disminuyendo constantemente con el tiempo 52. Una de las principales razones para que esto suceda es la transición al cuidado del adulto, que puede convertirse en una barrera. En efecto, la falta de continuidad en los cuidados médicos recibidos en la infancia hasta la adultez genera una ruptura en la atención de los supervivientes de cáncer infantil. Muchos de ellos, al convertirse en adultos, asisten a controles médicos desconociendo en gran parte el tipo de tratamiento recibido. Por su parte, los médicos internistas o familiares que los ven en consultas médicas de control desconocen a su vez cómo enfocar la consulta y qué exámenes de tamizaje se les deberían pedir a personas con este antecedente. Algunos de los supervivientes asintomáticos pueden no darle importancia a seguir recibiendo consultas médicas de seguimiento. Esta adherencia a los controles también se dificulta por el desconocimiento del superviviente de los efectos tardíos que pueden desarrollarse a través del tiempo. Además, puede aparecer el miedo o temor del paciente frente a la posibilidad de recibir otro diagnóstico de cáncer o de la presencia de un efecto tardío grave. Finalmente, muchos pacientes desean sentirse "curados" y dejar el diagnóstico de cáncer en el pasado, lo que puede impedir que un superviviente de cáncer infantil busque atención de seguimiento 53,54.
Los supervivientes de cáncer infantil constituyen una población muy heterogénea, tanto por el tipo de cáncer que tuvieron como por el tipo de tratamiento recibido. Esto hace que las recomendaciones sobre las estrategias de seguimiento sean a su vez muy variadas. Pensar en implementar estrategias de seguimiento en supervivientes de cáncer infantil, en el contexto colombiano, conllevaría los siguientes retos adicionales: Primero, sería necesario llamar la atención a los tomadores de decisiones en salud sobre el número creciente de supervivientes de cáncer infantil en nuestro país y de las particularidades y necesidades de esta población. Es prioritario pensar en optimizar y garantizar una buena calidad de vida a estos niños, para que en su adultez puedan ser miembros económica y socialmente activos de la sociedad. Posteriormente, sería necesario formular guías de seguimiento, adaptando y estandarizando recomendaciones de documentos y de seguimiento desarrollados en países afluentes. Esto con el fin de establecer un modelo de seguimiento (por ejemplo, el modelo de estratificación del riesgo y de riesgo compartido) donde se describa qué profesionales de la salud deben estar a cargo del seguimiento a supervivientes de cáncer infantil, cómo enfocar la consulta médica, qué pruebas de laboratorio y/o exámenes médicos es necesario solicitar y cada cuánto. Debe describirse la ruta de atención, diagnóstico, manejo y rehabilitación de los eventos adversos tardíos más relevantes, tanto en frecuencia como en gravedad. En ese sentido, sería muy importante pensar cómo se generaría esa consulta de seguimiento por parte de las EPS y así autorizar los procedimientos y tratamientos requeridos por los supervivientes. Por otra parte, es imperativo educar a los profesionales de la salud en el cuidado y en la atención a los supervivientes de cáncer infantil. En Estados Unidos, algunas facultades de medicina ofrecen la posibilidad de entrenarse como "fellows" en seguimiento a supervivientes de cáncer, como es el caso del St. Jude Children's Research Hospital 55.
Conclusiones
En Colombia, la falta de seguimiento clínico sistemático, a largo plazo, de los supervivientes de cáncer infantil, conlleva a mayor morbilidad y mortalidad de estos pacientes en la adultez, además de mayores costos para el sistema de salud. En Colombia desconocemos el tipo de eventos adversos que desarrollan los supervivientes de cáncer infantil. Por estas razones, la implementación de estrategias de seguimiento a largo plazo deben ir de la mano con la investigación clínica de esta población. Siguiendo la línea estratégica número 4 del Plan Decenal para el control del cáncer en Colombia 2012-2021, es imprescindible mejorar la calidad de vida de los pacientes y supervivientes de cáncer 56. Con este objetivo, el Plan Decenal menciona el desarrollo de políticas dirigidas a la reincorporación laboral para supervivientes de cáncer del adulto. Consideramos que la inclusión de políticas de seguimiento médico y psicosocial a largo plazo, para los supervivientes de cáncer infantil, también se alinearía con este punto. No debemos perder de vista a los adultos que fueron tratados por cáncer en su infancia, debido a que estos se convierten en una población en riesgo y nos recuerda las palabras de Giulio D'Angio -profesor emérito de radioterapia oncológica de la Universidad de Pennsylvania y pionero en el tratamiento del cáncer infantil-: En cáncer, la cura no es suficiente.