Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Infectio
Print version ISSN 0123-9392
Infect. vol.10 no.1 Bogotá Jan./Mar. 2006
Asociación Colombiana de Neumología y Cirugía del Tórax
Asociación Colombiana de Medicina Crítica y Cuidado Intensivo
Asociación Colombiana de Infectología
1 Este artículo fue publicado en la Revista Colombiana de Inmunología, el 17 de marzo de 2005
2 Médico internista, neumólogo, intensivista; coordinador del comité
3 Médico internista, neumólogo, intensivista
4 Médico internista, neumólogo, intensivista
5 Médico microbiólogo
6 Médico infectólogo
7 Médico internista, cardiólogo, intensivista
8 Médico internista, neumólogo, intensivista
9 Médico internista, neumólogo, intensivista
10 Médico internista, neumólogo, intensivista
11 Médica anestesióloga, intensivista
Fecha de recepción: 10/11/2005; Fecha de aceptación; 22/02/2006
TRATAMIENTO DE LA NEUMONÍA HOSPITALARIA
Las dificultades terapéuticas y los pobres resultados en el manejo de la neumonía adquirida en el hospital son los primeros factores de la imprecisión diagnóstica para definir la presencia o la ausencia de infección y determinar los gérmenes causales. El contexto clínico real es imperfecto, lo cual genera sistemas caóticos en los que se toman decisiones de gran trascendencia. Un análisis de regresión logística múltiple para estudiar los factores que influyeron en la mortalidad, demostró que la terapia inadecuada estaba fuertemente asociada con la mortalidad con un riesgo relativo 5,8 veces mayor al compararla con los resultados de los que habían recibido tratamiento adecuado (1). De manera tal que las recomendaciones para el tratamiento son tan complejas y equívocas como el problema en sí mismo. Las guías de consenso para el tratamiento tienen como objetivo principal reducir a valores aceptables los niveles de incertidumbre. Es ampliamente conocido que la morbilidad asociada con los diversos espectros clínicos, el antecedente de enfermedades pulmonares, los patrones de susceptibilidad en lugares específicos, el tiempo de aparición de la infección, la seriedad de la infección, el uso previo de antibióticos y las restricciones para la formulación o contraindicación son factores que afectan la decisión terapéutica en cada caso y cuyo impacto se pondera de manera diferente.
La precisión diagnóstica requiere definir la enfermedad, diferenciar entre colonización e infección, y determinar el germen causal. El primer principio en la terapia antibiótica es tratar una enfermedad bien reconocida, lo que no siempre sucede en la neumonía hospitalaria por la superposición con otras enfermedades (edema pulmonar, SDRA, hemorragia alveolar, etc.); el segundo es orientar la terapia a un germen causal, lo cual no siempre es factible, por las dificultades para obtener el aislamiento bacteriano. Existe 30% de casos con terapia excesiva, es decir, sin neumonía y con antibióticos; otra proporción ligeramente menor de pacientes, con la indicación y sin antibióticos, y un porcentaje bastante grande de pacientes con diagnóstico adecuado pero con tratamiento incorrecto (1). Estas inexactitudes llevan a equívocos que terminan en la presión selectiva sobre las cepas, en el aumento de los costos y, en el peor de los casos, en la muerte del paciente. Hay consenso sobre la mayor probabilidad de mortalidad de los pacientes cuyo tratamiento empírico ha sido mal enfocado desde el principio (1).
En la actualidad, hay serias dudas sobre algunos aspectos relacionados con la credibilidad de los resultados de los exámenes microbiológicos como pilar para iniciar la terapia, la utilidad de los métodos invasivos para el diagnóstico, el cumplimiento de las guías de práctica clínica, el momento de inicio y la duración de la terapia, el uso de monoterapia o politerapia, los tipos de asociación, el aumento o la disminución del espectro o número de moléculas, la asociación de anaerobicidas, de antimicóticos, la iniciación de terapia anti- Staphylococcus aureus meticilino resistente (SAMR) y el conocimiento de los perfiles de la resistencia bacteriana.
De acuerdo con los actuales diagramas de flujo, lo más recomendable es iniciar los antibióticos ante la sospecha clínica, intentar el aislamiento bacteriano cualquiera que sea el método diagnóstico utilizado y revaluar las medidas iniciadas según los resultados de los cultivos. Por otra parte, cuando los resultados son negativos o inconclusos, la recomendación es continuar la terapia según las guías, especialmente en los casos de alta probabilidad de muerte. No obstante, esta última recomendación es la más empleada y la que genera mayor controversia (2).
Finalmente, las recomendaciones terapéuticas están limitadas por la debilidad de la evidencia que sustenta una recomendación confiable, ya que la mayoría de los estudios tienden a demostrar igualdad o superioridad de un antibiótico sobre otro, pero no sobre las diversas variables de desenlace clínicamente relevantes.
Consideraciones generales. Ante la sospecha clínica de neumonía hospitalaria y neumonía asociada con el respirador, se decide iniciar tratamiento dirigido si hay aislamiento bacteriano o presuntivo; si no lo hay, otros aspectos que se deben considerar son el tiempo de terapia, la dosis y las formas de administración, la monoterapia o politerapia y los métodos de seguimiento.
Para la elección de los antibióticos, se deben tener en cuenta los siguientes aspectos.
a. Patrones de susceptibilidad de los agentes etiológicos potenciales, de acuerdo con los datos epidemiológicos locales y los aportados por los sistemas de vigilancia de cada institución. En caso de que no existan, se debe tener en cuenta el perfil regional (18). El consenso recomienda que cada institución y cada región implementen programas de vigilancia epidemiológica.
b. Morbilidad asociada y uso previo de antibióticos u otros medicamentos.
c. Información específica de los exámenes directos y cultivos tomados de las secreciones respiratorias. d. Actividad intrínseca específica de los antibióticos sobre esos gérmenes.
e. Consideraciones farmacocinéticas y farmacodinámicas.
f. Factores farmacoeconómicos.
Tratamiento empírico. Los esquemas de inicio del tratamiento antibiótico para la neumonía hospitalaria y la neumonía asociada con el respirador generalmente son empíricos. El problema de iniciar una terapia empírica es la elección del mejor esquema para cada caso en particular y para esto hay una serie de variables del huésped, el agente y el ambiente que afectan esta decisión. En varias publicaciones se ha intentado brindar una aproximación racional a la mejor elección basada en la epidemiología local, la presencia o ausencia de factores de riesgo y el tiempo de estancia en el hospital y en la UCI. En este orden de ideas, la American Thorax Society (1) ha establecido criterios para definir los antibióticos que pueden emplearse, de acuerdo con la presencia o ausencia de factores de riesgo para microorganismos multirresistentes.
Una vez se haya tomado la decisión de iniciar el tratamiento, la forma de abordar el manejo se basa en la determinación de la existencia de factores de riesgo que hagan más probable la presencia de microorganismos multirresistentes en el hospedero o en el paciente.
Las siguientes condiciones se consideran factores de riesgo.
i. el uso de antibióticos en los 90 días anteriores al evento;
ii. l a hospitalización actual mayor de 5 días;
iii. la estimación de alta probabilidad de presencia de microorganismos multirresistentes por la alta prevalencia de los mismos en la comunidad, el hogar comunitario o el centro hospitalario, o cualquier otro contexto donde se encuentre el paciente;
iv. la presencia de factores de riesgo de neumonía asociada a los cuidados médicos ( health care associated pneumonia, HCAP);
v. la hospitalización de dos o más días en los 90 días anteriores;
vi. la aplicación de antibióticos por programa de hospitalización domiciliaria o diálisis en los 90 días anteriores, cuidados de heridas recientes en centros hospitalarios o exposición a familiares portadores de microorganismos multirresistentes, y
vii. los pacientes con inmunosupresión por enfermedad o medicamentos, que tienen riesgo de infección por gérmenes oportunistas.
De esta manera, se definen dos poblaciones: la primera, sin factores de riesgo para la infección por gérmenes multirresistentes y, la segunda, con alta probabilidad.
El tratamiento empírico inicial para los pacientes sin factores de riesgo, inicio temprano, independiente de la gravedad, es el siguiente: (tabla 20)

Aunque el consenso recomienda el uso de cefalosporinas de tercera generación, su uso ha demostrado aumento de la incidencia de beta -lactamasas de espectro extendido (BLEE), por lo cual debe evitarse su uso indiscriminado y, en el caso de hacerlo, tener en cuenta las medidas de aislamiento de contacto, para que los pacientes colonizados con dichos gérmenes después de su uso, no sean fuentes de diseminación en la institución.
Por el contrario, cuando existe algún factor de riesgo de infección por gérmenes multirresistentes y más de 5 días de hospitalización, la recomendación se hace considerando lo siguiente: (tabla 21)
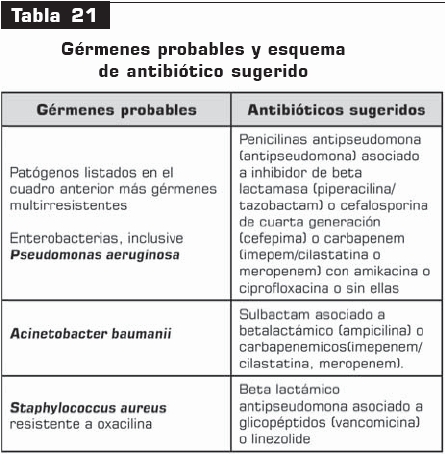
Recomendación. Aunque estos son los gérmenes probables y los antibióticos recomendados para ellos, el consenso no recomienda el inicio de tratamiento triconjugado, sino la selección de acuerdo con el juicio clínico y la prevalencia local de cada institución.
CONSIDERACIONES SOBRE LOS ANTIBIÓTICOS
La importancia de hacer una buena elección es fundamental en el pronóstico; la mortalidad es mayor cuando la elección es inadecuada. De acuerdo con los resultados de los estudios de análisis de regresión logística entre las variables de antibióticos elegidos y mortalidad, se encontraron diferencias estadísticamente significativas entre los grupos con tratamientos adecuados e inadecuados. Nivel de evidencia: IB. (2-8)
1. Impacto del tratamiento antibiótico
Tratamiento adecuado de pacientes con neumonía hospitalaria. Se considera que un tratamiento es adecuado cuando los antibióticos administrados para la enfermedad son aquéllos con actividad demostrada para los gérmenes causantes de la infección, en el tiempo y la dosis apropiados, con el menor riesgo de interacciones y toxicidad. El tratamiento adecuado de la neumonía hospitalaria reduce la mortalidad. Sterling et al., en un estudio de análisis de decisión clínica basado en el seguimiento de cohortes pareadas, demostraron que los pacientes tratados adecuadamente tenían una mortalidad de 45%, mientras que, en el caso contrario, la mortalidad aumentaba a 78% (9). Además, Celis y Moore demostraron en dos estudios diferentes que el tratamiento adecuado aumenta la supervivencia al doble (10, 11). Un estudio, diseñado para evaluar los factores de riesgo que influyeron en la mortalidad, reveló que la terapia inadecuada estaba fuertemente asociada con la mortalidad, con un riesgo relativo 5,8 veces mayor al compararla con un tratamiento adecuado (12). El exceso de mortalidad por el uso inadecuado de los antibióticos no se reduce al cambiar el tratamiento inicial con el resultado de los cultivos (13-15). Además, se encontró que un retraso mayor de 8 horas en el inicio de la terapia incrementa la mortalidad (OR = 7,68, IC 4,5 - 13,09) (15).
Administración de antibióticos en pacientes sin neumonía hospitalaria. El impacto del empleo de antibióticos en pacientes sin infección pulmonar adquirida en el hospital y el uso indiscriminado de los mismos aumentan la probabilidad de desarrollar neumonía en 28% y de morir por esta causa entre 53% y 71%, dado que incrementa la resistencia bacteriana por presión selectiva de la flora propia del paciente y de la existente en el entorno y el microambiente hospitalario.
2. ¿Qué antibióticos usar?
Tratamiento antibiótico sin aislamiento bacteriano. En este grupo de pacientes con diagnóstico de neumonía hospitalaria y neumonía asociada con el respirador hay varios factores que inciden en la decisión terapéutica inicial, que contemplan variables como el tiempo de estancia hospitalaria, la morbilidad asociada y los factores epidemiológicos propios de cada institución y el uso previo de antibióticos (1).
a. Estancia hospitalaria. De acuerdo con la definición dada en la sección de epidemiología, la selección del antibiótico depende en gran parte del tiempo de estancia hospitalaria.
b. Características del paciente y morbilidad asociada. Las características del paciente incluyen factores o enfermedades que pueden reducir la inmunidad o afectar la biodisponibilidad del medicamento. Para efectos del consenso, no se incluyen recomendaciones para huéspedes inmunocomprometidos, aunque es un factor que se debe tener en cuenta para los efectos terapéuticos, dada la alta probabilidad de infección por gérmenes oportunistas.
c. Epidemiología local. Hay evidencia suficiente de las diferencias en el perfil de susceptibilidad de los gérmenes entre instituciones e, incluso, entre servicios clínicos; por tanto, se recomienda que cada una conozca sus características microbiológicas, perfiles de resistencia y sus características epidemiológicas (17-22). El conocimiento de estos datos y la elección de los antibióticos en la terapia presuntiva mejora los resultados y reducen la morbimortalidad (8, 89).
d. Mantenimiento de la ecología hospitalaria. Aunque la efectividad de varias moléculas es similar, otro factor que se debe tener en cuenta es la capacidad de algunas de ellas para seleccionar gérmenes multirresistentes o para inducir mecanismos de resistencia, modificándolos de forma adversa y, por ende, disminuir las posibilidades terapéuticas en la atención de futuros pacientes. Dada la emergencia de resistencia en varias de las instituciones colombianas (17-22), el consenso recomienda el uso con precaución de imepenem ciprofloxacina, vancomicina y cefalosporinas de tercera generación, especialmente ceftazidime, por estar asociados a la presencia de Acinetobacter multirresistente, S. aureus resistente a la meticilina, Enterococcus resistente a la vancomicina, y enterobacterias productoras de beta lactamasas de amplio espectro (23-32). En caso de ser necesario su uso, se recomienda mantener un estricto cumplimiento del aislamiento de contacto desde el inicio, para evitar la posible diseminación de cepas multirresistentes.
e. Tratamiento dirigido. En los casos en los cuales sea posible hacer el aislamiento bacteriano, éste debe reorientar el manejo antibiótico de acuerdo con el perfil de susceptibilidad, teniendo en cuenta la interpretación adecuada del antibiograma. En la siguiente tabla 22, solamente se mencionan las recomendaciones antibióticas para los gérmenes multirresistentes.
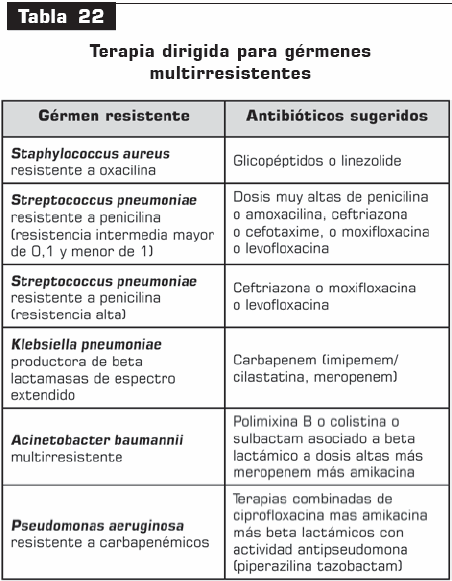
3. Monoterapia Vs. politerapia
La evidencia del empleo de monoterapia o de terapias combinadas es limitada. Por tanto, no hay consenso sobre la superioridad de una de las dos modalidades. Hay dos estudios (33) que demuestran que la asociación de aminoglicósidos a otro antibiótico no reduce la mortalidad ni genera ningún impacto sobre la aparición de resistencia en infecciones por Gram negativos, con riesgo relativo de 0,86 (IC95% 0,72 a 1,02) y de 0,95 (IC95% 0,84 a 1,24), respectivamente. Cometa no encontró ninguna ventaja en el empleo de la terapia combinada (imipemem asociado a netilmicina Vs. imipemem) (33). En un estudio de 140 pacientes con diagnóstico de neumonía asociada con el respirador que comparaba el meropenem con la ceftazidime más amikacina, se encontró superioridad de la monoterapia (68% Vs. 54,9%) (34).(tabla23)

No obstante, en los casos de infecciones pulmonares hospitalarias por Pseudomonas y Acinetobacter, hay dos estudios que demuestran mejores resultados con la terapia combinada que se evidencia por una mortalidad de 88% Vs. 35% (serie de casos) y, en otro estudio observacional con bacteriemia por Klebsiella, la mortalidad con terapia combinada fue de 24% Vs. 50% con la monoterapia (35, 36).
Hay dos estudios (37, 38) que refuerzan el empleo de la terapia combinada empírica en las infecciones hospitalarias en la UCI, por modelos matemáticos y por análisis de decisión de casos. En un análisis de decisión de Ost et al., el modelo matemático sugiere el uso de politerapia con beneficios sobre costo-efectividad y mortalidad (39).
La evidencia existente sobre el uso de la monoterapia Vs. la terapia con betalactámico más aminoglicósido o quinolona es insuficiente pues la mayoría de los estudios son series de casos con un número limitado de pacientes, cuyas únicas variables de desenlace son la mortalidad o la aparición de cepas multirresistentes. Sin embargo, por acuerdo entre expertos internacionales, la terapia combinada puede ser necesaria, al menos, en las fases iniciales y en los casos de neumonía grave, en aquellos casos con sospecha de Pseudomonas o Acinetobacter multirresistentes; además, no es claro que aporten valor agregado al pronóstico (evidencia: IC). La mayoría de los estudios que dan soporte a la terapia combinada se han realizado con betalactámicos de menor potencia que los disponibles en la actualidad. Por otra parte, no hay evidencia que sustente el empleo de la terapia combinada en las infecciones pulmonares hospitalarias causadas por gérmenes Gram negativos o positivos.
Recomendación del consenso. Con base en la información disponible para el tratamiento empírico de la neumonía hospitalaria y la neumonía temprana asociada con el respirador, el consenso recomienda el uso de monoterapia. Para el tratamiento de neumonía hospitalaria y neumonía tardía asociada con el respirador, se recomienda el uso de monoterapia o terapia combinada en aquellos casos con sospecha de gérmenes multirresistentes o más de un germen.
4. Utilidad de usar anaerobicidas
Dada la baja incidencia de anaerobios en la neumonía asociada con el respirador y en la neumonía por aspiración, el uso de antibióticos anaerobicidas no es necesario en forma rutinaria (evidencia C) (40).
5. Utilidad de usar glicopéptidos Sólo se justifica su uso en las infecciones pulmonares causadas por gérmenes Gram positivos, S. aureus resistente a oxacilina. No se aconseja su empleo rutinario, con la excepción de las instituciones con alta tasa de resistencia y cuyos pacientes tienen alto riesgo de colonización (estancia hospitalaria prolongada, uso prolongado de dispositivos intravasculares, uso previo de glicopéptidos, malas técnicas de aislamiento) (41).
Hay estudios doble ciego, aleatorizados, que no demuestran diferencias entre antiestafilocócicos, glicopéptidos o linezolide para la neumonía hospitalaria o la neumonía asociada con el respirador. Wunderink, en un análisis retrospectivo de dos estudios prospectivos aleatorizados doble ciego, comparó linezolide (600 mg) Vs. vancomicina (1 g dos veces al día) (7 a 21 días) y concluyó que el primero se asociaba con mejoría clínica y supervivencia, OR (razón de momios) = 3,3 (IC 1,3 a 8,3) en infecciones causadas por S. aureus resistente a la meticilina (41).
Recomendación del consenso. El consenso no recomienda el uso rutinario de anaerobicidas ni glicopéptidos en el inicio de la neumonía hospitalaria o de la neumonía asociada con el respirador, excepto en los grupos de pacientes con alta sospecha clínica de Staphylococcus aureus meticilino resistente (SAMR) o anaerobios. En caso de su inicio, puede seleccionarse cualquiera de los dos grupos de antibióticos para estafilococos (glicopéptidos o linezolide) y, para el caso de anaerobios, si el antibiótico inicial no tiene cobertura para dichos gérmenes, se puede adicionar clindamicina.
6. Utilidad de usar antimicóticos Dada la baja incidencia de infecciones micóticas hospitalarias en pacientes nmunocompetentes, no se justifica el uso rutinario de antimicóticos en el tratamiento empírico de la neumonía hospitalaria o la neumonía asociada con el respirador.
7. Formas de administración
Consideraciones farmacocinéticas y farmacodinámicas. Entre las condiciones que se deben tener en cuenta en la selección de un antibiótico, se resalta la importancia de lograr concentraciones adecuadas en el tejido pulmonar, no sólo para lograr la curación clínica sino para evitar la aparición de resistencia. En general, las moléculas recomendadas a las dosis recomendadas alcanzan concentraciones en el tejido pulmonar que superan las concentraciones inhibitorias mínimas (CIM) de los gérmenes frecuentes en la neumonía hospitalaria (42-51). Sin embargo, la penetración de los aminoglicósidos en las secreciones bronquiales es de 30% a 40% de los niveles séricos y, además, actúan mal a pH ácido lo que haría indeseable su empleo como monoterapia en neumonías hospitalarias. Los betalactámicos alcanzan el 50% de los niveles plasmáticos y las quinolonas y fluoroquinolonas presentan en los tejidos el máximo nivel de concentración que se puede lograr. El estado ideal es que los niveles en la secreción bronquial sean los más cercanos a los plasmáticos. Por otra parte, se recomienda, especialmente en los pacientes atendidos en cuidado intensivo, ajustar el uso de los antibióticos teniendo en cuenta las interacciones medicamentosas, la función renal, el uso de hemofiltros, el estado nutricional, etc. (52).
Los aspectos relacionados con la farmacodinamia de los antibióticos que implican su acción sobre los gérmenes, dependen de la naturaleza de la clase terapéutica (53). Los antibióticos se pueden clasificar en dependientes del tiempo o dependientes de la concentración. Los primeros se caracterizan porque su acción bactericida (o bacteriostática) depende del tiempo en que se obtengan concentraciones superiores a la CIM; es ideal mantenerlos 50% por encima de la CIM y se obtienen resultados óptimos cuando se consigue que la concentración en el tejido se mantenga en cuatro veces la CIM (52, 53). A este grupo pertenecen los betalactámicos y, en caso de buscar optimizar su manejo, se recomienda disminuir los intervalos de administración más que aumentar la dosis.
El otro grupo lo constituyen los antibióticos dependientes de la concentración; su efecto bactericida depende de la mayor concentración conseguida por encima de la CIM, sin importar el tiempo. La estrategia para optimizar la efectividad es incrementar la dosis para aumentar el pico de la misma, más que modificar los intervalos de administración. Este grupo lo constituyen las fluoroquinolonas y los aminoglicósidos (54-58).
Infusión intermitente Vs. infusión continua.
Varios autores han propuesto administrar los antibióticos betalactámicos en infusión continua, teniendo en cuenta el concepto de dependencia de tiempo para lograr concentraciones más estables y superiores a las conseguidas con la administración intermitente. Los resultados de estos estudios han mostrado que, efectivamente, sí se pueden lograr concentraciones similares y, en algunos casos, superiores o, al menos, mantener concentraciones tisulares y plasmáticas superiores a la CIM por un tiempo mayor; no obstante, no ha sido evidente el impacto de estas medidas sobre los resultados globales, dado que no se han reflejado en una mayor curación clínica. Otros estudios han demostrado beneficios farmacoeconómicos de la infusión continua por mejor costo-efectividad (59-72).
Hanes et al. compararon la dosis intermitente con la infusión continua con ceftazidime en pacientes con trauma (73). Se analizaron ambos esquemas de dosificación en función del tiempo sobre las CIM y los desenlaces terapéuticos. La comparación se hizo en un grupo de pacientes politraumatizados que se distribuyeron en dos grupos de manera aleatoria, para que recibieran dosis intermitente o infusión continua. A su vez, ambos grupos se compararon con un grupo de voluntarios sanos previamente estudiados. Los pacientes politraumatizados tenían incrementos significativos del volumen de distribución y depuración renal, al compararlos con el grupo de voluntarios sanos. El tiempo sobre las CIM fue de más de 92% para quienes habían recibido dosis intermitentes y los desenlaces fueron similares para ambos grupos. Por tanto, se concluye que los resultados de ambas modalidades de administración del antibiótico fueron similares. Sin embargo, los autores llaman la atención sobre el cuidado que se debe tener al extrapolar estos datos a bacterias tipo P. aeruginosa o Acinetobacter spp., que requieren CIM mayores que no se pueden obtener con esquemas de dosis intermitentes.
Recomendación del consenso. En resumen, la infusión continua en los pacientes críticos es una alternativa de administración de antibióticos dependiente del tiempo, considerando que los beneficios son por costo-efectividad. Sin embargo, se debe tener en cuenta la estabilidad de las moléculas usadas, especialmente en las regiones de Colombia con altas temperaturas.
8. Seguimiento y duración del tratamiento Por recomendación de los expertos, se ha establecido empíricamente que la duración del tratamiento sea de 14 a 21 días en la mayoría de los casos (11).
Lo anterior se basa en la presunción de presencia de bacterias tipo Pseudomonas spp. y S. aureus, cuyos tiempos de tratamiento son prolongados. Singh (74) demostró que limitar la duración de la terapia empírica a 3 días para pacientes con sospecha de neumonía hospitalaria o neumonía asociada con el respirador y con puntaje clínico de infección pulmonar (PICP) menor de 6 reducía la colonización y la infección por gérmenes resistentes. Ibrahim (75) demostró que la aplicación de una guía clínica incrementaba la frecuencia del tratamiento adecuado y reducía la duración de los antibióticos, con menos infecciones secundarias por gérmenes resistentes. Dennesen (76) sugirió que el mantenimiento de un tratamiento antibiótico adecuado por más de 7 días aumentaba la colonización por gérmenes resistentes.
En un estudio clínico aleatorizado, doble ciego, de 401 pacientes con neumonía asociada con el respirador, comprobada por microbiología, en 51 UCI de Francia, se comparó la efectividad del tratamiento adecuado por 8 días Vs. 15 días. No hubo diferencias significativas en cuanto al exceso de mortalidad 18,8% Vs. 17,2% (IC90% - 3,7 a 6,9) ni de infecciones recurrentes (28,9% Vs. 26%; IC - 3,2 a 9,1); los resultados de la eficacia fueron similares para ambos esquemas de duración del tratamiento. Sin embargo, hubo mayor frecuencia de resistencia bacteriana en el grupo que recibió el tratamiento más prolongado. El subgrupo de pacientes con infecciones por Gram negativos no fermentadores tuvo mayor incidencia de recurrencia con el tratamiento corto. No obstante, la recomendación de los autores es seguir el tratamiento por 8 días en todos los pacientes y hacer una vigilancia especial en pacientes con infección por microorganismos Gram negativos no fermentadores de lactosa (77).
El estudio más reciente es una investigación clínica aleatoria controlada, en la cual se evaluó un protocolo de suspensión de los antibióticos para los pacientes con sospecha clínica de neumonía asociada con el respirador, el cual se completó en 290 casos. No hubo diferencias significativas en los desenlaces de los episodios secundarios de neumonía asociada con el respirador, mortalidad hospitalaria y estancia. La conclusión es que el curso corto de antibióticos puede ser seguro (78).
Recomendación. La evidencia no justifica el uso de tratamientos prolongados. Los tratamientos cortos son tan seguros como los prolongados. Por lo tanto, el consenso recomienda suspender el tratamiento entre el 7º y el 8º día, si la respuesta clínica es la adecuada.
9. Impacto de terapias no antibióticas Hay estudios que han demostrado el papel de algunas citocinas como terapia coadyuvante. Se ha estudiado el factor de necrosis tumoral, las IL8, IL10 y IL12 y el factor estimulante de colonias granulocito macrófago. Algunas han demostrado potencial en reducir la mortalidad y están bajo investigación. La manipulación de la inmunidad es muy importante como terapia coadyuvante en los pacientes con inmunocompromiso o con inmunoparesia por infecciones graves (79).
El papel del factor estimulante de colonias de granulocitos en la neumonía hospitalaria grave ha sido motivo de controversia (80) y no existen tratamientos que demuestren éxito significativo, como tampoco hay consenso sobre el método óptimo ni sobre su duración.
Nathens et al. (81) evaluaron la efectividad de la administración temprana de alfatocoferol y ácido ascórbico para reducir el compromiso pulmonar y la disfunción multiorgánica en pacientes críticos. La justificación del estudio se basa en la contribución potencial del estrés oxidativo en el desarrollo del SDRA y la disfunción multiorgánica, ya sea por lesión directa o por activación de los genes responsables de la codificación de la producción de los mediadores de la respuesta inflamatoria sistémica. Los pacientes se distribuyeron al azar en dos grupos, los que recibieron los dos compuestos versus los de la terapia estándar. El desenlace primario del compromiso pulmonar fue el desarrollo de neumonía hospitalaria, SDRA o ambos, y los desenlaces secundarios fueron desarrollo de falla orgánica múltiple, tiempo de respiración asistida, estancia hospitalaria y mortalidad. Para los desenlaces de neumonía y SDRA, los resultados no fueron diferentes entre los dos grupos y el riesgo relativo de desarrollar compromiso pulmonar fue de 0,81 (IC95% 0,60-1,1), un valor considerado no significativo; por lo tanto, no fue un factor protector. Sin embargo, consiguió posicionarse como factor protector de desarrollo de disfunción multiorgánica (el riesgo relativo fue de 0,43 (IC 0,19-0,96)) y menor estancia hospitalaria.
Recomendación del consenso. Con base en la evidencia actual, no se recomienda su uso rutinario.
CONCLUSIÓN
Conceptos claves sobre el tratamiento antibiótico inicial
a. Empleo del algoritmo propuesto que separa los gérmenes según la ausencia o la presencia de factores de riesgo para patógenos multirresistentes.
b. Definir los períodos mayores de 5 días, la hospitalización en centros relacionados con el cuidado médico y la antibioticoterapia prolongada como factores de riesgo.
c. Elección de agentes específicos según la microbiología local, el costo, la disponibilidad y las restricciones de formularios.
d. Tratamiento de los pacientes con neumonía asociadaa centros de cuidados médicos como multirresistentes, independientemente del tiempo de evolución.
e. Terapia inadecuada como factor de riesgo de exceso de mortalidad y prolongación de la estancia hospitalaria.
f. Elección de otra clase terapéutica diferente a la que se venía empleando en la terapia empírica para quienes vienen en tratamiento antibiótico.
g. La demora en el inicio de la terapia se asocia con aumento de la mortalidad.
h. Inicio de la terapia empírica con base en los criterios de las tablas anteriores (18-20) pero haciendo ajustes de acuerdo con la epidemiología local.
Conceptos clave sobre las recomendaciones para el manejo antibiótico óptimo a. Dosis óptimas para asegurar la eficacia en la terapia empírica.
b. Inicio de terapia por vía intravenosa en todos los pacientes, con cambio a la vía oral cuando haya respuesta clínica adecuada y tracto digestivo funcional; las quinolonas y el linezolide poseen alta biodisponibilidad y puede pasarse fácilmente a la vía oral.
c. No hay pruebas que sustenten el empleo de antibióticos por inhalación; sin embargo, pueden ser terapia adyuvante en el manejo de pacientes con neumonías por Gram negativos que no responden a la terapia sistémica.
d. Se debe usar la terapia combinada si hay altas probabilidades de microorganismos multirresistentes.
e. Ningún dato ha comprobado superioridad de la terapia combinada sobre la monoterapia, excepto para aumentar la probabilidad de hacer un inicio adecuado de la terapia empírica.
f. Si hay respuesta, se deben suspender los aminoglicósidos a los 5 a 7 días como parte de la terapia combinada.
g. La monoterapia con agentes para microorganismos específicos puede estar indicada en casos de neumonía grave. Los pacientes en el grupo de riesgo anterior deben continuar con la terapia combinada hasta no demostrar que se puede utilizar un agente único.
h. Con tratamientos adecuados, debe hacerse el esfuerzo para acortar el tiempo de tratamiento de la recomendación clásica de 14 a 21 días, a períodos tan cortos como 7 días, siempre y cuando el patógeno causal no sea P. aeruginosa y bajo la condición de mejoría clínica con parámetros indicadores de resolución del problema.
Conceptos clave sobre recomendaciones para el manejo de gérmenes multirresistentes
a. Terapia combinada cuando se demuestra P. aeruginosa, dada la alta probabilidad de desarrollo de resistencia con la monoterapia.
b. Los carbapenemicos y el sulbactam son los agentes más activos para las especies de Acinetobacter; ningún dato ha comprobado mejores desenlaces con la terapia combinada.
c. En Gram negativos productores de beta lactamasas de amplio espectro, deben emplearse los carbapenems; se recomienda no administrar cefalosporinas de tercera o cuarta generación y penicilinas antiPseudomonas.
d. El linezolide es la alternativa de la vancomicina para el tratamiento de S. aureus resistente y mucho más recomendada cuando hay insuficiencia renal o nefrotoxicidad potencial.
e. Las restricciones de antibióticos limitan la aparición de epidemias por gérmenes multirresistentes. La heterogeneidad de las prescripciones y el uso cíclico pueden reducir la resistencia bacteriana.
Conceptos clave sobre las recomendaciones para el seguimiento y la valoración de la respuesta terapéutica
a. Valoración seriada de los parámetros clínicos para evaluar la respuesta al tratamiento.
b. Las modificaciones de la terapia empírica con base en los parámetros clínicos y los resultados microbiológicos.
c. La respuesta adecuada se observa a las 48 a 72 horas y no deben hacerse cambios en el tratamiento, a menos que las condiciones del paciente empeoren.
d. El que no haya respuesta se define el tercer día con base en la valoración seriada de los parámetros clínicos.
e. El paciente que responde se debe ajustar y enfocar con esquemas dirigidos con base en los resultados de los cultivos.
f. En quienes no responden, hay que evaluar otros diagnósticos diferenciales que simulan neumonía o considerar gérmenes oportunistas o infecciones en otra localización, resistencia bacteriana adquirida durante el tratamiento y complicaciones.
La terapia de las infecciones pulmonares hospitalarias es y será materia de controversia, dadas las limitaciones para adelantar investigaciones con resultados válidos que permitan hacer recomendaciones basadas en niveles aceptables de evidencia. El tema no acepta dogmas sino principios que deben seguirse con el fin de conseguir mejores resultados. Hasta el momento, no hay medidas eficaces que reduzcan la mortalidad, diferentes de las tendientes a evitar que la infección hospitalaria suceda; es por esto que el paciente que llega a la fase de tratamiento se puede considerar un fracaso en la medida en que no se pudo evitar la infección. No obstante, los pacientes que llegan a estas fases finales deben recibir la terapia con mayor efectividad y seguridad, teniendo como base la mejor evidencia disponible tomada de los estudios existentes.
REFERENCIAS
TRATAMIENTO
1. AMERICAN THORACIC SOCIETY. Hospital acquired pneumonia in adults: diagnosis, assessment of severity, initial antimicrobial therapy and preventative strategies. Am J Respir Crit Care Med. 1995;153:1711-25.
2. HEYLAND DK, COOK DJ, GRIFFITH L, KEENAN S, BRUN-BRUISSON C. The Attributable morbidity and mortality of ventilador-associated pneumonia in the critically ill patient. Am J Respir Crit Care Med. 1999;159:1249-56.
3. CELIS R, TORRES A, GATELL JM, ALMCLA M et al. Nosocomial pneumonia: a multivariate analisis of risk and prognosis. Chest. 1988;93:318-24.
4. KOLLEF MH, WARD S. The influence of mini-BAL cultures on patient outcomes implications for the antibiotic management of ventilator-associated pneumonia. Chest. 1998;113:412-20.
5. KOLLEF MH, SHERMAN G, WARD S, FRASER VJ. Inadequate antimicrobial treatment of infections. A risk factor for hospital mortality among critically ill patients. Chest. 1999;115:462-74.
6. LUNA CM, VUJACICH P, NIEDERMAN MS, VAY C, GHERARDI C, MATERA J, JOLLY EC. Impact of BAL data on the therapy and outcome of ventilator-associated pneumonia. Chest. 1997;111:676-85.
7. ALVAREZ-LERMA F, ICU acquired pneumonia study group. Modification of empiric antibiotic treatment in patients with pneumonia acquired in the intensive care unit. Intensive Care Med. 1996;22:387-94.
8. RELLO J, GALLEGO M, RARISCAL D, SOÑORA R, VALLES J. The value of routine microbiological investigation in ventilator-associated pneumonia. Am J Respir Crit Care Med. 1997;156:196-200.
9. STERLING TR, HO EJ, BRCHM WT, KIRKPATRICK MB. Diagnosis and treatment of ventilador-associated pneumonia-impact on survival: a decision analisis. Chest. 1996;110:1025-34.
. MOORE RD, SMITH CR, LIETMAN PS. Association of aminoglycoside plasma levels with therapeutic outcome in Gram negative pneumonia. Am J Med. 1984;77:657–62.
. CHASTRE J, FAGON JY. Ventilator associated pneumonia. State of the art. Am J Resp Crit Care Med. 2002;165:867-903.
. LUNA CM, VUJACICH P, NIEDERMAN MS, VAY C, GHERARDI C, MATERA J, JOLLY EC. Impact of BAL data on the therapy and outcome of ventilator-associated pneumonia. Chest. 1997;111:676-85.
13. KOLLEF MH, SHERMAN G, WARD S, FRASER VJ. Inadequate antimicrobial treatment of infections: a risk factor for hospital mortality among critically ill patients. Chest. 1999;115:462-74.
14. EVANS RS, PESTOTNIK SL, CLASSEN DC, CLEMMER TP, WEAVER LK, ORME JF JR, LLOYD JF, BURKE JP. A computer-assisted management program for antibiotics and other antiinfective agents. N Engl J Med. 1998;338:232-8.
15. DIEKEMA DJ, PFALLER MA, SCMITZ FJ et al. Survey of infections due to Staphylococcus species: frequency of occurrence and antimicrobial susceptibility of isolates collected in the United States, Canada, Latin America, Europe, and the Western Pacific region for the SENTRY Antimicrobial Surveillance Program, 1997-1999. Clin Infect Dis. 2001;15:S14-32.
16. ARIAS CA, REYES J, ZÚÑIGA M, CORTÉS L, CRUZ C, RICO L, PANESO D. Multicentre surveillance of antimicrobial resistance in enterococci and staphylococci from Colombian hospitals, 2001-2002. J Antimicrob Chemother 2003;51:59-68.
17. ROBLEDO J, CALLE D, REALPE T et al. Un programa de vigilancia de resistencia a antibióticos utilizando WHONET en seis hospitales de Medellín: resultados de los años 2001-2002. Infectio. 2003;7:107.
18. LEAL AL, CORTÉS JA, ÁLVAREZ CA, GREBO. Resistencia antimicrobiana en hospitales de tercer nivel en Bogotá, 2001-2002. Infectio. 2003;7:108.
19. ESPINAL PA, ALPUCHE C, SAAVEDRA C, LEAL AL, MANTILLA JR. Epidemiología molecular de infección por Klebsiella pneumoniae productora de betalactamasas de espectro extendido tipo SHV-5 en el Hospital Universitario Clinica San Rafael. Infectio. 2003;7:109.
20. WOODFORD N, SINCLAIR A, KAUFMANN ME, VÉLEZ JD, CASTAÑEDA CR, RECLADE M, LIVERMORE D, CRESPO MP. Outbreak of Pseudomonas aeruginosa producing a VIM-type carbapenemase in a tertiary hospital in Cali, Colombia. En: 43th Interscience Conference on Antimicrobial Agents and Chemotherapy. Chicago ILL; 2003.
21. PÉREZ MV, VILLEGAS MV, CORREA MC et al. First CTX-M enzyme extended spectrum ß-lactamase (ESBL) producing Enterobacteriaceae from Colombian hospitals. En: 43th Interscience Conference on Antimicrobial Agents and Chemotherapy. Chicago ILL; 2003.
22. PATTERSON JE. Extended-spectrum beta-lactamases. Sem Resp Crit Care Med. 2003;24:79-87.
23. BRADFORD P. Extended-spectrum â-lactamases in the 21st century: characterization, epidemiology, and detection of this important resistance threat. Clin Microbiol Rev. 2001;14:933-51.
24. LIN MF, HUANG ML, LAI SH. Risk factors in the acquisition of extended-spectrum beta-lactamase Klebsiella pneumoniae: a case-control study in a district teaching hospital in Taiwan. J Hosp Infect. 2003;53:39-45.
25. DU B, LONG Y, LIU H, CHEN D, LIU D, XU Y, XIE X. Extended-spectrum beta-lactamase-producing Escherichia coli and Klebsiella pneumoniae bloodstream infection: risk factors and clinical outcome. Intensive Care Med. 2002;28:1718-23.
26. PHILLIPS I, SHANNON K. Importance of beta-lactamase induction. Eur J Clin Microbiol Infect Dis. 1993;12:S19-26.
27. MULGRAVE L. The changing ecology of hospital bacteria and the selective role of cephalosporins. Epidemiol Infect. 1991;106:121-32.
28. LAUTENBACH E et al. Risk factors for fluoroquinolone resistance in nosocomial E. coli and K. pneumonie infections. Arch Intern Med. 2002; 162:2469-77.
29. GUYOT A et al. Molecular epidemiology of multiresistant Escherichia coli. J Hosp Infect. 1999;43:39-48.
30. SCOTT F, EDWARDS JR, COURVAL JM et al. The effect of vancomycin a third-generation cephalosporins on prevalence of vancomycin-resistant enterococci in 126 U.S. Adult intensive. Ann Intern Med. 2001; 135:175-83.
31. QUINTILIANI R, SAHM D, COURVALIN P. Mechanisms of resistance to antimicrobial agents. En: Murray P, Baron E, Pfaller M, Tenover F editors. Manual of Clinical Microbiology. Washington, D.C.: ASM Press; 1999. p.1506-27.
32. SIEGER B, BERMAN SJ, GECKLER RW, FRAGAS SA. Meropenem lower respiratoria infection group. Empiric treatment of hospital-acquired lower respiratory tract infections with meropenem or ceftazidime with tobramycin: a randomised study. Crit Care Med. 1997;25:1663-70.
33. COMETTA A, BAUMGARTNER JD, LEW D et al. Prospective randomized comparison of imipenem monotherapy with imipenem plus metilmicin for treatment of severe infections in nonneutropenic patients. Antimicrob Agents Chemother. 1994;38: 1309-13.
34. ÁLVAREZ LERMA F. Efficacy of meropenem as monotherapy in the treatment of ventilator associated pneumonia. J Chemother. 2001;13:70-81.
35. HILF M, YU VL, SHARP J, ZURAVLEFF JJ, KORVICK JA, MUDER RR. Antibiotic therapy for Pseudomonas aeruginosa bacteremia: outcome correlations in a prospective study of 200 patients. Am J Med. 1989;87:540-6.
36. KORVICK JA, BRYAN CS, FARBER B, BEAM TR, SCHENFELD L, MUDER RR,WEINBAUM D, LUMISH R, GERDING DN, WAGENER MM et al. Prospective observational study of Klebsiella bacteremia in 230 patients: outcome for antibiotic combinations versus monotherapy. Antimicrob Agents Chemother. 1992; 36:2639-44.
37. BONHOEFFER S, LIPSITCH M, LEVIN BR. Evaluating treatment protocols to prevent antibiotic resistance. Proc Natl Acad Sci. 1997;94:12106-11.
38. BELLOMO R, BERSTEN AD, BOOTS RJ et al. The use of antimicrobials in ten Australian and New Zealand intensive care units. The Australian and New Zealand intensive care multicentre studies group investigators. Anaesth Intensive Care. 1998;26:648-53.
39. OST DE, MAY CHS, JOSPH G, GINOCCHIO CH et al. Decision analysis of antibiotic and diagnostic strategies in ventilator-associated pneumonia. Am J Respir Crit Care Med. 2003;168:1060-7
40. MARIK P, CAREAU P. The role of anaerobes in patients with ventilador-associated pneumonia and aspiration pneumonia. A prospective study. Chest. 1999;115:178-83.
41. WUNDERINK RG, RELLO J, CAMMARATA SK et al. Linezolid Vs. vancomycin: analysis of two double-blind studies of patients with methicillin-resistant Staphylococcus aureus nosocomial pneumonia. Chest. 2003;124:1789-97.
42. BREILH D, SAUX MC, DELAISEMENT C, FRATTA A, DUCINT D, VELLY JF, COURAUD L. Pharmacokinetic population study to describe cefepima lung concentrations. Pulm Pharmacol Ther. 2001;14:69-74.
43. BERGOGNE-BEREZIN E. Pharmacodynamics of antibiotics in the respiratory tree. Expert Opin Pharmacother. 2004;5:15-23.
44. TOMASELLI F, MAIER A, SMOLLE-JUTTNER FM. Pharmacokinetics of antibiotics in inflamed and healthy lung tissue. Wien Med Wochenschr. 2003;153:342-4.
45. RODVOLD KA, DANZIGER LH, GOTFRIED MH. Steady-state plasma and bronchopulmonary concentrations of intravenous levofloxacin and azithromycin in healthy adults. Antimicrob Agents Chemother. 2003;47:2450-7.
46. TOMASELLI F, DITTRICH P, MAIER A, WOLTSCHE M, MATZI V, PINTER J, NUHSBAUMER S, PINTER H, SMOLLE J, SMOLLE-JUTTNER FM. Penetration of piperacillin and tazobactam into pneumonic human lung tissue measured by in vivo microdialysis. Br J Clin Pharmacol. 2003;55:620-4.
47. NIX DE. Intrapulmonary concentrations of antimicrobial agents. Infect Dis Clin North Am. 1998;12:631-46.
48. BOSELLI E, BREILH D, CANNESSON M, XUEREB F, RIMMELE T, CHASSARD D, SAUX MC, ALLAOU-CHICHE B. Steady-state plasma and intrapulmonary concentrations of piperacillin/tazobactam 4 g/0.5 g administered to critically ill patients with severe nosocomial pneumonia. Intensive Care Med. 2004; 30:976-9.
49. BYL B, JACOBS F, ROUCLOUX I, DE FRANQUEN P, CAPPELLO M, THYS JP. Penetration of meropenem in lung, bronchial mucosa, and pleural tissues. Antimicrob Agents Chemother. 1999;43:681-2.
50. PEA F, FURLANUT M. Pharmacokinetic aspects of treating infections in the intensive care unit: focus on drug interactions. Clin Pharmacokinet. 2001;40:833-68.
51. SORIANO F. Aspectos farmacocinéticos y farmacodinámicos para la lectura interpretada del antibiograma. Enferm Infecc Microbiol Clin. 2002; 20:407-12. 52. ESTES L. Review of pharmacokinetics and pharmacodynamics of antimicrobial agents. Mayo Clin Proc. 1998;73:1114-22. 53. AMBROSE P, OWENS R, GRASELA D. Antimicrobial pharmacodynamics. Med Clin North Am. 2000; 84:1431-46.
54. SCHENTAG J, GILLILAND K, PALADINO J. What have we learned from pharmacokinetic and pharmaco-dynamic theories? Clinical Infectious Diseases. 2001;32:S39-46.
55. ALI MZ, GOETZ MB. A meta-analysis of the relative efficacy and toxicity of single daily dosing versus multiple daily dosing of aminoglycosides. Clin Infect Dis. 1997;24:756-809.
56. BAILY TC, LITTLE JR, LITTENBERG RB et al. A meta-analysis of extended-interval dosing versus multiple daily dosing of aminoglycosides. Clin Infect Dis. 1997;24:786-95.
57. BARZA M, LOANNIDIS JPA, CAPPELLERI JC et al. Single or multiple daily doses of aminoglycosides: A meta-analysis. BMJ. 1996;312:338-45.
58. BLASER J, KONIG C. Once-daily dosing of aminoglycosides. Eur J Clin Microbiol Infect Dis. 2004; 39:1029-38.
59. BUIJK SL, GYSSENS IC, MOUTON JW et al. Pharmacokinetics of ceftazidime in serum and peritoneal exudate during continuous versus intermittent administration to patients with severe intraabdominal infections. J Antimicrob Chemother. 2002;49:121-8.
60. WYSOCKI M, DELATOUR F, FAURISSON F. Continuous versus intermittent infusion of vancomycin in severe staphylococcal infections: prospective multicenter randomized study. Antimicrob Agents Chemother. 2001;45:2460-7.
61. GEORGES B, ARCHAMBAUD M, SAIVIN S et al. Continuous versus intermittent cefepima infusion in critical care. Preliminary results. Pathol Biol. 1999;47:483-5.
62. BYL B, JACOBS F, WALLEMACQ P, ROSSI C, DE FRANCQUEN P, CAPPELLO M, LEAL T, THYS JP. Vancomycin penetration of uninfected pleural fluid exudate after continuous or intermittent infusion. Antimicrob Agents Chemother. 2003;47:2015-7.
63. THALHAMMER F, TRAUNMULLER F, EL MENYAWI I, FRASS M, HOLLENSTEIN UM, LOCKER GJ, STOISER B, STAUDINGER T, THALHAMMER-SCHERRER R, BURGMANN H. Continuous infusion versus intermittent administration of meropenem in critically ill patients. Antimicrob Chemother. 1999; 43:523-7.
64. KEIL S, WIEDEMANN B. Antimicrobial effects of continuous versus intermittent administration of carbapenem antibiotics in an in vitro dynamic model. Antimicrob Agents Chemother. 1997;41:1215-9.
65. TEGEDER I, SCHMIDTKO A, BRAUTIGAM L, KIRSCHBAUM A, GEISSLINGER G, LOTSCH J.Tissue distribution of imipenem in critically ill patients. Clin Pharmacol Ther. 2002;71:325-33.
66. BURGESS DS, WALDREP T. Pharmacokinetics and pharmacodynamics of piperacillin/tazobactam when administered by continuous infusion and intermittent dosing. Clin Ther. 2002;24:1090-104.
67. JARURATANASIRIKUL S, SRIWIRIYAJAN S, INGVIYA N. Continuous infusion versus intermittent administration of cefepima in patients with Gram-negative bacilli bacteraemia. J Pharm Pharmacol. 2002;54:1693-6.
68. MCNABB JJ, NIGHTINGALE CH, QUINTILIANI R, NICOLAU DP. Cost-effectiveness of ceftazidime by continuous infusion versus intermittent infusion for nosocomial pneumonia. Pharmacotherapy. 2001; 21:549-55.no CITADAS
69. NICOLAU DP, MCNABB J, LACY MK, QUINTILIANI R, NIGHTINGALE CH. Continuous versus intermittent administration of ceftazidime in intensive care unit patients with nosocomial pneumonia. Int J Antimicrob Agents. 2001;17:497-504.
70. GRANT EM, KUTI JL, NICOLAU DP, NIGHTINGALE C, QUINTILIANI R. Clinical efficacy and pharmacoeconomics of a continuous-infusion piperacillin-tazobactam program in a large community teaching hospital. Pharmacotherapy. 2002;22:471-83.
71. FLOREA NR, KOTAPATI S, KUTI JL, GEISSLER EC, NIGHTINGALE CH, NICOLAU DP. Cost analysis of continuous versus intermittent infusion of piperacillin-tazobactam: a timemotion study. Am J Health Syst Pharm. 2003;60:2321-7.
72. BOSELLI E, BREILH D, DUFLO F, SAUX MC, DEBON R, CHASSARD D, ALLAOUCHICHE B. Steady-state plasma and intrapulmonary concentrations of cefepima administered in continuous infusion in critically ill patients with severe nosocomial pneumonia. Crit Care Med. 2003;31:2102-6.
73. HANES SD, WOOD GC, HERRING V, CROCE MA, FABIAN TC, PRITCHARD E, BOUCHER BA. Intermittent and continuous ceftazidime infusion for critically ill trauma patients. Am J Surg. 2000;179:436-40.
74. SINGH N, ROGERS P, ATWOOD CW, WAGENER MM, YU VL. Short-course empiric antibiotic therapy for patients with pulmonary infiltrates in the intensive care unit. Am J Respir Crit Care Med. 2000;162: 505-11.
75. IBRAHIM EH, WARD S, SHERMAN G, SCAF R, FRASER VJ, KOLLEF MH. Experience with a clinical guideline for the treatment of ventilador-associated pneumonia. Crit Care Med. 2001;29:1109-15.
76. DENNESEN PJ, VAN DER VA, KESSELS AG, RAMSAY G, BONTEN MJ. Resolution of infectious parameters alters antimicrobial therapy in patients with ventilator-associated pneumonia. Am J Respir Crit Care Med. 2001;163:1371-5.
77. CHASTRE J, WOLF M, FAGON JY, CHEVRET S et al. Comparison of 8 Vs. 15 days of antibiotic therapy for ventilator-associated pneumonia in adults. JAMA. 2003;290:2588-98.
78. MICEK ST, WARD S, FRASER VJ, KOLLEF MH. A randomized controlled trial o fan antibiotic discontinuation policy for clinically suspected ventilator-associated pneumonia. Chest. 2004;125:1791-99.
79. NELSON S. Novel nonantibiotic therapies for pneumonia cytokines and host defense. Chest 2001;119:419S-25S.
80. NIEDERMANN M. Granulocyte colony-stimulating factor for severe pneumonia: What do we do when the best laid plans for men? Crit Care Med. 2003;31:635-6.
81. NATHENS AB, NEFF MJ, JURKOVICH GJ, KLOTZ P, FARVER K, RUZINSKI JT, RADELLA F, GARCÍA I, MAIER RV. Randomized, prospective trial of antioxidant supplementation in critically ill surgical patients. Ann Surg. 2002;236:814-22.














