Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Infectio
Print version ISSN 0123-9392
Infect. vol.10 no.3 Bogotá July/Sept. 2006
ARTÍCULO ORIGINAL
Prevalencia de Staphylococcus aureus resistente a meticilina en personal de la unidad de terapia intensiva de la Clínica Universitaria Bolivariana, Medellín 2004
Prevalence of personnel of the intensive of Medellín 2004
JUAN F. LONDOÑO,1
GLORIA M. ORTIZ, 2
ÁNGELA MARÍA GAVIRIA N.3
1 Semillero de Investigación de la Facultad de Ciencias de la Salud -SIFACS-, Institución Universitaria Colegio Mayor de Antioquia.
2 Clínica Universitaria Bolivariana.
3 SIFACS-, Institución Universitaria Colegio Mayor de Antioquia.
Fecha de recepción: 12/12/2005; fecha de aceptación; 29/06/2006
Resumen
Objetivos. Se determinó la prevalencia de Staphylococcus aureus resistente a meticilina en el personal de la unidad de terapia intensiva de la Clínica Universitaria Bolivariana y la prevalencia de S. aureus en fosas nasales y faringe en la misma población.
Metodología. En este estudio descriptivo, se tomaron muestras de fosas nasales y faringe de 45 trabajadores de la unidad de terapia intensiva. Las muestras se sembraron en agar sangre de cordero, a partir del cual se repicaron las colonias de Staphylococcus spp. identificadas por medio de la coloración de Gram y la prueba de catalasa. Mediante la prueba de la coagulasa en tubo y la fermentación del manitol, se confirmaron como S. aureus. A estos aislamientos se les determinó la sensibilidad a antibióticos por el método de Kirby-Bauer. Una vez establecida la resistencia a oxacilina a través del antibiograma, ésta se confirmó con la prueba de tamizaje en Mueller-Hinton con suplemento de oxacilina (6 µg/ml) y NaCl (4%). A los aislamientos SARM confirmados se les realizó el tamizaje de difusión por disco – con cefoxitina– para la predicción de la resistencia a meticilina mediada por el gen mecA. Los datos tabulados en Excel se analizaron en SPSS. Resultados. Laprevalencia de Staphylococcus aureus resistente a meticilina fue de 6,7%. La región anatómica en la que se obtuvo el mayor número de aislamientos correspondióa las fosas nasales.
Palabras clave: Staphylococcus aureus, meticilino-resistencia, MRSA, oxacilina.
Abstract
Objective. Our objective was to determine the prevalence of methicilin resistant Staphylococcus aureus (MRSA) and methicilin sensitive Staphylococcus aureus (MSSA) in the nasal cavity of the personal that labours at the intensive care unit at the Clínica Universitaria Bolivariana.
Methodology. In this descriptive study, samples from nasal cavity and pharynx were taken from 45 members of the Intensive Care Unit staff. The samples were seed on plates nurtured with lambs blood agar from which we isolated S. aureus colonies that were identified by means of the Gram coloration and the catalase. Coagulase test and manitol fermentation were perfomed in order to confirm S. aureus. The antibiotic sensitivity was determined by the Kirby Bauer method. The oxacillin resistance was confirmed with the Mueller Hinton screening test in oxacillin (6 mg/ml) and NaCl (4%) supplemented media. A diffusion screen test on disk with cefoxitin was performed to MRSA strains to predict whether the methicilin resistance was mediated by the mecA gen. The data was tabulated in Excel and analyzed in SPSS. Results. The prevalence of MRSA was 6.7%. Nasal cavity was the most common anatomical site from which the isolated came.
Key words: Staphylococcus aureus, methicillinresistant,MRSA, oxacillin.
INTRODUCCIÓN
Staphylococcus aureus es una de las cuatro causas principales de infecciones hospitalarias, junto con Escherichia coli, Enterococcus faecalis y Pseudomonas aeruginosa. Es causa de un amplio rango de infecciones. Además del impacto epidemiológico que produce debido a su amplia y frecuente distribución intra y extrahospitalaria, tiene una compleja y sofisticada patogenicidad que se refleja en elevadas tasas de morbimortalidad (1, 2). El interés del estudio de este microorganismo radica, por lo tanto, en su elevada frecuencia, su morbimortalidad y, además, en su resistencia a diversos fármacos, entre ellos, la meticilina, por lo que se denominan S. aureus resistentes a meticilina (SARM), cepas causantes de brotes de infección hospitalaria (3).
Las cepas SARM se identificaron por primera vez en Inglaterra en 1961, dos años después de la introducción de la meticilina (4). Desde entonces la prevalencia ha ido aumentando; en España se pasó de 1,5% en 1986 a 18% a 23% en 1996 (5). Determinadas áreas hospitalarias consideradas de alto riesgo, sobre todo la unidad de terapia intensiva, son endémicas para la infección por SARM (6). Velásquez et al., en 2002 (7), reportaron una prevalencia de 90% en la unidad de terapia intensiva, de 78% para cirugía general y especialidades y para los servicios de medicina interna, de 65%. En Alemania, para el año de 1997, era de 8% y, para el 2003, de 30% (8). Como caso nacional se encuentra el Hospital de San Jerónimo, Montería, en donde se demostró una alta resistencia a oxacilina en S. aureus (42%) (9). En el Hospital de Caldas, Valle, durante el período 1992-1994, se encontró una prevalencia de SARM mayor al 60% en la unidad de terapia intensiva (10).
La resistencia a la meticilina incluye resistencia a derivados -lactamicos, pero las cepas SARM presentan, en general, resistencia múltiple a varios grupos de antibióticos: cloranfenicol, tetraciclinas, macrólidos, lincosamidas, aminoglucósidos e, incluso, quinolonas (11), y se describen brotes de SARM sensibles sólo a los glucopéptidos, aunque se han reportado casos de sensibilidad intermedia a la vancomicina (12, 13).
Al igual que S. aureus sensible a meticilina (SASM), las cepas SARM ingresan al medio hospitalario a través de pacientes, visitantes o trabajadores asistenciales. Aunque los pacientes hospitalizados constituyen el reservorio fundamental con altas tasas de prevalencia, el personal asistencial colonizado por cepas SARM se puede convertir en fuente importante de infección para los pacientes más susceptibles y, en especial, para en la unidad de terapia intensiva (14). Por lo tanto, la vigilancia epidemiológica y las medidas de control son importantes para prevenir la transmisión estafilocócica. Las medidas utilizadas incluyen higiene rigurosa de manos y superficies, control de contactos, descubrimiento de portadores, control de la difusión aérea y por fómites, y búsqueda de la fuente de infección (1).
El aumento de la prevalencia de SARM en todo el mundo, junto con la descripción de cepas con sensibilidad disminuida a los glucopéptidos, que en la práctica traduce la pérdida de posibles alternativas terapéuticas, conduce a la necesidad de detectar y controlar este tipo de aislamientos. En la Clínica Universitaria Bolivariana, durante el 2003, el 2004 y el 2005, se ha encontrado una prevalencia de SARM en la unidad de terapia intensiva de 13%, 15% y 5%, respectivamente; para el 2005, la prevalencia fue de 25%. Hasta mediados del 2006 se encuentra en 9% para la unidad de terapia intensiva y en 26% para la Clínica, por lo que se espera que alcance niveles mayores a los años anteriores.
En la Clínica Universitaria Bolivariana, además de las medidas de control, se lleva a cabo la vigilancia epidemiológica de los pacientes infectados o colonizados por SARM, y se descubren portadores en el personal asistencial solamente durante un brote. El descubrir portadores en el personal de la unidad de terapia intensiva, área de la cínica más susceptible a ser contaminada con SARM y de la cual se puede extender a las demás áreas, se convierte en una alternativa más para controlar las tasas de infección por SARM.
Por lo tanto, el objetivo de este estudio fue determinar la prevalencia de aislamientos SARM en los trabajadores (asistenciales y no asistenciales) de la unidad de terapia intensiva de la Clínica Universitaria Bolivariana de Medellín, para así, de acuerdo con los resultados obtenidos, fortalecer o implementar nuevas medidas de control, para prevenir la aparición de brotes; además, determinar la prevalencia de S. aureus en fosas nasales y faringe en la misma población.
MATERIALES Y MÉTODOS
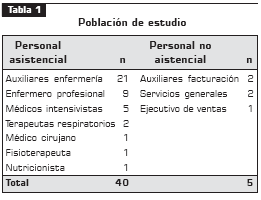
Recolección de las muestras. En este estudio descriptivo participaron los 45 trabajadores de la unidad de terapia intensiva de la Clínica Universitaria Bolivariana (tabla 1), a los cuales se les tomaron muestras de la zona anterior de las fosas nasales y la faringe. Una vez tomadas, se sembraron inmediatamente en agar sangre de cordero y se llevaron a incubación en atmósfera de CO2 a 35°C por 24 horas.
Pruebas microbiológicas. Transcurrido el tiempo de incubación, se examinaron las características de las colonias (1, 15). Se realizaron la coloración de Gram y la prueba de catalasa; como pruebas confirmatorias se utilizaron la prueba de coagulasa en tubo y la fermentación del manitol.
Pruebas de susceptibilidad. La determinación de la sensibilidad antibiótica se realizó a través del método de Kirby-Bauer de acuerdo con el Clinical and Laboratory Standards Institute (CLSI) (16). Los antibióticos evaluados fueron: ciprofloxacina (5 µg), clindamicina (2 µg), eritromicina (15 µg), levofloxacina (5 µg), oxacilina (1 µg), trimetoprimsulfametoxazol (STX, 1,25/23,75 µg) y vancomicina (30 µg). Con el objetivo de detectar el fenotipo inducible de resistencia a CC, los discos de éste y de E siempre se colocaron a una distancia de 15 mm el uno del otro.
Confirmación de la resistencia a oxacilina.
Una vez establecida la resistencia a oxacilina por medio del antibiograma, se procedió a realizar (según el CLSI) el tamizaje en placa de agar Mueller- Hinton con suplemento de oxacilina (6 µg/ml) y NaCl (4%) (6). Como control positivo se utilizó la cepa de S. aureus ATCC 43300 y como control negativo, S. aureus ATCC 29213. La incubación se realizó enaerobiosis a 35°C por 24 horas.
Tamizaje de sensibilidad a la vancomicina.
Ante un aislamiento de SARM sensible a la vancomicina se hace necesario confirmarla debido a la aparición de cepas con sensibilidad disminuida (12, 13). A los aislamientos SARM se les realizó el tamizaje en agar BHI con suplemento de vancomicina (6 µg/ ml). El control positivo fue E. faecalis ATCC 51299 y el negativo, S. aureus ATCC 29213. Se incubó en aerobiosis a 35°C por 24 horas.
Predicción de resistencia mediada por el gen mec A. A los aislamientos SARM confirmados se les realizó la prueba de tamizaje de difusión por disco para la predicción de la resistencia a meticilina mediada por el gen mecA. Se utilizó el disco de cefoxitina (30 µg). Según el NCCLS, un halo de 20 mm o mayor se da en un aislamiento sensible a meticilina y uno de 19 mm o menos indica un aislamiento con resistencia a meticilina probablemente mediada por el gen mecA (16).
Análisis de datos. Se creó una base de datos en Microsoft Excel y, posteriormente, se analizó en SPSS. Se hizo un análisis univariado para conocer las frecuencias de las variables.
RESULTADOS
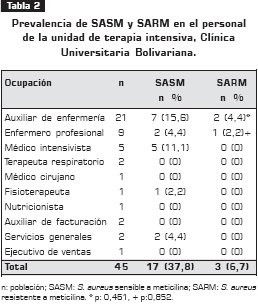
De la población estudiada se obtuvieron 20 aislamientos de S. aureus, de las cuales, 17 (85%) correspondieron a S. aureus sensible a meticilina (SASM) y 3 (15%) a SARM; de esta manera, la prevalencia de SARM correspondió a 6,7%. Los auxiliares de enfermería presentaron la mayor prevalencia (4,4%) (tabla 2).
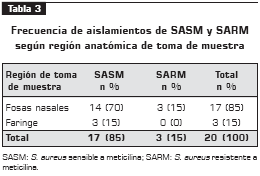
S. aureus se aisló principalmente de las fosas nasales con un porcentaje de 85%, mientras que para faringe fue de 15% (tabla 3).
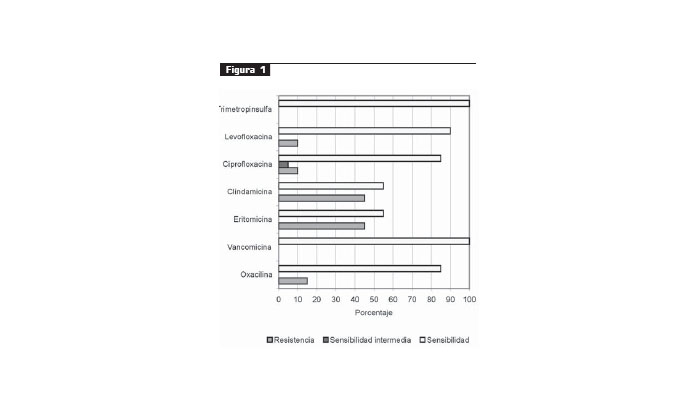
Los antibiogramas de los 20 aislamientos arrojaron los siguientes resultados: 15% fue resistente aoxacilina, 45% a eritromicina y clindamicina, 10% a ciprofloxacina y levopfloxacina; cinco presentaron el fenotipo inducible de resistencia para clindamicina, es decir, la resistencia a macrólidos indujo la resistencia a la clindamicina (dimetilación inducible o constitutiva de la metilasa que actúa sobre la subunidad ribosómica 23S, iMLSB o cMLSB, respectivamente) (20). Se presentó sensibilidad intermedia a CIP en 5% (figura 1).
De los tres aislamientos de SARM, tres fueron resistentes a eritromicina y clindamicina (sin presentar fenotipo inducible a esta última) y dos lo fueron a cirprofloxacina y lefloxacina; todos fueron sensibles a la vancomicina y al STX Estas cepas SARM fueron resistentes a la cefoxitina.
DISCUSIÓN
S. aureus es un patógeno con una compleja patogenicidad que lo hace causante de infecciones en diversos órganos y, por lo tanto, con un alto impacto epidemiológico, principalmente a nivel hospitalario. Las cepas SARM multirresistentes originanun problema terapéutico.
Este estudio buscó la prevalencia de SARM en el personal (asistencial y no asistencial) de la unidad de terapia intensiva, Clínica Universitaria Bolivariana, la cual fue de 6,7% y se encuentra entre lo reportado (0,8% a 20%) (14, 17-19). Aunque esta prevalencia es baja, los trabajadores asistenciales son una importante fuente de transmisión de S. aureus, ya sea de origen propio, actuando la persona como reservorio, o adquirido por contacto con un paciente infectado o material contaminado (20). Además, estos trabajadores pueden desencadenar brotes epidémicos (14, 18) La prevalencia de SASM de 37,8% se encuentra entre 32% y 50% reportado para adultos saludables, 40% reportado para el personal hospitalario y 34% reportado para hispanos residentes en los Estado Unidos (2, 14, 19, 20).
La variabilidad de la prevalencia entre este estudio y otro puede deberse, en parte, por la calidad de la muestra y los métodos de cultivo utilizados; igualmente, el sitio de la toma de la muestra influye, ya que es bien sabido que las fosas nasales son la principal localización en portadores (tasas que pueden ser mayores al 80%) y, por lo tanto, de aislamiento de S. aureus (18, 21). En este estudio, de las fosas nasales se obtuvieron 14 aislamientos (70%) de SASM y 3 (15%) de SARM, mientras de faringe sólo se obtuvieron 3 (15%) del primero y ningún aislamiento de éste ultimo; Mendoza et al., en 2001 (14), obtuvieron 26 aislamientos de los trabajadores asistenciales, de los cuales correpondieron fosas nasales 5 aislamientos (19%) de SASM y 4 (15%) de SARM, en tanto que para faringe fueron 12 (46%) y 5 (19%), respectivamente.
La existencia de cepas de SARM se conoce desde la década de 1960, poco tiempo después de que se hubiera introducido el uso de penicilinas resistentes a â -lactamasas (4). La resistencia a meticilina confiere resistencia a todas las penicilinas resistentes a la penicilinasa y cefalosporinas; además, generalmente hay resistencia a otras familias de antibióticos (macrólidos, lincosamidas, tetraciclinas, fenicoles, aminoglucósidos e, incluso, quinolonas) (11, 16).
En el presente estudio, 15% de los 20 aislamientos fue resistente a oxacilina, 45% a eritromicina y clindamicina, 10% a cirprofloxacina y a levofloxacina y 5% presentó sensibilidad intermedia a ciprofloxacina. No se encontró ningún aislamiento con sensibilidad disminuida a vancomicina ni resistente a STX. De los tres aislamientos de SARM, se encontraron dos con un patrón de sensibilidad igual, según los halos de inhibición (oxacilina, eritromicina, clindamicina, ciprofloxacina: 6 mm, vancomicina: 18 mm, levofloxacina: 10 mm y STX: 26 mm); esto puede sugerir que son el mismo aislamiento, a diferencia del tercero que presentó halos de inhibición mayores para ciprofloxacina (21 mm) y levofloxacina (24 mm). No obstante, los aislamientos SARM con el patrón de sensibilidad igual tendrían que ser estudiados mediante pruebas moleculares para descubrir si se trata de clones (22).
La explicación a esta situación podría ser la exposición de las dos personas (enfermera y auxiliar de enfermería) al mismo paciente colonizado o infectado por el SARM. Los tres aislamientos SARM presentaron resistencia a eritromicina y clindamicina, mas no se evidenció el fenotipo inducible de resistencia para clindamicina, por lo que habría que estudiar por medio de pruebas moleculares, qué clase de resistencia se presenta en éstos (23).
La resistencia a meticilina se da por la modificación del punto de acción del antibiótico, donde se sintetiza una nueva proteína fijadora de penicilina (PBP2a o PBP2) con baja afinidad a la meticilina y al resto de â-lactámicos. Esta proteína es codificada por el gen mec, el cual contiene dos loci distintos, el mecA que codifica la PBP2 y el mecR o gen regulador. Las cepas SARM con resistencia verdadera o intrínseca a meticilina poseerían los marcadores gen mecA y PBP2 (3).
En este estudio, por medio del disco de cefoxitina, se sospecha que las cepas SARM poseen como mecanismo de resistencia la producción de PBP2 mediada por el mecA. Actualmente, las pruebas moleculares (PCR, hibridación de ADN) para detectar el mecA representan el método de referencia para la identificación de la resistencia a meticilina;claro está, estas pruebas aún no están disponibles en la mayoría de laboratorios cínicos debido a sus altos costos (21, 24). No obstante, Fernández et al., en 2005 (24), al utilizar la prueba de tamizaje de difusión por disco de cefoxitina según la NCCLS (actualmente, CLSI), encontraron una sensibilidad y especificidad del 100% en 598 cepas estudiadas por medio de la PCR en búsqueda de la presencia o ausencia del gen mecA. Lo anterior valida el uso del disco de cefoxitina en este estudio como prueba de predicción de resistencia mediada por el gen mecA.
Además de la resistencia intrínseca, se encuentra la resistencia dudosa ( borderline) (BORSA) y la resistencia modificada (MODSA). La primera se da en aislamientos que presentan niveles bajos de resistencia dados por la hiperproducción de ßlactamasas, sin presentar el gen mecA ni PBP2 y, la segunda, por la alteración de las PBP 1, 3 y 4 (3, 25). Una forma de diferenciar los aislamientos con resistencia limítrofe de los SARM (resistencia intrínseca) es que su resistencia a otros antimicrobianos, mientras que los de sensibilidad límite no la presentan (26).
En el presente estudio, en el que dos de los aislamientos SARM eran resistentes a macrólidos, lincosamidas y quinolonas, y el restante lo fue a macrólidos y lincosamidas, se puede sospechar que se trata de aislamientos con resistencia limítrofe. A estas evidencias se suma la resistencia a la cefoxitina, por lo cual aumenta el grado de sospecha en cuanto a que los aislamientos resistentes a meticilina encontrados poseen una resistencia intrínseca.
La transmisión aérea de S. aureus se considera rara, aunque un portador nasal de esta bacteria con rinitis alérgica sintomática sin tratamiento antihistamínico disemina fácilmente el microorganismo en el ambiente cuando utiliza sólo una bata estéril, pero ésta junto al uso de una mascarilla estéril disminuye significativamente la dispersión (27). Como dato adicional en este estudio, de los tres portadores de SARM, dos reportaron tener rinitis alérgica (uno con tratamiento antihistamínico). La portación de S. aureus bien puede ser transitoria o permanente; de ésta última, Marjolein et al., en 1999, (28) observaron una persistencia de portación nasal de 71% al cabo de 8 años de identificada. Kluytmans et al., en 1997, (18) en su revisión sobre la portación nasal hacen referencia a su clasificación, en la cual el portador persistente es quien presenta más de 8 cultivos positivos en 10 exámenes, el intermitente, quien presenta entre 60% y 80% de cultivos positivos y el ocasional, quien tiene de 10% a 40% de cultivos positivos.
La vigilancia por medio de cultivos de los portadores entre los trabajadores de la salud se justifica, siempre y cuando, las investigaciones epidemiológicas sugieran que un miembro del personal es un portador permanente (29). Por esta razón, se recomienda identificar, entre los tres portadores de SARM, quién lo es de forma permanente, para implementar, además, medidas de control con el fin de evitar la diseminación del SARM en la unidad de terapia intensiva y, así, en la clínica.
La eliminación de la portación de SARM, como medida de control, podría disminuir la tasa de infecciones por éste. Una forma de eliminación sería por medio de la aplicación local de antibióticos. La mupirocina, antibiótico que inhibe la síntesis proteica, se aplica por vía intranasal para la eliminación nasal de S. aureus (20). Kluytmans et al., en 1997 (18), en su revisión se refieren al trabajo realizado por Doebbeling et al. (1993) en el cual la aplicación de mupirocina, dos veces al día por cinco días consecutivos, en trabajadores de la salud eliminó la portación en el 91% de los portadores nasales permanentes y, al cabo de 4 semanas, el 87% de éstos permanecía libre de S. aureus. Se realizó seguimiento a un subgrupo y a los 6 y 12 meses de la aplicación de la mupirocina la tasa de portación fue de 48% y 53%, respectivamente. En el mismo estudio, no se encontró resistencia a la mupirocina, aunque la literatura ha reportado resistencia de 62% durante el primer año de tratamiento en pacientes (30).
Igualmente, como medida de control, el tratamiento antihistamínico para controlar los signos de rinitis alérgica (en caso de sufrirla), junto con la utilización de bata y mascarilla, se sumaría a la vigilancia mencionada. Por añadidura, se debería reemplazar, en el programa de vigilancia epidemiológica para la prevención y el control de infecciones en la unidad de terapia intensiva, la toma de muestra de faringe por la de fosas nasales.
Como conclusiones, la prevalencia de SARM
(6,7%) encontrada en los trabajadores (asistenciales y no asistenciales) de la unidad de terapia intensiva, aunque baja en comparación con otros estudios (4, 17, 19, 28, 31), obliga a conocer el estado de portación para implementar medidas de control (eliminación de portación con mupirocina y tratamiento antihistamínico a portadores con rinitis alérgica), además de la vigilancia al portador permanente, sin olvidar las demás medidas de control como el lavado de manos y el uso de bata y mascarilla. La mayor prevalencia de S. aureus (85%) en fosas nasales sugiere optar por esta región anatómica en lugar de la faringe, al momento de tomar muestras en el programa de vigilancia epidemiológica en la unidad de terapia intensiva.
Agradecimientos
Al Laboratorio Clínico y a la Clínica Universitaria Bolivariana por el auspicio a esta investigación; a Francisco José Molina, coordinador de la Unidad de Terapia Intensiva, y al personal de ésta que contribuyeron con gran interés en esta investigación. A la profesora Claudia M. Cuervo, docente del Colegio Mayor de Antioquia, por sus grandes aportes en la realización del manuscrito.
REFERENCIAS
1. Myrvik QV, Weiser RS. Bacteriología y micología médicas. 2ª ed. McGraw-Hill Interamericana, S.A.; 1991. p.166-79. [ Links ]
2. Walker S. Microbiología. México, D.F.: McGraw-Hill Interamericana S.A.; 2000. P.134-9. [ Links ]
3. Camarena JJ, Sánchez R. Infección por Staphylococcus aureus resistente a meticilina. Sociedad Española de Enfermedades Infecciosas y Microbiología Clínica. Disponible en Internet: http://www.seimc.org/control/ [ Links ]
4. Jevons MP. Celbenin-resistant Staphyloccoci. En: Br Med J Vol. 1; p. 124-5. Citado por: Camarena, J.J. y Sánchez, R. Infección por Staphylococcus aureus resistente a meticilina. Disponible en Internet: http://www.seimc.org/control/revi_Bacte/sarm.htm [ Links ]
5. Cercenado E et al. Situación actual de la resistencia de Staphylococcus en España. Cuarto estudio nacional (1996). En: Rev Clin Esp 1997;197:12-8. Citado por: Camarena JJ. y Sánchez R. Infección por Staphylococcus aureus resistente a meticilina. Disponible en Internet: http://www.seimc.org/control/revi_Bacte/sarm.htm [ Links ]
6. Kollef MH, Fraser VJ. Antibiotic resistance in the intensive care unit. Ann Intern Med 2001;134:298-314. [ Links ]
7. Velásquez J et al. Vigilancia de la resistencia de Staphylococcus aureus a la oxacilina-vancomicina y patrones de correspondencia. Rev Per Soc Med Intern. 2002;15. [ Links ]
8. Gastmeier P et al. Mayor mortalidad en las infecciones por cepas de Staphylococcus aureus meticilina resistente (SAMR). Infection 2005;33:50-5. [ Links ]
9. Pérez D, Máttar S, Mercado M. Alta resistencia de los microorganismos nosocomiales en el Hospital San Jerónimo de Montería. Vniversitas Médica. 2003;44. [ Links ]
10. Jaramillo EL. Resistencia bacteriana a los antibióticos en la Unidad de Cuidados Intensivos, Hospital de Caldas, 1992-1994. Colombia Médica 1996;27:69-76. [ Links ]
11. Waldvogel FA. New resistance in Staphylococcus aureus. N Engl J Med 1999;340:556- 57. [ Links ]
12. Hiramatsu K, Hanaki H, Ino T, Yabuta K, Oguri T, Tenover FC. Methicillin-resistant Staphylococcus aureus clinical strain with reduced vancomycin susceptibility. J Antimicrob Chemother 1997;40:135-6. [ Links ]
13. Smith TL et al. Emergence of vancomycin resistance in Staphylococcus aureus. N Engl J Me. 1999;34:493-501. [ Links ]
14. Mendoza CT et al. Staphylococcus aureus meticilino resistente (MRSA): colonización y susceptibilidad en pacientes y personal de salud de un hospital de referencia. Diagnóstico (Perú); 40(3):149-56, mayo.-jun. 2001. ilus, tab Disponible en Internet: http://www.fihudiagnostico.org.pe/revista/numeros/2001/mayjun01/149-156.html [ Links ]
15. Koneman EW et al. Diagnóstico microbiológico. 5ta ed. Editorial Médica Panamericana; 1999. p.540-3. [ Links ]
16. Clinical and Laboratory Standards Institute. Performance standards for antimicrobial susceptibility testing, 6th ed. M100-S16. Vol. 26 No.3.2006. [ Links ]
17. Echavarría J, Iglesias D. Estafilococo meticilino resistente, un problema actual en la emergencia de resistencia entre los Gram positivos. Rev Med Hered 2003;14: [ Links ]
18. Kluytmans J, Belkum AV, Verbrugh H. Nasal carriage of Staphylococcus aureus: epidemiology, underlyng mechanisms, and associated risks. Clin Microbiol Rev 1997;10:505-20. [ Links ]
19. Mainous AG, Hueston WJ, Everett CJ, Díaz VA. Nasal carriage of Staphylococcus aureus and methicillin-resistan S. aures in the United States, 2001-2002. Ann Fam Medi 2006;4:132-7. [ Links ]
20. Lowy FD. Staphylococcus aureus infections. N Engl J Med 1998; 8:520-32. [ Links ]
21. Hardy KJ et al. Methicillin resistant Staphylococcus aureus in the critically ill. Br J Anaesthesiol 2004;92:121-30. [ Links ]
22. Brown DF, Edwards DI, Hawkey PM, Morrison D, Ridgway GL, Towner KJ, Wren MW. Guidelines for the laboratory diagnosis and susceptibility testing of methicillin-resistant Staphylococcus aureus (MRSA). J Antimicrob Chemother 2005;56:1000-18. [ Links ]
23. Chávez-Bueno S, Bozdogan B, Katz K, Bowlware KL, Cushion N, Cavuoti D, Ahmad N, Maccracken GH, Appelbaum PC. Inducible clindamycin resistance and molecular epidemiologic trends of pediatric community-acquired methicillin-resistant Staphylococcus aureus in Dallas, Texas. Antimicrob Agents Chemother 2005;49:2283-8. [ Links ]
24. Fernández CJ, Fernández LA, Collignon P. Cefoxitin resistance as a surrogate marker for the detection of methicillin-resistant Staphylococcus aureus. J Antimicrob Chemother 2005;55:506-10. [ Links ]
25. Gil M. Staphylococcus aureus: microbiología y aspectos moleculares de la resistencia a la meticilina. Rev Chil Infect 2000;17:145-52. [ Links ]
26. García JA et al. Métodos básicos para el estudio de la sensibilidad a los antimicrobianos 2000. Sociedad Española de Enfermedades Infecciosas y Microbiología Clínica. Disponible en internet:<http://www.seimc.org/protocolos/microbiologia/cap11.htm#B> [ Links ]
27. Basseti S, Sherertz RJ. Airbone dispersal of Staphylococcus aureus associated with symptomatic rhinitis allergica. Ann Intern Med 2003;139:236. [ Links ]
28. Marjolein F. et al. Follow-up of Staphylococcus aureus nasal carriage after 8 years: redefining the persistent carrier state. J Clin Microbiol 1999:3133-40. [ Links ]
29. Pittet D. To control or not to control colonization with MRSA thats the cuestion! Q J Med 1997;90:239-41. [ Links ]
30. Farr BM. Mupirocin to prevent S. aureus infections. N Engl J Med 2002;346:1905-6. [ Links ]
31. Lopardo HA, Hernández C, Vidal P. Resistencia de Streptococcus pyogenes a los antibióticos: experiencia de once años en un hospital pediátrico de Buenos Aires. Acta Bioquím Clín Latinoam 2004;38: 151-7. [ Links ]