Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Infectio
Print version ISSN 0123-9392
Infect. vol.10 no.3 Bogotá July/Sept. 2006
ARTÍCULO DE REVISIÓN
Células T reguladoras, infección y autoinmunidad: implicaciones en terapéutica
Regulatory T cells, Infection and Autoimmunity. Therapeutic implications
FRANCISCO JAVIER JARAMILLO1, LUIS MIGUEL GÓMEZ2, JUAN MANUEL ANAYA3
1 CES, Fundación Valle del Lili, Cali, Colombia
2 Corporación para Investigaciones Biológicas, Medellín, Colombia
3 Corporación para Investigaciones Biológicas, Medellín; Universidad del Rosario, Medellín, Colombia.
Fecha de recepción: 12/12/2005; fecha de aceptación; 06/07/2006
RESUMEN
El entendimiento del equilibrio del sistema inmune es, además de una pregunta aún no resuelta, una esperanza para el principio de la terapéutica en enfermedades que le siguen ganando la batalla al ejercicio médico. La respuesta inmune innata permite la diferenciación de lo propio y lo extraño mediante receptores de reconocimiento de patrones moleculares asociados a patógenos que activan las células presentadoras de antígeno cuando se unen con moléculas estructural y químicamente conservadas entre los patógenos. Sin embargo, el sistema inmune se torna tan complejo que estos controles iniciales no son suficientes para un funcionamiento perfecto. La presencia de enfermedades autoinmunes continúa sin una explicación absoluta y la señal de cuándo apagar una respuesta inmune no está completamente entendida hasta ahora. El redescubrimiento de las células T reguladoras satisface no sólo explicaciones del equilibrio inmune sino que también se convierte en un blanco terapéutico muy seductor para el anhelado control de la respuesta inflamatoria, fenómenos infecciosos y autoinmunes. Consecuente con esto, la célula T reguladora explicaría cómo las infecciones que estimulan su proliferación puedan ser protectoras de autoinmunidad independiente de la carga genética o medio ambiente en que se desarrolle el individuo. Las infecciones que, por el contrario, eliminen o inactiven las células T reguladoras, favorecen la presencia de autoinmunidad. Se consultaron únicamente artículos en inglés o español en la bases de datos PubMed hasta la fecha de envío del artículo.
Palabras clave: células T reguladoras, infección, autoinmunidad, terapéutica.
ABSTRACT
The mechanisms underlying the control of the immune system are still incompletely solved. The treatment of many human diseases is still a medical challenge. The innate immune system recognizes the difference between self and non-self antigens through the binding of pathogen associated molecular patterns to pattern recognition receptors present on the antigen presenting cells. The recent rediscovered regulatory T cells participate in the immune system homeostasis. On the other hand, regulatory T cells may be incriminated in the pathology of both inflammatory and infectious diseases. Thus, these cells would be a suitable target for the treatment of diseases in which they are involved. The participation of regulatory T cells in some infectious diseases could explain why there is an opposite association between some infectious diseases such as tuberculosis and autoimmune diseases. As a corollary, depletion or inactivation of regulatory T cells could facilitate the development of autoimmune phenomena.
Key words: regulatory T cells, infection, autoimmunity, treatment.
INTRODUCCIÓN
A finales de los 90 se demostró que la aplicación de interleucina 10 (IL-10) in vitro a células T CD4+, les confería la capacidad de regular respuestas inflamatorias tipo Th1, cuando dichas células se aplicaban in vivo.
La observación que algunos patógenos que producían infecciones crónicas eran inductores de la producción de IL-10 no tardó en ser relacionada con estas células reguladoras, haciéndolas responsables de la supresión del daño tisular colateral asociado a una respuesta inflamatoria prolongada (4).
Posteriormente, se observó que no siempre era necesario el estímulo de IL-10 para que las células T reguladoras (Treg) fueran activas por lo que se clasificaron inicialmente en Treg naturales y Treg inducibles, respectivamente. Sus efectos supresores son dados por el contacto célula-célula o por citocinas.
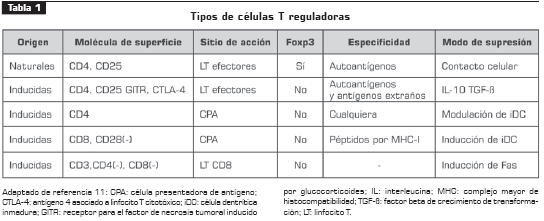
Hasta la fecha se han identificado varios subtipos de Treg con diferentes marcadores celulares y roles en respuestas inflamatorias diferentes (tabla 1).
CÉLULAS T REGULADORAS NATURALES
Son células T CD4+CD25+ y, aproximadamente, son el 5% de la población total de células TCD4+ (5). En ausencia de estas células se desarrollan enfermedades autoinmunes, lo que significa que las Treg naturales son importantes controladores de la tolerancia inmunológica. Estas células tienen un marcador exclusivo que se expresa tanto en fase activa como en reposo; el gen Foxp3, ubicado en el cromosoma X, que codifica para una proteína de nombre escurfina. La deficiencia de este gen desencadena varios síndromes autoinmunes incluyendo el de mala regulación inmune, poliendocrinopatía y enteropatía ligada al X (IPEX) (6). Su modo de supresión es mediante el contacto célula-célula.
Treg Th3. Son una población de células T CD4+CD25+ (7), que producen TGF-β como principal molécula efectora, y que actúan principalmente sobre células T efectoras. Típicamente son Foxp3 negativas.
Células CD8 supresoras. Fueron las primeras células reguladoras consideradas para la respuesta inmune. Actúan principalmente sobre células presentadoras de antígenos (CPA) y es posible que actúen sinérgicamente sobre otras Treg por el mecanismo de circunstante ( bystander), produciendo IL-10. También se cree que induce la aparición de células presentadoras reguladoras marcadas por CD186 (7,8).
Células T NK reguladoras. Hacen parte de la respuesta inmune innata y adaptativa. Característicamente, reconocen moléculas de 2-galactosilceramida que les son presentadas por medio de moléculas Cd1b o CD1d y pueden activarse produciendo citocinas típicas de la respuesta Th1 o pueden secretar predominantemente IL-10, ejerciendo así su papel regulador. No está claro aún qué estímulo hace que se diferencie al tipo regulador o al efector y es objeto de investigación actual (9, 10).
Células presentadoras reguladoras. Se ha propuesto la existencia de células presentadoras reguladoras (CPAreg), debido a la observación de subpoblaciones de macrófagos que, mediante el contacto célula-célula, inhiben la estimulación de los linfocitos T. Aunque se sugiere que su marcador de
superficie sea el CD186 aún no se ha demostrado esta hipótesis.
Células dendríticas tolerogénicas. Al igual que las CPAreg, no son células T. Sin embargo, tienen una característica biológica muy llamativa: producen la enzima indolamina-2,3dioxigenasa (IDO) que es responsable de la degradación del triptófano. Esto, además de producir un aumento en el número de Treg, hace que los patógenos tengan menor cantidad de triptófano, esencial para su desarrollo (12).
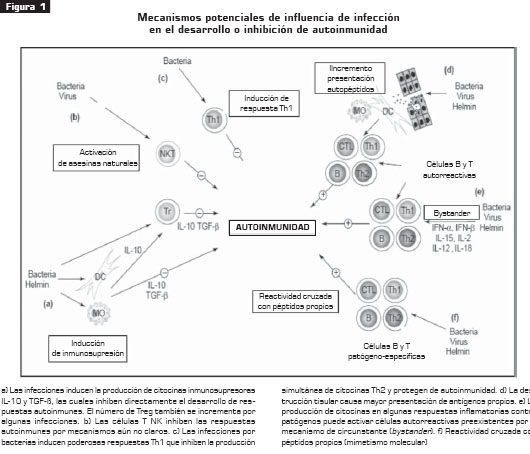
RELACIÓN ENTRE INFECCIÓN Y AUTOINMUNIDAD
La observación del incremento en la prevalencia de enfermedades autoinmunes en los países con notable disminución de infecciones por patógenos muy antiguos es la responsable de la aparición de la teoría de la "higiene", y la explicación de cómo la interacción del hombre con patógenos "amigos" previene la aparición de respuestas autoinmunes, posiblemente, al corregir errores del sistema inmune al principio del desarrollo del ser humano (13).
La otra parte la hacen algunas respuestas autoinmunes que pudieran aparecer después de infecciones, ya sea por reactividad cruzada de antígenos (mimetismo molecular) o por estimulación circunstante ( bystander) de células autorreactivas (14) (figura 1).
TREG E INFECCIÓN
Las células Treg pueden limitar la magnitud de la respuesta inmunológica contra patógenos lo cual puede provocar una respuesta fallida a la infección. Sin embargo, estas células pueden ayudar a limitar el daño tisular causado por respuestas inmunológicas intensas contra patógenos. Las Treg se pueden activar por infección y por los productos derivados de la infección. Además, responden a estos productos, expresando receptores tipo Toll ( toll-like receptors, TLR) en especial, TLR 4, 5, 7 y 8. Las condiciones creadas por los agentes infecciosos favorecen la llegada y la supervivencia de las Treg (15).
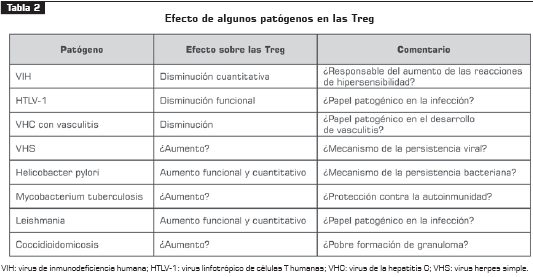
TREG Y VIH
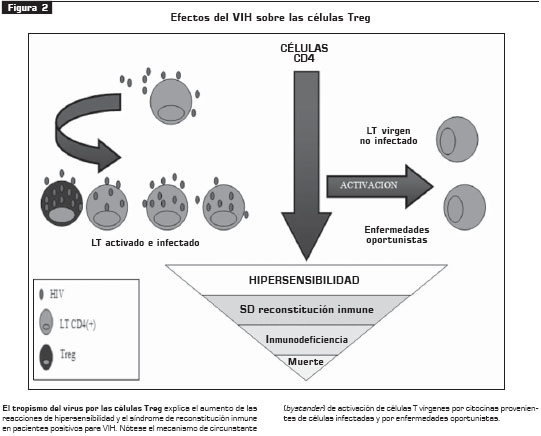
La disminución de las células CD4+ en la enfermedad por HIV obedece no solamente al efecto directo del virus sobre las células T sino también a mecanismos indirectos, como la estimulación por citocinas, que se producen continuamente en el cuadro de esta infección sobre las células T que no están infectadas.
El aumento de reacciones de hipersensibilidad en los pacientes positivos para VIH, especialmente de tipo IV, y el hecho de tener una mayor proporción de linfocitos T activados han llevado al planteamiento que un número reducido de células Treg en los pacientes positivos para VIH, puede ser el mecanismo de la perturbación del equilibrio del sistema inmune y de la hiperactivación crónica celular que termina en el "desgaste" del sistema inmune (16).
Las células Treg provenientes de voluntarios sanos son altamente susceptibles a la infección por VIH y son eliminadas directamente por el virus. Además, las células T vírgenes ( naive) son más susceptibles al virus cuando se induce en ellas la expresión de FoxP3 (17).
El impacto de la infección por VIH sobre las células Treg se ha cuantificado en sangre periférica, y se ha encontrado disminución del mRNA de FoxP3 y de células Treg inducibles, al compararse con sujetos que no están infectados (18).
Por otra parte, la relación existente entre las células Treg de pacientes positivos para VIH y el síndrome de reconstitución inmune fue más poderosa que otras variables como el conteo total de células CD4 y la carga viral total en un estudio en Uganda con 81 voluntarios positivos para VIH. Existe, pues, una relación inversa entre la cantidad de células Treg y la aparición del síndrome de reconstitución inmune (19).
De acuerdo con esto, la distribución de las células Treg en diferentes compartimentos humanos varía según el estadio de infección y se relaciona directamente con la carga viral del huésped. Es así como en pacientes que no reciben antirretrovirales y, por consiguiente, con mayor carga viral, presentan una mayor expresión de foxP3 y CTLA-4 en amígdalas y otros tejidos linfoides que los pacientes que reciben antirretrovirales y con menor carga viral, lo cual confirma el tropismo del virus por células Treg y plantea un nuevo blanco terapéutico en la inmunomodulación de la infección crónica por VIH (20) (véase figura 2).
TREG Y HTLV-1
En pacientes con enfermedades por el virus linfotrópico de células T humanas-1 (HTLV-1), como paraparesia espástica tropical, se quiso determinar la frecuencia y la función de las células Treg; se encontró que en estas células los niveles de mARN para escurfina y Foxp3 eran menores que en las células CD25+ de pacientes sanos.
Se propuso, pues, que el gen tax del virus HTLV-1 tiene un efecto directamente inhibidor sobre la expresión de Foxp3 y, por consiguiente, con la funcionalidad de células Treg. Esto sugiere que la infección directa de células Treg por HTLV-1 tiene un papel patogénico en el desarrollo de la enfermedad (21).
TREG, VIRUS DE LA HEPATITIS C Y DESARROLLO DE RIOGLOBULINEMIA MIXTA
El desarrollo de crioglobulinemia mixta en pacientes con infección crónica por el virus de la hepatitis C se asoció a la menor expresión de células T CD4+CD25+ en un estudio que comparó pacientes crónicamente infectados asintomáticos, pacientes crónicamente infectados sintomáticos y controles sanos. Los pacientes sintomáticos con crioglobulinemia mixta presentaron niveles significativamente reducidos de CD25+ respecto a pacientes infectados asintomáticos y pacientes sanos.
Estos hallazgos sugieren un papel protagónico de las células Treg en el desarrollo de vasculitis por crioglobulinemia mixta en pacientes positivos para el VHC y una relación directa con la autoinmunidad (22).
TREG Y VIRUS DEL HERPES
Las observaciones sobre la magnitud de la respuesta inmune en animales vacunados contra el virus del herpes en presencia o en ausencia de las células Treg hacen pensar que la expresión de estas células pudiese tener relación patológica con el desarrollo de infección latente por el virus del herpes (23).
Es así como los linfocitos T CD8+ de memoria tienen una respuesta tres veces mayor en animales con disminución de células Treg previa a la vacunación con péptidos de superficie del virus del herpes simple (24).
TREG Y VIRUS DE EPSTEIN-BARR
El virus de Epstein-Barr evita su erradicación por medio de la expresión de proteínas latentes que inducen respuestas inmunosupresoras.
Una de estas proteínas latentes, la LMP1, se ha implicado en la estimulación de la expresión de celulas Treg y parece ser un mecanismo para establecer infección latente en el hospedero, aunque el modo en que esto sucede no está claro aún (25).
TREG Y HELICOBACTER PYLORI
A pesar de que la infección por Helicobacter pylori induce una extensa infiltración de neutrófilos, macrófagos y de linfocitos B y T el resultado final en zonas de alta prevalencia es el establecimiento de una infección crónica y una pobre o nula erradicación de la bacteria, así como también una alta tasa de reinfección a pesar de tratamientos antibióticos agresivos (26).
La infección persistente no incrementa la respuesta de las células T de memoria; al contrario, los estudios realizados sugieren que disminuye dicha respuesta cuando se compara con las células T de sujetos no infectados con H. pylori (27).
Este planteamiento se ha reproducido con la depleción de las células T CD4+CD25+ de tejidos infectados con H. pylori o con la adición de IL-2 en los cultivos de células T de memoria para H. pylori. El resultado fue una proliferación de la respuesta celular contra la bacteria, que no ocurre en presencia de Treg.
En un estudio realizado en 55 pacientes positivos para H. pylori y 25 pacientes negativos para H. pylori, se sugiere que las células Treg tienen la capacidad de suprimir la respuesta contra H. pylori, como también que la subpoblación de estos linfocitos se expande en el contexto de una infección crónica (28).
TREG Y MYCOBACTERIUM TUBERCULOSIS
Actualmente se observa una disminución en la incidencia de las infecciones por micobacterias y un aumento paralelo de las enfermedades autoinmunes en países desarrollados (29). Las teorías acerca de esta posible relación explican cómo las micobacterias son "viejos amigos" en el desarrollo adecuado del sistema inmune y la corrección de fenómenos autorreactivos que pudiesen escapar al sistema de selección positiva en el timo (30). Desde el punto de vista biológico, poseer un sistema inmune muy competente (llámese resistente a la infección) es el precio que hay que pagar por desarrollar autoinmunidad.
La observación de aumento de los niveles de las citocinas producidas por células Treg en infecciones por Mycobacterium tuberculosis, como IL-10 y TGF-β, hace pensar que ιste favorece la expresiσn de cιlulas Treg y que, de esta forma, la interacción del hospedero con M. tuberculosis resulte en protección contra enfermedades como esclerosis múltiple y diabetes mellitus tipo1 (29, 30).
Sin embargo, no es claro aún si estas citocinas son producidas en este escenario por células Treg o por otra población celular, por lo que no se puede asegurar que las infecciones por micobacterias resulten en un aumento de la expresión de Treg, como estos hallazgos lo sugieren.
En un estudio reciente en células de sangre periférica, se demostró que la población de las Treg en pacientes es tres veces mayor veces que en individuos sanos y la expresión de FoxP3 es el doble. Las Treg contribuyen a la respuesta inmunológica fallida contra M. tuberculosis, dado que son bastante activas en los tejidos clave en donde se da la infección (31).
TREG Y LEISHMANIA
Después de la primera semana de infección con Leishmania amazonensis, se detectan altos niveles de células T CD25+, como también de Foxp3, y TGF- β1 en la piel y los ganglios linfαticos de ratones. Un resumen sobre el efecto de algunos patógenos sobre las Treg se ilustra en la tabla 2.
Para validar el papel benéfico de las Treg en la infección por Leishmania amazonensis, se transfieren células CD25+ en ratones RAG1 susceptibles a la infección y se compara con ratones RAG1 que no reciben células Treg. El efecto protector de estas células coincide con la disminución de los niveles de IFN-γ que producen las células T efectoras en la infección por Leishmania y sugiere un posible blanco terapéutico en esta enfermedad (32).
TREG Y COCCIDIOIDOMICOSIS
La respuesta inmune en la coccidioidomicosis está aún poco definida. Sin embargo, el hallazgo de células T CD25+ en un número similar al de las células T CD25 y las células B perigranulomatosas en muestras pulmonares sugiere que la respuesta celular está inhibida en la coccidioidomicosis por Treg (33).
CÉLULAS T REGULADORAS Y TERAPÉUTICA
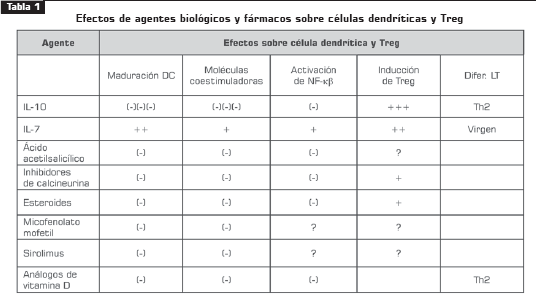
Así como las células dendríticas inducen la respuesta de las células T efectoras, las células dendríticas que generan tolerancia promueven el desarrollo de las Treg. La manipulación de células dendríticas mediante diferentes agentes biológicos o farmacológicos es una esperanza terapéutica para el mejor control de condiciones inflamatorias crónicas, como rechazos de trasplantes, enfermedades autoinmunes y algunas infecciones (tabla 3).
La IL-10 es una citocina con propiedades inmunomoduladoras muy poderosas. Regula la proliferación y la diferenciación de células B, timocitos y mastocitos. Una propiedad muy importante de la IL- 10, desde una perspectiva inmunoterapéutica, es la capacidad de inhibir las células Th1. Este efecto se consigue a través del bloqueo de las células presentadoras de antígeno para producir IFN-γ y asν la diferenciaciσn de linfocitos T CD4+ hacia Th1, además de bloquear también la producción de IL-12. Estas propiedades permitirían su uso en respuestas inflamatorias crónicas, mediadas por Th1, y podría limitar el daño tisular colateral al inducir la proliferación de las Treg (34).
Se han estudiado ejemplos que sustentan esta hipótesis en artritis reumatoide, enfermedad inflamatoria intestinal, psoriasis, hepatitis C crónica y enfermedad injerto Vs. huésped. Sin embargo, los resultados actuales han sido muy heterogéneos y muy inferiores a las expectativas (35).
Por otra parte, el uso de IL-7 en ratones positivos para VIH estimula la diferenciación periférica de linfocitos T efectores y la proliferación de linfocitos T vírgenes en el timo con posibilidad de diferenciarse a Treg, según el estímulo y el contexto celular al que sea sometido, por ejemplo, IL-10 (36).
Actualmente, algunos fármacos, como los análogos de la vitamina D (calcitriol), ejercen acciones inmunomoduladoras a través de la producción de IL- 10. Otros, como los inhibidores de calcineurina (ciclosporina A), inhiben la maduración de células dendríticas y, por lo tanto, inducen las Treg (tabla 3).
El papel de estos agentes en procesos infecciosos está aún por establecerse y hasta la fecha no existen estudios en humanos que demuestren beneficio.
CONCLUSIONES
El redescubrimiento de las células Treg y su papel en la respuesta inmune, no sólo brinda explicaciones sobre la fisiopatología de algunas enfermedades, sino que también las convierte en un blanco terapéutico muy atractivo para el tratamiento de enfermedades autoinmunes e infecciosas.
Sin embargo, se deben considerar otros aspectos a la hora de interpretar resultados, ya que la población de Treg entre humanos y ratones es diferente, además de que las poblaciones Treg son difíciles de aislar y su fenotipo es motivo de controversia.
Correspondencia: Juan Manuel Anaya, Corporación para Investigaciones Biológicas, Carrera 72A No.78B-141, Medellín, Colombia
Teléfono: (574) 441 0855; fax: (574) 441 5514
REFERENCIAS
1. Janeway CA. How the immune system works to protect the host from infection: A personal view. Proc Natl Acad Sci USA. 2001;7461-8. [ Links ]
2. Holm Tl, Nielsen J, Claesson MH. CD4+CD25+ regulatory T cells: I. Phenotype and physiology. APMIS. 2004;112:629-41. [ Links ]
3. Fontenot JD, Gavin MA, Rudensky AY. Foxp3 programs the development and function of CD4(+) CD25(+) regulatory T cells. Nat Immunol. 2003;4:330-6. [ Links ]
4. Sundstedt A, Oneill EJ, Nicolson KS, Wraith DC. Role for IL-10 in suppression mediated by peptide induced regulatory T cells in vivo. J Immunol. 2003;170:1240-8. [ Links ]
5. Sakaguchi S, Sakaguchi N, Asano M, Itoh M, Toda M. Immunologic self tolerance maintained by activated T cells expressing IL-2 receptor alpha chains (CD25). Breakdown of a single mechanism of self tolerance causes various autoimmune diseases. J Immunol. 1995;155:1151-64. [ Links ]
6. Bennett CI, Christie J, Ramsdell F, Brunkow ME, Ferguson PJ, Whitesell L, Kelly TE, Saulsbury FT, Chance PF, Ochs HD. The immune dysregulation, polyendocrinopathy, enteropathy, X-linked syndrome (IPEX) is caused for mutations in FoxP3. Nat Gen. 2001;27:18-20. [ Links ]
7. Weiner Hl. Induction and mechanism of action of transforming growth factor beta secreting Th3 regulatory cells. Immunol Rev. 2001;182:207-14. [ Links ]
8. Suvas S, Rouse BT. Regulation of microbial immunity: the suppressor cell renaissance. Viral Immunol. 2005;18:411-8. [ Links ]
9. Godfrey DI, Kronenberg M. Going both ways: immune regulation via Cd1 dependent NKT cells. J Clin Invest. 2004;114:1379-88. [ Links ]
10. Gómez LM, Delgado M, Martín J, Anaya JM. Linfocitos T reguladores. En: Anaya JM, Pineda-Tamayo R, Gómez LM et al. (editores). Artritis reumatoide: bases moleculares, clínicas y terapéuticas. Primera edición. Medellín: Corporación para Investigaciones Biológicas; 2006. p.87-93. [ Links ]
11. Gómez LM, Martín J, Anaya JM. Autoimmunity co-signaling system: regulatory T cells, CTLA-4 and FOXP3. Inmunología. 2005;24:283-97. [ Links ]
12. Mellor A, Munn DH. IDO expression by dendritic cells: tolerance and tryptophan catabolism. Nat Rev Immunol. 2004;4:763-74. [ Links ]
13. Bach JF. The effect of infections on susceptibility to autoimmune and allergic diseases. N Engl J Med. 2002;347:911-20. [ Links ]
14. Kamradt T, Goggel R, Erj KJ. Induction, exacer-bation and inhibition of allergic and autoimmune diseases by infection. Trends Immunol. 2005;26:260-7. [ Links ]
15. Belkaid Y, Rouse BT. Natural regulatory T cells in infectious disease. Nat Immunol. 2005;6:353-60. [ Links ]
16. Temesgen Z, Beri G. HIV and drug allergy. Immunol Allergy Clin N Am. 2004;24:521-31. [ Links ]
17. Oswald-Richter K, Grill SM, Shariat N, Leelawong M, Sundrud MS, Haas DW, Unutmaz D. HIV infection of naturally occurring and genetically reprogrammed human regulatory T-cells. PLoS Biol. 2004;2:E198. [ Links ]
18. Apoil PA, Puissant B, Roubinet F, Abbal M, Massip P, Blancher A. FOXP3 mRNA levels are decreased in peripheral blood CD4+ lymphocytes from HIV-positive patients. J Acquir Immune Defic Syndr. 2005;39:381-5. [ Links ]
19. Eggena MP, Barugahare B, Jones N, Okello M, Mutalya S, Kityo C, Mugyenyi P, Cao H. Depletion of regulatory T cells in HIV infection is associated with immune activation. J Immunol. 2005;174:4407-14. [ Links ]
20. Andersson J, Boasso A, Nilsson J, Zhang R, Shire NJ, Lindback S, Shearer GM, Chougnet CA. The prevalence of regulatory T cells in lymphoid tissue is correlated with viral load in HIV-infected patients. J Immunol. 2005;174:3143-7. [ Links ]
21. Yamano Y, Takenouchi N, Li HC, Tomaru U, Yao K, Grant CW, Maric DA, Jacobson S. Virus-induced dysfunction of CD4+CD25+ T cells in patients with HTLV-I-associated neuroimmunological disease. J Clin Invest. 2005;115:1361-8. [ Links ]
22. Boyer O, Saadoun D, Abriol J, Dodille M, Piette JC, Cacoub P, Klatzmann D. CD4+CD25+ regulatory T-cell deficiency in patients with hepatitis C-mixed cryoglobulinemia vasculitis. Blood. 2004;103: 3428-30. [ Links ]
23. Roncarolo MG, Levings MK. The role of different subsets of T regulatory cells in controlling autoimmunity. Curr Opin Immunol. 2000;12:676-83. [ Links ]
24. Toka FN, Suvas S, Rouse BT. CD4+ CD25+ T cells regulate vaccine generated primary and memory CD8+ T-cell responses against herpes simplex virus type 1. J Virol. 2004;78:13082-9. [ Links ]
25. Marshall NA, Vickers MA, Barker RN. Regulatory T cells secreting IL-10 dominate the immune response to EBV latent membrane protein 1. J Immunol. 2003;170:6183-9. [ Links ]
26. Ernst PB, Gold BD. The disease spectrum of Helicobacter pylori: the immunopathogenesis of gastroduodenal ulcer and gastric cancer. Annu Rev Microbiol. 2000;54:615-40. [ Links ]
27. Raghavan S, Suri-Payer E, Holmgren J. Antigen-specific in vitro suppression of murine Helicobacter pylori-reactive immunopathological T cells by CD4CD25 regulatory T cells. Scand J Immunol. 2004;60:82-8. [ Links ]
28. Lundgren A, Suri-Payer E, Enarsson K, Sven-nerholm AM, Lundin BS. Helicobacter pylori-specific CD4+ CD25high regulatory T cells suppress memory T-cell responses to H. pylori in infected individuals. Infect Immun. 2003;71:1755-62. [ Links ]
29. Rook GA, Adams V, Hunt J, Palmer R, Marti-nelli R, Brunet LR. Mycobacteria and other environmental organisms as immunomodulators for immunoregulatory disorders. Springer Semin Immunopathol. 2004;25:237-55. [ Links ]
30. Olobo JO, Geletu M, Demissie A, Eguale T, Hiwot K, Aderaye G, Britton S. Circulating TNF-a, TGF-b, and IL-10 in tuberculosis patients and healthy contacts. Scand J Immunol. 2001;53:85-91. [ Links ]
31. Guyot-Revol V, Innes JA, Hackforth S, Hinks T, Lalvani A. Regulatory T cells are expanded in blood and disease sites in tuberculosis patients. 2005 as doi:10.1164/rccm.200508-1294OC [ Links ]
32. Ji J, Masterson J, Sun J, Soong L. CD4+CD25+ regulatory T cells restrain pathogenic responses during Leishmania amazonensis infection. J Immunol. 2005;174:7147-53. [ Links ]
33. Li L, Dial SM, Schmelz M, Rennels MA, Ampel NM. Cellular immune suppressor activity resides in lymphocyte cell clusters adjacent to granulomata in human coccidioidomycosis. Infect Immun. 2005;73: 3923-8. [ Links ]
34. Penna G, Giarratana N, Amuchastegui S, Mariani R, Daniel KC, Adorini L. Manipulating dendritic cells to induce regulatory T cells. Microbes Infect. 2005;7:1033-9. [ Links ]
35. Asadullah K, Sterry W, Volk HD. Interleukin-10 therapy review of a new approach, Pharmacol Rev. 2003;55:241-69. [ Links ]
36. Llano A, Este JA. Chemokines and other cytokines in human immunodeficiency virus type 1 (HIV-1) infection. Inmunología. 2005;24:246-60. [ Links ]