Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Infectio
Print version ISSN 0123-9392
Infect. vol.10 no.3 Bogotá July/Sept. 2006
ARTÍCULO DE REVISIÓN
Anticuerpos monoclonales:desarrollo físico y perspectivas terapéuticas
Monoclonal antibodies: physical development and therapeutic perspectives
NINA PATRICIA MACHADO1,
GERMÁN ALBERTO TÉLLEZ2,
JOHN CARLOS CASTAÑO2
1 Universidad de Sucre, Sincelejo, Colombia
2 Grupo de Inmunología Molecular, Centro de Investigaciones Biomédicas,
Universidad del Quindío, Armenia, Colombia.
Fecha de recepción: 14/03/2006; fecha de aceptación; 06/07/2006
Resumen
Los anticuerpos monoclonales son glucoproteínas especializadas que hacen parte del sistema inmune, producidas por las células B, con la capacidad de reconocer moléculas específicas (antígenos). Los anticuerpos monoclonales son herramientas esenciales en el ámbito clínico y biotecnológico, y han probado ser útiles en el diagnóstico y tratamiento de enfermedades infecciosas, inmunológicas y neoplásicas, así como también en el estudio de las interacciones patógeno-hospedero y la marcación, detección y cuantificación de diversas moléculas.
Actualmente, la incorporación de las técnicas de biología molecular e ingeniería genética y proteica han permitido ampliar el horizonte de la generación de anticuerpos monoclonales y sus usos, y se han encontrado técnicas como la hibridación, la quimerización, la humanización y la producción de anticuerpos monoclonales totalmente humanos.
Es una de las áreas de mayor crecimiento en la industria biotecnológica y farmacéutica; en el mercado se encuentran cerca de 29 anticuerpos monoclonales aprobados por la Food and Drug Administration (FDA) de los Estados Unidos para uso en humanos.
Palabras clave: anticuerpos monoclonales, inmunoglobulinas, inmunoterapia.
Abstract
Monoclonal antibodies are specialized glucoproteins that belong to the immune system, produced by the B cells which have the ability to recognize other molecules (antigens). They are important tools in clinical practice and biotechnology and have been useful in the diagnosis and treatment of infectious, inflammatory, immunological and neoplasic diseases, as well as in the study of the host/patogen interaction, and in the detection and quantification of diverse molecules.
The incorporation of molecular biology, proteic and genetic engineering have extended the production and uses of monoclonal antibodies, finding techniques like hybridoma, chimerization, humanization and fully human monoclonal antibodies.
Monoclonal antibodies represent one of the major areas of growth on the biotechnology and pharmaceutical industry, and there are currenty 19 monoclonal antibodies approved by the FDA for human use.
Key words: monoclonal antibodies, immunoglobulin, immunotherapy
INTRODUCCIÓN
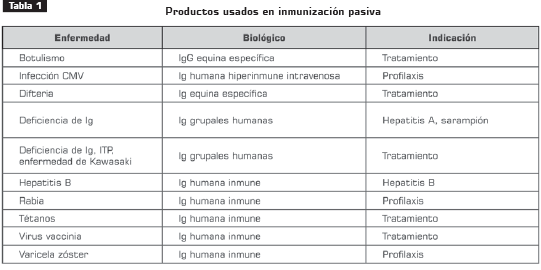
El reconocimiento de un componente protector (anticuerpos) en el suero de pacientes convalecientes de enfermedades infecciosas, marcó los inicios del desarrollo de la medicina preventiva (1 ). El uso de estos anticuerpos protectores como fracciones de inmunoglobulinas crudas que se unen a los antígenos representó el primer tratamiento efectivo de numerosas enfermedades infecciosas (tabla 1).
Los anticuerpos, también denominados inmunogloblulinas (Ig), son glucoproteínas especializadas que hacen parte de la inmunidad humoral; son producidas por las células del sistema inmune llamadas células B, que tienen la capacidad de reconocer otras moléculas específicas llamadas antígenos (2 ).
La respuesta inmunológica específica se desarrolla cuando un organismo ha sido expuesto a uno o varios antígenos, originando una respuesta policlonal, es decir, la producción de anticuerpos contra un rango amplio de estructuras presentes en los antígenos. Por el contrario, la respuesta monoclonal se da por la selección de un solo clon activado de células B que produce un anticuerpo para un determinante antigénico único (3 ).
ESTRUCTURA GENERAL DE LOS ANTICUERPOS
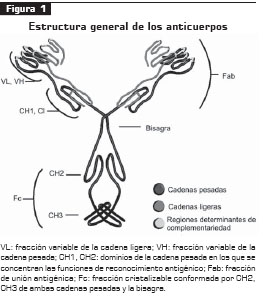
Los anticuerpos son proteínas que envuelven una estructura bioquímica compleja demarcada por la unión de cuatro cadenas proteicas: dos pesadas (CH), y dos ligeras (CL), unidas mediante puentes disulfuro (figura 1). Funcionalmente, los anticuerpos se dividen en una fracción que involucra el reconocimiento antigénico, denominada Fab, y una fracción cristalizable (Fc) que media funciones efectoras como la citotoxicidad celular que depende del anticuerpo ( antibody dependant cellular cytotoxicity, ADCC) y la citotoxicidad que depende del complemento (CD) (2, 4).
Las regiones Fab están conformadas por una región variable y otra conservada. La región variable tiene una diversidad casi infinita para el reconocimiento de antígenos, gracias a las regiones determinantes de complementariedad (CDR), o regiones hipervariables; la región conservada ayuda a la estabilización de la reacción entre los segmentos CDR con el antígeno (1, 4, 5, 6).
Los anticuerpos no sólo son componentes fundamentales del sistema inmune sino que, junto con el estudio y el descubrimiento de sus funciones, han servido como herramientas biológicas útiles usadas de rutina en las áreas diagnósticas, terapéuticas y de investigación.
APLICACIONES GENERALES DE LOS ANTICUERPOS MONOCLONALES
La propiedad de los anticuerpos de unirse con alta especificidad y afinidad a una molécula blanco permite su utilización como herramientas esenciales en investigación biomédica y clínica, las cuales han probado ser invaluables para (4, 5):
1. detectar y cuantificar niveles de expresión de genes;
2. determinar la localización de la expresión de genes a nivel celular, subcelular y en los tejidos;
3. identificar las interacciones moleculares con los productos de genes, por ejemplo, la inmuno-precipitación;
4. identificación de marcadores fenotípicos únicos de un tipo celular particular; ésta es la base de la moderna clasificación de linfocitos y fagocitos monucleares;
5. inmunodiagnóstico: en el diagnóstico de muchas enfermedades infecciosas y sistémicas al permitir la detección de antígenos y anticuerpos específicos en la circulación o tejidos usando anticuerpos monoclonales en inmunoensayos, y como marcadores específicos para el diagnóstico por imágenes;
6. diagnóstico y tratamiento de tumores específicos: los anticuerpos monoclonales se usan en la detección de tumores mediante técnicas inmunológicas de diagnóstico y para la inmunoterapia de tumores in vivo;
7. análisis funcionales de moléculas de la superficie celular o de proteínas secretorias;
8. en la investigación inmunológica, los anticuerpos monoclonales que se unen a las moléculas de la superficie celular que puedan estimular o inhibir funciones celulares particulares, son una herramienta invaluable para definir la función de moléculas, incluidos los receptores para antígenos;
9. en el estudio de los procesos de interacción hospedero- agente infeccioso, las aplicaciones de los anticuerpos monoclonales son prácticamente ilimitadas no sólo en los estudios funcionales sino, también, en la selección de posibles blancos terapéuticos y de candidatos para vacunas o el desarrollo de anticuerpos anti-anticuerpos (antiidiotipos) como vacunas.
PRODUCCIÓN Y DESARROLLO DE LOS ANTICUERPOS MONOCLONALES
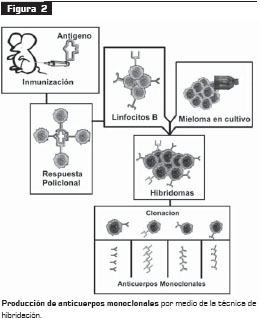
La producción de anticuerpos monoclonales se estableció con la tecnología creada en 1975 por Georges Köhler y César Milstein, que consistía en la generación de una línea celular estable, secretora de un isotipo determinado de inmunoglobulina contra un antígeno específico, fruto de la fusión de dos células diferentes por medios físicos y químicos (polietilenglicol- centrifugación) (figura 2).
La primera célula involucrada es un linfocito B de un animal previamente inmunizado con el antígeno de interés, que aporta la memoria inmune y la capacidad de producir anticuerpos contra el antígeno específico. La segunda es una célula tumoral de mieloma no secretora de anticuerpos, deficiente en la enzima hipoxantina-guanina-fosforribosil transferasa (HGPRT), útil en el proceso de selección posterior de los hibridomas, que aporta su capacidad de división ilimitada (inmortalidad). De esta unión surge un tipo de célula inmortal con la capacidad virtualmente ilimitada de producción de anticuerpos monoclonales, llamada hibridoma (3, 4).
Dos características de la hibridación de estas células somáticas son de extremo valor: 1) es uno de los métodos básicos de producción de anticuerpos monoclonales contra un determinante antigénico conocido, y 2) se puede utilizar para identificar antígenos desconocidos presentes en una mezcla, puesto que cada hibridoma es específico para un solo determinante antigénico (1, 3).
En la actualidad se han incorporado técnicas de biología molecular e ingeniería genética que han ampliado el horizonte de la generación de los anticuerpos monoclonales y sus usos. Desde que se introdujo el primer anticuerpo monoclonal producido por la tecnología del hibridoma para uso clínico, en pacientes con rechazo primario de trasplantes, se observó que estos anticuerpos monoclonales, por ser de origen de ratón, generaban intensas respuestas de hiperreactividad en los pacientes (7). Consecuente con ello, se han desarrollado diferentes técnicas para minimizar los componentes generadores de esta respuesta. Igualmente, han permitido el desarrollo de métodos in vitro de generación de anticuerpos monoclonales en bacterias mediante transgénesis con las secuencias de interés.
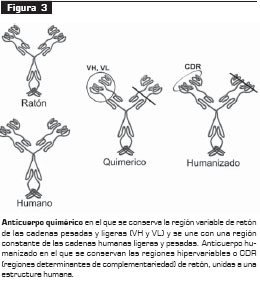
En 1985 se crearon los primeros anticuerpos quiméricos humanos a partir de ratones, con la tecnología del ADN recombinante, en la cual los genes que codifican la región variable de las Ig de ratón se unen con genes que codifican la región constante humana para, luego, ser insertados en células de mieloma, donde producirán nuevas moléculas de anticuerpo que tendrán una parte humana pero que tienen la unión específica del antígeno (Fab) generada en ratones (1, 5) (figura 3).
Una de las limitaciones presentadas con la quimerización de anticuerpos monoclonales de ratón es la baja frecuencia de transformantes que produzcan el anticuerpo quimérico.
Aunque los anticuerpos monoclonales quiméricos son menos inmunogénicos que los anticuerpos monoclonales de ratón, se han observado respuestas importantes de tipo anticuerpo-antiquiméricos en el 40% de los productos que se han usado en humanos (7).
En 1986 se incorporó la técnica de humanización de anticuerpos con el objetivo de minimizar los componentes del anticuerpo de ratón, generadores de la respuesta inmune. La construcción de anticuerpos monoclonales humanizados se da gracias a la ingeniería de proteínas (7). En este proceso se transfieren los CDR provenientes de las Ig de ratón a estructuras de las regiones variables de cadenas pesadas o ligeras de una Ig proveniente de una especie diferente, en este caso, la humana (5, 6).
Sin embargo, algunos estudios han reportado que esta transferencia puede generar una afinidad variable hacia el antígeno; estos tipos de anticuerpos los han hecho diferentes grupos de investigación y se han obtenido anticuerpos que mantienen la afinidad antigénica y anticuerpos que la han disminuido. Este proceso debe llevar consigo la conservación de la afinidad nativa para lo cual se ha implementado el modelo molecular de las regiones receptoras y donantes. Aunque la humanización de anticuerpos monoclonales ha minimizado la respuesta anti-anticuerpo humanizado, se han reportado respuestas exageradas con el 9% de los productos que se han usado (7).
GENERACIÓN DE ANTICUERPOS MONOCLONALES TOTALMENTE HUMANOS
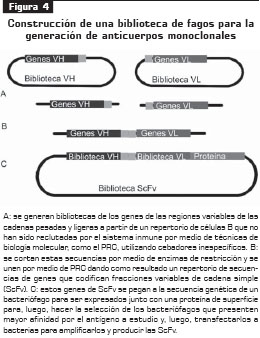
Mientras que la producción de anticuerpos monoclonales de ratón se lleva a cabo rutinariamente por la tecnología del hibridoma, la producción de anticuerpos monoclonales humanos por esta tecnología ha sido difícil, debido a que los hibridomas humanos y las líneas celulares derivadas de mieloma múltiple han sido difíciles de desarrollar, y la inmunización in vivo de humanos no es factible para muchos antígenos. Sin embargo, varias técnicas hacen posible la generación de anticuerpos monoclonales humanos como la expresión de fragmentos de Ig como los fracciones variables de cadena única, Fab y ScFv, en bacterias, gracias a las bibliotecas de bacteriófagos que tienen insertado dentro de su ADN tales genes (figura 4).
Actualmente, la tecnología del fago es una de las más utilizadas y bien establecidas para el desarrollo de nuevos anticuerpos monoclonales humanos
(4). La construcción de anticuerpos monoclonales recombinantes mediante la tecnología de bibliotecas de fagos con genes que codifican las regiones variables de Ig, ha probado ser útil en la investigación básica y en usos clínicos; es una de las estrategias mejor establecidas y optimizadas (8).
Las regiones ScFv son las candidatas usadas en esta tecnología, por contener los dominios de unión antigénica de las Ig. Estas construcciones de bibliotecas de genes proveen, entonces, unos repertorios de anticuerpos con alta afinidad para un amplio número de antígenos, lo cual está determinado por el tamaño de la biblioteca y alcanza tamaños de 6,7 x 109, los cuales pueden ser usados en laboratorios de biología molecular.
ANTICUERPOS HUMANOS GENERADOS EN RATONES TRANSGÉNICOS
Un enfoque radicalmente diferente para abordar el problema de la humanización de los anticuerpos, es la generación de hibridomas de ratón que produzcan anticuerpos totalmente humanos. Para este propósito, las Ig nativas procedentes de ratones transgénicos, a los cuales se les han reemplazado los genes de las regiones variables por humanas, en las que los ratones llevan a cabo la recombinación de los genes VDJ que son los responsables de la codificación y ensamblaje de las Ig; estos anticuerpos producidos tienen una alta afinidad con secuencias terminales humanas (4 ).
Por otra parte, también se han construido cromosomas artificiales de levadura (YAC) que albergan fragmentos grandes de los genes de Ig de ambas cadenas pesadas y livianas humanas, los cuales se introducen en una línea germinal de ratones para crear cepas de ratones capaces de producir anticuerpos específicos totalmente humanos, generando ratones con la capacidad de producir anticuerpos similares a los humanos, incluidos los procesos de reorganización genética, ensamblaje y diversidad nucleotídica (5 , 9).
El contar con ratones que produzcan anticuerpos totalmente humanos es una herramienta invaluable dentro de la terapéutica y el uso clínico de los anticuerpos monoclonales debido a que la preparación de anticuerpos monoclonales de ratón es un procedimiento que está bien establecido y ampliamente usado.
APLICACIONES CLÍNICAS DE LOS ANTICUERPOS MONOCLONALES
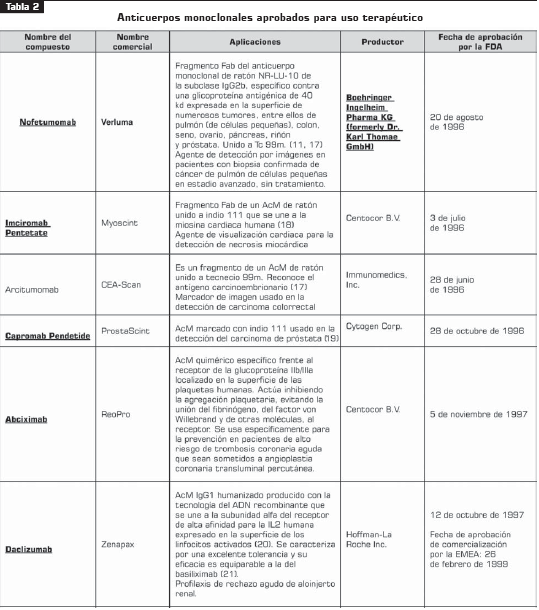
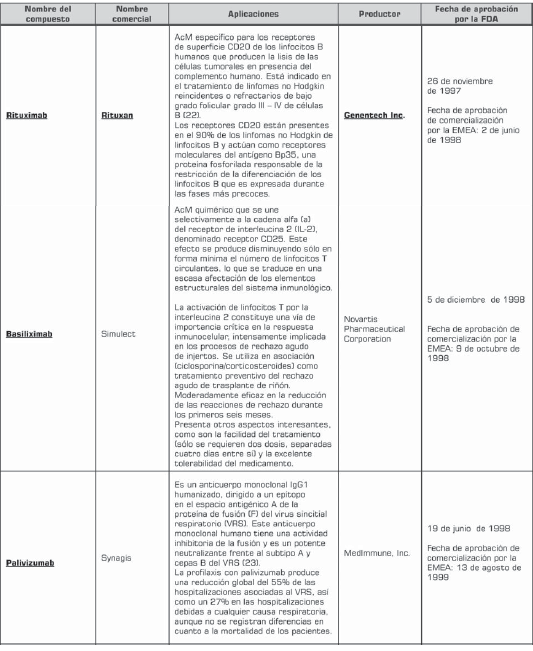
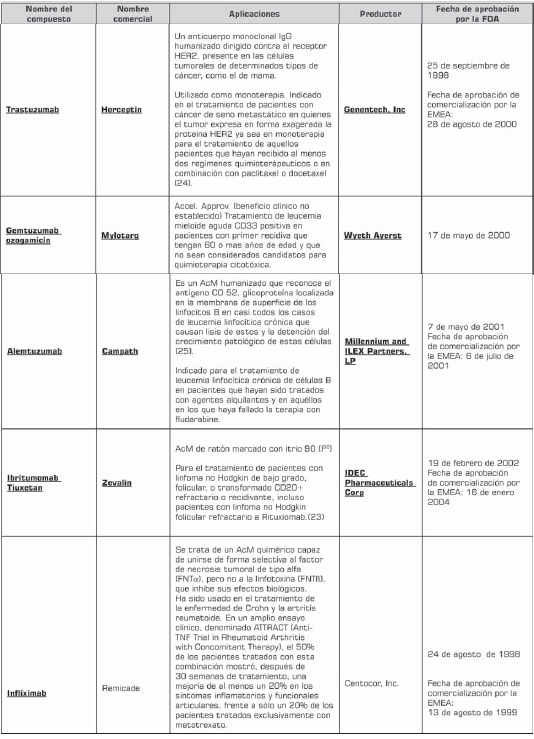
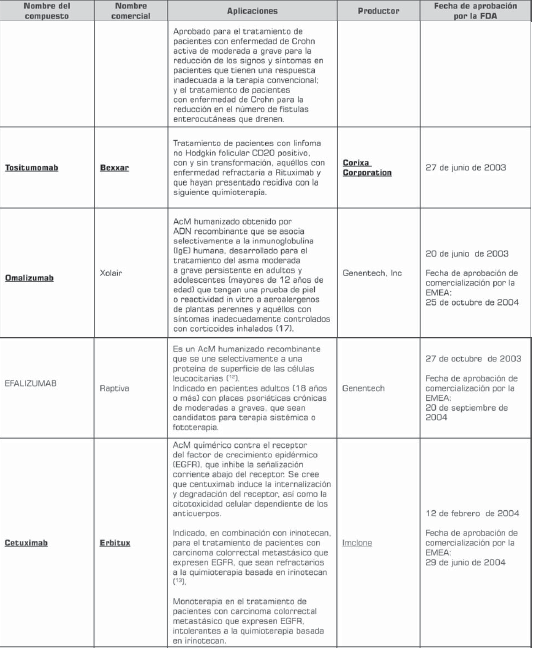
Actualmente, la terapia con anticuerpos monoclonales representa el área de crecimiento más grande de la industria farmacéutica. En 2003 y 2004, este desarrollo alcanzó 48% de incremento. Dentro del uso clínico se han aprobado cerca de 29 anticuerpos monoclonales para uso terapéutico o diagnóstico por la FDA (tabla 2) y cerca de 150 en estudios clínicos (6 , 10 ). En los próximos cuatro años se espera que el mercado de los anticuerpos monoclonales triplique su valor de US $10,3 billones en el 2004 a US $30,3 billones en el 2010 (7).

Cuando un anticuerpo es diseñado como medicamento, todas sus diferentes características, incluidas inmunogenicidad, afinidad, estabilidad, función efectora, vida media, penetración del tejido y distribución, deben ser tomadas en consideración y optimizadas (7, 11).
El primer anticuerpo monoclonal empleado con fines terapéuticos fue autorizado en Estados Unidos en junio de 1986 para la prevención del rechazo en los trasplantes de riñón (Muromonab Orthoclonne OKT3®) (7) .
Otro anticuerpo monoclonal, el nebacumab (CentoxinÒ), inactiva selectivamente la fracción lipídica de la endotoxina presente en la membrana exterior de las bacterias Gram negativas; fue retirado en 1993 debido a la detección de un exceso de mortalidad en los pacientes tratados.
Los anticuerpos antimelanoma (Tecnemab K1® ) son fragmentos de anticuerpos antimelanoma 225.28S combinados con tecnecio radiactivo (Tc99) para formar un radiofármaco de uso en el diagnóstico para la detección de tumores. Concretamente, se usa como coadyuvante junto con otros procedimientos diagnósticos para la visualización mediante inmunogammagrafía y ayuda en el diagnóstico diferencial en caso de sospecha de melanoma ocular; en el 2000 fue retirado del mercado por la Comisión Médica Europea de Procedimientos.
El igovomab (Indimacis 125®) es un fragmento de anticuerpo (Fab) IgG monoclonal de ratón, específico para el antígeno CA-125, presente en algunos cánceres de ovario. Al ser marcado con indio radioactivo (In111), permite la detección por inmunogammagrafía de recaídas de adenocarcinomas ováricos. En 1999 fue retirado del mercado.
El votumonab (Humaspect® ) es un anticuerpo monoclonal humano dirigido contra los antígenos asociados a células tumorales positivas para la citoqueratina del adenocarcinoma humano de colon, agente de diagnóstico por imagen. Nunca fue comercializado.
ANTICUERPOS MONOCLONALES EN LISTA DE ESPERA PARA USO CLÍNICO
Natalizumab: es un anticuerpo monoclonal recombinante IgG4 dirigido contra la integrina alfa 4; ha demostrado su eficacia en las recaídas en pacientes con esclerosis múltiple y enfermedad de Crohn. Los datos preliminares muestran beneficios en la colitis ulcerativa. Para determinar su papel en la terapéutica en necesario compararlo con otras modalidades existentes (8).
Nerelimomab: ha demostrado tener algunos beneficios en el tratamiento del choque séptico; sin embargo, los datos clínicos son conflictivos, y dificultan la valoración de su eficacia. También ha sido evaluado en artritis reumatoide, colitis ulcerativa y enfermedad de Crohn (12).
Oregovomab: es un anticuerpo monoclonal de ratón que reconoce el antígeno CA125 asociado a tumores de ovario; algunos estudios sugieren que la respuesta inmune inducida por el oregovomab es capaz de incrementar el tiempo de recaída en pacientes con carcinoma avanzado de ovario. Junto con el tenecio 99, en algunos estudios ha sido usado con éxito en radioinmunogammagrafía para el cáncer de ovario (12).
Priliximab: es un anticuerpo monoclonal intravenoso que induce una significante y prolongada supresión de las células CD4 circulantes. Su eficacia se ha observado en la micosis fungoide, así como en la profilaxis del rechazo en el trasplante de corazón (combinada con terapia inmunosupresora). En un estudio controlado, el priliximab fue inefectivo en la esclerosis múltiple (12).
Afelimomab: es un anticuerpo monoclonal que está en investigación para el tratamiento de la sepsis y el choque séptico. Sin embargo, los datos clínicos han sido limitados lo cual imposibilita la valoración de su eficacia (12).
Apolizumab: es un anticuerpo monoclonal (Hu1D10) contra el antígeno leucocitario humano HLADR; está indicado en pacientes con recaídas con linfomas no Hodgkin, especialmente en pacientes con linfoma folicular (12).
Bectumomab: unido al tecnecio 99 (Tc99m LL2 Fab), es un agente usado en imágenes para linfomas no Hodgkin y está indicado como un ayudante para el diagnóstico junto con las técnicas convencionales, en particular, en la estadificación de estos pacientes. Algunos datos limitados sugieren los beneficios del bectumomab marcado con I131 en el tratamiento de linfomas no Hodgkin (12).
Edrecolomab: es un anticuerpo monoclonal indicado como terapia ayudante en el posoperatorio del carcinoma colorrectal.
Enlimomab: es un anticuerpo monoclonal que se une a la ICAM-1 pudiendo inhibir la adhesión de los neutrófilos al endotelio vascular. Algunos datos limitados sugieren mejoría de los pacientes receptores de trasplante renal. Otros potenciales usos incluyen la artritis reumatoide y el trasplante hepático.
Felvizumab: es un anticuerpo monoclonal para el tratamiento y la prevención en niños de la infección grave por el virus sincitial respiratorio.
Inolimomab: según datos preliminares, ha demostrado ser promisorio en la prevención y el tratamiento del rechazo de trasplantes.
PERSPECTIVAS
Debido al creciente interés que existe en dilucidar el papel de la variedad de proteínas existentes en la superficie de muchos parásitos, virus y bacterias, los anticuerpos monoclonales se han utilizado para investigar el papel de la citoxicidad dependiente de anticuerpos para el control de las infecciones por estos agentes y, también, dilucidar la importancia de estas proteínas en la invasión y la proliferación celular (13 , 14 ).
Nos encontramos dentro de una revolución y somos testigos de sus avances con el pasar del tiempo; recientemente, Abraham Karpas, Allan Dremuchervan y Barbara Zepulkowski, del Departamento de Hematología de la Universidad de Cambrigde, lograron el establecimiento de una línea celular estable de mieloma humano, lo que ha ampliado mucho más el horizonte terapéutico de los anticuerpos monoclonales al permitir la generación de un sinnúmero de anticuerpos monoclonales humanos (15 ), y ya se están dando los primeros pasos en el desarrollo de nanoanticuerpos (la partícula más pequeña de un anticuerpo natural, capaz de reconocer un antígeno) en el campo de la terapéutica contra el cáncer por Virna Cortez-Retamozo y colaboradores en el Instituto Interuniversitario para la Biotecnología en Bélgica (16 ). Se espera una oleada de anticuerpos totalmente humanos a partir del 2007.
El impacto científico y tecnológico que han tenido los nuevos descubrimientos y su incidencia en el progreso científico o en el desarrollo tecnológico, han servido de base para el mejoramiento de aplicaciones tecnológicas a la solución de problemas sociales. El desarrollo de los anticuerpos monoclonales y la producción de vacunas, entre otros, han dado lugar a un gran número de patentes que, actualmente, están autorizados y comercializados para el beneficio de la sociedad.
Correspondencia: Grupo de Inmunología Molecular, Centro de Investigaciones Biomédicas, Universidad del Quindío, Carrera 15 calle 12 Norte, Armenia, Quindío, Colombia.
REFERENCIAS
1. Sindelar RD. Pharmaceutical biotechnology. An introduction for pharmacists and pharmaceutical Scientists. 1st ed. Amsterdam: Harwood Academic Publisher; 1997. p.288-9. [ Links ]
2. Rojas W, Cano LE. Inmunología. 12a edición. Medellín: Corporación para Investigaciones Biológicas; 2001. p.155-6. [ Links ]
3. Gavilondo JV. Anticuerpos monoclonales. Teoría y práctica. La Habana: Elfos Scienticiae; 1995. p.47-51. [ Links ]
4. Bona CA, Bonilla FA. Textbook of immunology. Second edition. Amsterdam: Harwood Academic Publisher; 1990. [ Links ]
5. Bruggemann M, Caskey HM, Teale C, Waldmann H, Williams GT, Surani MA, Neuberger MS. A repertoire of monoclonal antibodies with human heavy chains from transgenic mice. Proc Natl Acad Sci USA. 1989;86:6709-13. [ Links ]
6. U.S. Food and Drug Administration, Center for Drug Evaluation and Research. Listing of approved oncology drugs with approved indications. Disponible en: http://www.fda.gov/cder/cancer/druglistframe.htm (30 de enero de 2006) [ Links ]
7. Bakr MA. Induction therapy. Exp Clin Transplant. 2005;3:320-8. [ Links ]
8. Thomson MICROMEDEX. Sistema de investigación de drogas. Disponible en internet en: http://acpcommunity.acp.edu/mdxdocs/whatsnew.htm 7 de febrero de 2006). [ Links ]
9. Mendez MJ, Green LL, Corvalan JR, Jia XC, Maynard-Currie CE, Yang XD, Gallo ML, Louie DM, Lee DV, Erickson KL, Luna J, Roy CM, Abderrahim H, Kirschenbaum F, Noguchi M, Smith DH, Fukushima A, Hales JF, Klapholz S, Finer MH, Davis CG, Zsebo KM, Jakobovits A. Functional transplant of megabase human immunoglobulin loci recapitulates human antibody response in mice. Nature Genetics. 1997;15:146-56. [ Links ]
10. U.S. Food and Drug Administration, Center for Drug Evaluation and Research. Therapeutic biological products. Disponible en http://www.fda.gov/cder/biologics/default.htm (30 de enero de 2006) [ Links ]
11. Balaban EP, Walter BS, Cox JV et al. Radionuclide imaging of bone marrow metastases with a Tc-99m labeled monoclonal antibody to small cell carcinoma. Clin Nucl Med. 1991;16:732-6. [ Links ]
12. EMEA. Comité de medicamentos de uso humano. Informe público europeo de evaluación (EPAR) ZENAPAX Denominación Común Internacional (DCI): Daclizumab. EMEA© 2005. EMEA/H/C/198. Disponible en: http://www.emea.eu.int/humandocs/PDFs/EPAR/Zenapax/017599es1.pdf [ Links ]
13. Castaño JC, Martínez AR, Marcet R, Sarracent J. Producción de anticuerpos monoclonales contra las proteínas mayoritarias de la membrana p30 (SAG 1) y p22 (SAG 2) de Toxoplasma gondii. Revista de Investigaciones Universidad del Quindío 2003;4:97-106. [ Links ]
14. Castaño JC, Sarracent J. Inmunización intranasal de ratones con la proteína SAG2 de Toxoplasma gondii asociada con la toxina colérica. Rev Cubana Invest Biomed. 2002;21:35-45. [ Links ]
15. Karpas A, Dremucheva A, Czepulkowski B H. A human myeloma cell line suitable for the generation of human monoclonal antibodies. Proc Natl Acad Sci USA. 2001;98:1799-804. [ Links ]
16. Cortez-Retamozo V, Backmann N, Senter PD, Wernery U, De Baetselier P, Muyldermans S, Revets H. Efficient cancer therapy with a nanobody-based conjugate. Cancer Res. 2004;64:2853-7. [ Links ]
17. EMEA. Comité de medicamentos de uso humano. Informe público europeo de evaluación (EPAR) XOLAIR Denominación Común Internacional (DCI) Omalizumab EMEA© 2005. EMEA/H/C/606.Disponible en: http://www.emea.eu.int/humandocs/PDFs/EPAR/Xolair/28009505es1.pdf [ Links ]
18. U.S. Food and Drug Administration. Radiolabeled antibodies for diagnostic imaging. FDA Medical Bulletin 1996;26(3) Disponible en http://www.fda.gov/medbull/oct96/radioant.html(6 de febrero de 2006) [ Links ]
19. Haseman MK, Rosenthal SA, Polascik TJ. Capromomab pendetide imaging of prostate cancer. Cancer Biother Radiopharm. 2000;15: 131-40. [ Links ]
20. Department of Health and Human Services. Biological license application No. 97-0736 annotated clinical review. Department of Health and Human Services. December 19, 1997. [ Links ]
21. EMEA. Comité de medicamentos de uso humano. Informe europeo público de evaluación (EPAR). Rituximab, denominación común internacional (DCI) MABTHERA EMEA© 2005. EMEA/H/C/165. Disponible en: http://www.emea.eu.int/humandocs/PDFs/EPAR/Mabthera/025998es1.pdf [ Links ]
22. EMEA. Comité de medicamentos de uso humano. Informe público Europeo de evaluación (EPAR) Palivizumab Denominación Común Internacional (DCI) SYNAGIS EMEA© 2005. EMEA/H/C/257. Disponible en: http://www.emea.eu.int/humandocs/PDFs/EPAR/Synagis/190499es1.pdf [ Links ]
23. EMEA. Comité de medicamentos de uso humano. Informe público europeo de evaluación (EPAR) Trastuzumab Denominación Común Internacional (DCI) HERCEPTIN EMEA© 2005. EMEA/H/C/257.Disponible en: http://www.emea.eu.int/humandocs/PDFs/EPAR/Herceptin/177400es1.pdf [ Links ]
24. EMEA. Committee for medical products for human use. European public assessment report (EPAR) Mabcampath InternationalNonproprietary Name (INN): Alemtuzumab. EMEA© 2005. EMEA/H/C/353. Disponible en: http://www.emea.eu.int/humandocs/PDFs/EPAR/mabcampath/H-353-PI-es.pdf [ Links ]
25. EMEA. Comité de medicamentos de uso humano. Informe público Europeo de evaluación (EPAR) ZEVALIN Denominación Común Internacional (DCI) Ibritumomab tiuxetan EMEA© 2005. EMEA/H/C/0547. Disponible en: http://www.emea.eu.int/humandocs/PDFs/EPAR/zevalin/535103es1.pdf [ Links ]
26. EMEA. Comité de medicamentos de uso humano. Informe público europeo de evaluación (EPAR) RAPTIVA Denominación Común Internacional (DCI) Efalizumab MEA© 2005. EMEA/H/C/198. Disponible en: http://www.emea.eu.int/humandocs/PDFs/EPAR/raptiva/6565604es1.pdf [ Links ]
27. EMEA. Comité de medicamentos de uso humano. Informe público europeo de evaluación (EPAR) ERBITUX Denominación Común Internacional (DCI): Cetuximab. EMEA© 2005. EMEA/H/C/558. Disponible en: http://www.emea.eu.int/humandocs/PDFs/EPAR/erbitux/089404es1.pdf [ Links ]
28. EMEA. Comité de medicamentos de uso humano. Informe público europeo de evaluación (EPAR) AVASTIN Denominación Común Internacional (DCI): Bevacizumab. EMEA© 2005. EMEA/H/C/582. Disponible en: http://www.emea.eu.int/humandocs/PDFs/EPAR/avastin/17199204es1.pdf [ Links ]