Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Infectio
Print version ISSN 0123-9392
Infect. vol.10 no.4 Bogotá Oct./Dec. 2006
REVISIÓN DE TEMA
Avances en la terapia antirretroviral: inhibidores de entrada
Update in antiretroviral therapy: entry inhibitors
ANA MARÍA URDANETA1 MIKE VIVAS2
1Unidad de Farmacología, Universidad de la Sabana, Chía, Colombia.
2 Dirección Médica, Pfizer, Bogotá, D.C., Colombia.
Fecha de recepción: 31/10/2006; fecha de aceptación; 17/11/2006
Resumen
En los últimos años se ha observado una tendencia creciente en la aparición de cepas de VIH resistentes a los antirretrovirales de uso corriente. Esto plantea la necesidad del desarrollo de nuevos agentes con mecanismos de acción innovadores que evidencien una actividad antiviral más amplia. Los fármacos que bloquean los diferentes pasos previos al ingreso del virus a la célula se han denominado conjuntamente «inhibidores de entrada». Actualmente existe una gran variedad de moléculas que se encuentran en distintas fases de estudios clínicos y han mostrado resultados prometedores en su eficacia. Aún no es claro el perfil de aparición de resistencia in vivo y está por definirse la indicación más adecuada para su uso clínico.
Palabras clave: agentes antirretrovirales/antagonistas & inhibidores; agentes antirretrovirales/ farmacología; receptores, CCR5/antagonistas & inhibidores.
Abstract
The increasing number of multi-resistant HIV isolates that have been seen in the last years raises the need to develop new antiretrovirals with innovative mechanisms of action. Agents that block different pathways in viral entry are known as entry inhibitors. Currently, there are several drugs being evaluated in clinical trials that have shown hopeful results. It has to be defined the exact role of these agents in clinical practice.
Key words: HIV fusion inhibitors/pharmacology, HIV entry inhibitors/pharmacology, receptors CCR5/antagonists; receptors CCR5/inhibitors.
INTRODUCCIÓN
Desde la introducción de la terapia llamada highly active antiretroviral therapy (HAART), el virus de inmunodeficiencia humana (VIH) ha pasado de ser una enfermedad rápidamente mortal, a una enfermedad crónica y controlable. Sin embargo, los virus resistentes a los antirretrovirales no han tardado en aparecer y se ha notado aumento de estas cepas en Norteamérica y Europa (1 , 2 ).
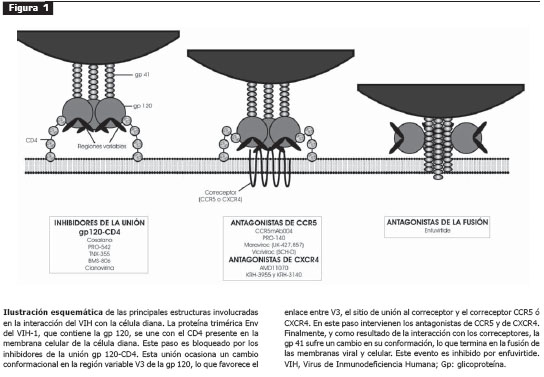
Por fortuna, la tendencia actual en el desarrollo de nuevos antirretrovirales es la innovación en el mecanismo de acción, con fármacos que inhiben los eventos previos a la integración del virus a la célula, lo que los hace activos contra virus resistentes a inhibidores de proteasa e inhibidores de la transcriptasa reversa. Estos fármacos han sido denominados colectivamente inhibidores de entrada. Existe una gran variedad de moléculas en estudio que tienen como objetivo la envoltura del VIH o las proteínas de membrana celular, ambas implicadas en la fusión del virus a la célula (figura 1). Muchas de estas moléculas han demostrado eficacia en estudios de fase temprana.
En este artículo se describen brevemente los mecanismos de la entrada del VIH a la célula diana y se revisan las principales moléculas que tienen como mecanismo de acción la inhibición o el bloqueo de los eventos implicados en la entrada del virus a la célula, así como los reportes más recientes sobre los resultados de estudios clínicos.
MECANISMOS DE LA ENTRADA DEL VIH A LA CÉLULA
Los mecanismos de unión y fusión entre el VIH y la célula huésped son procesos mediados por la interacción entre la proteína Env del VIH y dos correceptores de membrana de las células diana, CCR5 y CXCR4 (figura 1).
La proteína madura Env es una subunidad trimérica que consiste en tres subunidades de glucoproteína (gp) 120, cada una de las cuales se encuentra unida a gp41 (figura 1). Cada subunidad gp120 tiene cinco regiones variables (V1 a V5), intercaladas con regiones constantes, que tienen la capacidad de tolerar cambios estructurales significativos sin alterar la función de la Env, lo que constituye un reto para el desarrollo de vacunas y nuevos antirretrovirales (3 ).
Los correceptores CCR5 y CXCR4 pertenecen a la familia de los receptores acoplados a la proteína G. Están formados por un dominio N-terminal extracelular, tres asas transmembrana a ambos lados de la membrana plasmática y un extremo Cterminal citoplasmático. Cualquier célula que exprese la molécula CD4 y alguno de los dos correceptores (CCR5 o CXCR4) es susceptible de ser infectada por el VIH (24). Este tipo de células incluyen macrófagos, linfocitos T CD4+ y células de la microglía (4 ). El VIH se clasifica según el tipo de correceptor que utilice para infectar la célula: los virus que usan sólo un correceptor se denominan virus con tropismo único R5 o X4; y los que utilizan ambos correceptores, virus con tropismo dual o R5X4.
Luego de unirse a la CD4, la gp 120 sufre una serie de cambios en su conformación que terminan en la exposición de la región V3, de modo tal que se hace más accesible a los correceptores, así como de una región denominada sitio de unión al correceptor. Todo esto favorece la unión entre el asa V3 y el sitio de unión al correceptor, con el extremo N-terminal de CCR5 o CXCR4 (5 ). Se ha demostrado que la región V3 es la principal responsable del tropismo que tiene el virus por alguno de los correceptores y, de hecho, se ha encontrado que la presencia de residuos de carga positiva en las posiciones 11 y 25 de la secuencia de aminoácidos le confieren al virus la habilidad de usar CXCR4 en vez de CCR5. Varios autores han descrito una serie de modelos de bioinformática mediante los cuales se puede predecir el tropismo viral, usando como base la secuencia de aminoácidos del virus (6 -7 ).
La unión con los correceptores es el evento gatillo que va a originar los cambios en la conformación de la gp41 que terminan en la interacción entre HR1 y HR2, lo que finalmente conlleva a la fusión entre las membranas viral y celular (8 ).
INHIBIDORES DE ENTRADA
Los inhibidores de entrada bloquean la unión y la fusión del virus a la célula huésped mediante uno de tres mecanismos primarios:
1. interacción con el receptor de CD4;
2. interacción con los correceptores CCR5 o CXCR4, o
3. inhibición de la fusión entre las membranas plasmáticas viral y celular.
Los inhibidores de la molécula CD4 pueden ejercer su acción de dos maneras: 1) al unirse con la gp120, bloquean la unión con la CD4 y así, el cambio en la conformación que induce la CD4 sobre la proteína Env (9 ); 2) al unirse directamente con la CD4, bloquean los cambios en la conformación necesarios en la Env (10 ). Los antagonistas de los correceptores se unen a CCR5 o a CXCR4 e impiden su interacción con la proteína Env (11 ). Los inhibidores de la fusión se unen directamente a la gp41 e interfieren con la formación del haz de seis hélices, necesario para la fusión del virus con la célula huésped. En la actualidad sólo hay un fármaco inhibidor de la fusión aprobado por la Food and Drug Administration, enfuvirtide (12 ).
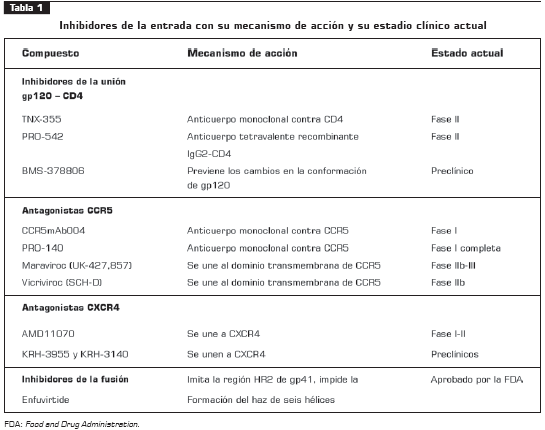
A la fecha, existen nueve inhibidores de la entrada en estudios clínicos fase I, II y III (tabla 1) y, al menos, 21 moléculas en estudios preclínicos.
INHIBIDORES DE LA UNIÓN ENTRE EL VIRUS Y LA CÉLULA: GP120-CD4
La molécula CD4 es un receptor de alta afinidad por el VIH-1, que se expresa en la membrana celular de linfocitos, macrófagos y células dendríticas. La unión entre la gp120 y la CD4 es el primer paso en el proceso de unión del virus, lo que induce un cambio en la conformación de la gp120, evento necesario para su interacción con los correceptores y para el ciclo de vida del virus (1 ).
Análogos de cosalano. El cosalano es un inhibidor de la replicación viral, que tiene actividad contra el VIH-1 y el VIH-2, y ejerce su acción al inhibir la interacción entre la gp120 y la CD4. Tiene algunas ventajas como el sinergismo con AZT y actividad contra una amplia variedad de cepas de VIH-1 y VIH-2 resistentes a los antirretrovirales; sin embargo, evidencia una potencia media (2 ) y tiene una biodisponibilidad muy baja debido que es altamente lipofílico (3 ). Actualmente se están desarrollando algunas moléculas derivadas de cosalano (4 ).
PRO-542. PRO-542 (Progenics Pharmaceuticals, Tarrytown, NY, EE.UU) es una proteína de fusión de CD4, similar a un anticuerpo monoclonal humano, que se une a la gp120, previniendo así la unión entre la Env y los linfocitos CD4+ (5 ). Al ser similar a la CD4, el VIH se une a la PRO-542 en vez de hacerlo a la CD4, volviéndose de este modo incapaz de infectar las células.
Por su mecanismo de acción novedoso, emerge como una alternativa para virus resistentes a otros antirretrovirales. Los estudios clínicos fase I han mostrado buena tolerabilidad, así como una reducción en la carga viral aún luego de una infusión única (6 ). Tiene una vida media de tres a cuatro días (7 ) y tiene la ventaja de haber sido probado en población pediátrica (8 ). Actualmente se encuentra en estudios clínicos de fase II.
TNX-355. TNX-355 (Tanox-Biogen, Houston, TX, EE.UU) es un anticuerpo monoclonal «humanizado» que se une al dominio 2 del receptor de CD4 y es activo contra cepas con tropismo R5, X4 y duales/ mixtas (9 ). Aparentemente ejerce su mecanismo de acción impidiendo que se lleve a cabo el cambio en la conformación de la gp120 necesario para la unión con los correceptores (10 , 11 ). Estudios de fase Ia han mostrado que el fármaco es bien tolerado y que ocasiona una reducción significativa de la carga viral en pacientes infectados por virus refractarios al tratamiento con otros antirretrovirales (12 ). Una ventaja del anticuerpo TNX-355 es que puede administrarse desde una vez a la semana hasta una vez cada tres semanas. Sin embargo, los macacos que han tenido múltiples exposiciones a este agente evidencian anticuerpos que bloquean su acción. Este inconveniente no ha sido demostrado en los estudios en humanos con dosis únicas y debe ser seguido de cerca antes de avanzar a estudios clínicos fase II (25).
BMS-806. BMS-806 (Bristol-Myers Squibb Company ) es un inhibidor temprano de la entrada que se une a la gp120 de manera específica y reversible, bloqueando la unión de ésta con los linfocitos CD4+ (13 ). Es probable que tenga un efecto aditivo y aún sinérgico con otros inhibidores de la entrada. Ha evidenciado buena biodisponibilidad así como un bajo porcentaje de unión a proteínas plasmáticas, lo que lo hace un buen candidato para ser administrado por vía oral.
En modelos de transmisión vaginal de VIH en macacos, se ha observado que el uso de microbicidas que contienen BMS-806 inhiben la infección de linfocitos T y de tejido cervical, otorgando una protección significativa hasta seis horas después de la exposición (14 ).
Sin embargo, se han observado cepas con diferentes perfiles de susceptibilidad lo que puede ser un indicador de aparición temprana de resistencia (26).
Cianovirina. La cianovirina es una proteína natural aislada de la cianobacteria Nostocellipsosporum, que evidencia una actividad potente contra el VIH-1, el VIH-2, el virus de inmunodeficiencia de los simios y el virus de inmunodeficiencia felino.
Ejerce su mecanismo de acción al unirse con una afinidad elevada a la gp120 (15 ). En la actualidad se encuentra en estudios preclínicos y se perfila como un microbicida prometedor para la prevención de la transmisión del VIH-1 (16 ).
ANTAGONISTAS DEL CORRECEPTOR CCR5
Una gran variedad de agentes terapéuticos que tienen como objetivo la unión del correceptor CCR5 y la proteína Env, han evolucionado a estudios clínicos, incluyendo CCR5mAb004 (Human Genome Sciences, Rockville, MD, EE.UU), PRO-140 (Progenics Pharma-ceuticals), maraviroc (UK-427,857; Pfizer, Sandwich, Reino Unido) y vicriviroc (SCH-D; Schering-Plough, Kenilworth, NJ, EE.UU).
CCR5mAb004 es un anticuerpo monoclonal humano, antagonista del correceptor CCR5. Actualmente se encuentra en estudios clínicos de fase I en pacientes naive (sin exposición previa) y ha evidenciado buena tolerabilidad así como una actividad antiviral potente (17 , 18 ).
PRO-140 es un anticuerpo monoclonal humanizado de administración parenteral que se une a una región específica del correceptor CCR5, sin interferir con su función normal (19 ). Los resultados de los estudios de fase Ib han demostrado que no ejerce resistencia cruzada con otros antagonistas del CCR5 (20 ).
Maraviroc (UK-427,857) es un antagonista selectivo y reversible de CCR5 de administración por vía oral. Los resultados de estudios de fase I y II han mostrado una reducción de la carga viral de =1,6 log10 administrado en dos dosis diarias (21 ). Ha sido bien tolerado y no se han reportado eventos adversos graves relacionados con el medicamento (34). El análisis interino a las 24 semanas de uno de los estudios en fase IIb-III, evidenció una eficacia no inferior a efavirenz (22 ) y un aumento significativamente mayor en el recuento de moléculas CD4 comparado con un placebo (38). Actualmente se encuentra en estudios de fase III en pacientes naive con virus trófico CCR5 y en pacientes infectados por virus no CCR5.
Vicriviroc ha mostrado una potente actividad antiviral in vitro contra un elevado número de aislamientos de HIV-1, incluyendo aquellos resistentes a otros antirretrovirales (23 ). Se ha evaluado como monoterapia en estudios de fase I y se ha encontrado una disminución promedio de la carga viral de 1,62 log10. No se han reportado eventos adversos graves (24 ); sin embargo, existe la preocupación acerca de cinco casos de neoplasias cuya relación con el agente permanece incierta (25 ).
El estudio de fase IIb en pacientes naive se terminó prematuramente y el brazo de la dosis de 5 mg se suspendió por mostrar eficacia subóptima (38). Actualmente se encuentra en estudios de fase IIb en pacientes expuestos en terapia antirretroviral.
El candidato de GlaxoSmithKline, aplaviroc, fue retirado en estudios clínicos de fase III debido a la aparición de toxicidad hepática (38).
ANTAGONISTAS DE CXCR4
En los estadios tempranos de la infección por VIH predominan los virus que usan el correceptor CCR5 para entrar a la célula (26 ). Sin embargo, en las etapas tardías de la infección, entre 20% y 50% de los virus presentan tropismo por el correceptor CXCR4 (27 ). Debido a que los virus con tropismo por CXCR4 se asocian con una mayor progresión a SIDA y a muerte, resulta necesario el desarrollo de moléculas antagónicas a este correceptor.
AMD-11070 es un agente con buena biodisponibilidad que bloquea la unión del VIH-1 al correceptor CXCR4 (28 ). Actualmente se encuentra en estudios de fase IIB-IIA tanto en pacientes naïve como con virus resistentes.
KRH-3955 y KRH-3140 son dos moléculas candidatas a antagonistas del CXCR4. Los estudios preclínicos han demostrado que estos compuestos se unen al correceptor CXCR4, sin evidenciar afinidad por otros receptores de quimiocinas. No se ha observado toxicidad significativa en ratas y los compuestos tienen biodisponibilidad por vía oral (29 ).
Existen otras moléculas antagonistas del CXCR4 que en la actualidad se encuentran en estudios preclínicos (30 , 31 ).
INHIBIDORES QUE BLOQUEAN LA FUSIÓN
La glucoproteína de envoltura gp41 consta de tres dominios, uno intracelular o endodominio, uno transmembrana y uno extracelular o ectodominio (32 ). El ectodominio tiene tres unidades funcionales: un péptido de fusión y dos repeticiones de héptadas ( heptad repeats, HR), cada una de las cuales consta de una serie de componentes involucrados en los cambios de la conformación de la gp41 necesarios para la fusión del virus con la célula huésped (33 ). Durante el proceso de fusión, el ectodominio de la gp41 emerge, exponiendo un bolsillo profundo y bien definido, que ha sido identificado como un objetivo antiviral potente (34 ).
Enfuvirtide (también llamado T-20 y Fuzeon) es el primer miembro de la nueva clase de antirretrovirales conocida como inhibidores de fusión. Es un péptido de 36 aminoácidos basado en HR2, de modo tal que se une con elevada afinidad a HR1, impidiendo la interacción HR1-HR2, proceso necesario para la fusión (35 ). Enfuvirtide, etiquetado como terapia de rescate, se ha caracterizado por causar muy pocos eventos adversos sistémicos y escasas interacciones medicamentosas (44). Más aún, ha mostrado actividad antiviral potente contra virus con tropismo R5, X4 y duales/mixtos, incluso cepas de virus resistentes a otros antirretrovirales.
Se ha demostrado que los pacientes expuestos tienen dos veces más posibilidades de alcanzar una carga viral indetectable si se adiciona enfuvirtide a un esquema de base óptimo (36 ).
A la fecha, se han reportado escasos casos de resistencia cruzada entre los distintos inhibidores de la fusión, muy probablemente debido a que la mayoría de las mutaciones en la Env son específicas para cada fármaco (37 ). Además de esto, en estudios in vitro se ha observado que ejercen un efecto altamente sinergista con los antagonistas de correceptores (38 ), lo que podría ser una ventaja en el tratamiento de pacientes con virus multirresistentes.
Sin embargo, existen ciertas características que han limitado el uso masivo de enfuvirtide, como son la necesidad de administración subcutánea dos veces al día, la complejidad que implica la preparación del compuesto y el elevado costo del tratamiento (39 ).
CONCLUSIÓN
Los inhibidores de entrada se perfilan como agentes prometedores en el manejo de pacientes con VIH/SIDA, en especial en aquéllos infectados con virus resistentes a otros antirretrovirales o en terapia de rescate.
Sus principales ventajas son ser una nueva clase de antirretrovirales, lo que les confiere actividad antiviral contra virus resistentes a otras clases de antirretrovirales, así como tener un mecanismo de acción extracelular y un aparente sinergismo entre ellos y con otros antirretrovirales. Sin embargo, todavía no se cuenta con datos acerca de la aparición de resistencia in vivo y aún está por definirse la indicación clínica más adecuada (inicio temprano Vs. tardío en la evolución de la enfermedad), así como el esquema terapéutico más conveniente para su administración. Del mismo modo, es necesario obtener datos acerca de la seguridad y de la eficacia a largo plazo.
Conflictos de interés: Declaramos un posible conflicto de intereses teniendo en cuenta que uno de los autores es el actual director médico de Pfizer y que, la autora principal, se encuentra actualmente realizando el año de servicio social obligatorio con un convenio entre la Universidad de La Sabana y Pfizer; sin embargo, el artículo fue escrito de la manera más ecuánime, sin tener alguna otra pretensión que la de contribuir a la educación médica y científica.
REFERENCIAS
1 Leonard JL, Roy K. The HIV entry inhibitors revisited. Current Medicinal Chemistry. 2006;13:911-34 [ Links ]
2 Maxeiner HG, Keulen W, Schuurman R, Bijen M, de Graaf L, van Wijk A, Back N, Kline MW, Boucher CA, Nijhuis M. Selection of zidovudine resistance mutations and escape of human immunodeficiency virus type 1 from antiretroviral pressure in stavudinetreated pediatric patients. J Infect Dis. 2002;185:1070. [ Links ]
3 Tisdale M, Kemp SD, Parry NR, Larder BA. Rapid in vitro selection of human immunodeficiency virus type 1 resistant to 3'-thiacytidine inhibitors due to a mutation in the YMDD region of reverse transcriptase. Proc Natl Acad Sci USA. 1993;90:5653. [ Links ]
4 Mansky LM. The mutation rate of human immunodeficiency virus type 1 is influenced by the vpr gene. Virology. 1996;222:391-400. [ Links ]
5 Zhu P, Olson WC, Roux KH. Structural flexibility and functional valence of CD4-IgG2 (PRO 542): potential for cross-linking human immunodeficiency virus type 1 envelope spikes. J Virol. 2001; 75:6682. [ Links ]
6 Jacobson JM, Lowy I, Fletcher CV, ONeill TJ, Tran DN, Ketas TJ, Trkola A, Klotman ME, Maddon PJ, Olson WC, Israel RJ. Singledose safety, pharmacology, and antiviral activity of the human immunodeficiency virus (HIV) type 1 entry inhibitor PRO 542 in HIV-infected adults. J Infect Dis. 2000;182:326. [ Links ]
7 Mukhtar M, Parveen Z, Pomerantz RJ. Technology evaluation: PRO-542, Progenics Pharmaceuticals Inc. Curr Opin Mol Ther. 2000;2:697-702. [ Links ]
8 Shearer W, Israel R, Starr S. Recombinant CD4-IgG2 in human immunodeficiency virus type 1-infected children: phase 1/2 study. The Pediatric AIDS Clinical Trials Group Protocol 351 Study Team. J Infect Dis. 2000;182:1774. [ Links ]
9 Kuritzkes DR, Jacobson J, Powderly WG. Antiretroviral activity of the anti-CD4 monoclonal antibody TNX-355 in patients infected with HIV type 1. J Infect Dis. 2004;189:286-91. [ Links ]
10 Duensing T, Fung M, Lewis S. In vitro characterization of HIV isolated from patients treated with the entry inhibitor TNX-355. 13th Conference on Retroviruses and Opportunistic Infections. Denver, CO, USA, 5-8 February, 2006. Abstract 158LB. [ Links ]
11 Laakso MM, Doms RW. The molecular bBasis of HIV Eetry and its inhibition. The Journal of Viral Entry. 2006;2(1):4-12. [ Links ]
12 Kuritzkes DR, Jacobson JM, Powderly WG. 10th Conference on Retroviruses and Opportunistic Infection, Boston, USA, February, 10-14, 2003, Abstract 13. [ Links ]
13 Lin PF, Gong K, Fridell R, Ho HT, Yamanaka G, Colonno R. 9th Conference on Retroviruses and Opportunistic Infection, Seatle, USA, February, 24-28, 2002, Abstract 09. [ Links ]
14 Veazey RS, Klasse PJ, Schader SM. Protection of macaques from vaginal SHIV challenge by vaginally delivered inhibitors of viruscell fusion. Nature. 2005;438:99-102. [ Links ]
15 Boyd MR, Gustafson KR, McMahon JB, Schoemaker RH, O´Keefe BR, Mori T. Discovery of cyanovirin-N, a novel human immuno deficiency virus-inactivating protein that binds viral surface envelope glycoprotein gp120: potential applications to microbicide development. Antimicrob Agents Chemother. 1997;41:1521. [ Links ]
16 Kelly BS, Chang LC, Bewley CA. Engineering an obligate domainswapped dimer of cyanovirin-N with enhanced anti-HIV activity. J Am Chem Soc. 2002;124:3210. [ Links ]
17 US National Institutes of Health. (Citado en mayo 16 de 2006). Disponible en www.clinicaltrials.gov/ct [ Links ]
18 Ji C, Brandt M, Dioszegui M et al. Novel CCR5 monoclonal antibodies with potent anti-HIV activities and unique binding properties. 46th Interscience Conference on Antimicrobial Agents and Chemotherapy. San Francisco, California, Sept. 2006. Abstract H-242. [ Links ]
19 Poli G. PRO-140 (Progenics). IDrugs 2001;4:1068-71. [ Links ]
20 Olson WC, Ketas TJ, Franti M et al. The CCR5 m Ab PRO 140 ans small-molecule CCR5 antagonists possess complementary HIV-1 resistance profiles. 46th Interscience Conference on Antimicrobial Agents and Chemotherapy. San Francisco, California, Sept. 2006. Abstract H-241. [ Links ]
21 Fatkenheuer G, Pozniak AL, Johnson M, Hoepelman IM, Rockstroh J, Goebel F, Abel S, James I, Rosario M, Medhurst C et al. Effect of short-term monotherapy with UK-427,857 on viral load in HIVinfected patients. Nature Medicine. 2005;11:1170-2. [ Links ]
22 Datos no publicados. Presentados por el Dr. Tressler, R. en XVI International AIDS Society. 2006, Toronto, Canadá. [ Links ]
23 Strizki JM, Remblay C, Xu S et al. Discovery and characterization of vicriviroc (SCH417690), a CCR5 antagonist with potent activity against human immunodeficiency virus type 1. Antimicrob Agents Chemother. 2005;49:4911-9. [ Links ]
24 Schurmann D, Rouzier R, Nougarede R, Reynes J, Fatkenheuer G, Raffi F, Michelet C, Tarral A, Hoffmann C, Kiunke J et al. SCH D: antiviral activity of a CCR5 receptor antagonist. The 11th Conference on Retroviruses and Opportunistic Infections, 2004 Feb 8-11, San Francisco, CA. [ Links ] [Abstract 140LB].
25 Scrip. World Pharmaceutical News. Informa UK Ltd 2002 - 2006. (Citado en septiembre 1 de 2006). Disponible en www.scripnews.com. [ Links ]
26 Zhu T, Mo H, Wang N et al. Genotypic and phenotypic characterization of HIV-1 patients with primary infection. Science. 1993;261:1179-81. [ Links ]
27 Connor RI, Sheridan KE, Ceradini D et al. Change in coreceptor use correlates with disease progression in HIV-1 infected individuals. J Exp Med. 1997;185:621-8. [ Links ]
28 Marks K, Gulick RM. New antiretroviral agents for the treatment of HIV infection. Curr HIV/AIDS Rep. 2004;1:82-8. [ Links ]
29 Tanaka Y, Okuma K, Tabaka R et al. Development of novel orally bioavailable CXCR4 antagonists, KRH-3955 and KRH-3140: binding specificity, pharmacokinetics, and anti- HIV-1 activity in vivo and in vitro. 13th Conference on Retroviruses and Opportunistic Infections. Denver, CO, USA, 5-8 February, 2006. Abstract 49LB. [ Links ]
30 Blair W, Cao J, Jackson L et al. Execution of a high throughput HIV- 1 replication screen and the identification of a novel small molecule inhibitor that targets HIV-1 envelope maturation. 13th Conference on Retroviruses and Opportunistic Infections. Denver, CO, USA, 5-8 February, 2006. Abstract 50LB. [ Links ]
31 Delmedico M, Bray B, Cammack N et al. Next generation HIV peptide fusion inhibitor candidates achieve potent, durable suppression of virus replication in vitro and improved pharmacokinetic properties. 13th Conference on Retroviruses and Opportunistic Infections. Denver Colorado, 2006. Abstract 48. [ Links ]
32 Kazmierski WM, Peckham JP, Duan M, Kenakin TP, Jenkinson S, Gudmundsson KS, Piscitelli SC, Feldman PL. Curr Med Chem Anti-Infec Agents. 2005,4:133. [ Links ]
33 Root MJ, Kay MS, Kim PS. Protein design of an HIV-1 entry inhibitor. Science. 2001;291:884. [ Links ]
34 Sia SK, Carr PA, Cochran AG, Malashkevich VN, Kim PS. Short constrained peptides that inhibit HIV-1 entry. Proc Natl Acad Sci USA. 2002;99:14664. [ Links ]
35 Chen CH, Matthews TJ, McDanal CB et al. A molecular clasp in the human immunodeficiency virus (HIV) type 1 TM protein determines the anti-HIV activity of gp41 derivatives: implication for viral fusion. J Virol. 1995;69:3771-7. [ Links ]
36 Lalezari JP, Henry K, OHearn M et al. Enfuvirtide, an HIV-1 fusion inhibitor, for drugresistant HIV infection in North and South America. N Engl J Med. 2003;348:2175-85. [ Links ]
37 Briz V, Poveda E, Soriano V. HIV entry inhibitors: mechanisms of action and resistance pathways. J Antimicrob Chemother. 2006; 57:619-27. [ Links ]
38 Tremblay C. Effects of HIV-1 entry inhibitors in combination. Curr Pharm Des. 2004;10:1861-5. [ Links ]
39 Manfredi R, Sabbatini S. A novel antiretroviral class (fusion inhibitors) in the management of HIV infection. Present features and future perspectives of enfuvirtide (T-20). Curr Med Chem. 2006;13:2369-84. [ Links ]