Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Infectio
Print version ISSN 0123-9392
Infect. vol.10 no.4 Bogotá Oct./Dec. 2006
Guía de práctica clínica de VIH/SIDA.
Recomendaciones basadas en la evidencia, Colombia
Clinical practice guidelines of HIV/AIDS,evidence based recommendations, Colombia
La elaboración de estas guías fue coordinado por un grupo de profesionales de tres instituciones: ACIN (Carlos DíazGranados, Carlos Arturo Álvarez y Guillermo Prada), FEDESALUD (Carlos Sarmiento, Félix Martínez) y Ministerio de la Protección Social (Adriana Pulido, Ricardo Luque y Guillermo Córdoba).
A continuación se hace un resumen ejecutivo, haciendo énfasis en la metodología y recomendaciones.
El documento completo se puede consultar en la página web del Ministerio de la Protección Social (1).
Palabras clave: guías de práctica clínica, VIH, SIDA.
Keywords: practice guidelines, HIV, AIDS.
INTRODUCCIÓN
La infección por el virus de inmunodeficiencia humana (VIH) y el síndrome de inmunodeficiencia adquirida, o sida, se han considerado en el Sistema General de Seguridad Social en Salud (SGSSS) como patologías de alto costo, por generar un fuerte impacto económico sobre las finanzas del (SGSSS) y por causar un efecto considerable sobre la calidad de vida del paciente y su familia, incluidas las repercusiones laborales.
Se estima que el manejo del VIH/sida ha comprometido en los últimos años el 0,5% del gasto en salud del país y cerca del 1% del gasto en seguridad social en salud (2).
Frente a esta situación, y no sólo sobre la base de las implicaciones económicas, sino frente a la calidad de vida y de la atención en los servicios de salud, en diferentes ámbitos se ha venido planteando la necesidad de implementar programas de prevención primaria y secundaria, fortalecer el diagnóstico temprano, definir y aplicar protocolos de tratamiento, frenar la transición del VIH al sida y disminuir, por tanto, los costos de hospitalización y las complicaciones, la incapacidad y la mortalidad.
Es muy importante resaltar que, con un tratamiento adecuado, la gran mayoría de los pacientes positivos para VIH, diagnosticados oportunamente, pueden desarrollar su vida sin limitaciones. Por ello, debe estandarizarse la práctica clínica bajo los parámetros más estrictos de calidad en el manejo de los pacientes, mediante pautas validadas y considerando las recomendaciones basadas en la evidencia científica.
Con base en lo anterior, se ha llevado a cabo el proceso para el desarrollo de las guías de práctica clínica cuyo objetivo último no es la elaboración en sí, sino lograr su aplicación generalizada en el sistema. Por tanto, dentro del mismo proceso de elaboración de la guías de práctica clínica se han previsto los métodos de difusión que faciliten dicha aplicación. Algunos estudios (3) han mostrado cómo, a pesar de que la mayoría de profesionales consideran útiles las guías de práctica clínica, no siempre hacen uso de ellas. Así lo señalan, por ejemplo, Garfield et al. (4) o Larizgoitia et al. (5).
En este sentido, es necesario considerar los siguientes aspectos, señalados por Grimshaw et al. (6):
l El hecho de que las guías de práctica clínica hayan sido elaboradas por los profesionales que las utilizarán favorece su aplicación. Sin embargo, hay pocos estudios que lo apoyen. De hecho, parece que las guías de práctica clínica elaboradas por líderes de opinión son más creíbles.
l La difusión pasiva (revistas, distribuciones por correo) conlleva el conocimiento de las guías de práctica clínica, pero no su aplicación.
l La difusión activa (las visitas personales o la formación con participación de los profesionales) es más probable que facilite la aplicación.
Por esto hoy se invita a todos los profesionales de la salud, las Instituciones Prestadoras de Servicios (IPS), los funcionarios de las entidades responsables del aseguramiento y de las entidades territoriales, así como a las universidades, asociaciones de pacientes y demás organizaciones relacionadas con la atención del VIH/sida, a apoyar e incentivar la aplicación de estas guías de práctica clínica que proporcionarán los beneficios esperados no sólo a los pacientes, principales favorecidos, sino a todos y cada uno de los actores del Sistema General de Seguridad Social en Salud.
DESARROLLO DE LAS GUÍAS
1. Metodología, descripción del proceso, participación de expertos y usuarios
La elaboración de la guía se llevó a cabo en el marco de la metodología Scottish Intercollegiate Guidelines Network (SIGN) (7) concebida por expertos en elaboración de guías de práctica clínica, metodología ampliamente reconocida en el ámbito internacional que permitió una adecuada secuencia en el desarrollo y un proceso estandarizado apropiado a los objetivos del proyecto.
Para la revisión de las recomendaciones, construidas de forma sistemática, para facilitar a los profesionales y a los pacientes la toma de decisiones informadas sobre la atención sanitaria más apropiada, por haber seleccionando las opciones diagnósticas y terapéuticas más adecuadas en el abordaje de un problema de salud o una condición clínica específica, se ha llevado a cabo el siguiente proceso de acuerdo con la propuesta presentada y aprobada por el Ministerio de la Protección Social.
1.1 Revisión de las guías existentes
Inicialmente se conformaron tres equipos para la revisión de las guías, correspondientes a cada una de las enfermedades objeto, conformados por un experto clínico y un epidemiólogo/salubrista.
Posteriormente, y con base en la metodología propuesta, se realizó la búsqueda y selección de guías de práctica clínica considerando los siguientes criterios.
Criterios de inclusión
l Guías con enfoque integral sobre la patología, publicadas y difundidas a nivel nacional o internacional, con enfoque general para el manejo en las áreas de prevención, diagnóstico y tratamiento.
l Guías desarrolladas por grupos de profesionales, asociaciones de especialidades médicas, sociedades científicas, agencias gubernamentales a nivel nacional, instituciones que ofrezcan planes de atención en salud u otras organizaciones de reconocida trayectoria internacional relacionadas con cada uno de los temas, que son consideradas como referencia a nivel mundial y en las cuales se han basado especialistas de varios países o regiones para adaptarlas a su entorno nacional o regional de conformidad con un rigor metodológico.
Criterios de exclusión
l Guías no integrales y cuya referencia sea únicamente a una particularidad en el manejo de la patología.
l Documentos referidos a modelos de atención, aspectos terapéuticos, de diagnóstico o promoción que no han sido formulados como guías de práctica clínica y, por ende, no cumplen con el rigor metodológico para ser evaluadas con la metodología de evaluación propuesta.
Además, se tuvo en cuenta que las guías seleccionadas hubiesen sido desarrolladas o revisadas a partir del año 2000, o que contaran con una versión actualizada después de este año. Se exceptúan las guías nacionales del Proyecto ISSASCOFAME, cuyo año de publicación corresponde a 1997.
El desarrollo o publicación dentro de los últimos 5 años fue un criterio tenido en cuenta para incluir las guías en la mayoría de las bases de datos, como en el National Guidelines Clearinghouse (NGC) (8).
Para la evaluación de la calidad de las guías de práctica clínica, se utilizó AGREE (9), un proyecto internacional multicéntrico financiado por la Unión Europea cuyo instrumento de evaluación contempla aspectos relacionados con el nivel de evidencia científica que fundamenta la guías de práctica clínica, su validez, fiabilidad, reproductibilidad, aplicabilidad y flexibilidad clínica, claridad, multidisciplinariedad, planificación de revisiones y documentación; razón por la cual FEDESALUD optó por utilizar este instrumento de evaluación, considerando también que, según los National Institutes of Health de Estados Unidos y diversos grupos de expertos de Europa, AGREE es uno de los centros más importantes que disponen de instrumentos para evaluar la calidad de las guías de práctica clínica.
De toda la información recopilada utilizando diferentes fuentes de información, adicionales a las bases de datos mencionadas, se tuvieron en cuenta las guías referenciadas, parcialmente implementadas en el ámbito nacional y en países con sistemas similares al nuestro, que con mayor firmeza describen procedimientos aplicables al manejo del VIH/sida.
Las guías finalmente seleccionadas para revisión fueron las siguientes:
l Department of Health and Human Services (USA). Guidelines for the use of antiretroviral agents in HIV-1 infected adults and adolescents convened. October 2004.
l Treatment for adult HIV infection. 2004 recommendations of the International AIDS Society - USA panel. JAMA 2004; 292(2):251-65.
l Guías de atención VIH-SIDA. Clínica de Chile. Ministerio de Salud de Chile-CONASIDA. Octubre de 2001.
l Sida, guía de práctica clínica basada en la evidencia - Proyecto ISS – ASCOFAME, 1997.
l Guía de atención del VIH/SIDA, Ministerio de Salud de Colombia, adoptada mediante Resolución 412 de 2000.
l Galiana Luis Fransi. Guías clínicas en atención primaria VIH-SIDA Propuesta desde la visión de la Atención Primaria en Salud, en la base de datos Guías de práctica clínica en español a través del buscador Fisterra.com, España,
l U.S. Department of Health and Human Services, CDC. National Center for HIV, STD and TB prevention. HIV prevention case management. Atlanta, Georgia, September 1997.
l Guía sobre atención integral de personas que viven con la coinfección de TBC-VIH en América Latina y el Caribe – OPS, 2004.
Finalizada la revisión de las guías existentes, se inició el proceso de participación de expertos, pacientes y otros usuarios institucionales, con la reunión para formular las preguntas clave sobre diagnóstico y tratamiento del VIH/sida que deberían ser tenidas en cuenta para la elaboración de la nueva guía.
1.2 Formulación de preguntas clave y definición temas para abordaje mediante guías de práctica clínica
l Determinación de todas las condiciones clínicas e identificación de las posibles intervenciones preventivas, diagnósticas o terapéuticas utilizadas en su abordaje mediante una guías de práctica clínica. Especificación de los posibles resultados que se deben tener en cuenta en el diseño de la guías de práctica clínica (clínicos, económicos, preferencias de los enfermos, etc.).
l Primera reunión de consenso: se llevó a cabo la primera reunión de consenso para la formulación de las preguntas clave (10), con base en el formato PICO (11) (paciente, intervención, comparación y resultado - output-), cuyo objetivo fue "Generar consenso en torno a los diversos aspectos críticos a considerar en la guía en el diagnóstico y tratamiento del VIH/sida, a través de las iniciativas aportadas por todos y cada uno de los participantes".
Como resultado de esta reunión y después de llevar a cabo la consolidación y consulta con todos los participantes, se seleccionaron 20 de 27 preguntas prioritarias que sirvieron como base para la identificación de las palabras clave que hicieron parte del protocolo de búsqueda bibliográfica. Cabe mencionar que la selección de preguntas consideró aquéllas que estaban relacionadas con temas objeto de guía y se separaron aquéllas que hacían referencia a aspectos del modelo de atención, que se trabajó en el mismo proyecto.
1.3 Revisión sistemática de la evidencia científica
Con base en el método de la medicina basada en la evidencia (13) y después de elaborar el protocolo de búsqueda de evidencia a partir de la base de preguntas clínicas estructuradas, resultado de la formulación durante reunión de consenso, se llevó a cabo ésta para identificar artículos científicos capaces de responder cada pregunta.
Para esta búsqueda se utilizaron términos múltiples que describen la condición o ítem de interés y se combinaron con el operador booleano «OR». Se identificaron los artículos indexados que incluían, por lo menos, uno de los términos utilizados. Algunos resultados fue necesario reducirlos utilizando posteriormente el operador booleano «AND», para obtener artículos más específicos. Se utilizaron los términos en inglés por ser el idioma oficial de publicación en la mayoría de las bibliotecas.
Paralelamente, se llevó a cabo el diseño preliminar de la estructura/índice de la guía, la cual fue sometida a consideración y revisión para sugerencias y comentarios por parte de todos los participantes en la reunión de consenso para la formulación de preguntas clave.
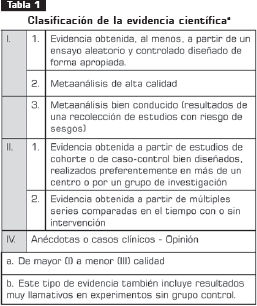
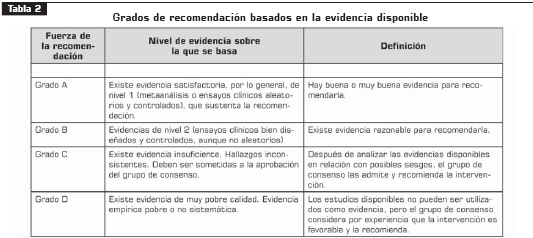
Una vez consensuada y aprobada la estructura, se inició la elaboración de las recomendaciones para cada ítem a partir de la evidencia recopilada y que fue clasificada según las siguientes tabla 1 y tabla 2, derivadas de las tablas usadas por la Red Escocesa Intercolegiada de Guías-SIGN, la Asociación Americana de Enfermedades Infecciosas y el Servicio de Salud Pública de los Estados Unidos- IDSA-USPHS (13), y la adaptación española de Novell (14).
Igualmente, se llevo a cabo la discusión sobre los resultados de las evaluaciones de las guías existentes para seleccionar parámetros relevantes, que se tuvieron en cuenta en la elaboración de la guía de práctica clínica.
Se procedió a la redacción de la versión preliminar de la guía de práctica clínica y, una vez revisada por expertos clínicos, miembros de la Asociación Colombiana de Infectología (ACIN), y presentada al Ministerio de la Protección Social, fue sometida a consideración de los participantes convocados a la segunda reunión de consenso para validar la factibilidad de la guía de práctica clínica en un ámbito de aplicación concreto, se estimaron los posibles beneficios de su aplicación y se logró su aprobación definitiva.
Participantes en el Panel de Expertos. Asociación Colombiana de Infectología
Carlos Alquichire
Ellen Mendivelson
Jaime Saravia
Ernesto Martínez
Otto Sussmann
Roberto Támara
Carlos Saavedra
Henry Mendoza
Álvaro Villanueva
Jorge Cortés
Carlos Pérez
Reuniones de consenso, participantes
El grupo consistió de expertos en infectología, salud pública, epidemiología, medicina de laboratorio, nutrición, trabajo social, medicina familiar y metodología.
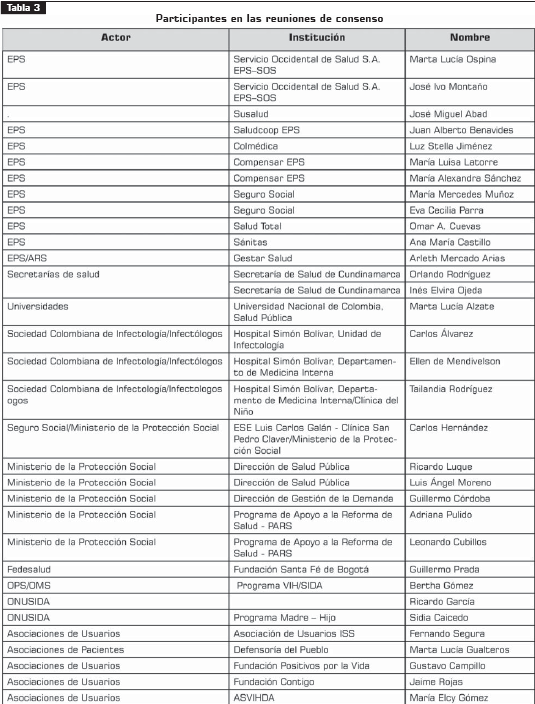
Así mismo, se tuvieron en cuenta representantes de los pacientes, de las administradoras de planes de beneficios (EPS y ARS), de instituciones públicas, incluido el Ministerio de la Protección Social, y organizaciones no gubernamentales nacionales e internacionales que participaron en las reuniones de consenso. Tabla 3
2. Alcance y objetivos
La guía se refiere específica y únicamente al VIH/ sida en el adulto, la gestante infectada y el recién nacido, sin profundizar en las patologías concomitantes. Su objetivo es proporcionar las recomendaciones pertinentes acerca del manejo eficaz, efectivo, eficiente del VIH/sida, abordado de una forma integral para su prevención, diagnóstico y tratamiento, que contempla la atención por niveles de complejidad en el SGSSS.
El desarrollo incluyó el proceso de revisión y rediseño de las guías de atención, basado en evidencia, para las fases de prevención, diagnóstico y tratamiento de la enfermedad, así como la propuesta de difusión, junto con la evaluación de eficacia, efectividad, eficiencia, pertinencia local e impacto sobre equidad del modelo y su aplicación en el marco del Sistema General de Seguridad Social en Salud.
3. Justificación de la guía
Para la evaluación de los contenidos de los planes de beneficios en cuanto a su pertinencia y costo efectividad, el Ministerio de la Protección Social dio prioridad al análisis de las intervenciones relacionadas con patologías que generan un gran gasto de recursos dentro del mismo plan, denominadas patologías de alto costo o catastróficas, entre ellas, el tratamiento del VIH/sida, que representa cada vez más un porcentaje mayor del gasto en salud.
Para enfrentar esta problemática, el CNSSS expidió en el año 2003 varios acuerdos; en uno de ellos (Acuerdo 245 de 2003, artículo 5) precisó la necesidad de desarrollar guías de atención en salud para estas patologías que, aplicadas en el marco de un modelo de atención, permitan lograr la eficiencia en el manejo de los recursos, alcanzar el mayor impacto positivo en la salud de los pacientes y definir los contenidos más costo-efectivos para la atención de dichas patologías con pertinencia local.
Siendo explícitos, el desarrollo y la implementación de estas guías se justifica para:
l prevenir la transmisión del VIH;
l mejorar la calidad de vida de las personas con VIH y sida;
l frenar la progresión del VIH hacia el sida;
l reducir la proporción de complicaciones y hospitalizaciones de los pacientes con sida, especialmente con el buen manejo de los antirretrovirales, y l lograr de esta forma contener los costos del tratamiento y la mortalidad por la enfermedad.
4. Población objeto de la guía
Usuarios diana: infectólogos, médicos generales, especialistas, enfermeras, bacteriólogas, nutricionistas y, en general, todo el personal de la salud encargado de la atención de pacientes con VIH/sida.
Tipo de pacientes: población en general afiliada o no afiliada al SGSSS y, en particular, personas con VIH/sida, específicamente jóvenes, adultos y mujeres embarazadas.
5. Metodología de extracción de información
Específicamente, para cada capítulo de la guía se utilizó la metodología de extracción de información que se registra a continuación.
5.1 Prevención
Para la evaluación de la evidencia existente para prevenir el VIH en general, se utilizó la estrategia descrita por King Holmes durante una de las sesiones plenarias de la 42ª Reunión de la Asociación Americana de Enfermedades Infecciosas (IDSA) en Boston, MA, en octubre de 2004. Esta estrategia fue: base de datos Medline y el registro Cochrane de ensayos clínicos controlados, y las memorias de congresos internacionales de 2002 a 2004. Se incluyeron ensayos clínicos aleatorios que tuvieran que ver con prevención de VIH, que usaran medidas objetivas sistemáticas. Se emplearon las palabras «prevention AND (STD OR STI OR HIV)» y se obtuvieron 27.647 títulos. Limitándose a ensayos clínicos aleatorios y que cumplieran con los criterios mencionados, se seleccionaron 43 estudios.
Se llevó a cabo una segunda búsqueda para indagar sobre evidencia adicional (diferente a la derivada de ensayos clínicos) acerca de la efectividad del uso del condón para prevenir la transmisión sexual del VIH. Se empleó la base de datos Medline desde 1966 hasta el 15 de junio de 2005, utilizando la siguiente estrategia: (exp condoms OR *sexual behavior OR *contraceptive devices) AND (*HIV seropositivity/transmission OR *HIV infections/ transmission OR *acquired immunodeficiency syndrome/transmission OR *HIV infections/ prevention and control) AND (exp incidence OR exp risk factors), LIMIT TO: (humans, abstract available). Se obtuvieron 392 títulos que se revisaron para seleccionar estudios que hicieran referencia a la efectividad del condón para prevenir la transmisión del VIH.
Además, se empleó la base de datos Cochrane Database of Systematic Reviews, utilizando la siguiente estrategia: (sexual behavior OR contraceptive devices OR Condoms) AND (HIV seropositivity OR HIV transmission OR HIV infections OR acquired immunodeficiency síndrome OR HIV prevention). Se obtuvieron 19 títulos que se revisaron para seleccionar los que hicieran referencia a la efectividad del condón para prevenir la transmisión del VIH.
5.2 Diagnóstico-detección
La información presentada aquí se derivó de las guías de asesoría, diagnóstico y referencia del VIH y las recomendaciones para tamizaje de VIH en mujeres embarazadas, publicadas por el CDC en 2001 y revisadas en 2003. Estas guías se basan en la evidencia y, aunque no tienen grados de recomendación, son el producto de una revisión de más de 5.000 resúmenes, de más de 600 publicaciones, revisión de 20 guías previas del CDC y consenso de expertos del CDC.
Se obtuvo información acerca de las pruebas rápidas usando la página de la OMS, referente a las características operativas de los ensayos de diagnóstico de VIH, específicamente el reporte 14 de las pruebas rápidas y, además, se hizo una búsqueda de la literatura empleando la base de datos Medline desde 1996 hasta julio 2005 y la siguiente estrategia: (exp HIV) AND (rapid test.mp). Se obtuvieron 29 títulos que se revisaron para extracción de la información.
Para obtener información reciente en tamizaje en ginecoobstetricia, se utilizó la siguiente estrategia de búsqueda usando la base de datos Medline y con limitación a publicaciones en humanos en los últimos 5 años, con las siguientes palabras MESH: pregnancy AND HIV detection (301 referencias), prenatal HIV testing (191 referencias) y HIV screening of pregnant women (274 referencias). De esta búsqueda se seleccionaron 35 artículos.
Para obtener información reciente acerca del tamizaje en niños se utilizó la información de las guías publicadas por el Instituto Nacional de Salud de los Estados Unidos y el grupo de trabajo en cuidado médico y manejo de la terapia antirretroviral en niños en el 2005.
Además, se consultó al organismo regulador local (INVIMA) acerca de las pruebas de detección de VIH aprobadas para comercialización en Colombia.
5.3 Atención
Para extraer información pertinente al médico, se utilizó la base de datos Medline y las siguientes estrategias:
1. (HIV OR AIDS) AND (quality of care, accessibility, coordination, comprehensiveness) AND (primary care);
2. (HIV OR AIDS) AND (quality of healthcare OR primary health care, OR health services accessibility, OR continuity of patient care, OR comprehensive health care) AND (outcome assessment).
Se revisaron los títulos considerados relevantes. Para obtener evidencia referente al programa, se emplearon la base de datos Medline y las siguientes estrategias:
1. nutritional evaluation AND prognosis AND HIV;
2. social work AND HIV AND prognosis, y
3. social support AND AIDS AND adherence. Se revisaron los títulos considerados relevantes.
5.4 Valoración inicial
Se buscó información referente a la prevalencia de ciertas condiciones utilizando las siguientes fuentes y estrategias:
1. Base de datos Medline, estrategia: anemia AND HIV AND prevalence. Se obtuvieron 274 títulos.
2. Base de datos Medline, estrategia: HIV AND prevalence AND nephropathy. Se obtuvieron 157 referencias.
3. Se revisaron boletines nacionales de prevalencia de las posibles enfermedades oportunistas y aquéllas asociadas a la infección.
4. Se revisaron las recomendaciones de las guías para el uso de agentes antirretrovirales en pacientes infectados con VIH del Health Department de los Estados Unidos (actualizadas en abril 7 de 2005) y las guías de cuidado primario para el manejo de personas infectadas con virus de la inmunodeficiencia humana de la Asociación Medicina de VIH y la Sociedad Americana de Enfermedades Infecciosas.
Se tuvo en cuenta la información mencionada en la sección de atención del paciente VIH, donde se incluye la evidencia en favor de ciertos componentes del programa de manejo integral.
La información sobre las pruebas para objetivar el estadio de la infección, el riesgo de infecciones oportunistas y la necesidad de antirretrovirales, se obtuvo como se describe en las secciones de iniciación y modificación de la terapia antirretroviral.
5.5 Tratamiento antirretroviral
Para extraer la información referente al momento de iniciación de la terapia, se empleó la base de datos Medline, utilizando las siguientes palabras clave y estrategia: (*acquired immunodeficiency syndrome OR *HIV-1 OR *HIV infections) AND (exp CD4 lymphocyte count) AND (exp disease progression OR exp time factors) AND (exp cohort studies OR comparative study). Se obtuvieron 685 títulos (17 de mayo de 2005), que se revisaron para la selección de los estudios considerados pertinentes. Se revisaron los resúmenes de esos estudios y, cuando se consideró necesario, se obtuvo el artículo original. Además, se empleó la base de datos Cochrane Database of Systematic Reviews utilizando las palabras (CD4 lymphocyte count) y se obtuvieron 3 títulos (25 de junio de 2005) ninguno de los cuales se consideró relevante.
Para obtener la información pertinente a la escogencia del régimen inicial, se empleó la base de datos Medline, utilizando las siguientes palabras clave y estrategia: (*anti-HIV agents/tu OR *antiretroviral therapy, highly active), LIMIT TO: study type (clinical trial, phase iii; clinical trial, phase iv; controlled clinical trail;meta-analysis;randomized controlled trial), age (all adults), humans. Se obtuvieron 508 títulos (17 de mayo de 2005), que se evaluaron para la selección de los estudios considerados pertinentes. También se realizó una búsqueda independiente en la misma fecha, para lo referente a resistencia viral, utilizando la misma base de datos y las siguientes palabras clave: (genotype.exp OR mutation.exp) AND (Drug resistance.exp) AND (nevirapine), que generó 75 títulos (10 de mayo de 2005); efavirenz.mp, que generó 61 títulos; indinavir AND ritonavir, que generó 24 títulos; abacavir.mp, que generó 72 títulos; lopinavir.mp, que generó 35 títulos, saquinavir.exp, que generó 69 títulos; atazanavir.mp, que generó 6 títulos. Se revisaron los resúmenes de esos estudios y, cuando se consideró necesario, se obtuvo el artículo original. Además, se tuvieron en cuenta las referencias de los artículos encontrados y se revisaron los resúmenes de conferencias internacionales recientes ( 11th Conference on Retrovirus and Opportunistic Infections (CROI), 2004; XV Internacional AIDS Conference (IAC), Bangkok, Thailand, 2004; 44th Interscience Conference on Antimicrobial Agents and Chemotherapy (ICAAC), Washington, DC, 2004; 42th Meeting of the Infectious Diseases Society of America (IDSA), Boston, MA, 2004; 12th Conference on Retrovirus and Opportunistic Infections (CROI), Boston, MA, 2005). Finalmente, se realizó una búsqueda utilizando la base de datos Cochrane Database of Systematic Reviews, utilizando las siguientes estrategias: (acquired immunodeficiency syndrome OR HIV) AND (antiretroviral therapy), LIMIT to: (systematic reviews), que generó 17 títulos; y (acquired immunodeficiency syndrome OR HIV) AND (drug resistance), LIMIT to: (systematic reviews), que generó 14 títulos.
Para obtener la información pertinente sobre la modificación de la terapia antirretroviral, se utilizaron los resultados de la estrategia de búsqueda mencionada para la sección de iniciación de la terapia y la que se menciona en la sección de pruebas de genotipificación.
La información acerca de la utilidad de las pruebas de genotipificación se obtuvo utilizando los títulos obtenidos con la estrategia de búsqueda referente a resistencia mencionada en la sección de iniciación de la terapia. Además, se empleó la base de datos Medline y la siguiente estrategia: (treatment failure.exp OR treatment outcome.exp OR drug resistance.exp) AND (genotype.exp) AND (*anti-HIV agents OR *antiretroviral therapy, highly active OR *hiv infections/drug therapy). La búsqueda generó 384 títulos (mayo 10, 2005). Finalmente, se empleó la base de datos Cochrane Database of Systematic Reviews y la siguiente estrategia: (acquired immunodeficiency síndrome OR HIV) AND (genotype), que generó 10 títulos (25 de junio 25 de 2005). Se revisaron los títulos y se seleccionaron los considerados pertinentes para la revisión de resumen, de texto completo o de ambos.
La evidencia referente a la optimización del cumplimiento con la terapia antirretroviral se extrajo usando la base de datos Medline y la siguiente estrategia: *patient compliance AND (*anti-HIV agents OR *antiretroviral therapy, highly active OR *HIV infections, drug therapy), LIMIT TO: study type (clinical trial, controlled trial randomized controlled trial) AND abstract available. La estrategia generó 59 títulos (mayo 10, 2005). Una segunda estrategia empleó la base de datos Cochrane Database of Systematic Reviews y la siguiente estrategia: adherence AND HIV, LIMIT to systematic reviews. Esta estrategia generó 82 títulos (25 de junio 25 de 2005). Los títulos se revisaron para seleccionar los estudios considerados relevantes. Además, se revisaron las memorias de congresos recientes: 12th CROI, Boston, MA, 2005; 42nd Meeting of the IDSA, Boston, MA, 2004; XV IAC, Bangkok, Thailand, 2004.
5.6 Seguimiento del paciente infectado
La información referente al seguimiento clínico se extrajo durante la revisión de la sección de valoración inicial del paciente infectado y componentes del programa.
La evidencia pertinente al seguimiento paraclínico de condiciones prevalentes y efectos tóxicos empleó las estrategias de búsqueda que se mencionan en la sección de la evaluación inicial del paciente infectado, en la sección de iniciación de la terapia antirretroviral y en la sección de modificación de la terapia. La evidencia referente al seguimiento terapéutico del paciente que recibe antirretrovirales se buscó utilizando la base de datos Medline y las siguientes estrategias: 1) estrategia 1: treatment outcome.exp AND (*viral load OR *RNA, viral OR *CD4 lymphocyte count) AND HIV- 1.exp; 2) estrategia 2: (frequency.mp or frequent.- mp) AND (*CD4 lymphocyte count OR *viral load OR *RNA, viral) AND HIV.exp. La primera estrategia arrojó 108 títulos (5 de mayo de 2005) y la segunda, 71 títulos (5 de mayo 5 de 2005). Los títulos se revisaron para seleccionar los estudios pertinentes.
5.7 VIH y embarazo
La evidencia referente a VIH y embarazo se basó en las guías del Task Force de Salud Pública de los Estados Unidos (febrero de 2005) sobre el uso de medicamentos antirretrovirales en mujeres embarazadas VIH positivas para salud materna e intervenciones para disminuir la transmisión perinatal del VIH. Además, se presentan algunos estudios derivados de conferencias médicas recientes (IAC 2004, CROI 2005).
5.8 Profilaxis de infecciones oportunistas
La información acerca de la profilaxis y prevención de infecciones oportunistas se adaptó de las Guías de prevención de las infecciones oportunistas en personas infectadas con VIH del Servicio de Salud Pública de los Estados Unidos y la Sociedad Americana de Enfermedades Infecciosas (USPHS/IDSA Guidelines for the Prevention of Opportunistic Infections in Persons Infected with Human Immunodeficiency Virus. MMWR 2002;51(RR-8).
5.9 Exposición de riesgo
La información expuesta en la sección de exposición ocupacional de riesgo se adaptó de las guías validadas de los CDC de Atlanta y el US Public Health Service del 2001.
La información expuesta en la sección de exposición no ocupacional de riesgo se adaptó de las guías validadas del CDC y el US Public Health Service del 2005.
Aspectos clínicos
Los aspectos cubiertos por la guía son: prevención de la transmisión, exposición ocupacional y no ocupacional de riesgo, diagnóstico en adultos, mujeres embarazadas y recién nacidos, atención integral en adultos, tratamiento antirretroviral en adultos, seguimiento del paciente infectado, y VIH y embarazo.
1. Prevención
Recomendaciones
El retraso en el inicio de la actividad sexual y la minimización del número de parejas sexuales son recomendables para evitar la transmisión sexual del VIH (IIIA).
La detección precoz y el manejo sindrómico de las infecciones de transmisión sexual deben promoverse para prevenir la transmisión del VIH (IA).
Las intervenciones psicoeducativas de tipo conductual pueden ser eficaces para prevenir la infección por VIH, pero su utilización sistemática es dispendiosa y el efecto pequeño (IC).
El uso correcto del condón es una herramienta útil y recomendable para prevenir la infección por VIH (IIA).
La terapia antirretroviral es útil para prevenir la transmisión del VIH (IIA).
Aunque el riesgo es menor, los pacientes que reciben terapia antirretroviral pueden transmitir el virus y, por lo tanto, debe estimularse en ellos la minimización de la exposición sexual y no sexual al VIH de otras personas (IIIA).
2. Diagnóstico–detección
Recomendaciones
2.1 Detección en el adolescente y el adulto (no gestante) asintomático
2.1.1 Indicaciones de actividades de asesoría y detección (IIIB)
1. Si la prevalencia es superior al 1%, se recomienda asesoría y oferta generalizada de la prueba (la prevalencia estimada en Colombia, en general, es inferior al 1% (45), pero pueden existir diferencias regionales y en ciertos grupos de población con mayor prevalencia o mayor vulnerabilidad, como hombres que tienen sexo con hombres, pacientes renales crónicos que inician hemodiálisis, trabajadores sexuales y, posiblemente, personas institucionalizadas y privadas de la libertad.
2. Individuo que tiene o ha tenido relaciones sexuales no protegidas con preservativo.
3. Personas con antecedentes de infecciones de transmisión sexual o a quienes se les diagnostica infección sexual asintomática.
4. Persona que usa drogas intravenosas.
5. Persona con antecedentes de tatuajes o piercing cuando se han usado instrumentos compartidos sin adecuada desinfección o esterilización.
6. Sujeto fuente e individuo expuesto al riesgo (ver sección de exposición de riesgo).
7. A la pareja en la consulta preconcepcional o de planificación familiar.
8. Solicitud voluntaria de la prueba por parte del individuo/paciente.
2.1.2 Pruebas de tamizaje recomendadas
1. Utilice ELISA o pruebas rápidas, excepto en exposición de riesgo y en circunstancias en las que la complejidad requerida para las pruebas de ELISA sea inexistente (IIIB).
2. En exposición de riesgo se recomienda el uso de una prueba rápida, previa asesoría, para la fuente, si la fuente está disponible. Al expuesto se le puede realizar la prueba rutinaria de ELISA o la prueba rápida (III B).
3. Las pruebas rápidas de tamizaje deben utilizarse como reemplazo a la prueba de ELISA en circunstancias en las cuales la complejidad de laboratorio requerida para las pruebas de ELISA es inexistente (por ejemplo, laboratorios periféricos, etc.) (IIIB).
4. Las pruebas rápidas utilizadas para diagnóstico deben tener una sensibilidad igual o superior a 99% y una especificidad superior o cercana a 98% (IIIB), idealmente corroborada por estudios externos a las compañías fabricantes.
2.1.3. Pruebas confirmatorias recomendadas
1. Se recomienda Western Blot o IFI como pruebas confirmatorias en todos los casos en los que pruebas de tamizaje repetidas hayan resultado positivas (reactivas) (IIIB).
2. Se recomienda adelantar estudios locales de campo que permitan la validación de algoritmos diagnósticos alternativos basados en el uso de dos o tres pruebas de ELISA, antes de su adopción rutinaria (IIIB).
2.2 Detección en el adolescente y el adulto (no gestante) sintomático
2.2.1 Indicaciones de actividades de asesoría y detección (IIIB)
1. Paciente con síntomas sugestivos de inmuno-deficiencia, que incluyen las condiciones clínicas clasificadas como B o C del CDC (ver anexo).
2. Presencia de infecciones de transmisión sexual.
3. Paciente con cuadro clínico compatible con el síndrome retroviral agudo (síndrome mononucleósico).
4. Sujeto fuente e individuo expuesto al riesgo (ver sección de exposición de riesgo).
2.2.2 Pruebas de tamizaje recomendadas
1. Utilice ELISA o pruebas rápidas, excepto en exposición de riesgo, en circunstancias en las que la complejidad requerida para las pruebas de ELISA sea inexistente (IIIB) y en pacientes con cuadro clínico compatible con síndrome retroviral agudo o pacientes con diagnóstico de agammaglobulinemia (IIIB).
2. En exposición de riesgo, se recomienda el uso de una prueba rápida para la fuente, si la fuente está disponible. Al expuesto se le puede realizar la prueba rutinaria de ELISA o la prueba rápida (III B).
3. Las pruebas rápidas de tamizaje deben utilizarse como reemplazo de la prueba ELISA en circunstancias en las cuales la complejidad de laboratorio requerida para las pruebas ELISA sea inexistente (por ejemplo, laboratorios periféricos, etc.) (IIIB).
4. En el individuo con síndrome retroviral agudo y en pacientes con agammaglobulinemia, utilice pruebas de detección de VIH basadas en ácidos nucleicos (IIIB).
5. Las pruebas rápidas utilizadas para diagnóstico deben tener una sensibilidad igual o superior a 99% y una especificidad superior o cercana a 98% (IIIB), idealmente, corroboradas por estudios externos a las compañías fabricantes.
2.2.3 Pruebas confirmatorias recomendadas
1. Se recomienda Western Blot o IFI como pruebas confirmatorias en todos los casos en los que pruebas de tamizaje repetidas hayan resultado positivas (reactivas) (IIIB).
2. Se recomienda adelantar estudios locales de campo que permitan la validación de algoritmos diagnósticos alternativos basados en el uso de dos o tres pruebas de ELISA, antes de su adopción rutinaria (IIIB).
2.3 Detección en la gestante
1. El prestador debe realizar sin excepción la asesoría y ofrecer la prueba de tamizaje (ELISA o prueba rápida), en el primer trimestre de embarazo o durante el primer control prenatal a todas las mujeres (IA).
2. La estrategia de ofrecimiento y realización de la prueba recomendada es la siguiente: el profesional de la salud efectúa la asesoría previa a la prueba, mencionando que se recomienda realizar la prueba a toda gestante y que ella tiene la opción de aceptar o rehusar, firmando un documento. Aquéllas que acepten realizarse la prueba, deben firmar el consentimiento informado. Aquéllas que no acepten deben firmar el documento de no aceptación (ver anexo). Lo anterior implica que el 100% de las mujeres embarazadas deben tener documentación escrita en la historia clínica del proceso de asesoría y el ofrecimiento de la prueba, así como del desenlace de dicho proceso (aceptación o rechazo) (IIIB).
3. La prueba debe repetirse en el tercer trimestre en las siguientes circunstancias: historia de ITS, presencia de signos y síntomas sugestivos de infección aguda por VIH, uso de drogas intravenosas o sustancias psicoactivas, trabajo sexual, varios compañeros sexuales durante el embarazo, compañero sexual VIH positivo. Además, la prueba debe ofrecerse en el tercer trimestre a mujeres que no la hayan aceptado en el primer trimestre o durante controles prenatales previos (IIB).
4. En mujeres que se presentan en trabajo de parto y no tienen prueba de tamizaje previa durante el embarazo, se debe realizar asesoría y ofrecer una prueba rápida de tamizaje (IIA).
5. Las pruebas rápidas utilizadas para diagnóstico deben tener una sensibilidad superior a 99% y una especificidad superior o cercana a 98% (IIIB), idealmente, corroboradas por estudios con iniciativa externa a las compañías fabricantes.
6. Excepto cuando el parto sea inminente, confirme el diagnóstico (con Western Blot o IFI) antes de decidir iniciación del tratamiento (ver indicaciones de tratamiento en la sección de terapia antirretroviral y embarazo).
2.4 Detección en el hijo de mujer infectada
1. En hijos nacidos de mujeres infectadas, realice una prueba de detección de ácido nucleico viral (ARN o ADN) antes del cumplir el primer mes y entre 4 y 6 meses de nacido (IIA).
2. Si alguna de las pruebas es positiva, confirme el diagnóstico utilizando otra técnica diferente, pero
que también se base en la detección de ácidos nucleicos (IIA).
3. Si las pruebas de detección seriadas son negativas, clasifique al niño como no infectado (IIB).
4. No realice ELISA ni pruebas rápidas en recién nacidos o lactantes (IIA).
3. Atención
Recomendaciones
3.1 Programa de atención
1. Todo paciente con infección por VIH debe manejarse como parte de un programa de atención integral (IIIB).
2. El programa de atención integral a pacientes con VIH debe incluir un médico encargado, con experiencia y entrenamiento adecuados (IIIA), de preferencia, médico experto, en todo lugar donde el manejo por el experto no represente una barrera de acceso.
3. El programa de atención integral no debe manejar más de dos pacientes hora por hora-médico contratada (IIIB).
4. El programa de atención a pacientes con VIH debe incluir personal, espacio y equipos necesarios para labores profesionales de nutrición (IIIA).
5. El programa de atención a pacientes con VIH debe incluir personal, espacio y equipos necesarios para labores profesionales de psicología (IIIA).
6. El programa de atención a pacientes con VIH debe
incluir personal, espacio y equipos necesarios para labores profesionales de trabajo social (IIIA).
7. El programa de atención a pacientes con VIH debe incluir personal, espacio y equipos necesarios para labores profesionales de un trabajador de la salud encargado de asesorar el cumplimiento (TEC) (IIIA).
3.2 Indicaciones de referencia-interconsulta a experto en VIH/sida o enfermedades infecciosas (IIIB)
1. Cada vez que el médico encargado (no experto) del programa lo considere necesario.
2. Coinfección con hepatitis B.
3. Coinfección con hepatitis C.
4. Coinfección con tuberculosis.
5. Segundo fracaso terapéutico en adelante.
6. Intolerancia grave a más de dos esquemas terapéuticos.
7. Paciente con morbilidades asociadas que requieran la administración de múltiples medicamentos con potenciales interacciones medicamentosas significativas.
8. Síndrome de hiperlactatemia.
9. Interpretación de pruebas de genotipificación.
10. Exposición de riesgo ocupacional y no ocupacional ( la evaluación del experto nunca debe retrasar el inicio de la profilaxis posterior a la exposición, de estar indicada).
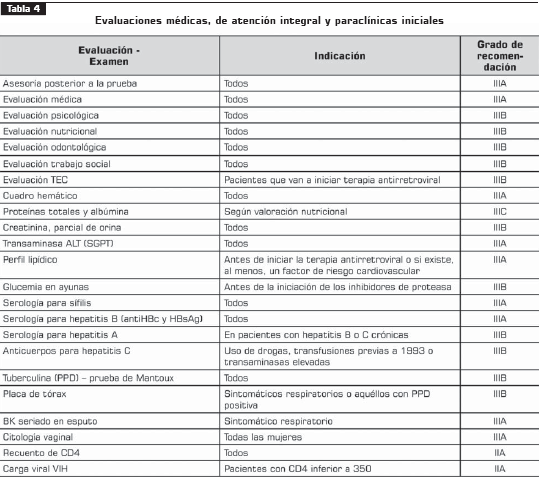
4. Valoración inicial
Recomendaciones
Componentes de la evaluación médica inicial (IIIB) Anamnesis
1. Fecha de diagnóstico de VIH
2. Complicaciones asociadas al VIH, incluso infecciones oportunistas, neoplasias y síntomas relacionados
3. Morbilidades asociadas: neuropatía, enfermedad gastrointestinal, hepatitis viral, dislipidemia, diabetes, enfermedad renal
4. Antecedentes de enfermedades infecciosas como varicela, tuberculosis o exposición a tuberculosis, enfermedades de transmisión sexual, parasitismo intestinal y de posible exposición a otras infecciones potencialmente oportunistas como tripanosomiasis, leishmaniasis, toxoplasmosis, paracoccidioidomicosis, histoplasmosis o criptococosis
5. Esquemas previos de vacunación
6. Uso y alergias a medicamentos
7. Historia familiar sobre enfermedad cardiovascular y diabetes
8. Comportamientos y hábitos como el uso de cigarrillo, alcohol, sustancias psicoactivas, prácticas sexuales, incluso, uso de condón y anticonceptivos
9. Situación familiar, empleo y el grado de apoyo
10.Información sobre si la(s) pareja(s) sexuales conoce(n) el diagnóstico. En caso de que aún no le(s) haya informado, se recomienda asesorar al paciente sobre la importancia del diagnóstico de su(s) pareja(s) sexuales actual(es) y brindar el apoyo necesario para lograr este objetivo. Al considerar dar información a contactos, a familiares o a ambos, debe tenerse en cuenta la normatividad vigente.
Revisión por sistemas
1. Fiebre
2. Sudoración nocturna
3. Cefalea
4. Alteraciones visuales
5. Odinofagia y disfagia
6. Síntomas respiratorios
7. Síntomas gastrointestinales
8. Alteraciones dérmicas
9. Estado de ánimo, concentración, memoria, líbido,
patrones de sueño y apetito.
Examen físico
1. Signos vitales: pulso, presión arterial, temperatura.
2. Peso.
3. Piel: presencia de dermatitis seborreica, sarcoma de Kaposi, foliculitis, infecciones micóticas, psoriasis y prúrigo.
4. Orofaringe: presencia de candidiasis, leucoplasia oral, sarcoma de Kaposi, aftas orales, enfermedad periodontal.
5. Fundoscopia: especialmente en pacientes con sida, y determinar la necesidad de evaluación por oftalmología.
6. Presencia de linfadenopatías, esplenomegalia o hepatomegalia.
7. Periné: presencia de lesiones de condiloma, úlceras o herpes.
8. Neurológico: evaluar función cognitiva, motora y sensorial.
Intervenciones iniciales
1. Educación sobre la enfermedad, modos de transmisión, riesgos reales para seres queridos, recomendaciones generales alimentarias, precauciones relevantes para la prevención de infecciones oportunistas, eficacia de la terapia antirretroviral, requisitos para tener éxito con la terapia
2. Asesoría sobre el estilo de vida (comportamiento sexual, uso de alcohol o drogas, tabaquismo)
3. Vacuna para la hepatitis B (en aquéllos con serología negativa)
4. Vacuna contra la influenza (para todos los pacientes)
5. Vacuna contra Streptococcus pneumoniae (en aquéllos con CD4 superior a 200).
5. Terapia antirretroviral
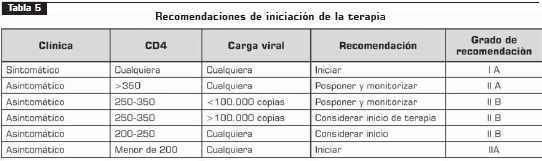
5.1 Iniciación de la terapia
5.2 Selección inicial de antirretrovirales
Esquema preferido
AZT – 3TC – efavirenz* (IA)
Esquemas alternativos – para usar según indicación En pacientes con anemia moderada o grave de base (hemoglobina menor de 10 mg/dl), se pueden utilizar los siguientes esquemas terapéuticos:
1. D4T + 3TC + efavirenz (IA)
2. DDI* + 3TC + efavirenz (IB) o
3. Abacavir + 3TC + efavirenz (IA).
Esta última combinación también se puede utilizar en reemplazo de AZT–3TC, cuando el médico y el trabajador encargado del cumplimiento (TEC) determinen que el paciente, por su estilo de vida, requiere de un esquema de administración en una sola dosis al día.
4. AZT + 3TC + nevirapina (IA)
l Usar en reemplazo de efavirenz, si el paciente es mujer en edad reproductiva, no utiliza anticoncepción efectiva y tiene un recuento de CD4 menor a 250.
l Usar en reemplazo de efavirenz, en mujer embarazada si el recuento de CD4 es menor de 250.
l Usar en reemplazo de efavirenz, en pacientes con enfermedad psiquiátrica, si es mujer y con CD4 menor a 250, o si es hombre y con CD4 menor de 400.
En los casos en los que nos se pueda utilizar EFV y la NVP no se considere como el tratamiento alternativo de elección, se puede recomendar como esquema de primera línea el AZT + 3TC (con las mismas consideraciones anteriores) junto con un inhibidor de proteasa, balanceando la posibilidad de cumplimiento y el costo para decidir individualmente, así (IB):
l Lopinavir-ritonavir
l Saquinavir-ritonavir
l Atazanavir ± ritonavir
l Fosamprenavir* ± ritonavir
5. Nelfinavir (IB):
l Usar en reemplazo de efavirenz, en mujer embarazada si el recuento de CD4 es mayor a 250.
l Se asocia a zidovudina + lamivudina con las mismas observaciones que en el ítem del efavirenz.
Consideraciones adicionales para tener en cuenta antes de iniciar la terapia.
Antes de que el paciente inicie la toma de los medicamentos, debe evaluarse si está física y mentalmente listo para iniciar la terapia. El paciente debe tener un proceso educativo y de sensibilización sobre la importancia del cumplimiento en la terapia y la posibilidad de efectos adversos por el tratamiento.
Un requisito fundamental para el éxito de la terapia antirretroviral es el cumplimiento por parte del paciente de las citas de consulta externa. Por eso, se recomienda iniciar la terapia en la consulta externa y únicamente de manera excepcional en el paciente hospitalizado (III B).
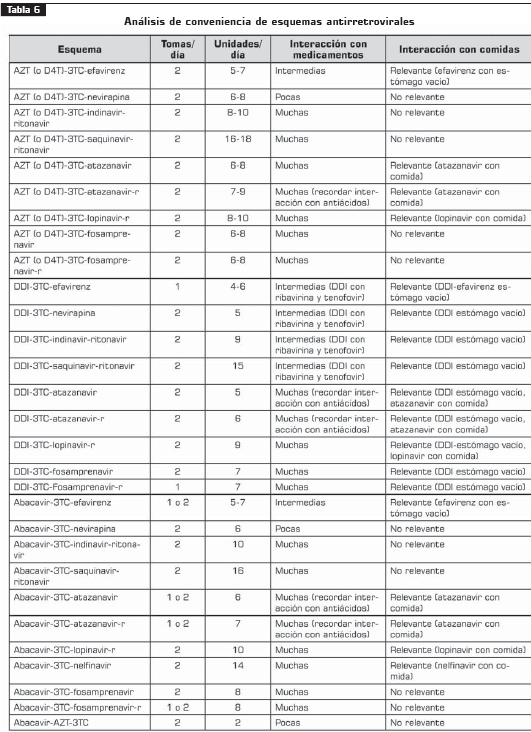
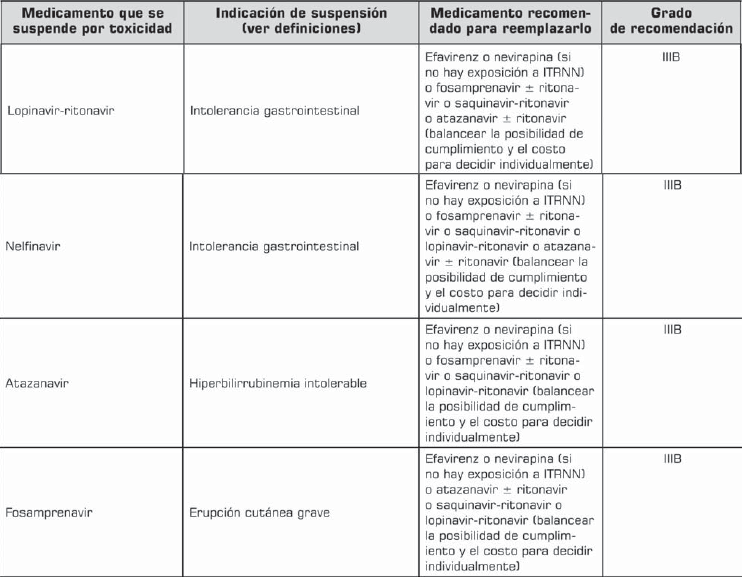
5.3 Modificación de la terapia antirretroviral
Toxicidad y tolerancia
Cuando la reacción no pone en peligro inmediato al paciente, el médico debe optimizar la ayuda farmacológica y no farmacológica para controlar el síntoma o signo, continuando la misma terapia antirretroviral (IIIA).
Si el paciente continúa con intolerancia, a pesar de la optimización del manejo del efecto adverso, el medicamento considerado tóxico debe ser reemplazado rápidamente (IIIA).
Cuando la gravedad de la reacción pone en peligro inmediato la salud del paciente, la medicación considerada tóxica debe ser reemplazada (IIIA).
Cuando considere reemplazar el inhibidor de proteasa en un esquema, utilice preferentemente un ITRNN y no utilice abacavir, excepto si el paciente no tolera o no cumple otra terapia (IA).
* La administración de una cápsula de 600 mg de efavirenz es preferible (mas no obligatoria) a la de tres cápsulas de 200 mg por conveniencia.
* Se recomienda únicamente el uso de la didanosina en cápsulas entéricas de 400 mg para administrar una vez al día por conveniencia,
superior tolerancia y ventajas farmacocinéticas. No se recomienda el uso de didanosina de 100 mg.
En pacientes con alergia a las sulfas, el fosamprenavir debe ser utilizado con precaución por la posibilidad de alergia cruzada grave.
Cuando un paciente presente reacción cutánea a la nevirapina, siempre verifique si existe compromiso hepático concomitante. De existir evidencia de compromiso hepático, NO reemplace la nevirapina por efavirenz (IIIB).
Cuando esté manejando hiperlipidemias en pacientes con inhibidores de proteasa, NO utilice lovastatina ni simvastatina (IIE).
Cualquier modificación debe hacerse con precaución y SIEMPRE debe tenerse en cuenta la historia previa de exposición a antirretrovirales (IIIA).
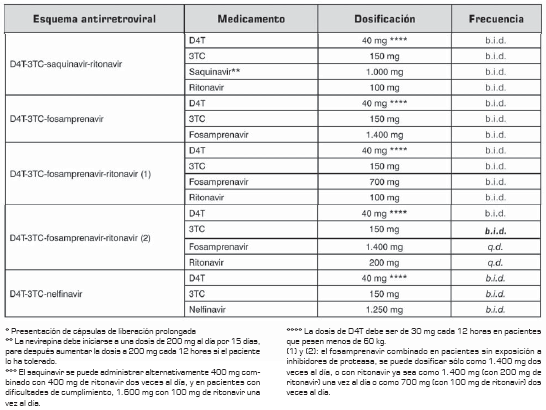
La tabla 8 tabla 8a muestra recomendaciones específicas de modificación de la terapia y sus indicaciones.
5.4 Fracaso terapéutico
Del segundo fracaso terapéutico en adelante, la modificación de la terapia debe realizarse con asesoría directa de un experto en enfermedades infecciosas o en VIH (IA).
* Presentación de cápsulas de liberación prolongada
** La nevirapina debe iniciarse a una dosis de 200 mg al día por 15 días, para después aumentar la dosis a 200 mg cada 12 horas si el paciente lo ha tolerado.
*** El saquinavir se puede administrar alternativamente 400 mg combinado con 400 mg de ritonavir dos veces al día, y en pacientes con dificultades de cumplimiento, 1.600 mg con 100 mg de ritonavir una vez al día. **** La dosis de D4T debe ser de 30 mg cada 12 horas en pacientes que pesen menos de 60 kg.
(1) y (2): el fosamprenavir combinado en pacientes sin exposición a inhibidores de proteasa, se puede dosificar sólo como 1.400 mg dos veces al día, o con ritonavir ya sea como 1.400 mg (con 200 mg de ritonavir) una vez al día o como 700 mg (con 100 mg de ritonavir) dos veces al día.
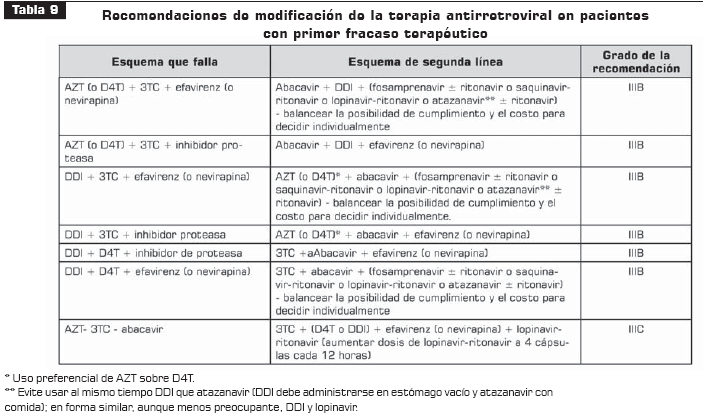
La tabla 9 resume las recomendaciones de modificación de la terapia antirretroviral aplicables únicamente al paciente con primer fracaso terapéutico.
Nunca cambie un solo antirretroviral en un esquema que está fracasando (IA).
No añada un antirretroviral a un esquema que ha tenido una respuesta subóptima (IA). La única excepción es añadir ritonavir a un esquema basado en inhibidor de proteasa, en un paciente que tiene carga viral cercana a indetectable (IIIB).
Cuando un esquema esté fallando, cámbielo en su totalidad de ser posible y, de lo contrario, procure añadir dos o más medicamentos a los que el paciente no haya tenido exposición (IA).
Procure iniciar el nuevo esquema antes de que la carga viral del paciente alcance más de 10.000 copias (IB).
Si el paciente no puede iniciar el nuevo esquema inmediatamente se diagnostica el fracaso terapéutico, continúe el esquema que está fracasando si el paciente lo tolera en lugar de suspender los medicamentos (IIB).
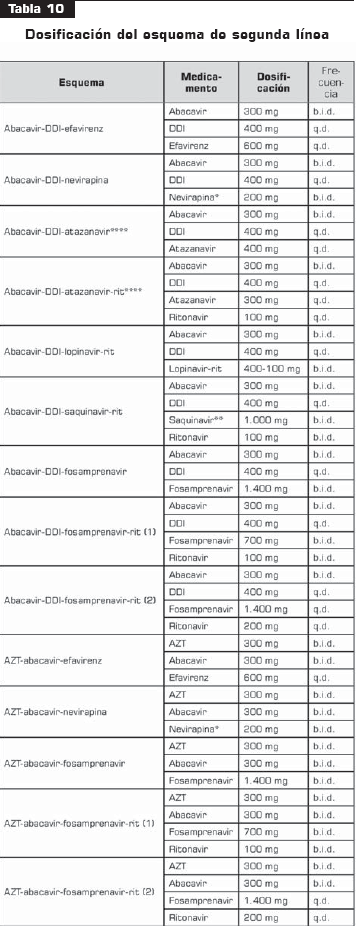
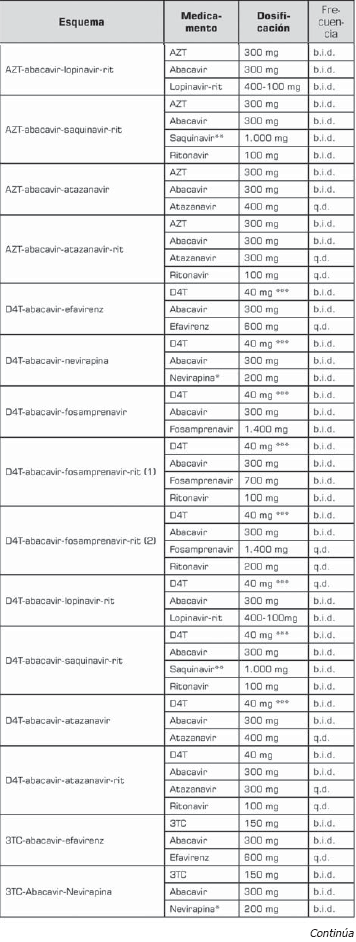
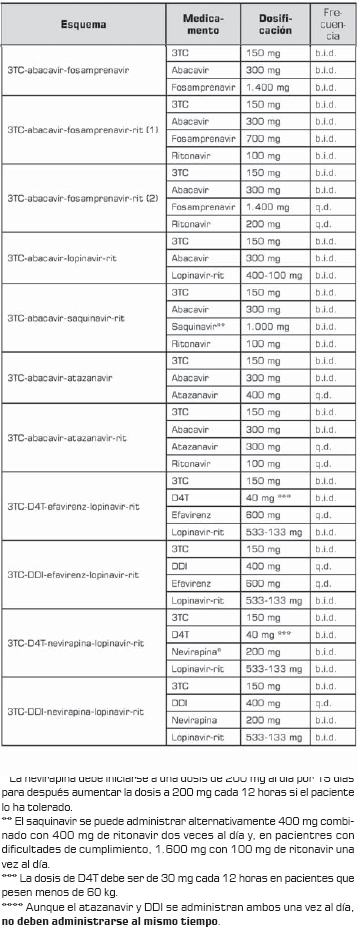
La tabla 10 tabla 10a tabla 10b muestra la dosificación de los esquemas de segunda línea.
5.5 Uso de pruebas de genotipificación
No ordene pruebas de genotipificación en pacientes con problemas activos de incumplimiento, intolerancia o inconsistencia en la toma de medicamentos (III A).
Siempre confirme fracaso virológico y carga viral mayor a 1.000 copias, antes de ordenar una prueba de genotipificación (II A).
La prueba de genotipificación debe realizarse en pacientes que se presentan con un segundo o tercer fracaso terapéutico, previa autorización del experto en enfermedades infecciosas o VIH-sida (I B). La prueba de genotipificación debe interpretarse con la participación de un experto en enfermedades infecciosas o en VIH-sida (I B).
La conducta que se derive de la información de las pruebas de genotipificación debe ser siempre supervisada por un experto en enfermedades infecciosas o en VIH-sida (IIIA).
El paciente debe estar consumiendo los medicamentos del esquema que fracasa en el momento en que se le toma la muestra para la prueba de genotipificación o dentro de las dos a cuatro semanas posteriores a su suspensión (II B).
5.6 Optimización del cumplimiento – factores del paciente
El programa debe incluir un profesional de la salud con entrenamiento en educación cognitivoconductual basada en la teoría de autoeficacia para asesorar las actividades de optimización de cumplimiento (IB).
El médico y el trabajador encargado de asesorar el cumplimiento deben establecer el grado de preparación y disposición psicológica y física del paciente para iniciar la terapia antes de que se suministre la medicación (IIA).
El médico y trabajador encargado de asesorar el cumplimiento deben dar educación al paciente sobre el VIH y la posibilidad de mejorar la calidad y cantidad de vida si se cumple con la toma de las medicinas (IIB).
El médico y el trabajador encargado de asesorar el cumplimiento deben educar al paciente sobre los medicamentos propiamente dichos, incluso las interacciones con drogas y comidas, y los efectos adversos (IIB).
El médico debe anticipar los efectos adversos más frecuentes y prescribir medicamentos para manejarlos (en caso de presentarse) por un período de 3 a 7 días (IIIC).
El trabajador encargado de asesorar el cumplimiento y el médico deben diseñar con el paciente un horario que se ajuste a su estilo de vida (IIA).
El trabajador encargado de asesorar el cumplimiento o su relevo debe estar disponible y accesible para resolver dudas que el paciente tenga acerca del tratamiento (IIB).
El médico y el trabajador encargado de asesorar el cumplimiento deben evaluar rutinariamente barreras de cumplimiento en visitas de seguimiento y deben proveer al paciente de retroalimentación acerca de su desempeño (IIB).
El trabajador encargado de asesorar el cumplimiento debe evaluar al paciente antes de iniciar el tratamiento (IIB).
Si el trabajador encargado de asesorar el cumplimiento considera que el paciente no está listo para iniciar la terapia o que la prescripción del médico no se ajusta al estilo de vida del paciente, el trabajador encargado de asesorar el cumplimiento está en capacidad de posponer la iniciación de la terapia, pero debe comunicarse con el médico en un plazo no mayor a una semana (IIIB).
El trabajador encargado de asesorar el cumplimiento debe evaluar al paciente presencialmente entre 10 y 15 días después de la iniciación del tratamiento (IIIB).
Durante las primeras 4 semanas del tratamiento, el trabajador encargado de asesorar el cumplimiento debe comunicarse con el paciente, de manera presencial o no presencial, al menos una vez por semana para evaluar el cumplimiento y las barreras (IIIB).
Las barreras detectadas deben discutirse con el médico tempranamente (durante el primer mes) para realizar modificaciones a la terapia antirretroviral si es necesario (IIIB).
Se recomiendan, por lo menos, dos sesiones presenciales de refuerzo del cumplimiento al año, en el paciente que parece no tener barreras de cumplimiento. Las visitas deben hacerse con mayor frecuencia si se identifican barreras de cumplimiento (IIB).
El uso de dispositivos de recordación es opcional (IIIC).
6. Seguimiento del paciente infectado
Recomendaciones
6.1 Seguimiento clínico
Grado recomendaciones – III B:
La visita médica rutinaria de seguimiento debe hacerse en los pacientes en tratamiento y en los que no están recibiendo tratamiento y debe registrar:
1. los síntomas referidos por el paciente;
2. los medicamentos que toma;
3. la historia de alergias;
4. los signos vitales, el peso, una revisión mínima de sistemas (cavidad oral, adenopatías, auscultación pulmonar, abdomen, piel y faneras, sistema nervioso);
5. periódicamente (cada 6 meses), debe examinarse el paciente en busca de manifestaciones de enfermedades de transmisión sexual, ya que su detección y manejo oportunos son relevantes para la prevención de la transmisión del VIH;
6. laboratorios recientes (incluidos fecha y resultado de última carga viral si se ha hecho y recuento de CD4);
7. un análisis o impresión;
8. un plan claramente establecido;
9. la impresión del médico en lo referente a estado de ánimo, uso de alcohol y drogas, estado nutricional, comportamientos de riesgo y entorno social (familiar, laboral y otros).
En el paciente que se encuentra en tratamiento la visita de seguimiento debe incluir, además:
1. un registro cuantitativo del cumplimiento del tratamiento, ya sea el porcentaje basado en autorreporte o el puntaje o categoría derivado de las escalas internacionalmente validadas, y
2. un registro de tolerancia a las medicinas, con especificación de los efectos adversos en la historia clínica.
Mientras que el paciente asintomático que no esté en tratamiento puede realizar estas visitas médicas cada 6 meses, el paciente sintomático o en tratamiento debe realizarlas con mayor frecuencia.
El paciente que inicia tratamiento antirretroviral debe asistir a la consulta médica mensualmente, por lo menos, durante los primeros tres meses:
1. En el primer mes, el equipo médico-paciente debe concentrarse en el cumplimiento con el tratamiento y en el manejo y la vigilancia de eventos adversos.
2. Al final del segundo mes, el paciente debe asistir para la tomarse el examen de carga viral (ver sección de seguimiento paraclínico) y para optimizar el cumplimiento y la tolerancia.
3. Una vez el resultado de la carga viral se encuentre disponible (cerca del final del tercer mes), debe asistir a la consulta para que el médico evalúe la respuesta al tratamiento. Al revisar los exámenes, el médico determina si la respuesta es adecuada o no. Si la respuesta es adecuada, el paciente puede volver tres meses después a realizarse la carga viral y el recuento de CD4 de control de 6 meses y en las semanas siguientes debe visitar a su médico para la discusión de resultados.
El paciente que se encuentra en tratamiento por más de 6 meses y ha tenido una respuesta adecuada, puede visitar al médico cada 3 meses, por lo menos, (puede ser más frecuente según el concepto del médico).
En la primera visita del semestre, el equipo médico-paciente debe concentrarse en:
1. el cumplimiento con la terapia,
2. la tolerancia a las medicinas,
3. los comportamientos de riesgo,
4. el estado nutricional,
5. la funcionalidad social, y
6. opcional, revisión de algunos exámenes de laboratorio que sean necesarios.
En la segunda visita del semestre, el paciente debe presentar los laboratorios de control terapéutico, es decir, la carga viral y el recuento de CD4. Según los resultados, la siguiente visita se planea al mes siguiente, a los dos meses siguientes o a los tres meses siguientes (ver sección de seguimiento paraclínico).
Los controles anexos incluyen visitas al trabajador encargado de asesorar el cumplimiento, a nutrición, a psicología y a trabajo social. Las visitas de cumplimiento pueden ser realizadas por cualquier trabajador de la salud con experiencia en educación de pacientes (enfermería, psicología, pedagogía, trabajo social) y deben seguir las recomendaciones estipuladas en la sección de cumplimiento. Las visitas a nutrición, psicología y trabajo social deben programarse según la necesidad. Si después de la valoración inicial por nutrición y psicología se detectan alteraciones nutricionales o psicológicas de base, los profesionales de nutrición, psicología y trabajo social deben programar el seguimiento del paciente. Si no existen alteraciones de base, entonces el paciente puede regresar según la decisión del médico y de acuerdo con el seguimiento que siempre debe hacerse de las condiciones nutricionales (mediante el registro del peso e idealmente el índice de masa corporal), las condiciones psicológicas (según seguimiento del estado de ánimo y del uso de alcohol y drogas) y las sociales (persistencia de comportamientos de riesgo, inestabilidad familiar o laboral, dificultades de funcionamiento con el entorno en general).
Además, el seguimiento clínico debe incluir la valoración por médicos especialistas, según la necesidad determinada por el médico del programa.
6.2 Seguimiento de laboratorio
Posponga la realización de la carga viral dos semanas si el paciente tiene una infección aguda o vacunación reciente (IIB). (Véase tabla 11).
7. VIH y embarazo
Recomendaciones
Los cambios fisiológicos ocurridos durante la gestación pueden afectar la absorción, distribución, biotransformación y eliminación de los medicamentos, lo que explica las dos primeras consideraciones. De otro lado, el grado de riesgo de los antirretrovirales sobre el feto no sólo depende de la sustancia en sí, sino de otros factores como la dosis utilizada, la edad gestacional en la que se administra el medicamento y la duración de la exposición. La información sobre la seguridad de ciertos medicamentos en el embarazo se deriva de datos de toxicidad obtenidos en animales, lo cual es particularmente cierto para los antirretrovirales. Aunque los datos clínicos sobre antirretrovirales en el embarazo son muy limitados, hay suficiente información disponible sobre algunos agentes que permite clasificarlos como recomendados, agentes alternativos y contraindicados o no recomendados (7).
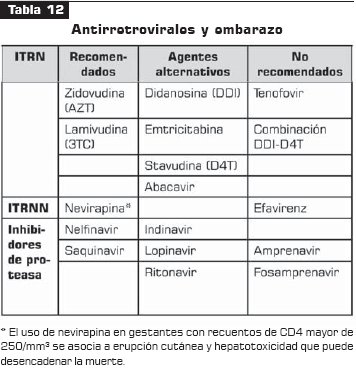
La tabla 12 muestra las consideraciones principales de los antirretrovirales en el embarazo.
El objetivo primordial de la quimioprofilaxis durante la gestación es reducir los niveles de ARN viral para disminuir el riesgo de transmisión vertical. El esquema de profilaxis más aceptado incluye la utilización de zidovudina (AZT) antes, durante y después del parto (tabla 13), que debe iniciarse luego de terminar el primer trimestre en todas las pacientes gestantes, independientemente del recuento de CD4, del nivel de carga viral y de la presencia o ausencia de síntomas.
7.1 Detección
Las recomendaciones de detección de VIH en embarazo se mencionan en la sección general de detección y diagnóstico.
7.2 Terapia antirretroviral y la mujer embarazada
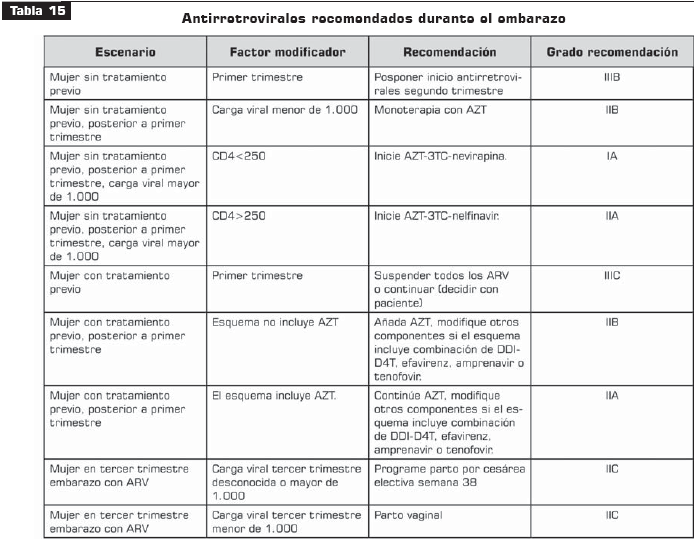
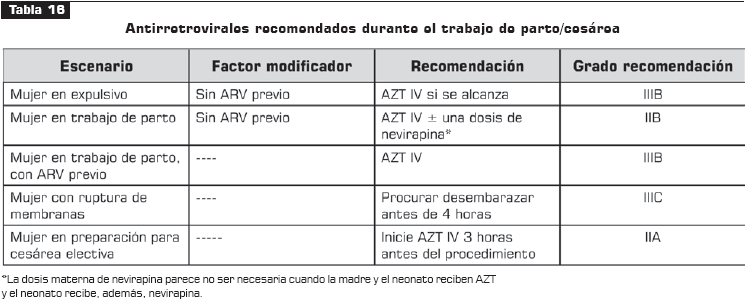
Véanse tabla 14, tabla 15, tabla 16 y tabla 17.
7.3 Evaluación inicial y seguimiento de la gestante infectada
Todo lo mencionado en las secciones de evaluación inicial y seguimiento del paciente con VIH se aplican para la mujer embarazada. Las siguientes son recomendaciones adicionales. (Véase tabla 18).
7.4. Profilaxis del recién nacido de mujer infectada o de mujer con prueba de tamizaje positiva o dudosa con pruebas confirmatorias pendientes
Véase tabla 19
7.5 Seguimiento del hijo de mujer infectada
El seguimiento del recién nacido se menciona en la sección de detección.
8. Profilaxis de infecciones oportunistas
Véase tabla 20
9. Exposición de riesgo
9.1 Exposición ocupacional
El sitio corporal donde ocurrió la exposición debe ser lavado con agua y jabón, en el caso de la piel, y con agua en irrigación, en el caso de mucosas (IIIA). No existe evidencia que soporte el uso de antisépticos, pero tampoco están contraindicados. No se recomienda el uso de corrosivos o cáusticos. Una vez ocurrida la exposición, el trabajador debe contactar al personal de epidemiología hospitalaria si está disponible y, si no está disponible, debe acudir al servicio de urgencias. Se debe llenar un reporte por escrito que incluya fecha, hora, detalles de la exposición, fuente de la exposición y conducta adoptada. Todo el proceso de evaluación y toma de decisiones debe hacerse en las horas inmediatamente siguientes a la exposición (IIA). La evaluación debe considerar un posible riesgo de transmisión de otros patógenos (sífilis, hepatitis B, hepatitis C) (IIA). Se debe recomendar al expuesto prácticas que permitan evitar la posible transmisión del VIH a terceros durante el período de seguimiento, mediante la utilización de condón, entre otros (ver sección de prevención) (IIIA).
De estar indicada, la profilaxis postexposición debe iniciarse tan pronto como sea posible. Los estudios en animales sugieren que entre más rápido se inicie la profilaxis es mejor, con un efecto cuestionable después de 48 a 72 horas de ocurrida la exposición. La siguiente tabla muestra las recomendaciones de la profilaxis postexposición (IIA).
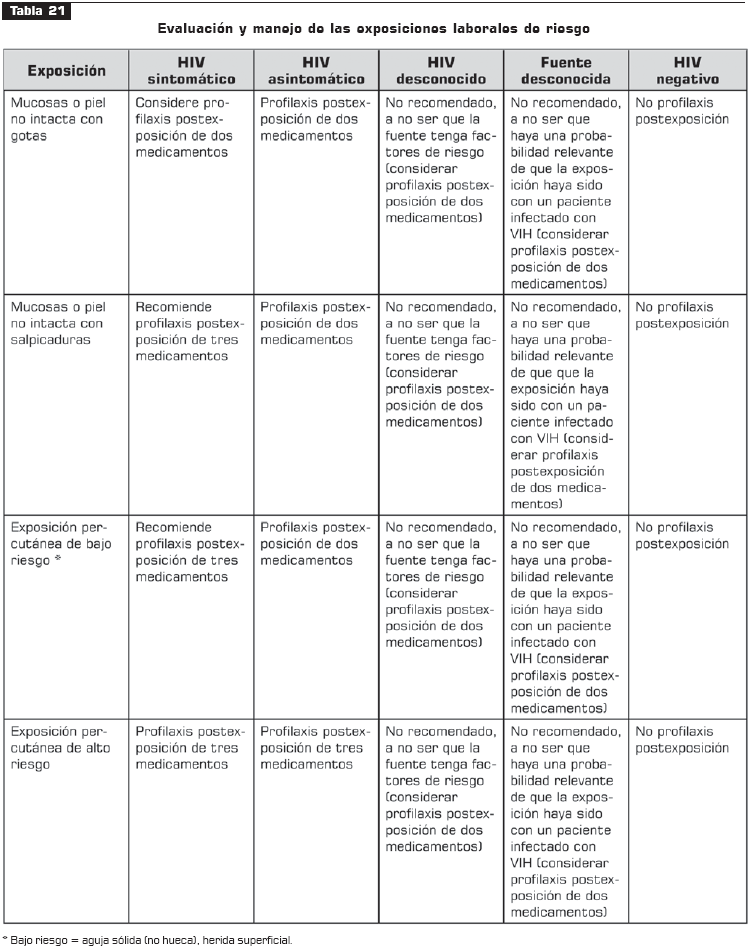
La selección de los componentes de la profilaxis postexposición no es rígida sino que depende de la historia de resistencia y de exposición de la fuente (IIIB). De estar disponible, debe consultarse un experto en enfermedades infecciosas o VIH/sida, pero, bajo ninguna circunstancia se debe retrasar el inicio de la profilaxis postexposición si está indicada (IIIB). (Véase tabla 21).
Profilaxis postexposición de dos medicamentos: AZT-3TC o D4T-3TC. Hay que tener en cuenta si está disponible la historia de la fuente.
Profilaxis postexposición de tres medicamentos: AZT-3TC-tercer medicamento, guiada según la historia de exposición y la resistencia antirretroviral de la fuente; se puede usar el mismo esquema que para la iniciación de ARV (efavirenz), si la historia de exposición es limitada. Si la fuente tiene una historia de exposición a múltiples esquemas o si la historia de exposición de la fuente es desconocida, considere utilizar como tercer medicamento lopinavirritonavir.
Prescribir la profilaxis postexposición por 4 semanas (IIB).
Evaluar los efectos adversos dos semanas después de la iniciación de la PPE (IIIB).
Obtenga los mismos exámenes paraclínicos que en pacientes que inician la terapia (ver sección de seguimiento) (IIIB).
Debe realizarse VIH-ELISA de base, al trabajador expuesto, en las horas siguientes al accidente (IIIB).
Realizar VIH-ELISA a los 3 meses y a los 6 meses al trabajador expuesto a VIH, expuesto a fuente con estado de VIH desconocido o a fuente desconocida (IIIB).
Cuando la fuente es VIH negativo, no se requiere seguimiento (IIA).
9.2 Exposición no ocupacional
Si se decide administrar profilaxis postexposición, se debe escoger un esquema que tenga en cuenta la historia de la experiencia antirretroviral y la resistencia viral en la fuente. Si se desconocen esas circunstancias, se debe escoger un esquema potente y bien tolerado. Se puede utilizar la misma recomendación mencionada en la sección de iniciación de la terapia (AZT-3TC-efavirenz) si la historia de exposición a antirretrovirales en la fuente es limitada (IIIB). Si el individuo fuente tiene una historia de exposición a múltiples esquemas terapéuticos o si se desconoce la historia de exposición de la fuente, considere utilizar dos ITRN combinados con lopinavir-ritonavir (IIIB).
De estar disponible, debe consultarse un experto en enfermedades infecciosas o VIH/sida, pero, bajo ninguna circunstancia se debe retrasar el inicio de la profilaxis postexposición si está indicada (IIIB).
El seguimiento es similar al mencionado en la exposición ocupacional (IIIB).
ABREVIA TURAS UTILIZADAS
3TC: lamivudina
Abac: abacavir
ADN: ácido desoxirribonucleico
AINES: antiinflamatorios no esteroides
ALT: transaminasa glutámico-pirúvica (SGPT)
Anti-HBc: anticuerpo anti-Core para hepatitis B
ARN: ácido ribonucleico
ARV: antirretroviral
AZT: zidovudina
b.i.d.: dos veces al día (cada 12 horas)
BK: tinción para el bacilo de la tuberculosis
CDC: Centers for Disease Control and Prevention, Atlanta
CROI: Conference on Retrovirus and Opportunistic Infections
CV: carga viral
D4T: estavudina
DDI: didanosina
EF: efavirenz
FDA: Food and Drug Administration
FTC: emtricitabina
HBsAg: antígeno de superficie de la hepatitis B
IAC: International AIDS Conference
ICAAC: Interscience Conference on Antimicrobial
Agents and Chemotherapy
IDSA: Infectious Diseases Society of America
IgG: inmunoglobulina G
IP: inhibidores de proteasa
ISS: Instituto de Seguros Sociales
ITRN (o N): inhibidores de la transcriptasa reversa nucleósidos
ITRNN: inhibidores de la transcriptasa reversa no nucleósidos
ITS: infecciones de transmisión sexual
IV: intravenoso
LDL: lipoproteínas de baja densidad
N (o ITRN): Inhibidores de la transcriptasa reversa nucleósidos
n: número
PCR: reacción en cadena de la polimerasa
PPD: derivado proteico purificado (tuberculina)
q.d.: una vez al día
Ref: referencia
Rit, r: ritonavir
Sida: síndrome de inmunodeficiencia adquirida
TAC: tomografía axial computarizada.
TEC: trabajador encargado de asesorar el cumplimiento
US PHS: United States Public Health Service
VIH: virus de la inmunodeficiencia humana.
VO: por vía oral
VPH: virus del papiloma humano.
REFERENCIAS
1. http://www.minproteccionsocial.gov.co/VBeContent/library/documents/DocNewsNo15103DocumentNo1844.PDF Consultado el 28 de noviembre del 2006.
2. Rossi, Sáenz y Vargas. Cuentas Nacionales VIH/SIDA. Fundación Mexicana para la Salud FUNSALUD. Iniciativa Regional sobre SIDA para América Latina y el Caribe SIDALAC. Programa Conjunto de las Naciones Unidas sobre el VIH/SIDA, ONUSIDA. Bogotá: Ministerio de Salud de Colombia; 2002.
3. The Appraisal of Guidelines, Research, and Evaluation in Europe (AGREE) Collaborative Group. Guideline Development in Europe: An International Comparison. Int J Technol Assess Health Care 2000;16:1039-49.
4. Garfield FB, Garfield JM. Clinical judgment and clinical practice guidelines. Int J Technol Assess Health Care 2000;16:1050-60.
5. Larizgoitia I, Rodríguez JR, Granados A, Comité Asesor Científico. ¿Cómo se toman las decisiones clínicas en atención primaria? Opinión de los profesionales. Barcelona: Coopers & Lybrand; 1998.
6. Grimshaw J, Freemantle N, Wallace S, Russell I, Hurwitz, Watt I, et al. Developing and implementing clinical practice guidelines. Qual Health Care 1995;4:55-64.
7. http://www.sign.ac.uk. Consultado el 9 de abril de 2005.
8. http://ngc.org/. Consultado el 11 de marzo de 2005.
9. http://www.agreecollaboration.org/. Consultado el 11 de marzo de 2005.
10. Oxman AD, Sacket DL. Guyatt GH, Evidence Based Medicine Working Group. How to Get Started. Based on the Users Guides to Evidence-based JAMA 1993;270(17):2093-5.
11. Barchini GE, Budán PD, Palliotto D. Procesos claves en la práctica de la MBE. Universidad Nacional de Santiago del Estero - Facultad de Ciencias Exactas y Tecnologías, Departamento de Informática. Santiago del Estero, Argentina.
12. Satya-Murti Evidence-Based Medicine: How to practice and teach EBM JAMA 2000; 284: 2382-2383.
13. http://www.journals.uchicago.edu/CID/journal/issues/v32n6/001571/001571.web.pdf Consultado en abril del 2005.
14. Jovell AJ, Navarro-Rubio MD. Evaluación de la evidencia científica. Med Clin (Barc) 1995;105:740-3.