Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Infectio
Print version ISSN 0123-9392
Infect. vol.11 no.3 Bogotá July/Sept. 2007
GUÍAS DE PRÁCTICA
Guía de práctica clínica para toxoplasmosis durante el embarazo y toxoplasmosis congénita en Colombia
Clinical practice guidelines for toxoplasmosis during pregnancy and congenital toxoplasmosis in Colombia
Reunión de consenso, 14 de mayo de 2007
Hotel Las Camelias, Montenegro, Quindío
Asociación Colombiana de Infectología
Fecha de recepción: 11/03/2007; fecha de aceptación; 20/08/2007
Líder de la elaboración de la guía:
Jorge Enrique Gómez, M.D., M.Sc. en Biomedicina Tropical, Ph.D. en Biología Parasitaria; profesor asociado, Facultad de Ciencias de la Salud, Universidad del Quindío; presidente, Capítulo del Eje Cafetero, Asociación Colombiana de Infectología, Armenia, Quindío.
Colaboradores y panel de expertos
Bayron Ruiz, médico ginecólogo; profesor, Facultad de Ciencias de la Salud, Universidad del Quindío, Armenia, Quindío; Pedro Silva, médico ginecólogo; presidente, Sociedad Santandereana de Ginecología y Obstetricia, Bucaramanga, Santander; Sandra Beltrán, médica pediatra, infectóloga; Asociación Colombiana de Infectología, Bogotá, D. C.; Jorge Cortés, médico infectólogo; profesor, Universidad Nacional de Colombia, Bogotá, D. C.; José Montoya, médico infectólogo; Laboratorio de Toxoplasmosis, Palo Alto Medical Research Foundation, Stanford University, California, Estados Unidos; Alejandro Agudelo, médico ginecólogo; Universidad del Valle, Cali, Colombia.
INTRODUCCIÓN
La toxoplasmosis congénita puede llevar a serias consecuencias en el desarrollo neurológico y en la salud visual del niño y es, en la mayoría de casos, el resultado de una infección primaria en una mujer inmunocompetente que se encuentre embarazada. El médico responsable del control prenatal requiere, entonces, de unas guías de manejo que le permitan establecer –de acuerdo con la mejor evidencia posible– el riesgo de una mujer en gestación, asesorar, prevenir y tomar decisiones importantes sobre:
i) la indicación de la realización de pruebas de laboratorio para el diagnóstico de infección primaria;
ii) la diferenciación entre infección primaria e infección anterior a la gestación y, en el mejor de los casos, poder precisar la fecha de infección, o datación;
iii) asesorar a los padres sobre el riesgo de infección según la datación de la infección;
iv) la realización de pruebas complementarias, tales como amniocentesis y ecografía de tercer nivel;
v) inicio de profilaxis con espiramicina o pirimetamina-sulfonamidas.
Además de la toma de decisiones en la consulta individual, en Colombia es necesario establecer un consenso sobre la indicación de las pruebas de tamización universal prenatal y neonatal y la relación costo-beneficio. Los responsables de tomar decisiones sobre programas de salud pública requieren determinar si un programa de tamización prenatal o neonatal está indicado con base en el beneficio que se puede ofrecer a los casos detectados, y si la inversión que hace la sociedad en estos programas está justificado en la relación costo-beneficio.
El objetivo de esta guía de práctica clínica basada en la evidencia es ofrecer un consenso de las indicaciones para la detección, el manejo y el control de la toxoplasmosis en el embarazo en Colombia.
METODOLOGÍA
a. Primera etapa de selección de preguntas.
Los coordinadores elaboraron un cuestionario de preguntas clínicas a las que la guía debía responder. Estas preguntas se distribuyeron a todos los miembros del grupo con las siguientes alternativas: inclusión, exclusión, complementación o adición. En una segunda ronda, se votó por cada una de las preguntas para adición o exclusión únicamente.
b. Segunda etapa de revisión de la literatura.
Para cada pregunta se seleccionaron las palabras clave y se hizo una revisión sistemática de la literatura con clasificación de la evidencia.
La búsqueda inicial de estudios se llevó a cabo de la siguiente manera:
- Búsqueda de publicaciones a través de Pubmed (http://www.nlm.nih.gov/) utilizando los siguientes términos sin restricción de año ni de idioma: "toxoplasmosis and Colombia", "toxoplasmosis and metaanalysis", "toxoplasmosis pregnancy and treatment", "toxoplasmosis pregnancy and risk factors", "toxoplasmosis and diagnosis", "toxoplasmosis diagnosis pregnancy",
- Búsqueda de algunas de las referencias de los estudios seleccionados en la búsqueda por PubMed.
- Consulta a expertos y a la biblioteca del Centro de Investigaciones Biomédicas de la Universidad del Quindío.
Una vez se completó la búsqueda, se continuó con una clasificación de títulos y resúmenes del nivel de evidencia.
Los datos reportados por los estudios se analizaron describiendo la validez interna, el tipo de estudio (retrospectivo, cohorte de seguimiento), el tamaño de la muestra del grupo con intervención y sin intervención, y el tipo de análisis estadístico.
1. Para los tratamientos: se construyeron tablas de cada estudio en las cuales se registraban las diferencias en el tratamiento entre el grupo control y el tratado, y tabla comparativa con autor, título, año de publicación, población de estudio, tamaño de la muestra, grupo sin intervención o histórico, con esquema alternativo, el criterio diagnóstico y el desenlace al año de vida –coriorretinitis o evaluación neurológica–.
2. Para los factores de riesgo: los valores de odds ratio (OR) se consignaron en una tabla comparativa con autor, título, año de publicación, población de estudio, tamaño de la muestra, número de casos y controles o grupo de cohorte, y definición de caso.
3. Para las pruebas diagnósticas: se listaron la sensibilidad, la especificidad y el índice diagnostic odds ratio (DOR). La tabla comparativa debía incluir: autor, título, año de publicación, población de estudio, tamaño de la muestra, patrón de referencia, técnica utilizada, sensibilidad encontrada, especificidad encontrada y DOR. En los casos en los que no se contó con todos los datos del estudio, se utilizaron los valores de sensibilidad y especificidad reportados por el autor.
Se calificó el nivel de evidencia de acuerdo con el siguiente esquema:
- – Para estudios epidemiológicos:
– I: estudio epidemiológico con muestra representativa de selección aleatoria (control de errores I
y II) utilizando técnicas de referencia estandarizadas o estudios longitudinales o de cohortes
– II: estudios de casos y controles
– III: estudios de factores asociados a la prevalencia
– IV: estudios descriptivos no controlados o sin control de error tipo I o tipo II
- – Para estudios diagnósticos:
– Nivel I: estudios con muestras con niveles de confianza mayores de 95%, estándar de referencia o algoritmo diagnóstico prospectivo
– Nivel II: estudios con estándar de referencia o algoritmo diagnóstico retrospectivo
– Nivel III: estudio de niveles de confianza menores de 90%
- – Para estudios clínicos:
Ia: experimento clínico aleatorio controlado de excelente calidad, que incluye un metaanálisis
Ib: estudios clínicos controlados aleatorios de buena calidad
II: estudios clínicos controlados abiertos o sin asignación aleatoria
III: estudios descriptivos de series de casos sin controles o controles históricos
IV: opiniones de expertos
RESULTADOS
Epidemiología y factores de riesgo
¿Se conoce la frecuencia de la infección por toxoplasmosis durante el embarazo en Colombia?
Se hizo una revisión en PubMed (http://www.ncbi.nlm.nih.gov/entrez/query.fcgi http://www.ncbi.nlm.nih.gov/entrez/query.fcgi) (6 abril de 2007) con los términos "toxoplasmosis" y "Colombia". Para la literatura nacional se buscaron las memorias de eventos nacionales, principalmente, la revista Infectio (publicación oficial de la Asociación Colombiana de Infectología) y Biomédica (publicación oficial del Instituto Nacional de Salud). Se hicieron dos análisis sobre:
1. la prevalencia de anticuerpos IgG en mujeres embarazadas, con lo cual se puede estimar el grado de exposición de la población al parásito; esto permite estimar el porcentaje de población que es susceptible durante el periodo de gestación (mujeres seronegativas para IgG), y
2. la frecuencia de infección primaria, lo que permite estimar la frecuencia de infecciones que son adquiridas durante el periodo de gestación.
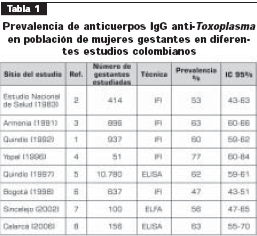
Luego de la búsqueda en PubMed, se encontraron 23 referencias y sólo una se refirió a estudios de seroprevalencia con cálculo de la frecuencia de infección primaria (1). El estudio se llevó a cabo en el departamento del Quindío en una muestra representativa, aplicando técnicas de referencia del diagnóstico (nivel de evidencia I). Este estudio fue representativo de la población de mujeres gestantes del Quindío (937 embarazadas). En las 937 mujeres examinadas, 569 (60%; IC 95% 59-62) fueron reactivas por la técnica de IFI-IgG. Esta técnica es de referencia para la medición de anticuerpos IgG.
En la literatura nacional no indexada se encontraron 10 estudios publicados entre 1988 y 2006, y uno sin publicarse (2-11). Se encontró un estudio adelantado en 1980 por el Ministerio de Salud en una muestra representativa de todo el país (9.139 personas) aplicando la prueba de IFI-IgG. Este estudio encontró una prevalencia de 47% en la población general y de 63% en una submuestra de 414 mujeres embarazadas (nivel de evidencia I).
Llama la atención que en todos los estudios de prevalencia hechos en Colombia en mujeres embarazadas siempre se encuentran prevalencias mayores a las de la población general, sin importar la región en la que se haya llevado a cabo (2-7). Los resultados de los estudios de prevalencia de anticuerpos IgG, que indican el porcentaje de población inmune durante el embarazo, se presentan en la tabla 1.
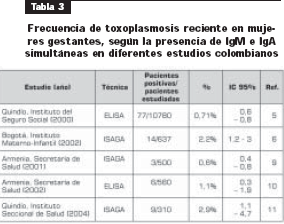
Con respecto a la frecuencia de la infección primaria, sólo tres estudios en Colombia (7, 11, 12) han reportado tasas de seroconversión basados en el seguimiento de mujeres negativas por serología (tabla 2). Los resultados son de baja confiabilidad debido al tamaño reducido de las muestras (error tipo I). Esto se refleja en los amplios intervalos de confianza que incluyen 0% de seroconversión. Por esta razón, se han utilizado los estudios serológicos de corte transversal en la población de mujeres en edad fértil para estimar la incidencia de la infección primaria.
Sin embargo, las técnicas que han permitido mejorar la sensibilidad de la detección de la IgM detectan por mayor tiempo esta inmunoglobulina. En el estudio de 1993 en el departamento del Quindío, se utilizaron métodos de corrección de la persistencia de IgM y se encontró una frecuencia de 2 casos por 100 mujeres seronegativas (IC 95%: 1,2 - 2,8) lo cual se corroboró en un modelo matemático de cambios de prevalencia según la edad (1).
Los resultados de varios estudios sugieren que esta frecuencia es similar en diferentes sitios del país. En el Estudio Nacional de Salud de 1980, el cambio anual estimado en la seroprevalencia según la edad, pasó de 1,46% en mujeres del grupo de edad de 10 a 15 años a 0,7% en las de 40 a 44 años (2). En el estudio del Quindío fue de 1,5% en el grupo de mujeres de 15 años y pasó a 0,75 en el de 35 años (1). En un nuevo análisis del cambio de prevalencia por edad usando el mismo modelo matemático en el año 2002 y sobre datos de 310 gestantes, se encontró que era de 1,3% en las mujeres de 15 años y pasó a 0,7% en las de 35 años (9).
Esto sugiere que las condiciones de transmisión entre 1993 y 2002 en el departamento del Quindío se han mantenido sin modificar el riesgo de seroconversión. La aplicación de modelos matemáticos para estimar los porcentajes de cambios de prevalencia según la edad es la manera más económica y fiable para conocer el riesgo de seroconversión para toxoplasmosis sin tener que recurrir a estudios de seguimiento de madres negativas serológica-mente (13). El modelo matemático de cambio de prevalencia según la edad sugiere que la duración promedio de la IgM en una población de gestantes colombianas es de 2 años (1).
Otra manera de establecer el diagnóstico de una infección reciente es determinando la presencia simultánea de IgM e IgA anti- Toxoplasma. En Colombia, según los estudios realizados en diferentes regiones del país, las frecuencias en el embarazo van de 0,6% a 3% (tabla 3). El problema de estas estimaciones indirectas que incluyen la IgA es que los valores pronósticos positivos cambian de manera importante según la técnica utilizada. Así, la sensibilidad reportada con ELISA IgA es de 72% y la especificidad de 76% en sueros con infección crónica; en cambio, la técnica ISAGA-IgA en el mismo grupo de pacientes tenía una sensibilidad de 97% para detectar los casos agudos y una especificidad de 97% en los sueros de pacientes crónicos (14). Esto puede explicar por qué en los dos estudios que utilizaron ELISA IgA las frecuencias son menores a las que se encontraron utilizando la prueba de ISAGA. Los resultados de los estudios hechos con ISAGA IgA muestran frecuencias de infección primaria entre 0,6% y 2,9% en Bogotá y Armenia, cifras que, de nuevo, se encuentran dentro de las estimadas por los cambios de prevalencia según la edad.
Análisis de la evidencia. Existen indicios sólidos de que en diferentes regiones de Colombia, más de la mitad de las mujeres embarazadas (50% a 60%) tiene anticuerpos anti- Toxoplasma. Esto indica una alta exposición y circulación del parásito en el país y es posible calcular el número de susceptibles.
No se encontraron estudios de cohorte que describieran la seroconversión anual en gestantes. Sin embargo, los resultados de los modelos matemáticos, tanto en un estudio nacional de muy buena calidad -aunque se llevó a cabo hace más de 20 años- como en los obtenidos en el Quindío, comparados con los estudios de corte transversal mediante marcadores de infección reciente, dan resultados concordantes. De acuerdo con esto, es de esperarse que entre 0,6% y 3% de las gestantes adquieran la infección durante el embarazo. Este riesgo está claramente influido por la edad y es mayor en mujeres adolescentes (1,5%) y menor en mujeres gestantes de 35 años o más (0,7%).
¿Cuál es el impacto en términos de niños infectados y de síntomas al nacimiento?
La revisión de PubMed encontró un estudio en una muestra representativa de los recién nacidos en el Quindío (15). Se encontró una frecuencia de 0,62% (IC 95% 0,19-2,2). Los niños estaban asintomáticos y se trataron por un año sin que presentaran secuelas al final del primer año de vida. Otro estudio encontrado en PubMed se llevó a cabo en un centro de referencia de tercer nivel y encontró una frecuencia de 0,5% y un niño mortinato (16).
En la revisión de la literatura nacional se encontraron datos publicados en otro centro de referencia (Hospital Infantil Lorencita Villegas de Santos, Bogotá) que reportaron, en 1985, una prevalencia de 0,2% (17). En un reporte de serie de casos en 21 niños sintomáticos estudiados en la Universidad de Quindío de 1988 a 1997, y 6 casos de toxoplasmosis congénita estudiados en la Unidad de Parasitología de la Universidad Nacional durante 1998-1999, se encontró: parto prematuro en 5 casos, síndrome visceral (ictericia, hepatoespleno-megalia) en 16 casos, coriorretinitis en 11 casos y compromiso del sistema nervioso central (SNC), como calcificaciones, hidrocefalia o microcefalia, en 12 casos (18).Otro estudio en el Quindío (19) era prospectivo con seguimiento al año de edad y estaba basado en los casos detectados durante los programas de tamización prenatal o neonatal. Entre 17 niños, 7 estaban sintomáticos (41%); dos murieron (11,7%); en 4 de los 13 en los que se hizo examen oftalmológico hubo compromiso ocular (30%), y en 4 de los 11 en los que se hizo estudio de imágenes cerebrales hubo compromiso neurológico (36%).
Análisis de la evidencia. Tanto en centros de referencia como en hospitales locales, los datos muestran una frecuencia de toxoplasmosis congénita de 2 casos por 1.000 nacidos vivos, aproximadamente. Sin embargo, estos estudios sólo se han hecho en Quindío y en Bogotá. El único estudio prospectivo que permite describir la historia natural de los casos en el país se llevó a cabo en el departamento del Quindío e indica que puede ocurrir mortalidad hasta en 10% de los casos, síntomas neurológicos en 36% y síntomas oculares en 30%, al primer año de vida.
¿Se conocen los factores de riesgo para la transmisión de la toxoplasmosis durante el embarazo en Colombia?, y ¿cuáles son las recomendaciones para la prevención de la infección durante el embarazo?
Solamente se encontró un estudio de casos y controles de los factores de riesgo, realizado en el departamento del Quindío (nivel II). Se identificaron tres factores de riesgo: consumo de carne cruda o poco cocida (OR = 13,2, IC 95% 1,3-132, p = 0,01), consumo de bebidas hechas con agua sin hervir (OR = 4,5, IC 95% 1,1-17 p = 0,01) y contacto con gatos menores de 6 meses (OR indefinido, p = 0,01). El consumo de agua embotellada fue un factor protector (OR: 0,24, IC 95% 0,06-0,95, p = 0,02).
Evaluación de la evidencia. A pesar de que se requieren estudios en otros sitios del país con el fin de determinar si existen variaciones en los factores de riesgo, el estudio en Armenia confirma factores de riesgo previamente reconocidos y ampliamente conocidos. Puede ser de mayor importancia evaluar las estrategias que disminuyen la exposición a ellos, por ejemplo, el impacto del control de los gatos callejeros, el valor de las campañas educativas, la evaluación de la reducción de la infección por distribución subsidiada de agua embotellada , entre otras. Se considera prioritario evaluar las diferentes estrategias y determinar su impacto en la reducción de la infección congénita.
¿Cuáles son los criterios de infección durante el embarazo?, ¿cuál prueba de detección de anticuerpos se debe seleccionar en primer lugar?, ¿cuál como confirmación para definir toxoplasmosis adquirida durante el embarazo?, y ¿cuál debe ser la periodicidad del seguimiento de una mujer gestante seronegativa?
Se hizo una búsqueda PubMed de «toxoplasmosis congenital/diagnosis» (5 de abril de 2007) y se encontraron 474 referencias. Se encontró un solo estudio de buena calidad que responde a la pregunta sobre la prueba que se debe seleccionar en primer lugar y cuál como confirmación (20).
Este estudio se realizó con estándar de referencia (muestras de seroconversión y sueros de pacientes crónicos con fechas conocidas de infección), fue multicéntrico y se controlaron los errores tipo I y II (nivel I). Se evaluaron 195 combinaciones entre 20 ensayos para IgG de avidez, IgM, IgA, IgE e IgG AC/HS. Se utilizaron 276 sueros y participaron 20 centros de referencia; el objetivo era responder a la pregunta sobre la prueba de primera línea (tamiz) y la prueba para confirmación.
Todos los IgM –excepto uno– tuvieron una sensibilidad mayor o igual a 93%. La ISAGA-IgM (=9 puntos) tuvo una sensibilidad de 100% y 61% de especificidad. Dos ELISA IgA fueron los más específicos (> 95%) pero con sensibilidad menor de 86%. Dos ensayos de IgG de avidez tuvieron una especificidad mayor de 90%. Ninguna combinación fue capaz de distinguir en el 100% de los casos las infecciones agudas de las otras. La mejor combinación fue una prueba de IgM más una prueba de IgG de avidez (sensibilidad: 95%; especificidad: 99%).
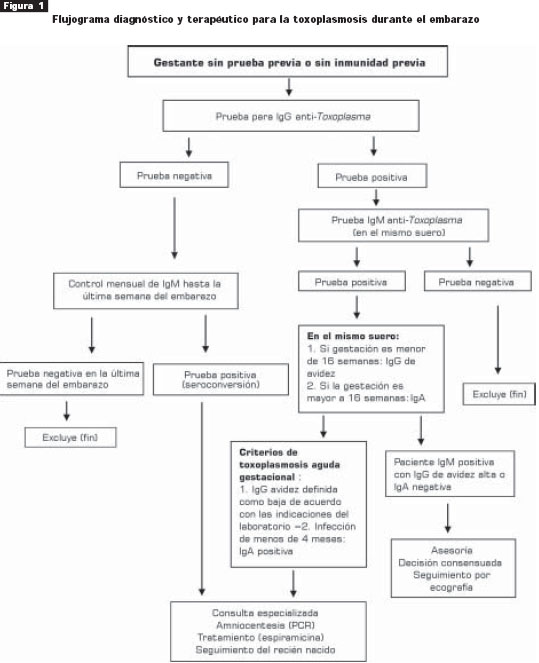
Evaluación y recomendaciones. De acuerdo con esta información, el grupo propone un flujograma estandarizado para la tamización prenatal utilizando tres pruebas serológicas específicas para los isotipos anti- Toxoplasma IgG, IgM e IgA (figura 1).
A todas las gestantes se les debe determinar una IgG inicial y a todas las gestantes positivas para IgG se les debe cuantificar la IgM en el mismo suero (recomendación A, nivel de evidencia I). A las gestantes negativas para IgG (no inmunes) se les debe hacer un seguimiento mensual con determinación de IgM (recomendación A, nivel de evidencia I). De acuerdo con un metaanálisis reciente sobre la eficacia del tratamiento (ver más adelante), la espiramicina tiene un efecto positivo sólo si se inicia en las primeras cinco semanas luego de la conversión serológica. Por esta razón, la única oportunidad de sacar algún provecho de esto es si se hace un seguimiento mensual.
Según el resultado de la IgG, en todas las pruebas positivas se debe analizar en el mismo suero la presencia de IgM. Dada la importancia del diagnóstico precoz en esta infección, los laboratorios no deberían esperar una orden médica adicional para practicar la prueba en el mismo suero de una mujer gestante. Una prueba positiva para IgG en una mujer gestante sin el resultado de la IgM no permite tomar una decisión clínica y, por lo tanto, sería un resultado inútil. Una prueba negativa para IgM descarta el riesgo de toxoplasmosis adquirida durante la gestación.
La situación más compleja se presenta cuando se encuentra una IgM positiva (presente en alrededor de 4% a 5% de la población colombiana de mujeres gestantes). Como pudo establecerse en el estudio multicéntrico europeo, la recomendación es practicar una prueba de IgG de avidez. Sin embargo, esto debería reservarse para las gestantes con edad de gestación menor de 16 semanas. Una avidez alta luego de este periodo, sin tener pruebas previas, no permite descartar infecciones durante las primeras semanas de gestación. Por lo tanto, la recomendación en gestaciones de más de 16 semanas sin pruebas previas es cuantificar la IgA en el mismo suero.
Se considera que las madres con IgG de avidez baja o positivas para IgA satisfacen los criterios de toxoplasmosis adquirida durante la gestación y deben remitirse a centros especializados de atención perinatal.
Dado que la IgA tiene una sensibilidad reducida, se recomienda ofrecer a las madres con IgM positiva e IgA negativa, asesoría y seguimiento mensual por ecografía.
El grupo hace énfasis en que, de acuerdo con los datos disponibles, pueden existir variaciones importantes en los valores de sensibilidad y especificidad de las pruebas, debido a las variaciones en el control de calidad de los laboratorios o de las marcas de las pruebas disponibles. Por lo tanto, es muy importante exigirles a los laboratorios que establezcan programas de control de calidad, internos y externos, y se recomienda que estas pruebas se efectúen en los laboratorios de referencia.Las pacientes con IgG negativa deben recibir las siguientes recomendaciones para evitar la infección durante el embarazo:
- Lavar bien las manos y los alimentos antes de comer o preparar alimentos.
- Cocinar la carne hasta que cambie de color.
- Evitar el contacto con gatos menores de 6 meses.
- No consumir agua sin hervir; se aconseja tomar agua filtrada o hervida, por lo menos, durante 10 minutos después del primer hervor.
- Se recomienda que a toda mujer en edad fértil se le practique una prueba de IgG anti-Toxoplasma antes de la concepción.
- Las pacientes con IgG positiva antes del embarazo no requieren pruebas adicionales durante los embarazos subsiguientes.
¿Cuándo y para qué (probabilidad antes y después de la prueba) debe realizarse la amniocentesis para el diagnóstico de infección fetal?
Se encontraron 12 estudios que evaluaron la sensibilidad y la especificidad de la prueba de reacción en cadena de la polimerasa en el líquido amniótico. La sensibilidad acumulada en el total de estos estudios fue de 79,6% y la especificidad, de 98%. Todos estos estudios se basaron en datos recolectados retrospectivamente (nivel de evidencia II).
Un estudio multicéntrico de buena calidad (nivel I) fue adelantado por la red europea de estudio en toxoplasmosis congénita (EMSCOT). Este estudio se hizo de manera prospectiva en una cohorte de 678 niños seguidos hasta el primer año de vida para determinar el estado de infección (21). La sensibilidad de la PCR en el líquido amniótico fue de 58% en mujeres con conversión serológica en la semana 12 y se elevó a 78% en aquéllas con seroconversión a la semana 30. El incremento en 5% por semana de gestación en la sensibilidad no fue estadísticamente significativo. La sensibilidad fue de 69% (IC95% 0,58-0,79). No hubo evidencia de un efecto del tratamiento sobre la sensibilidad, aunque los intervalos de confianza fueron amplios debido a que hubo pocas pacientes sin tratamiento. El cambio más grande en la probabilidad posterior a la prueba ocurrió con un resultado positivo en el primer trimestre de gestación, así, en una mujer con seroconversión a la semana 12, el resultado positivo de PCR aumenta el riesgo de infección fetal de 9% a 84%. La especificidad de la prueba fue de 96% (IC95% 0,94-0,98).
Evaluación y recomendaciones. La prueba de PCR en líquido amniótico tiene una gran especificidad.
Un resultado positivo indica infección fetal; sin embargo, un resultado negativo no la descarta. Esto debe advertirse a los padres antes de la realización de la prueba. La mayor indicación es para el cambio de terapia con espiramicina por tratamiento con pirimetamina-sulfadiazina o sulfadoxina. El grupo recomienda hacer la amniocentesis después de la semana 18.
¿Cuál es el valor de la ecografía para definir el pronóstico?
Se encontró un estudio prospectivo de buena calidad en 27 niños (nivel I) sin lesiones según la ecografía pero con infección congénita, seguidos entre 15 a 71 meses de vida; de ellos, en 10 se observaron signos radiológicos o coriorretintis aunque con desarrollo neurológico normal (22). Otro estudio multicéntrico con 36 casos seguidos prospectivamente durante dos años, se hizo en hijos de madres con conversión serológica durante el primer trimestre del embarazo y sin anomalías en la ecografía. En 7 niños se encontró coriorretinitis sin mayor pérdida de la agudeza visual y el desarrollo intelectual fue normal; sólo un niño (3%) desarrolló lesión macular, retardo psicomotor y convulsiones (23).
Evaluación y recomendaciones. Existe evidencia de que la ecografía es un buen indicador de buen pronóstico fetal (baja probabilidad de desarrollo de lesiones graves). Estos datos se obtuvieron en sitios de referencia con ecografistas perinatólogos: no existe evidencia del valor de las ecografías.
¿Qué antibiótico (dosis y duración) debe darse durante una infección adquirida durante el embarazo?
Existe un revisión sistemática en la base Cochrane (24) y otra revisión sistemática europea actualizada en el 2006 (25). Estas revisiones no encontraron estudios aleatorios controlados que determinaran el beneficio del tratamiento prenatal.
Un metaanálisis publicado en el 2007 se basó en datos individuales de pacientes y se realizó en 22 cohortes europeas (550 niños) y 4 cohortes de otros países (141 niños), así: 1 cohorte de Estados Unidos, una de Colombia y dos de Brasil (26). Para el análisis del efecto sobre el riesgo de transmisión al niño, se analizaron los datos de las cohortes europeas y se encontró que el tratamiento con espiramicina (3 g diarios hasta el parto) producía un OR ajustado de 0,48 (IC95% 0,2-0,8), si éste se hacía en las primeras tres semanas después de la seroconversión; de 0,64 (IC95% 0,4-1,0), si se hacía entre 3 y 5 semanasdespués de la seroconversión; de 0,6 (IC95% 0,3-1), entre 5 a 8 semanas después de la seroconversión; y, un OR igual al de referencia (sin efecto), si se hacía luego de 8 semanas de seroconversión.
El análisis de todas las cohortes encontró un OR ajustado de 0,42 (IC95% 0,2-0,9) para el riesgo de encontrar síntomas clínicos en el niño, si el tratamiento prenatal con espiramicina (3 g diarios hasta el nacimiento) se administraba en las primeras 4 semanas después de la seroconversión, y este OR bajaba a 0,64 (IC95% 0,4-0,99) si se daba después de este tiempo.
En las cohortes europeas, este efecto protector fue menos evidente y compatible con efecto o ningún efecto, así: 0,68 (IC95% 0,3-1,5), si se hacía antes de pasadas 5 semanas de la seroconversión y de 0,87 (IC95% = 0,4-1,8), si se hacía luego.
En Austria se emplea un esquemas diferente al de la espiramicina, con tratamiento con pirimetamina-sulfadiazina inicialmente; en el metaanálisis no se encontraron diferencias entre el efecto protector de la espiramicina y el de pirimetamina-sulfadiazina (ambas opciones daban el mismo nivel de efecto protector relacionado con el tiempo de inicio con respecto a la seroconversión).
No se encontraron estudios válidos que evaluaran otros antibióticos diferentes de los analizados en el metaanálisis para el tratamiento prenatal de la toxoplasmosis.
Evaluación y recomendaciones. El nivel de evidencia para un beneficio del tratamiento prenatal no permite determinar con certeza si existe beneficio o no, ya que no se han controlado los efectos de confusión por tratamiento selectivo tardío de madres con mayor riesgo de transmisión. Esto sólo es posible con estudios aleatorios controlados. Frente a esto, el grupo considera que, dada la posibilidad de un efecto benéfico, se debe ofrecer siempre el tratamiento cuando se encuentran criterios serológicos (seroconversión o IgM positivo).
Según el metaanálisis, el efecto puede ser en el mejor de los casos de 80% o en el peor de 20% (estimación de acuerdo con los intervalos de confianza para el tratamiento en las primeras 8 semanas).
Según el metaanálisis de datos individuales, un tratamiento después de 8 semanas de ocurrida la infección puede no tener ningún efecto. Si la infección se detecta después de este periodo, se debe brindarles orientación a los padres indicando que el tratamiento puede que no tenga ningún efecto. En todos los casos, con los criterios serológicos de infección durante el embarazo, se recomienda la vigilancia por ecografía, la amniocentesis y el estudio del recién nacido. Si no es posible la datación de la infección, se debe estimar el riesgo máximo probable restando 4 semanas a la fecha del primer resultado de IgG.
Se propone el siguiente esquema, basado en el uso de espiramicina, la cual es muy bien tolerada y sin riesgo de toxicidad fetal en el caso de infecciones maternas sin infección fetal comprobada:
– Infección detectada antes de la semanas 18ª de gestación: espiramicina, 3 g al día (9 millones de unidades), hasta determinar si hay infección después de la amniocentesis o si no la hay.
– Infección detectada después de más de 18 semanas de gestación: pirimetamina-sulfadoxina (Falcidar®), 3 tabletas cada 8 días más ácido folínico, 15 mg al día hasta el final del embarazo, o pirimetamina, 25 mg al día más sulfadiazina, 4 g al día y ácido folínico, 15 mg al día hasta el final del embarazo.
Luego de practicar la amniocentesis, si el resultado de la PCR en el líquido amniótico es positivo, se debe continuar el tratamiento con pirimetamina-sulfa y, si es negativo, se debe volver a la espiramicina hasta el final del embarazo. Se debe aclarar que se desconoce el efecto de la duración del tratamiento de la espiramicina y, por lo tanto, se recomienda el tratamiento hasta el final del embarazo (tal como fue analizado en los metaanálisis de las cohortes europeas), hasta que no existan estudios que examinen diferentes tiempos de administración.
¿Qué tratamiento debe hacerse en caso de PCR positiva en líquido amniótico o de lesiones visibles en la ecografía?
Los datos disponibles provienen de los estudios de metaanálisis que incluyeron niños infectados y no infectados. El análisis del efecto del tratamiento debe hacerse en el contexto del efecto del tratamiento prenatal sobre síntomas clínicos en los niños infectados.En el estudio de metaanálisis basado en datos individuales (27, Grupo SYROCOT datos sin publicar), se encontró que los niños en Suramérica estaban más afectados que los niños en Europa y en ellos fue relevante un efecto benéfico del tratamiento, ya fuera que se iniciara en la madre en las primeras 4 semanas de seroconversión (mayor efecto: OR ajustado 0,42) o después de las 4 semanas de seroconversión (menor efecto: OR ajustado 0,64). Estos efectos tienen un alto grado de incertidumbre sobre el porcentaje de beneficio, ya que puede ir de 10% a 90% (IC95% 0,2-0,9) para los tratamientos prenatales en las primeras 4 semanas de seroconversión, o de 1% a 60% (IC95%: 0,4-0,99) si se hace después de este periodo. No hubo diferencias en el tratamiento con espiramicina o pirimetamina-sulfadiazina o pirimetaminasulfadoxina.
Análisis y recomendaciones. La evaluación del beneficio en el caso de madres con examen positivo del líquido amniótico se considera de manera diferente a la de las madres con sólo diagnóstico de seroconversión o con criterios basados en la presencia de marcadores de infección reciente. La evidencia del nivel de beneficio es difícil de determinar por las diferencias en cepas entre Europa y América, y porque no se incluyeron datos de madres tratadas en Suramérica.
Dado que un resultado positivo en la PCR tiene una alta especificidad y que en este caso se considera que existe prueba de infección fetal, por el impacto social y psicológico de demostrar infección congénita y, por otra parte, la existencia de una posibilidad de efecto benéfico, el grupo considera que en este caso la alternativa es la administración de espiramicina, 3 g al día, en infecciones adquiridas durante las primeras 18 semanas de gestación.
Luego de 18 semanas de gestación, las alternativas (en ausencia de antecedentes de alergia a sulfonamidas) son:
- – pirimetamina-sulfadoxina (Falcidar®), dosis de carga de 6 tabletas en la primera dosis y, luego, 3 tabletas cada 8 días, más ácido folínico, 15 mg al día hasta el final del embarazo;
- – pirimetamina en dosis de carga el primer día de 50 mg y, luego, 25 mg al día más sulfadiazina, 8 g el primer día y, luego, 4 g al día, acompañadas de ácido folínico, 15 mg al día hasta el final del embarazo.
Dentro del grupo existe controversia sobre el uso de la combinación pirimetamina-sulfadoxina dado el riesgo de reacciones graves, como el síndrome de Stevens-Johnson. De acuerdo con la literatura, el uso de la combinación pirimetamina-sulfadoxina es seguro si se usa adecuadamente; existe amplia experiencia en el uso de esta combinación durante el embarazo en África, para el tratamiento o la profilaxis de paludismo (27). En el caso del uso de la combinación fija pirimetamina-sulfadoxina (Falcidar ®), no se debe dar con intervalos menores de 8 días debido a los riesgos elevados de reacciones alérgicas si se hace con menor frecuencia.
¿Cuáles son los criterios diagnósticos en el recién nacido?
Se encontraron tres estudios de buena calidad, comparables, prospectivos, con controles de error tipo I y II, y todos con el criterio diagnóstico basado en la persistencia de IgG al año de vida.
En uno de ellos (28), prospectivo con 233 casos de infección congénita y 661 controles, se encontró que el diagnóstico por la técnica ISAGA en sangre neonatal (IgM, 98%; IgA, 100%) era más específico que en cordón umbilical (IgM, 85%; IgA, 88%). La sensibilidad no fue diferente en la sangre neonatal (IgM, 61%; IgA, 60%) que en el cordón umbilical (67% y 54%). Si se combinaba IgM e IgA, la sensibilidad aumentaba a 73%.
En otro estudio multicéntrico de 14 laboratorios europeos, con 55 niños con infección congénita y 50 controles (29), se encontró que si se añadía un criterio basado en la comparación de perfiles inmunológicos madre e hijo por Western blot o ELIFA, aumentaba la sensibilidad a 98%.
Otro estudio multicéntrico de 10 centros europeos (30), estudió 170 recién nacidos infectados y 822 controles. La sensibilidad fue muy baja por inmunofluorescencia indirecta para IgM (10%) y ELISA IgM (29%), pero similar para ISAGA IgM (54%), ISAGA IgA (58%) y ELISA IgA (52%). La especificidad fue más baja para ELISA IgA (91%) que para ISAGA IgM (96%), IFI IgM (100%) y ELISA IgA (98%). Para IgM, pero no para IgA, la sensibilidad fue menor cuando la madre tuvo la seroconversión en el primero o el segundo trimestre del embarazo. La sensibilidad era mayor si se tomaba la muestra una a dos semanas después del nacimiento y, la especificidad mayor, si se tomaba cuatro semanas después del nacimiento.
Análisis y recomendaciones. Dado que existe agotamiento de la IgM en el niño cuando la madre se ha infectado en los primeros meses de gestación, el diagnóstico no se puede hacer basándose sólo en pruebas para IgM. La combinación de pruebas permite mejorar la sensibilidad del diagnóstico.
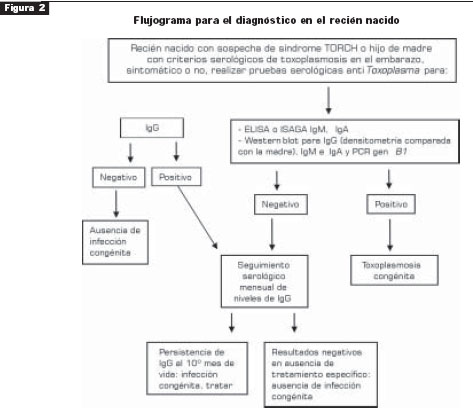
El grupo propone un flujograma de diagnóstico (figura 2) para el recién nacido sintomático o asintomático. En el niño, se proponen como criterios diagnósticos los siguientes:
a. Niños con pruebas ISAGA o ELISA IgM o IgA anti- Toxoplasma positivas en sangre del cordón umbilical (se debe confirmar a los 10 días de vida pues puede haber paso de IgM o IgA maternas durante el parto) o en los meses que siguen al nacimiento.
b. Niños con persistencia de títulos IgG anti-Toxoplasma más allá del primer año de vida. c. Niños que no tienen descenso de los títulos IgG anti- Toxoplasma o cuando estos títulos aumentan durante el seguimiento a partir del tercer mes de vida.
¿Cuándo se debe tratar al niño con infección congénita, con cuáles antibióticos y durante cuánto tiempo?
No se encontraron estudios aleatorios controlados sobre la eficacia del tratamiento posnatal de la toxoplasmosis congénita. Todos los estudios han sido abiertos con controles históricos; en una revisión previa por un experto se evaluaron los resultados de estos estudios (31). Luego de esta revisión, apareció el reporte con la serie de casos más grande para este tipo de estudios: el National Collaborative Chicago-Based, Congenital Toxoplasmosis Study, que validó un año de tratamiento con pirimetamina-sulfadiazina, comparando los desenlaces de 120 niños sintomáticos tratados con controles históricos (32).
Evaluación y recomendaciones. Existe consenso internacional en que los niños sintomáticos deben tratarse (31, 33-35). En este caso, no existe consenso sobre la duración del tratamiento; en Dinamarca se da por tres meses y, en Francia, en unos centros se hace por un año y en otros, por dos años (31). No existe evidencia firme de que una duración sea mejor que otra.
En todos los casos es deseable que a los niños asintomáticos se les haga seguimiento con el fin de detectar la aparición de síntomas y tratarlos si se presenta una fase aguda.
Para el tratamiento de niños sintomáticos, el grupo propone:
- pirimetamina, 2 mg/kg el primer día y, luego, continuar 1 mg/kg al día (sin exceder 15 mg al día) hasta completar un año;
- sulfadiazina, 100 mg/kg al día repartidos en dos dosis, hasta completar un año.
En Colombia no es fácil obtener sulfadiazina. A continuación se ofrece la dirección y el teléfono de un químico farmacéutico de Bucaramanga con quien se puede obtener: Miguel Moreno, Carrera 29 Nº 48-49; teléfono fijo: 741-7557 y celular (315) 741 7557.
Si no se consiguen los fármacos anteriores, se plantean las siguientes opciones.
– Opción 1: pirimetamina más sulfadoxina tabletas (Falcidar®, 1 comprimido de 500 mg de sulfadoxina y 25 mg de pirimetamina). Se da disuelto e, igualmente, con base en la dosis de sulfadoxina, 25 mg/kg. Se da una dosis de carga de 50 mg/kg, según la sulfadoxina. el primer día y, luego, 25 mg/kg hasta el primer año de vida.
Existe controversia dentro del grupo sobre el uso de esta combinación debido al riesgo de efectos adversos y las dudas sobre los niveles terapéuticos durante la administración a intervalos semanales. En la literatura aparece un estudio de farmacocinética en 89 niños que valida la dosis semanal para obtener niveles terapéuticos (36). Sin embargo, en otro estudio con un número menor de niños, se encontró mucha variabilidad en la farmacocinética de niños (37).
– Opción 2: pirimetamina, 1 mg/kg al día por vía oral más clindamicina, 20 mg/kg al día por vía intramuscular dividido en tres dosis en la fase aguda y, luego, pasar a vía oral (Dalacín, suspensión, 75 mg = 5 ml) para mantenimiento hasta los dos años.
En los dos esquemas se debe administrar ácido folínico (Leucovorín® o Rescovulin® o Tecnovorin ®, tabletas por 15 mg) durante el tiempo del tratamiento: media tableta interdiaria. Si hay anemia, se pasa a media tableta diaria. Si la anemia no cede en el control al mes siguiente, se deben suspender de manera transitoria los medicamentos y reanudar cuando se normalicen los niveles. Si hay alergia (erupción cutánea) se debe suspender el tratamiento. Durante la suspensión, se puede reemplazar con otra alternativa recientemente descrita por un equipo chino: azitromicina, 10 mg/kg al día durante 8 días por dos meses y, luego, se sigue un mes con tratamiento y un mes sin tratamiento (38).
En el seguimiento de los niños, se recomienda lo siguiente:
– Primer mes de tratamiento con pirimetamina: examinar el cuadro hemático, las plaquetas y los niveles del medicamento (si es posible).
– Posteriormente, solicitar cuadro hemático y recuento de plaquetas cada dos semanas.
– Cada 3 meses, hacer examen parcial de orina, creatinina, serología para toxoplasmosis y niveles del medicamento.
– Control pediátrico mensual, vigilando el adecuado desarrollo neurológico.
– Si el análisis del líquido cefalorraquídeo inicial es anormal, debe tomarse un control a los 6 meses. Si las pruebas bioquímicas son anormales, hay que repetirlas a los 3 meses.
– Evaluaciones neurológica, oftalmológica y auditiva (audiometría) a los 6 meses y al año.
– Ultrasonido cerebral a los 3 y 6 meses de la evaluación inicial y TAC al año.
Estos elementos para el seguimiento deben permitir evaluar una buena respuesta y la ausencia de efectos adversos. Se debe observar disminución de los niveles de IgG o la desaparición de la IgM y la IgA; en caso contrario, por ejemplo, si hay aumento en los niveles de IgG o reaparición de IgM o IgA, esto es indicativo de un problema en la absorción o en la toma del medicamento. Si esto ocurre, se debe valorar la causa y corregirla. Una ayuda ideal para esto sería medir los niveles séricos de primetamina y sulfadoxina.
Luego de un año de tratamiento, se continúa el seguimiento con:
– serología al mes, a los 6 meses y al año después del tratamiento;
– examen audiológico y oftalmológico cada año, y,
– examen neurológico anual.
REFERENCIAS
1. GÓMEZ-MARÍN JE, CASTAÑO JC, MONTOYA MT. A maternal screening program for congenital toxoplasmosis in Quindío (Colombia) and application of mathematical models to estimate incidence using age-stratified data. Am J Trop Med Hyg. 1997;57:180-6.
2. JULIAO O, CORREDOR A, MORENO GS. Estudio Nacional de Salud: Toxoplasmosis en Colombia. Bogotá: Instituto Nacional de Salud; 1988.
3. GÓMEZ-MARÍN JE, MONTOYA MT, CASTAÑO JC, RÍOS MP. Epidemiología de la infección por Toxoplasma gondii en gestantes de Armenia (Quindío). Colombia Médica. 1993;24:14-8.
4. POSADA MP, OSORIO LE, ÁLVAREZ CA, LÓPEZ C, MONCADA L, CÁCERES E, ET AL. Seroprevalencia del Toxoplasma gondii en mujeres consultantes al hospital de Yopal, Casanare. Rev Fac Med UN. 1997;45:128-31.
5. MONTOYA MT, GÓMEZ-MARÍN JE, RUIZ B, CASTAÑO JC. Frequency of specific IgM and IgA anti- Toxoplasma in pregnant women from Armenia. Abstract WePS6-2. Abstract Book Volume 2. XVth International Congress for Tropical Medicine and Malaria. Cartagena, August 20-25, 2000. p.119.
6. BARRERA AM, CASTIBLANCO P, GÓMEZ-MARÍN JE, LÓPEZ MC, RUIZ A, MONCADA L, REYES P, CORREDOR A. Frecuencia de toxoplasmosis adquirida durante el embarazo en el Instituto Materno Infantil de Bogotá. Revista de Salud Pública. 2002;4:286-93.
7. MANRIQUE E, MACHADO N, BLANCO P, RUIZ B. Alta tasa de seroconversión para toxoplasma en gestantes de Sincelejo, Sucre. Infectio. 2004;8:263-7.
8. MONTOYA MT, GÓMEZ JE, NIETO OA, QUINTERO L, RAMÍREZ ME, CASTAÑO JC. Reporte diagnóstico del sistema de vigilancia epidemiológica para toxoplasmosis congénita en la ciudad de Armenia. SEInvestiga. 2001;6:36-7.
9. MONTOYA MT, GÓMEZ JE, NIETO OA, QUINTERO L, RAMÍREZ ME, CASTAÑO JC. Programa de control prenatal para toxoplasmosis congénita en la ciudad de Armenia. Infectio. 2002;6:87.
10. GONZÁLEZ MM, CASTAÑO JC, JIMÉNEZ IE, BARRERA JG, GÓMEZ JE. Seroprevalencia de la toxoplasmosis gestacional en el departamento del Quindío, 2002. Infectio. 2004;8:95.
11. RESTREPO M, JARAMILLO V, KURTZER A. Infección por Toxoplasma gondii durante el embarazo. Antioquia Médica. 1976;25:335-47.
12. SANTACRUZ MM, HEREDIA R, CORREDOR A. Efecto de medidas preventivas contra la toxoplasmosis. Biomédica. 1992;2:61-7.
13. PAPOZ L, SIMONDON F, SAURIN W, SARMINI H. A simple model relevant to toxoplasmosis applied to epidemiologic results in France. Am J Epidemiol. 1986;123:154-61.
14. MONTOYA MT, GÓMEZ-MARÍN JE, LOANGO N, CASTAÑO JC, MARX C, FOUDRINIER F, ET AL. Utilidad de dos pruebas serológicas para IgA humana anti-toxoplasma como pruebas de referencia para toxoplasmosis materna reciente. Acta Méd Colomb. 1998;23:275-82.
15. GÓMEZ-MARÍN JE, GONZÁLEZ MM, MONTOYA MT, GIRALDO A, CASTAÑO JC. A newborn screening programme for congenital toxoplasmosis in the setting of a country with less income. Arch Dis Child. 2007;92:88.
16. GALLEGO-MARÍN C, HENAO AC, GÓMEZ-MARÍN JE. Clinical validation of a Western blot assay for congenital toxoplasmosis and newborn screening in a hospital in Armenia (Quindío) Colombia. J Trop Ped. 2006;52:107-12.
17. ROMERO J. El síndrome TORSCH en perinatología. Pediatría. 1990;25:51-61.
18. GÓMEZ-MARÍN JE, CASTAÑO JC, MONTOYA-LONDOÑO MT, LOANGO N, LÓPEZ C, SARMIENTO MC, NAVARRO L, ALVARADO F. Toxoplasmosis congénita en Colombia: análisis clínico y de laboratorio en 27 casos. Pediatría. 2000;35:52-7.
19. LÓPEZ CA, DÍAZ J, GÓMEZ-MARÍN JE. Factores de riesgo en mujeres embarazadas, infectadas por Toxoplasma gondii en Armenia- Colombia. Revista de Salud Pública. 2005;7:180-90.
20. ROBERTS A, HEDMAN K, LUYASU V, ZUFFEREY J, BESSIERES MH, BLATZ RM, ET AL. Multicenter evaluation of strategies for serodiagnosis of primary infection with Toxoplasma gondii. Eur J Clin Microbiol Infect Dis. 2001;20:467-74.
21. THALIB L, GRAS L, ROMAND S, PRUSA A, BESSIERES MH, PETERSEN E, GILBERT R. EMSCOT. Prediction of congenital toxoplasmosis by polymerase chain reaction analysis of amniotic fluid. Br J Obstet Gynecol. 2005;112:567-74.
22. BERREBI A, KOBUCH WE, BESSIERES MH, ET AL. Termination of pregnancy for maternal toxoplasmosis. Lancet. 1994;344:36-9.
23. BERREBI A, BARDOU M, BESSIERES MH, NOWAKOWSKA D, CASTAGNO R, ROLLAND M, ET AL. Outcome for children infected with congenital toxoplasmosis in the first trimester and with normal ultrasound findings: A study of 36 cases. Eur J Obstet Gynecol Reprod Biol. 2007; en prensa.
24. PEYRON F, WALLON M, LIOU C, GARNER P. Treatments for toxoplasmosis in pregnancy. Cochrane Database Syst Rev. 2000;2: CD001684.
25. THIEBAUT R, BRICOUT H, COSTANZO S, MOUILLET E. Systematic review of published studies evaluating postnatal treatment effect. Disponible en: http://eurotoxo.isped.u-bordeaux2.fr
26. THE SYROCOT STUDY GROUP. Effectiveness of prenatal treatment for congenital toxoplasmosis: a meta-analysis of individual patients data. Lancet. 2007;369:115-22.
27. PETERS PJ, THIGPEN MC, PARISE ME, NEWMAN RD. Safety and toxicity of sulfadoxine/pyrimethamine: implications for malaria prevention in pregnancy using intermittent preventive treatment. Drug Saf. 2007;30(6):481-501
28. WALLON M, DUNN D, SLIMANI D, GIRAULT V, GAY-ANDRIEU F, PEYRON F. Diagnosis of congenital toxoplasmosis at birth: what is the value of testing for IgM and IgA? Eur J Pediatr. 1999;158:645-9.
29. PINON JM, DUMON H, CHEMLA C, ET AL. Strategy for diagnosis of congenital toxoplasmosis: evaluation of methods comparing mothers and newborns and standard methods for postnatal detection of immunoglobulin G, M and A antibodies. J Clin Microbiol. 2001; 39:2267-71.
30. GILBERT R, THALIB L, TAN HK, ET AL. Screening for congenital toxoplasmosis: accuracy of immunoglobulin M and immunoglobulin A test after birth. J Med Screen. 2007;14:8-13.
31. PETERSEN E. Toxoplasmosis. Seminars Fetal Neon Med. 2007; en prensa.
32. MCLEOD R, BOYER K, KARRISON T, ET AL. Toxoplasmosis Study Group. Outcome of treatment for congenital toxoplasmosis, 1981- 2004: the National Collaborative Chicago-Based, Congenital Toxoplasmosis Study. Clin Infect Dis. 2006;42:1383-94.
33. GÓMEZ-MARÍN JE, DE LATORRE A. Positive benefit of postnatal treatment in congenital toxoplasmosis. Arch Dis Child. 2007; 92:88-9.
34. GILBERT R. A randomised controlled trial of neonatal screening for congenital toxoplasmosis is needed. Arch Dis Child. 2007; en prensa.
35. ROIZEN N, SWISHER CN, STEIN MA, ET AL. Neurologic and developmental outcome in treated congenital toxoplasmosis. Pediatrics. 1995;95:11-20.
36. TRENQUE T, SIMON N, VILLENA I, CHEMLA C, QUEREUX C, LEROUX B, ET AL. Population pharmacokinetics of pyrimethamine and sulfadoxine in children with congenital toxoplasmosis. Br J Clin Pharmacol. 2004;57:735-41.
37. CORVAISIER S, CHARPIAT B, MOUNIER C, WALLON M, LEBOUCHER G, AL KURDI M, ET AL. Population pharmacokinetics of pyrimethamine and sulfadoxine in children treated for congenital toxoplasmosis. Antimicrob Agents Chemother. 2004;48:3794-800.
38. CHEN EF, FANG YH, GUO DX, FENG XW, ET AL. Follow up of 16 cases with congenital toxoplasmosis treated with azithromiciyn. Zhonghua Erke Za Zi. 2004;42:23-5.