Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Infectio
Print version ISSN 0123-9392
Infect. vol.11 no.4 Bogotá Oct./Dec. 2007
1 Hospital Universitario del Valle, Cali, Colombia.
2 Clínica San Pedro Claver, Bogotá, D.C., Colombia.
3 Hospital Militar Central, Bogotá, D.C., Colombia.
4 Fundación Santa Fe de Bogotá, Bogotá, D.C., Colombia.
5 Wyeth Pharmaceutical, Bogotá, D.C., Colombia.
Fecha de recepción: 16-01-2008 Fecha de aceptación: 21-02-2008
Resumen
Introducción: la tigeciclina, el primer representante del grupo de las glicilciclinas, nueva clase de antibióticos, ha sido recientemente introducida en Colombia y no se disponen aún de datos en el país de su actividad in vitro.
Objetivo: evaluar la actividad in vitro de la tigeciclina contra aislamientos clínicos de pacientes hospitalizados en tres hospitales colombianos de tercer nivel.
Materiales y métodos: los aislamientos de bacterias aerobias y anaerobias facultativas de pacientes hospitalizados de tres centros de alta complejidad fueron remitidos a un laboratorio de referencia para la determinación de la concentración inhibitoria mínima (CIM) por el método de microdilución en caldo para la tigeciclina y otros antibióticos. Para los puntos de corte se utilizaron los criterios de interpretación de la CLSI 2006 y para la tigeciclina sugeridos por la FDA.
Resultados: la susceptibilidad a la tigeciclina de las cepas evaluadas y sus respectivas CIM50-90 fueron las siguientes: Staphylococcus aureus (n=78), 100%, 0,12 y 0,12 mg/L; Streptococcus pneumoniae (n=24) 100%, 0,015 y 0,5 mg/L; Streptococcus agalactiae (n=10), 100%, 0,03 y 0,06 mg/L; Enterococcus spp. (n=43) 100%, 0,06 y 0,12 mg/L; Klebsiella pneumoniae (n=56), 96,4%, 0,5 y 1 mg/L; Klebsiella oxytoca (n=15), 93,3%, 0,25 y 2 mg/L; Escherichia coli (n=89) 100%, 0,12 y 0,5 mg/L; Enterobacter cloacae (n=48), 100%, 0,5 y 2 mg/L; Serratia marscescens (n=42) 96,2%, 0,5 y 2 mg/L. Para Haemophilus influenza (n=15) y Acinetobacter baumannii (n=36), que no tienen puntos de corte definidos, las CIM50-90 fueron 0,06 y 0,12 y 0,5 y 2 mg/L, respectivamente. El 100% de los aislamientos productores de beta-lactamasas de espectro extendido de Escherichia coli (n=18) y el 94,4% de los de Klebsiella pneumoniae (n=18) fueron susceptibles a tigeciclina. Las CIM50-90 para Pseudomonas aeruginosa (n=63) fueron 8 y 16 mg/L.
Discusión: la tigeciclina mostró gran actividad in vitro contra cocos Gram positivos y bacilos Gram negativos recuperados de pacientes hospitalizados en Colombia. Dicha actividad fue independiente de la presencia de la resistencia a otros antimicrobianos.
Palabras clave: tigeciclina, Colombia, cocos Gram positivos, enterobacterias, Acinetobacter.
Abstract
Introduction: Tigecycline, the first agent of a new antibiotic class, the glicylcyclines, has been recently introduced in Colombia and there is no local data available regarding its in vitro activity.
Objective: To evaluate in vitro activity of tigecycline on clinically relevant bacterial isolates from hospitalized patients in three institutions in Colombia.
Methods: Aerobic and facultative anaerobic isolates from infections in inpatients from the three participant institutions were sent to a central referral laboratory to determine minimal inhibitory concentration (MIC) by microdilution broth method for tigecycline and other antimicrobials. Breakpoints for tigecycline and others antibiotics were adopted from the FDA and the CLSI recommendations, respectively.
Results: In vitro susceptibility in percentage and MIC50/90 values were as follows: Staphylococcus aureus (n=78) 100%, 0.12/0.12 mg/L; Streptococcus pneumoniae (n=24) 100%, 0.015/0.5 mg/L; Streptococcus agalactiae (n=10) 100%, 0.03/0.06 mg/L; Enterococcus spp (n=43) 100%, 0.06/0.12 mg/L; Klebsiella pneumoniae (n=56) 96.4%, 0.5/1 mg/L; Klebsiella oxytoca (n=15) 93.3%, 0.25/2 mg/L; Escherichia coli (n=89) 100%, 0.12/0.5 mg/L; Enterobacter cloacae (n=48) 100%, 0.5/2 mg/L; Serratia marscescens (n=42) 96.2%, 0.5/2 mg/L. For Haemophilus influenza (n=15) and Acinetobacter baumannii (n=36), which still lack defined breakpoints, MIC50/90 were 0.06/0.12 and 0.5/2 mg/L, respectively. 100% of extended espectrum betalactamase producers of Escherichia coli (n=18) and 94.4% of those of Klebsiella pneumoniae (n=18) were susceptible to tigecycline. MIC50/90 for Pseudomonas aeruginosa (n=63) were 8/16 mg/L.
Discussion: Tigecycline showed excellent in vitro activity against gram positive cocci and gram negative bacilli recovered from hospitalized patients in Colombia regardless of the presence of resistance to others antimicrobial agents.
Keywords: Tigecycline, Colombia, Gram positive cocci, enterobacteriaceae, Acinetobacter.
Introducción
La tigeciclina (9-t-butil-glicil-amido-minociclina) es el primer agente disponible de una nueva clase de antibióticos semisintéticos, las glicilciclinas (1-4). Ha demostrado una potente actividad contra una gran variedad de microorganismos patógenos aerobios Gram positivos y Gram negativos y anaerobios, que incluyen Staphylococcus aureus, Enterococcus spp., Streptococcus pneumoniae, Haemophilus influenzae, Moraxella catarrhalis, Neisseria gonorrhoeae, la mayoría de las enterobacterias y Bacteroides fragilis. Su espectro de actividad in vitro no se ve afectado por la mayoría de los mecanismos de resistencia a las tetraciclinas y se extiende a microorganismos con resistencia a betalactámicos, carbapenémicos, aminoglucósidos, quinolonas y vancomicina (4-9).
La tigeciclina es bacteriostática y actúa al unirse a la subunidad 30S del ribosoma y bloquear la entrada de moléculas de aminoacilo del ARNt al sitio A del ribosoma e impedir la incorporación de residuos de aminoácidos en la cadena polipeptídica en formación. La cadena lateral 9-t-butil-glicila-mido unida a una molécula base de minociclina le confiere la capacidad de evadir los dos principales mecanismos determinantes de la resistencia a las tetraciclinas: las bombas de salida y protección ribosómica, lo que resulta en un amplio espectro de actividad antimicrobiana (1-4). La tigeciclina no exhibe actividad contra Pseudomonas aeruginosa y presenta actividad reducida contra miembros de la familia Proteus spp., como Proteus mirabilis y Morganella morganii (2,4).
Aunque sus indicaciones aprobadas son infecciones complicadas o graves intraabdominales o de piel y tejidos blandos (10-14), su uso está siendo extendido a infecciones causadas por gérmenes multirresistentes al no disponerse frecuentemente de otras alternativas terapéuticas (5,8,15-20).
En Colombia no se dispone de datos de actividad microbiológica de la tigeciclina y el propósito de este estudio es reportar la experiencia colombiana del estudio colaborativo multicéntrico internacional TEST (Tigecycline Evaluation and Surveillance Trial, www.testsurveillance.com/main.php), de evaluación y vigilancia de la actividad in vitro de la tigeciclina comparada con otros antibióticos con actividad similar en aislamientos clínicamente relevantes de microorganismos Gram positivos y bacilos Gram negativos de pacientes hospitalizados en tres centros hospitalarios de Colombia con infecciones adquiridas en la comunidad u hospitalarias.
Materiales y métodos
Entre el año 2005 y el 2006, en tres hospitales universitarios de alta complejidad de Bogotá, se recolectó un número predefinido por protocolo y no mayor de 200 microorganismos causantes de infección clínica en pacientes hospitalizados por cada una de las instituciones participantes, de acuerdo con el siguiente listado: 15 S. pneumoniae, 15 Enterococcus spp., 25 S. aureus, 10 S. agalactiae, 15 H. influenzae, 15 Acinetobacter spp., 25 E. coli, 25 Enterobacter spp., 20 P. aeruginosa, 10 Serratia spp. y 25 Klebsiella spp. No se incluyeron aislamientos de Proteus spp. Sólo se permitió un aislamiento por paciente proveniente de cualquier sitio de infección y los aislamientos de orina no excedieron el 25% del total por protocolo.
Las cepas con sus respectivos datos demográficos y clínicos del paciente y los locales de susceptibilidad fueron remitidas a un laboratorio central de referencia, el International Health Management Associates, Inc., IHMA (Schaumburg, IL, USA) en concordancia con la reglamentación internacional de la IATA, para confirmar su identidad y realizar pruebas de susceptibilidad antimicrobiana mediante la determinación de las concentraciones inhibitorias mínimas (CIM) 50 y 90 por el método de microdilución en caldo y análisis de la información.
Como control de calidad se utilizaron las cepas recomendadas por el Clinical and Laboratory Standards Institute, CLSI, (22) E. coli ATCC 25922, H. influenzae ATCC 49766 y 49247, S. aureus ATCC 29213, P. aeruginosa ATCC 27853, Enterococcus faecalis ATCC 29212 y S. pneumoniae ATCC 49619, según fuese requerido.
Se estimó la concentración inhibitoria mínima capaz de inhibir el 50% y 90% de los aislamientos (CIM50 y CIM90, respectivamente). Se analizaron las distribuciones de frecuencias de las CIM y las tablas de porcentaje de susceptibilidad utilizando Crystal Reports, versión 8.0.1., una base de datos en formato Microsoft Access 2003.
Se emplearon dos páneles preparados por MicroScan (Dade Behring, Sacramento, CA, USA) para el estudio, el B1020-80W para microorganismos Gram positivos y el B1020-79W para Gram negativos, reconstituidos con el caldo Mueller-Hinton ajustado por catión y los recomendados aditivos para S. pneumoniae, S. agalactiae y H. influenzae de acuerdo con las recomendaciones del CLSI 2006 (22). Ambos páneles contenían amoxicilina/clavulanato, piperacilina/tazobactam, levofloxacina, ampicilina, ceftriaxona, minociclina, tigeciclina e imipenem. El panel para Gram positivos también incluyó oxacilina, linezolida, vancomicina y penicilina. El panel para Gram negativos adicionó cefepima, ceftazidima y amikacina.
La preparación e incubación del inóculo siguieron las pautas recomendadas por el fabricante. Se utilizaron los criterios de la CLSI 2006 (22) para la interpretación de los resultados de la actividad in vitro de los antibióticos comparados y para la tigeciclina se emplearon los puntos de corte sugeridos por la Food and Drug Administration (FDA) de acuerdo con el inserto para la tigeciclina (Tygacil 2005, Philadelphia, PA, Wyeth Pharmaceuticals Inc.) (12).
Los resultados para S. pneumoniae, H. influenzae, Acinetobacter spp. y P. aeruginosa se presentan en mg/L sin interpretación de susceptibilidad, dado que aún no se definen los puntos de corte correspondientes a la tigeciclina para estos microorganismos.
Resultados
Se obtuvieron 553 cepas, distribuidas en número similar entre las tres instituciones participantes dada la metodología del estudio, correspondientes a 155 cocos Gram positivos y 398 bacilos Gram negativos.
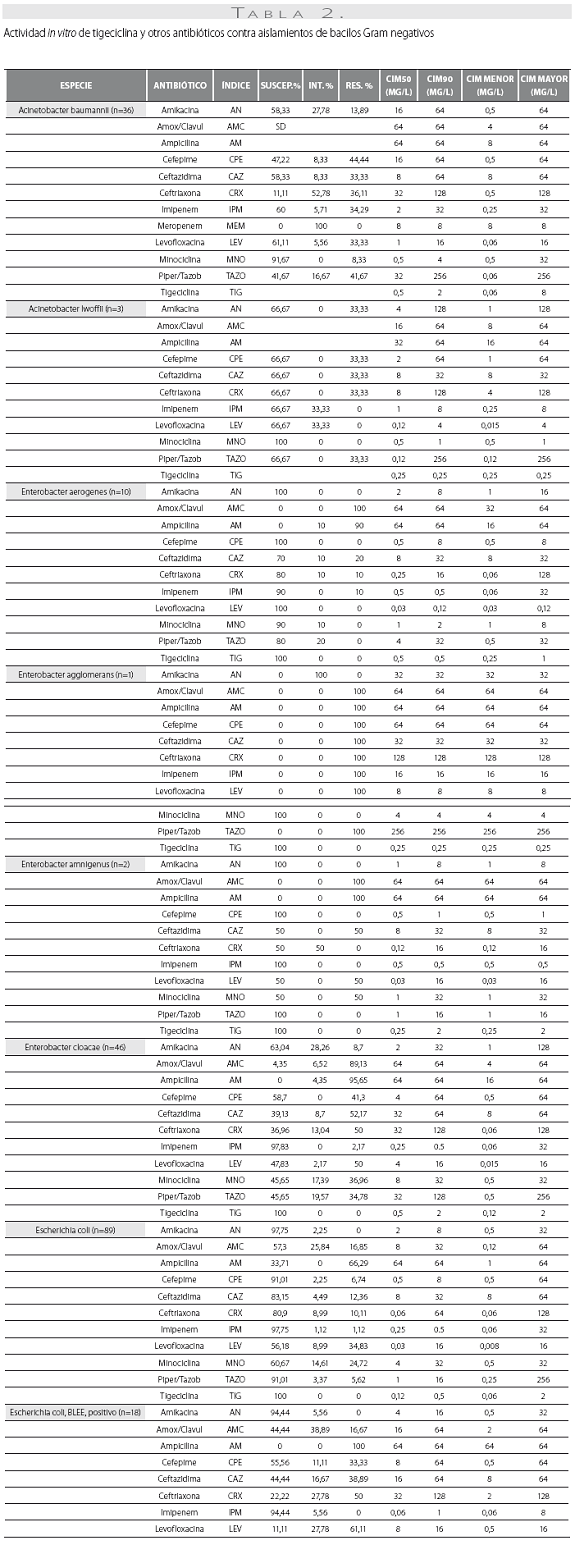
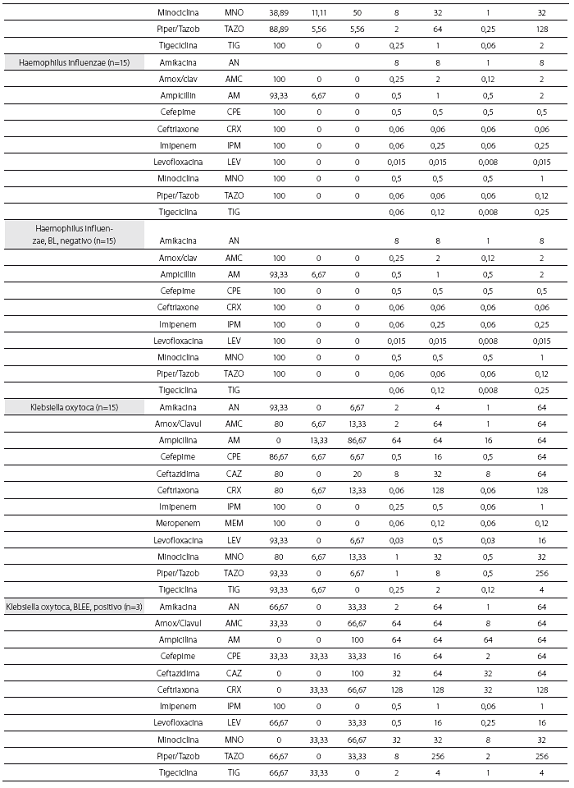
Las tablas 1 y tabla 2 detallan la actividad in vitro de la tigeciclina y los antibióticos evaluados comparativamente para los cocos Gram positivos y bacilos Gram negativos, respectivamente, expresada en términos de porcentajes de susceptibilidad y resistencia, CIM50, CIM90 y rango de CIM.
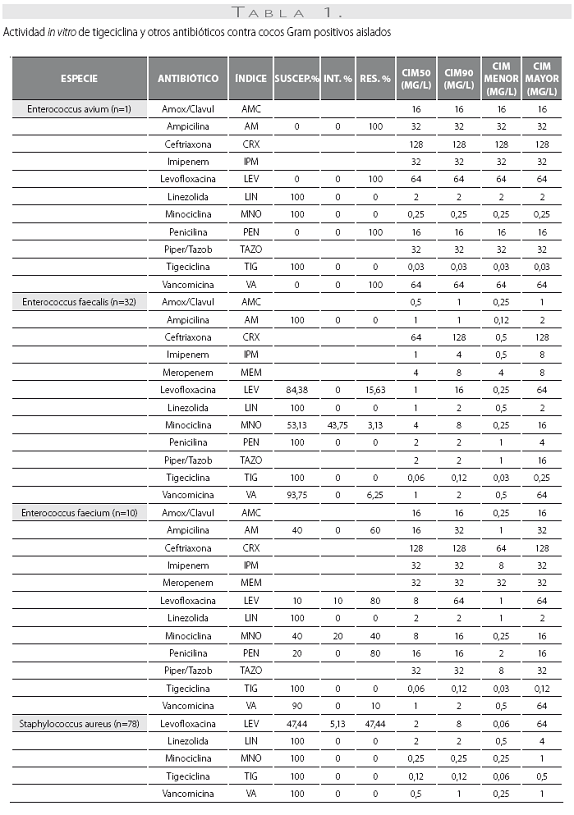
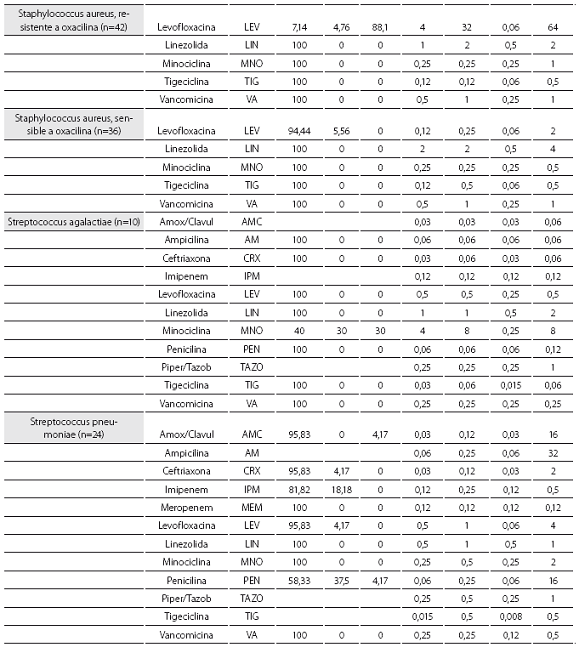
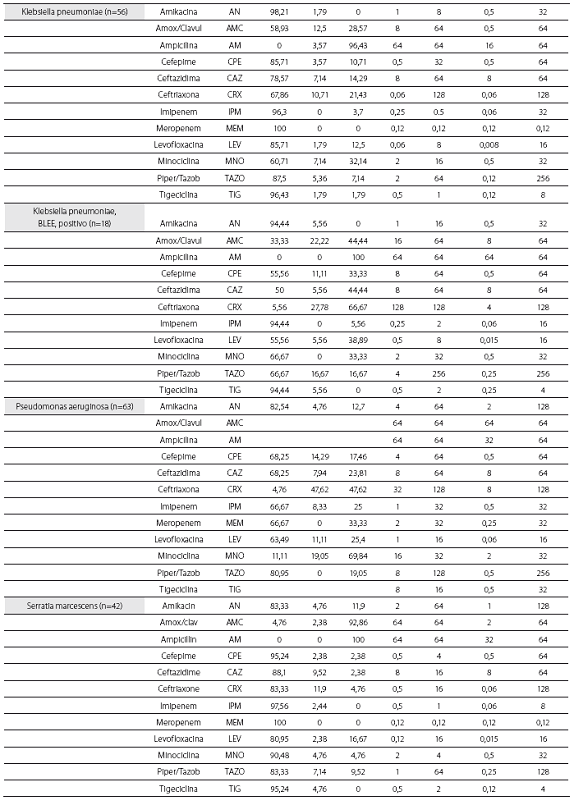
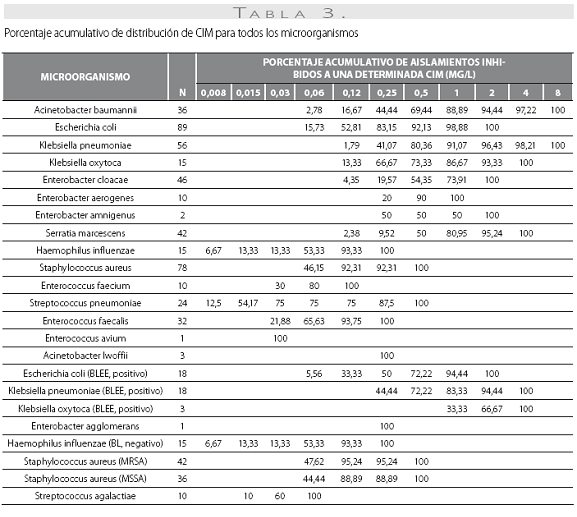
La tigeciclina demostró una excelente actividad contra microorganismos Gram positivos y se reportaron como susceptibles a ella el 100% de los aislamientos obtenidos. Esta actividad fue igual para S. aureus sensible y resistente a oxacilina, con CIM50 y CIM90 de 0,12 y 0,12 mg/L en ambos casos. S. pneumoniae mostró alta susceptibilidad, incluidos los aislamientos con sensibilidad disminuida a la penicilina (n=10, 41,7%), con CIM50/90 de tigeciclina muy bajas (0,015 y 0,5 mg/L) (tabla 1). De igual modo, la CIM90 fue muy baja (<0,5 mg/L) frente a los enterococos, incluidas las especies resistentes a la ampicilina (n=7, 16,3%) (tabla 3).
De las 261 enterobacterias, todos los aislamientos de E. coli (n=89) y Enterobacter spp. (n=59) fueron susceptibles a la tigeciclina, mientras que 1 de los 56 de K. pneumoniae (1,8%), 1 de 15 de los K. oxytoca (6,7%) y 1 de 42 de S. marscescens (4,8%) mostraron susceptibilidad intermedia a la tigeciclina, y 1 cepa de K. pneumoniae fue resistente. El 100% de las cepas fueron susceptibles a imipenem. De notar, la producción de betalactamasas de espectro extendido (BLEE) por E. coli (20%) y K. pneumoniae (31%) no afectó la actividad in vitro de la tigeciclina. Fue común la resistencia a las quinolonas, con base en la evaluación de levofloxacina, entre Enterobacter spp. (50% para E. cloacae), E. coli (34,8%) y K. pneumoniae (12,5%). Esta resistencia fue mayor en presencia de betalactamasas de espectro extendido: 61,1% de E. coli y 38,9% de K. pneumoniae productores de BLEE.
Se obtuvieron 36 aislamientos de Acinetobacter baumanni, la mayoría multirresistentes. La mayor susceptibilidad antimicrobiana de los antibióticos comparados fue dada por, en su orden, minociclina (91,7%), levofloxacina (61,1%), imipenem (60%) y amikacina y ceftazidima (58,3% para ambos). No se disponen aún de puntos de corte para Acinetobacter baumannii, por lo que el resultado de la CIM no se correlaciona con la interpretación de susceptibilidad in vitro. La CIM50 y la CIM90 fueron de 0,5 y 2,0 mg/L, respectivamente, con un mínimo de 0,06 y un máximo de 8 mg/L.
Los 15 aislamientos de H. influenzae fueron susceptibles a ampicilina, dado que no se obtuvieron cepas productoras de betalactamasas y presentaron unas CIM50-90 muy bajas a la tigeciclina (0,06 y 0,12 mg/L), lo cual ilustra la gran potencia y actividad de este antibiótico contra este microorganismo.
Las CIM50-90 de tigeciclina para los 63 aislamientos de P. aeruginosa fueron de 8 y 16 mg/L, respectivamente,
Discusión
La tigeciclina se ha introducido como una nueva herramienta terapéutica antibiótica de amplio espectro en una era en la que surgen pocas nuevas alternativas antimicrobianas y, en especial, activa contra gérmenes con gran variedad de mecanismos de resistencia (5, 8, 23).
El Instituto Nacional de Vigilancia de Medicamentos y Alimentos, INVIMA, le otorgó el registro sanitario a la tigeciclina en octubre de 2005 como un antibiótico alternativo en infecciones graves y complicadas de piel, tejidos blandos o intraabdominales, producidas por gérmenes Gram positivos, Gram negativos, anaerobios y atípicos susceptibles (24).
La tigeciclina ha demostrado ampliamente ser activa contra los gérmenes patógenos usuales asociados con estas infecciones (11, 13, 14); éste es el primer reporte de su actividad contra los microorganismos aislados de infecciones en pacientes hospitalizados en tres instituciones de tercer nivel en Colombia.
Si bien el origen de las cepas evaluadas en este estudio no es sólo de los sitios anatómicos de las indicaciones aprobadas, los resultados obtenidos brindan un sustento microbiológico importante para el uso clínico de la tigeciclina. La excelente actividad y potencia observada contra S. aureus, tanto sensible como resistente a oxacilina, lo confirma como un agente con gran actividad en infecciones graves originadas en la piel y en los tejidos blandos. La alta susceptibilidad observada de los bacilos Gram negativos entéricos respalda su uso en las infecciones polimicrobianas de piel y sus anexos, como la fasciítis necrosante o el pie diabético; así mismo, para las infecciones intraabdominales, generalmente polimicrobianas. Este espectro de acción contra las enterobacteriáceas se complementa con la acción contra los anaerobios de la tigeciclina reportada in vitro por Jacobus et al. (25) y Edlund et al. (26), entre otros, lo cual indica el potencial de la tigeciclina como una opción en la selección de un antibiótico de primera intención o empírico en el tratamiento de estas infecciones.
Los aislamientos de S. pneumoniae y H. influenzae, patógenos respiratorios por excelencia y, especialmente, en las infecciones adquiridas en la comunidad, fueron inhibidos a CIM50-90 muy bajas de tigeciclina. Esta potente característica in vitro, que corrobora los reportes de otros investigadores (27), se encuentra en correlación con los estudios clínicos de fase III que se desarrollan actualmente sobre la acción de la tigeciclina en la neumonía adquirida en la comunidad y cuyos primeros resultados aún no han sido publicados.
Entre los resultados obtenidos en nuestro estudio cabe resaltar la actividad de la tigeciclina contra los microorganismos que expresan diferentes mecanismos de resistencia, entre ellos S. aureus resistente a oxacilina, Enterococcus spp. resistente a ampicilina, E. coli y Klebsiella spp productores de BLEE y A. baumannii multirresistente. No se observó modificación de la susceptibilidad de estos microorganismos a la tigeciclina, lo que corrobora su mecanismo único de acción. Gales (28) en Latinoamérica y otros (8,9,15,20,29,30) han observado estos mismos resultados, sustentando su papel potencial en el manejo clínico de estas infecciones con gérmenes multirresistentes ya reportadas con frecuencia en Colombia y de escasas alternativas terapéuticas en nuestro medio (32-35, 37-39).
Las CIM50-90 de la tigeciclina para A. baumannii de 0,5 y 2,0 mg/L, con 88,9% de las cepas inhibidas a una CIM<1 mg/L (tabla 3) indican una potente actividad in vitro del antibiótico, que da soporte a los reportes de varios autores (16-19,31) y que se constituye en uno de los aspectos más novedosos de este nuevo antibiótico, especialmente en Colombia donde la presencia de A. baumannii es creciente en las unidades de cuidados intensivos y en los hospitales universitarios y centros de referencia (32-35), y con características de multirresistencia que incluyen los carbapenémicos (32,34). Aun cuando no se dispone de los puntos de corte para la determinación de la susceptibilidad in vitro de la tigeciclina contra A. baumannii, las características farmacocinéticas y farmacodinámicas de la tigeciclina definidas por Agwult et al. (36), determinando el índice farmacodinámico de área bajo la curva Vs. CIM como el mejor indicador de la respuesta terapéutica microbiológica, permiten inferir una buena actividad in vivo y eficacia en infecciones causadas por este microorganismo. A nivel regional, en los 317 aislamientos de A. baumannii evaluados para Latinoamérica del estudio TEST se reportaron CIM50-90 de 0,5 a 1,0 mg/L (37), muy similares a la experiencia colombiana.
La tigeciclina mostró gran actividad in vitro contra los microorganismos aislados de los pacientes hospitalizados en instituciones colombianas con infecciones moderadas a graves de manejo hospitalario, que incluían una amplia variedad de cocos Gram positivos, bacilos Gram negativos entéricos y Acinetobacter spp., independiente de la presencia de mecanismos de resistencia a otros antibióticos. Esta característica in vitro amerita ser evaluada en una forma más extensa en Colombia para sustentar definitivamente el uso de la tigeciclina en el tratamiento de las infecciones graves en pacientes de este país.
Financiación
El estudio TEST es un protocolo de evaluación internacional de la actividad de la tigeciclina financiado por Wyeth Farmaceuticals, Inc.
Conflictos de interés
Los autores Ernesto Martínez, Guillermo Prada, Carlos Alquichire y Carlos Pérez no expresan ningún conflicto de interés. Los autores Varinia Rozo y Jorge Larotta son empleados de la División Médica de Wyeth Farmaceuticals en Colombia y esta afiliación se indica en la sección de autoría al inicio del artículo.
Referencias
1. Sum PE, Petersen P. Synthesis and structure-activity relationship of novel glycylcycline derivatives leading to the discovery of GAR-936. Bioorg Med Chem Lett. 1999;9:1459-62. [ Links ]
2. Projan SJ. Preclinical pharmacology of GAR-936, a novel glycylcycline antibacterial agent. Pharmacotherapy. 2000;20(Pt2):219S-8. [ Links ]
3. Zhanel GG, Homenuik K, et al. The glycylcyclines: a comparative review with the tetracyclines. Drugs. 2004;64:63-88. [ Links ]
4. Petersen PJ, Jacobus NV, Weiss WJ, et al. In vitro and in vivo antibacterial activities of a novel glycylcycline, the 9-tbutylglycylamido derivative of minocycline (GAR-936). Antimicrob Agents Chemother. 1999;43:738-44. [ Links ]
5. Rossi F, Andreazzi D. Overview of tigecycline and its role in the era of antibiotic resistance. Braz J Infect Dis. 2006;10:203-16. [ Links ]
6. Abbanat D, Macielag M, Bush K. Novel antibacterial agents for the treatment of serious Gram-positive infections. Expert Opin Investig Drugs. 2003;12:379-99. [ Links ]
7. Gales AC, Jones RN. Antimicrobial activity and spectrum of the new glycylcycline, GAR-936 tested against 1,203 recent clinical bacterial isolates. Diagn Microbiol Infect Dis. 2000;36:19-36. [ Links ]
8. Biedenbach DJ, Beach ML, Jones RN. In vitro antimicrobial activity of GAR-936 tested against antibiotic-resistant gram-positive blood stream infection isolates and strains producing extended-spectrum beta-lactamases. Diagn Microbiol Infect Dis. 2001;40:173-7. [ Links ]
9. Patel R, et al. In vitro activity of GAR-936 against vancomycin-resistant enterococci, methicillin-resistant Staphylococcus aureus and penicillin resistant Streptococcus pneumoniae. Diagn Microbiol Infect Dis. 2000;38:177-9. [ Links ]
10. Bradford P, Weaver-Sands PT, Petersen PJ. In vitro activity of tigecycline against isolates from patients enrolled in phase 3 clinical trials for complicated skin and skin structure infections and complicated intra-abdominal infections. Clin Infect Dis. 2005;41(Suppl.5):S315-32. [ Links ]
11. Postier RG, Green SL, Klein SR, et al. Results of a multicenter, randomized, open-label efficacy and safety study of two doses of tigecycline for complicated skin and skin-structure infections in hospitalized patients. Clin Ther. 2004;26:704-14. [ Links ]
12. Tygacil®. Tigecycline FDA package insert. 2005 [ Links ]
13. Babinchak T, Ellis-Grosse E, Dartois N, Rose G, Loh E. The efficacy and safety of tigecycline for the treatment of complicated intra-abdominal infections: analysis of pooled clinical trial data. Clinical Infect Dis. 2005;41:354-67. [ Links ]
14. Ellis-Grosse EJ, Babinchak T, Dartois N, Rose G, Loh E. The efficacy and safety of tigecycline in the treatment of skin and skin-structure infections: results of 2 double-blind phase 3 comparison studies with vancomycin. Clin Inf Dis. 2005;41:S341-53. [ Links ]
15. Petersen PJ, et al. In vitro and in vivo activities of tigecycline (GAR-936), daptomycin, and comparative antimicrobial agents against glycopeptide intermediate Staphylococcus aureus and other resistant gram-positive pathogens. Antimicrob Agents Chemother. 2002;46:2595-601. [ Links ]
16. Scheetz MH, Qi C, Warren JR, Postelnick MJ, Zembower T, Obias A, Noskin GA. In vitro activities of various antimicrobials alone and in combination with tigecycline against carbapenem-intermediate or -resistant Acinetobacter baumannii. Antimicrob Agents Chemother. 2007;51:1621-6. [ Links ]
17. Hoban DJ, Bouchillon SK, Dowzicky MJ. Antimicrobial susceptibility of extended-spectrum beta-lactamase producers and multidrug-resistant Acinetobacter baumannii throughout the United States and comparative in vitro activity of tigecycline, a new glycylcycline antimicrobial. Diagn Microbiol Infect Dis. 2007;57:423-8. [ Links ]
18. Pachón-Ibáñez ME, Jiménez-Mejías ME, Pichardo C, Llanos AC, Pachón J. Activity of tigecycline (GAR-936) against Acinetobacter baumannii strains, including those resistant to imipenem. Antimicrob Agents Chemother. 2004;48:4479-81. [ Links ]
19. Curcio D, Fernández F. Acinetobacter spp. susceptibility to tigecycline: a worldwide perspective. J Antimicrob Chemother. 2007;60:449-50. [ Links ]
20. Cercenado E, Cercenado S, Gomez JA, Bouza E. In vitro activity of tigecycline (GAR-936), a novel glycylcycline, against vancomycin-resistant enterococci and staphylococci with diminished susceptibility to glycopeptides. J Antimicrob Chemother. 2003;52:138-9. [ Links ]
21. Sader HS, Jones RN, Stilwell MG, Dowzicky MJ, Fritsche TR. Tigecycline activity tested against 26,474 bloodstream infection isolates: a collection from 6 continents. Diagn Microbiol Inf Dis. 2005;52:181-6. [ Links ]
22. Clinical and Laboratory Standards Institute (CLSI). Performance standards for antimicrobial susceptibility testing. Sixteenth informational supplement. CLSI document M100-S16. Wayne, PA: CLSI; 2006. [ Links ]
23. Connell SR, Tracz DM, Nierhaus KH, Taylor DE. Ribosomal protection proteins and their mechanism of tetracycline resistance. Antimicrob Agents Chemother. 2003;47:3675-81. [ Links ]
24. Resolución No. 2005020380 de 24/10/2005 . http://www.invima.gov.co/. [ Links ]
25. Jacobus NV, McDermott LA, Ruthazer R, Snydman DR. In vitro activities of tigecycline against the Bacteroides fragilis group. Antimicrob Agents Chemother. 2004;48:1034-6. [ Links ]
26. Edlund C, Nord CE. In vitro susceptibility of anaerobic bacteria to GAR-936, a new glycylcycline. Clin Microbiol Infect. 2000;6:159-63. [ Links ]
27. Fritsche TR, Kirby JT, Jones RN. In vitro activity of tigecycline (GAR-936) tested against 11,859 recent clinical isolates associated with community-acquired respiratory tract and Gram-positive cutaneous infections. Diagn Microbiol Infect Dis. 2004;49:201-9. [ Links ]
28. Gales A, Jones RN, Andrade S, Pereira A, Sader H. In vitro activity of tigecycline, a new glycylcycline, tested against 1.326 clinical bacterial strains isolated from Latin America. Brazil J Infect Dis. 2005;5:348-56. [ Links ]
29. Boucher HW, Wennersten CB, Eliopoulos GM. In vitro activities of the glycylcycline GAR-936 against Gram-positive bacteria. Antimicrob Agents Chemother. 2000;44:2225-9. [ Links ]
30. Kitzis MD, Ly A, Goldstein FW. In vitro activities of tigecycline (GAR-936) against multidrug-resistant Staphylococcus aureus and Streptococcus pneumoniae. Antimicrob Agents Chemother. 2004;48:366-7. [ Links ]
31. Halstead DC, Abid J, Dowzicky MJ. Antimicrobial susceptibility among Acinetobacter calcoaceticus-baumannii complex and Enterobacteriaceae collected as part of the Tigecycline Evaluation and Surveillance Trial. J Infect. 2007;55:49-57. [ Links ]
32. Villegas MV, Kattan JN, Correa A, Lolans K, Guzman AM, Woodford N, Livermore D, Quinn JP. Dissemination of Acinetobacter baumannii clones with OXA-23 carbapenemase in Colombian hospitals. Antimicrob Agents Chemother. 2007;51:2001-4. [ Links ]
33. Miranda MC, Pérez F, Zuluaga T, Olivera MR, Correa A, Reyes SL, Villegas MV, Grupo de Resistencia Bacteriana Nosocomial de Colombia. Antimicrobial resistance in gram negative bacteria isolated from intensive care units of Colombian hospitals, WHONET 2003, 2004 and 2005. Biomédica. 2006;26:424-33. [ Links ]
34. Moreno CA, Rosenthal VD, Olarte N, Gómez WV, Sussmann O, Agudelo JG, Rojas C, Osorio L, Linares C, Valderrama A, Mercado PG, Bernate PH, Vergara GR, Pertuz AM, Mojica BE, Navarrete Mdel P, Romero AS, Henríquez D. Device-associated infection rate and mortality in intensive care units of 9 Colombian hospitals: findings of the International Nosocomial Infection Control Consortium. Infect Control Hosp Epidemiol. 2006;27:349-56. [ Links ]
35. Leal AL, Eslava-Schmalbach J, Álvarez C, Buitrago G, Méndez M, Grupo para el Control de la Resistencia Bacteriana en Bogotá. Endemic tendencies and bacterial resistance markers in third-level hospitals in Bogotá, Colombia. Rev Salud Pública (Bogotá). 2006;8(Suppl.1):59-70. [ Links ]
36. Agwult KN, MacGowan R. Pharmacokinetics and pharmacodynamics of the tetracyclines including glycylcyclines. J Antimicrob Chemother. 2006;58:256-65. [ Links ]
37. Villegas MV, Correa A, Pérez F, Miranda MC, Zuluaga T, Quinn JP; Colombian Nosocomial Resistance Study Group. Prevalence and characterization of extended-spectrum beta-lactamases in Klebsiella pneumoniae and Escherichia coli isolates from Colombian hospitals. Diagn Microbiol Infect Dis. 2004;49:217-22. [ Links ]
38. Villegas MV, Correa A, Pérez F, Zuluaga T, Radice M, Gutkind G, Casellas JM, Ayala J, Lolans K, Quinn JP, Colombian Nosocomial Resistance Study Group. CTX-M-12 beta-lactamase in a Klebsiella pneumoniae clinical isolate in Colombia. Antimicrob Agents Chemother. 2004;48:629-31. [ Links ]
39. Espinal PA, Mantilla JR, Saavedra CH, Leal AL, Alpuche C, Valenzuela EM. Molecular epidemiology of nosocomial infection by extended-spectrum beta-lactamases-producing Klebsiella pneumoniae. Biomédica. 2004;24:252-61. [ Links ]














