Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Infectio
Print version ISSN 0123-9392
Infect. vol.11 no.4 Bogotá Oct./Dec. 2007
1 Unidad de Infectología, Hospital Universitario San Ignacio, Pontificia Universidad Javeriana, Bogotá, D.C.
2 Departamento de Medicina, Facultad de Medicina, Universidad Nacional de Colombia, Bogotá, D.C.
3 División de Apoyo de Infectología, Facultad de Medicina, Universidad Nacional de Colombia, Bogotá, D.C.
4 Grupo de Infectología, Instituto Nacional de Cancerología, E.S.E., Bogotá, D.C.
Fecha de recepción: 29/05/2007; fecha de aceptación; 24/09/2007
INTRODUCCIÓN
Más de 400 millones de personas en el mundo están infectadas crónicamente por el virus de la hepatitis B (VHB) (1,2). El virus es responsable de 300.000 casos de cáncer hepático cada año, aproximadamente, y de un número similar de hemorragias gastrointestinales y casos de ascitis. La mortalidad atribuible es de 25% (1).
La infección por VHB es una de las infecciones más comunes en el mundo, según la Organización Mundial de la Salud (OMS) una tercera parte de la población está infectada por VHB y, aproximadamente, 5% esta crónicamente infectada (1-3). En Colombia la tasa nacional de hepatitis B para el 2002 es de 2,6 por 100.000 habitantes con una mayor frecuencia de infección hacia las costas y la región amazónica (4).
Afortunadamente, existe una vacuna recombinante contra el VHB que ha demostrado una efectividad de 95%. Más de 90 países en el mundo tienen programas de vacunación universal para todos los recién nacidos (3,5). La vacuna para hepatitis B está incluida en el programa ampliado de inmunizaciones en Colombia desde 1993.
El tratamiento para la hepatitis B se encuentra disponible hace, aproximadamente, dos décadas; se utiliza interferón alfa (IFNa) o interferón pegilado (PEG-IFN), o análogos nucleósidos como lamivudina, adefovir, tenofovir o entecavir con el objetivo de disminuir o eliminar la replicación viral (6); el éxito descrito de la terapia está entre el 7% y el 33%. Los principales factores pronósticos de una adecuada respuesta al tratamiento son un título bajo de carga viral y un alto valor de transaminasas al inicio de la terapia (6,7). En los siguientes párrafos resolvemos las preguntas más frecuentes en relación con el tratamiento de la hepatitis B crónica.
1. ¿CUÁL ES LA HISTORIA NATURAL DE LOS PACIENTES CON HEPATITIS B CRÓNICA?
Después de una infección aguda por hepatitis B, 90% de las personas que adquieren la infección en el periodo neonatal, 30% en la infancia temprana y 3% a 5% en la edad adulta pueden desarrollar una enfermedad crónica por hepatitis B. El curso de la hepatitis B crónica se puede dividir en cuatro fases, inmunotolerante, inmunoactivo, portador inactivo y reactivación (8-12).
La fase inmunotolerante se identifica, principalmente, en las personas que adquieren la enfermedad en el nacimiento o en la infancia temprana; puede durar décadas y se caracteriza por altos niveles de ADN del virus B lo cual refleja alta replicación y mínima actividad inmune. Por esta razón, se observan enzimas hepáticas normales y baja actividad necroinflamatoria; el paciente está, usualmente, asintomático. Esta fase, generalmente, no se presenta en las personas que adquieren la infección en la adolescencia o posteriormente. Durante esta fase de la enfermedad, por lo general, no existe indicación para el manejo de los pacientes para hepatitis B (11).
La segunda fase, o fase inmunoactiva, se caracteriza por la elevación de las transaminasas, los niveles fluctuantes de ADN del virus B y necroinflamación hepática, la cual puede tener duración variable, desde meses hasta años, lo cual se relaciona con la extensión del daño hepático y la reactivación puede ser lo suficientemente grave, como para provocar infección aguda fulminante. Durante esta fase, los pacientes son candidatos a tratamiento para hepatitis B. Los pacientes usualmente presentan HBeAg positivo, aunque existe un grupo de pacientes con HBeAg negativo, secundario a la presencia de variantes de VHB que son incapaces de expresar el HbeAg. La variante más habitualmente descrita tiene un cambio de guanina a adenosina en el nucleótido 1896 (G1896A) lo cual crea una parada en el codón en la región precore del genoma del VHB y elimina completamente la producción de HBeAg (1). Estas variantes del virus son más frecuentes en los países asiáticos o del Mediterráneo. Este grupo de pacientes presenta menor respuesta al tratamiento (9-11).
En la tercera fase, o fase de portador inactivo (tabla 1), los niveles de ADN viral disminuyen, y se presenta seroconversión del antígeno e (HBeAg), con producción de anticuerpos contra el antígeno e (AntiHBe) o desaparece su nivel sérico. Además, las transaminasas se normalizan y la patología hepática entra en fase quiescente (11). La seroconversión en adultos hacia la fase de portador inactivo ocurre a una tasa de 8% a 15% por año; aproximadamente, 300 millones de personas en el mundo son portadoras inactivas de HBsAg. Los pacientes portadores inactivos de HBsAg forman el grupo más grande de pacientes infectados crónicamente por VHB; estos pacientes se diagnostican teniendo en cuenta las variables descritas en la tabla 1 (10). El pronóstico de los portadores inactivos de HBsAg es bueno; los estudios de seguimiento a largo plazo muestran que la gran mayoría de estos pacientes tienen remisión bioquímica sostenida y muy bajo riesgo de desarrollo de cirrosis o carcinoma hepatocelular (11-13).
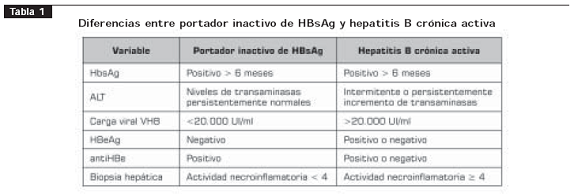
La última fase es la de reactivación, puede ocurrir espontáneamente o bajo condiciones de inmunosupresión y está asociada con elevación de la ALT y de los niveles de ADN viral (11). Aproximadamente, 20% a 30% de los pacientes portadores inactivos puede presentar reactivación espontánea de hepatitis B; por esta razón, estos pacientes requieren seguimiento a largo plazo (14,15).
2. ¿QUÉ EVALUACIÓN INICIAL SE LE DEBE REALIZAR A UN PACIENTE CON HEPATITIS B CRÓNICA?
1. Historia clínica y examen físico completo, dirigido especialmente a detección de síntomas y signos de hipertensuadro hemático.
ión portal (circulación abdominal colateral, esplenomegalia, hiperesplenismo) y falla hepática (ictericia, hematemesis, ascitis, encefalopatía).
2. Exámenes de laboratorio: pruebas de función hepática (transaminasas, albúmina, protrombina), c
3. Pruebas de evidencia de replicación de VHB: HBeAg, antiHBe (anticuerpos contra el antígeno e), carga viral.
4. Endoscopia de vías digestivas altas para búsqueda de varices esofágicas (opcional).
5. Tamización para carcinoma hepatocelular con a-fetoproteína y ecografía hepática; repetir cada dos años.
6. Tamización para coinfección con otros virus: anticuerpos contra el virus de hepatitis C (antiVHC), anticuerpos contra el virus de hepatitis D (antiVHD), anticuerpos contra el virus de hepatitis A (antiVHA), ELISA para VIH (virus de inmunode-ficiencia humana)
7. Biopsia hepática (opcional); es el indicador más sensible de enfermedad hepática, es útil para establecer el compromiso basal del paciente; sin embargo, no se practica en todos los pacientes porque se trata de un procedimiento invasivo.
3. ¿QUÉ IMPORTANCIA TIENE EL GENOTIPO EN LOS PACIENTES CON HEPATITIS B CRÓNICA?
Existen 8 genótipos de hepatitis B (A-H) basados en la secuenciación del ADN, con una variabilidad entre cada genotipo de 4% en el antígeno S y de 8% en el genoma entero. Estos genotipos se distribuyen a través del mundo, en Latinoamérica el genotipo G y H son los más prevalentes; en nuestro país no existen estudios que evalúen el genotipo predominante. El genotipo A es prevalente en norteamérica, el norte de Europa, India y África, el genotipo B y C en Asia, el genotipo D en el sur de Europa e India, el genotipo E en Africa occidental y Suráfrica, el genotipo G en Estados Unidos y Europa (16).
El tipo de genotipo se ha relacionado con el riesgo de progresión a enfermedad hepática grave y carcinoma hepatocelular, los cuales son más frecuentes con el genotipo C que con B; además, con mutaciones en el precore (pacientes con hepatitis B crónica antígeno e negativo) que pertenecen más frecuente al genotipo B, C, D y con la respuesta al tratamiento con interferón que es mejor en los pacientes con genotipo A y B que en los pacientes con genotipo C y D (16).
4. ¿QUÉ PACIENTES DEBEN RECIBIR TRATAMIENTO PARA HEPATITIS B CRÓNICA?
El tratamiento para la hepatitis B tiene una limitada eficacia a largo plazo, antes de iniciar el tratamiento se deben hacer consideraciones acerca de la edad del paciente, la gravedad de la enfermedad hepática, la probabilidad de respuesta, los efectos adversos y las complicaciones del tratamiento (6,17,18).
Las siguientes son indicaciones para el inicio de tratamiento para la hepatitis B crónica:
1. Los pacientes con hepatitis B crónica con HBeAg positivo.
1.1 Los pacientes con transaminasas elevadas más de dos veces el valor normal o hepatitis o fibrosis moderada a grave en la biopsia hepática y carga viral para hepatitis B mayor de 20.000 UI/ml.
1.2 Los pacientes con hepatitis B crónica con transaminasas persistentemente normales o levemente elevadas (menos de dos veces) usualmente no son candidatos a tratamiento antirretro-viral.
2. Los pacientes con hepatitis B crónica con HBeAg negativo.
2.1 Los pacientes con transaminasas elevadas más de dos veces el valor normal y carga viral para hepatitis B mayor de 20.000 UI/ml.
2.2 Los pacientes con transaminasas levemente elevadas con carga viral para hepatitis B entre 2.000 y 20.000 UI/ml e inflamación moderada a grave o fibrosis en la biopsia hepática.
3. Los pacientes con cirrosis compensada (Chile Pugh A y B) con transaminasas elevadas más de dos veces el valor normal.
4. Los pacientes con cirrosis compensada (Chile Pugh A y B) con transaminasas normales o ligeramente elevadas, con carga viral para hepatitis B mayor de 2.000 UI/ml
5. Los pacientes con cirrosis descompensada, en coordinación con los centros de trasplante.
6. Los pacientes con estado de portador inactivo no son candidatos a tratamiento antiviral. Se les debe solicitar transaminasas cada 6 a 12 meses y evaluar la necesidad del inicio de tratamiento; además, se les debe realizar tamización para carcinoma hepatocelular cada dos años.
5. ¿CUÁLES SON LAS METAS DEL TRATAMIENTO PARA HEPATITIS B CRÓNICA?
El objetivo de la terapia antirretroviral es suprimir la replicación viral de la hepatitis B y, de esta manera, prevenir la progresión a cirrosis que puede evolucionar a falla hepática o carcinoma hepatocelular y puede causar la muerte o la necesidad de trasplante hepático de las personas afectadas.
Existen diferentes aspectos paraclínicos considerados para medir la respuesta en la hepatitis B crónica y se evalúan de la siguiente manera (6,17,18):
Respuesta bioquímica: disminución de las transaminasas al valor normal. Es una manera económica y simple para evaluar la respuesta, pero es insuficiente para evaluar el pronóstico.
Respuesta serológica: pérdida de HBeAg en pacientes que fueron inicialmente positivos para HBeAg, con aparición de antiHBe; la desaparición de este antígeno se asocia con una tasa reducida de progresión a cirrosis y una reducida probabilidad de descompensación (19,20).
Respuesta virológica: disminución de la carga viral a nivel indetectable.
Respuesta histológica: disminución del índice de actividad histológica, por lo menos, dos puntos comparado a la biopsia hepática previa al tratamiento. La biopsia hepática es un método ideal para valorar la respuesta al tratamiento, pero su invasividad y el riesgo de complicaciones pueden limitar el uso rutinario.
Respuesta completa: criterios de completa respuesta virológica e histológica y pérdida del HBsAg.
La respuesta al tratamiento en el tiempo se mide durante la terapia cada 3 a 6 meses, al final del tratamiento y 6 a 12 meses después de finalizar la terapia; esta última respuesta es llamada respuesta sostenida.
6. ¿CUÁLES SON LAS PROBABILIDADES DE RESULTADO DEL TRATAMIENTO?
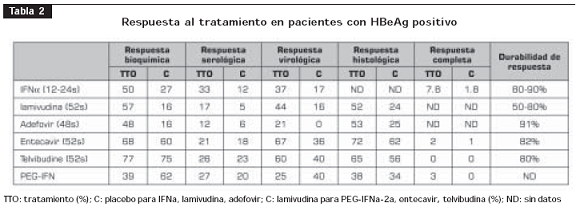
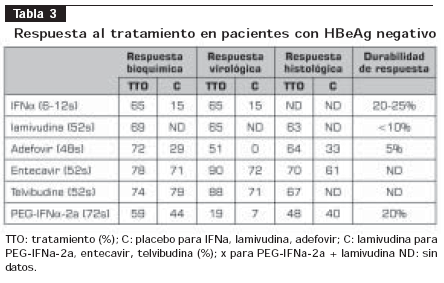
La tabla 2 y la tabla 3 resumen los resultados de los estudios clínicos relevantes realizados acerca del tratamiento para HB crónica (6,21-56).
7. ¿QUÉ OPCIONES DEL TRATAMIENTO EXISTEN PARA EL MANEJO DE LA HEPATITIS B CRÓNICA?
a. Recomendaciones generales: los pacientes deben evitar el consumo de alcohol, practicar sexo seguro (pareja estable, uso de condón) y vacunarse para la hepatitis A. En estos pacientes se deben utilizar los medicamentos inmunosupresores con precaución para evitar activar la infección por VHB (6,17). Se les debe recomendar a las personas con las que los pacientes comparten vivienda vacunarse para la hepatitis B.
b. Interferón alfa: es una citocina producida en respuesta a diferentes infecciones, tiene efecto antiviral, antiproliferativo y de inmunomodulación. Fue usado por primera vez en 1980 y fue el primer medicamento utilizado en el tratamiento de la hepatitis B crónica (18).
Utilidad en pruebas clínicas: en pacientes positivo para HBeAg ha mostrado ser útil. Un metanálisis (21) de 15 ensayos controlados y aleatorios, queincluían 837 pacientes adultos, mostró una mayor respuesta virológica en los pacientes tratados, comparada con los controles (p<0,05). Los más importantes factores predictores de respuesta al tratamiento con interferón son: altos niveles de ALT previo al tratamiento y bajos niveles de carga viral (22,23). La eficacia del IFN es similar en niños y en adultos (24-26). En un metanálisis de 240 niños se encontró que el tratamiento con IFNa incrementaba la eliminación de la carga viral (OR=2,2), la eliminación del HBeAg (OR=2,2), y la normalización de ALT (OR=2,3) comparado con los controles no tratados (27).
En pacientes negativo para HbeAg, la respuesta virológica al final del tratamiento varía entre 38% y 90% en los pacientes tratados, comparado con 0% a 37% en los controles; la respuesta sostenida a 12 meses varía de 10% a 47% entre los pacientes tratados y es 0% en los controles (16,28-30). El único factor predictor de respuesta sostenida al tratamiento es la duración del tratamiento (12 Vs. <6 meses). Los pacientes con tratamiento por 12 meses tienen el doble de respuesta sostenida (31). El principal problema del tratamiento con IFN para la hepatitis B con HBeAg negativo es la recaída al tratamiento; aproximadamente, 50% de los pacientesla presentan y puede ser hasta 5 años después de haber finalizado el tratamiento (32).
Efectos adversos: el efecto adverso más frecuente son los síntomas similares una infección por influenza que se acompaña de fiebre, cefalea, mialgias, malestar general y se presenta en 25 a 30% de los pacientes. Otros efectos adversos frecuentes son leucopenia (<1.000 u/l), trombocitopenia (<60.000 u/l), labilidad emocional o, inclusive, depresión, caída de cabello, o cambios endocrinológicos como aparición o reagudización del hipotiroidismo (33).
Los efectos adversos en niños son similares a los de los adultos (27).
Duración: la duración del tratamiento recomendada para los pacientes con hepatitis B crónica y HBeAg positivo son 16 a 24 semanas. Para los pacientes con HBeAg negativo, la duración mínima es de 12 meses.
c. Interferón con polietilenglicol «pegilado»: el PEG-IFNa-2a es una modificación del IFN y resulta de la unión de una molécula de polietilénglicol (PEG) a la estructura del IFN que disminuye la eliminación renal, altera el metabolismo e incrementa la vida media del IFN, con lo cual se logra una administración de esta molécula una vez a la semana (18). Para los pacientes que requieren manejo con interferón, esta presentación del medicamento ha remplazado la administración de IFNa por su efectividad clínica y facilidad en administración.
Utilidad en pruebas clínicas: En un estudio clínico que comparaba el tratamiento con PEG-IFNa- 2a con lamivudina se demostró mejor respuesta serológica, virológica y bioquímica con este medicamento (34). Se observa mejor respuesta al tratamiento en los pacientes con genotipo A, bajos valores de carga viral y altos niveles de transaminasas previos al inicio del tratamiento.
Dosis: se utiliza una dosis subcutánea una vez a la semana.
Duración: la duración del tratamiento recomendada para los pacientes con hepatitis B crónica con HBeAg positivo o negativo, son 12 meses.
Efectos adversos: los mismos del IFNa.
d. Lamivudina: es un análogo nucleósido sintético, que sufre fosforilación intracelular y se convierte en el metabolito activo 3TC trifosfato e inhibe la transcriptasa viral inversa causando una terminación prematura de la cadena de ADN; se utiliza desde 1998 para el tratamiento de la hepatitis B (18).
Utilidad en pruebas clínicas: en pacientes con HBeAg positivo la respuesta virológica y sexológica del tratamiento con lamivudina por un año es de 16 a 18%, comparada con 4% a 6% en los controles no tratados. La respuesta histológica es de 49% a 56% en pacientes tratados, comparado con 23% a 25% en los controles (35,36). El principal factor predictor de respuesta es el nivel de ALT antes del tratamiento (37). La lamivudina es eficaz y segura en niños, el nivel previo de ALT en este grupo de pacientes también es el principal factor predictor de la respuesta (38).
En los pacientes con hepatitis B y HBeAg negativo después de un año de tratamiento, la respuesta virológica es de 65%, y la respuesta histológica de 60% (39-41). Sin embargo, la gran mayoría de pacientes recaen cuando se suspende el tratamiento e, infortunadamente, la extensión de la duración del tratamiento resulta en menor respuesta por la aparición de mutantes resistentes (42).
Dosis: la dosis para los pacientes con infección asociada por VIH es más elevada.
Duración: la duración recomendada para adultos con HBeAg positivo es como mínimo de un año.
El tratamiento debe ser continuado hasta que el paciente logre seroconversión del HBeAg y se debe prolongar por 6 meses después de la aparición de antiHBe. El tratamiento para los pacientes con HBeAg negativo se debe prolongar hasta la eliminación del HbsAg (6).
Efectos adversos: la lamivudina es un medicamento bien tolerado, los efectos adversos reportados son náuseas, diarrea, cefalea y dolor abdominal(40-42).
Resistencia a la lamivudina: la resistencia que se produce durante el tratamiento con lamivudina es la principal limitación del uso de esta terapia; la mutación más común que genera resistencia a este antiretroviral es la YMDD, que genera cambios en el gen de la polimerasa del ADN del VHB (metionina a valina o isoleucina rtM204V/I). Esta mutación se acompaña frecuentemente de otra mutación que cambia una leucina por una metionina (43). La consecuencia clínica de la presencia de la mutación YMDD es la reactivación de la enfermedad, definida como la reaparición del ADN del VHB. En los estudios realizados en Asia (43,44), la resistencia genotípica se encuentra en 14% de los pacientes con tratamiento en el primer año y aumenta a 38%, 49%, 66% y 69% después de 2, 3, 4 y 5 años de tratamiento, respectivamente. Los estudios de seguimiento a largo plazo sugieren que, a través del tiempo, no se mantiene el beneficio del tratamiento con lamivudina en los pacientes con mutantes resistentes a este medicamento (45).
e. Adefovir dipivoxil: es una prodroga de adefovir, un análogo nucleótido de adenosina monofosfato que inhibe tanto la transcriptasa inversa como la actividad de la polimerasa de ADN; se incorpora dentro del ADN del VHB y causa la terminación prematura de la cadena (46,47).
Utilidad en pruebas clínicas: en un estudio de 515 pacientes con hepatitis B crónica con asignación aleatoria a recibir 10 o 30 mg de adefovir o placebo por 48 semanas, 25%, 53% y 59% de los pacientes, respectivamente, presentaron respuesta histológica (p=0,001), la pérdida del HBeAg fue de 11%, 24% y 27% (p<0,001) para ambos grupos de tratamiento comparados a placebo, y la seroconversión de HBeAg fue de 6%, 12% y 14% (p<0,005) para ambos grupos de tratamiento comparados a placebo, los niveles de carga viral de VHB disminuyeron, en promedio, 0,6, 3,5 y 4,8 log10 copias/ml (p<0,001), y la normalización de ALT se observó en 16%, 48% y 55% (p<0,001) de los pacientes (47).
En los pacientes con hepatitis B crónica y HBeAg negativo, en un estudio de 185 pacientes que recibieron adefovir, 10 mg, o placebo por 48 semanas, se encontró respuesta histológica en 64% Vs. 33% (p<0,001), respuesta bioquímica en 72% Vs. 29% (p<0,001) y respuesta virológica en 51% Vs. 0% (p<0,001) (48). Durante el segundo año de seguimiento, el grupo de pacientes que recibió adefovir se dividió para recibir adefovir, 10 mg, o placebo. La proporción de pacientes con carga viral indetectable de ADN y ALT normal incrementó de 46% en la semana 48, a 51% en la semana 96 en el grupo que recibió adefovir y disminuyó de 59% a 3% en el grupo que suspendió la terapia (48). Parece que en este grupo de pacientes existe una recaída de la infección por hepatitis B cuando se suspende el adefovir después del primer año y, por tal razón, probablemente se deban utilizar tratamientos más prolongados.
Por último, el adefovir ha demostrado ser una terapia útil para el manejo de la hepatitis B resistente a la lamivudina, especialmente, en el escenario de cirrosis descompensada y en los pacientes con trasplante hepático (49,50).
Dosis y duración: se debe ajustar la dosis en los pacientes con depuración de creatinina <50 ml/Minuto. El adefovir no ha sido aprobado para su uso en niños. La recomendación de duración del tratamiento es igual a la de lamivudina.
Efectos adversos: el adefovir es bien tolerado, su efecto adverso más frecuente es el desarrollo de disfunción tubular renal, especialmente cuando se utilizan dosis altas; por esta razón, la dosis aprobada por la FDA es de 10 mg. El adefovir tiene un riesgo de nefrotoxicidad de 0 a 2,5% que aumenta con la duración de la terapia (>1 año) y en los pacientes con trasplante hepático o cirrosis de 12% a 28% (48). Se debe controlar la función renal cada 3 Meses en los pacientes con riesgo de insuficiencia renal y en los pacientes que tengan más de un año de tratamiento con adefovir; en los pacientes con insuficiencia renal de base se puede utilizar el medicamento pero se debe ajustar la dosis a la depuración de creatinina del paciente.
Resistencia a adefovir: se ha descrito la emergencia de resistencia a adefovir con la producción de mutaciones N236T y A181V/T en 3% de los pacientes después de dos años de tratamiento, 11% al tercer año, 18% al cuarto año y 29% a los 5 años (51). La mutación N236T ha demostrado conservar sensibilidad a la lamivudina y al entecavir, mientras que la mutación A181V/T produce resistencia cruzada a estos medicamentos con persistencia de la susceptibilidad al tenofovir.
f. Entecavir: es un análogo carbocíclico de la 2'deoxiguanosina que inhibe la replicación del VHB en tres pasos diferentes, la preparación de la polimerasa del ADN del VHB, y la síntesis de la primera y segunda banda del ADN del VHB (52).
Utilidad en pruebas clínicas: la FDA y las autoridades de salud europeas aprobaron el entecavir en el 2005 basados en los resultados de tres estudios en los cuales el entecavir fue comparado a la lamivudina, y demostró en pacientes con hepatitis B crónica, positivos y negativos para HbeAg, superior respuesta virológica, bioquímica e histológica (53- 55) (tabla 2 y tabla 3). En el seguimiento de los pacientes a 96 semanas de tratamiento con entecavir comparado con lamivudina, se ha demostrado la persistencia de una respuesta virológica superior (80% Vs. 39%, P<0,0001) (56,57).
En un estudio de 286 pacientes con HBeAg positivo con viremia persistente en el manejo con lamivudina, se asignaron al azar los pacientes a recibir lamivudina, 100 mg al día, o entecavir, 1 mg al día; después de un año de seguimiento, el entecavir mostró superioridad en la respuesta virólogica (21% Vs. 1%), histológica (55% Vs. 28%) y bioquímica (75% Vs. 23%) (58).
Dosis y duración: la dosis utilizada es diferente para los pacientes con virus resistentes a la lamivudina (52,53). La dosis se debe ajustar en los pacientes con depuración de creatinina menor de 50 ml/minuto. La recomendación de la duración del tratamiento es igual a la de la lamivudina.
Efectos adversos: los principales efectos adversos son: cefalea, dolor abdominal, diarrea, fatiga, mareo y un grave pero breve empeoramiento de la hepatitis B después de suspender el entecavir. El perfil de seguridad es similar al de la lamivudina.
Resistencia: la resistencia al entecavir en los pacientes nuevos al tratamiento antiretroviral es rara, 3% después de 96 semanas del tratamiento; la resistencia fenotípica es relativamente leve comparada con la resistencia a la lamivudina (52,53).
La resistencia al entecavir requiere de dos pasos diferentes, el primero está relacionado con la presencia de la mutación M204I/V, seguida por mutaciones en cualquiera de estas cuatro posiciones: 169, 184, 202 o 250; cuando se presentan solas no tienen implicaciones en la susceptibilidad al entecavir pero cuando se asocian a las mutaciones de resistencia a la lamivudina, disminuye de 10 a 250 veces la actividad del medicamento (59). Por esta razón, cuando se use entecavir en pacientes con previa resistencia a la lamivudina, se recomienda suspender la lamivudina para evitar la presión de inducción de resistencia por este medicamento.
g. Telvibudine: es un análogo L nucleósido con potente actividad contra el VHB, que no se encuentra disponible en nuestro país. En las pruebas clínicas ha demostrado efectividad superior a la lamivudina, pero tiene la importante limitación de rápida inducción de resistencia y resistencia cruzada con ella, por lo que tiene grandes limitaciones como monoterapia.
Utilidad en pruebas clínicas: en pacientes con HBeAg positivo, en un ensayo clínico de 921 pacientes que comparaba la efectividad de la telvibudina con la lamivudina, demostró superioridad en la respuesta virológica después de uno y dos años de tratamiento (p<0,05); no hubo superioridad en la respuesta serológica. En los pacientes negativo para HbeAg, se analizaron 446 pacientes y, de igual manera, demostró superioridad virológica frente a la lamivudina después de uno y dos años de seguimiento (60,61) (tablas 2 y 3).
Dosis y duración: se debe ajustar la dosis a los pacientes con depuración de creatinina menor de 50 ml/minuto. La recomendación de duración del tratamiento es igual a la de la lamivudina.
Efectos adversos: es un medicamento bien tolerado y los efectos adversos son similares a los presentados por la lamivudina.
Resistencia: la resistencia al tenofovir es menos frecuente que a la lamivudina pero se desarrolla rápidamente; se han detectado mutaciones en el gen YMDD, especialmente, M204I. En la prueba clínica de fase III con este medicamento (57,58), se desarrolló resistencia genotípica en 4,4% y 21,6% de pacientes positivo para HBeAg y en 2,7% y 8,6% de pacientes negativos para HBeAg después de 1 y 2 años de tratamiento, respectivamente.
h. Tenofovir: es un análogo nucleótido aprobado para el tratamiento para VIH, actualmente no se encuentra disponible en nuestro país. Tiene un mecanismo de acción contra el virus de la hepatitis B idéntico al del adefovir; se administra en una dosis de 300 mg al día. En los estudios clínicos aleatorios se ha comparado con el adefovir en los pacientes con VIH y hepatitis B y ha demostrado mejor respuesta virológica; también, se ha comparado en pacientes sin VIH con similares resultados (62-64).
Este medicamento parece ser muy prometedor para el manejo de los pacientes con hepatitis B; en los pacientes con infección asociada de VIH se indica como manejo de primera línea en combinación con la lamivudina en los pacientes en tratamiento antirretroviral (65).
Entre los efectos adversos, se debe tener en cuenta el riesgo de nefrotoxicidad (la dosis del medicamento se debe ajustar a la función renal) y su relación poco frecuente «pero reportada» con el síndrome de Fanconi (6).
i. Emtricitabine: es un análogo nucleósido con inhibición potente del VHB y del VIH, con igual mecanismo de acción, efectividad, perfil de seguridad e inducción de resistencia que la lamivudina. No se encuentra disponible en nuestro país. Este medicamento parece tener un pobre potencial en el manejo de pacientes con hepatitis B por sus similitudes a la lamivudina.
8. ¿ES ÚTIL LA TERAPIA DE COMBINACIÓN?
Las terapias de combinación han demostrado ser útiles para el tratamiento de hepatitis C o VIH; sin embargo, en la hepatitis B la terapia de combinación IFNa y lamivudina (66,67) no ha demostrado ningún efecto sinergista en pacientes tratados por rimera vez ni en pacientes que no responden al IFNa. Algunos estudios sugieren que la terapia de combinación puede disminuir el desarrollo de mutantes resistentes a la lamivudina (68). Existen cinco ensayos clínicos de adecuada validez de pacientes tratados con interferón (uno con IFNa y cuatro con PEG-IFNa), más lamivudina; en todos se demuestra una mejor respuesta virológica con la terapia de combinación comparados con la lamivudina pero no superioridad en el grupo de terapia de combinación comparada con el interferón (35,69,70). Sólo existe un ensayo clínico que utilizo PEG-IFN inicialmente por 8 semanas y, posteriormente, adicionó lamivudina, que encontró una mayor respuesta virológica sostenida con esta terapia al compararla con la monoterapia con lamivudina (71). La razón de utilizar este tipo de dosis es el concepto teórico que el PEG-IFN aumenta la eliminación del VHB, incluido el cccDNA, y que la adición de la lamivudina después de un tiempo previene la reinfección de los hepatocitos. Se deben llevar a cabo estudios adicionales para poder sacar una conclusión de esta terapia de combinación.
La combinación de lamivudina y adefovir, similar a lo observado con la combinación de IFNa y lamivudina, no ha demostrado en las pruebas clínicas beneficios en cuanto a eficacia del tratamiento aunque se ha relacionado con menor inducción de mutantes resistentes a la lamivudina; las razones para la ausencia del efecto aditivo no se conocen, pero existe la posibilidad de la inhibición de un medicamento con el otro por la unión a la polimerasa del ADN del VHB o por las competencia por las enzimas que fosforilan estos medicamentos para que sean activos (72,73). En los pacientes con VHB resistentes a la lamivudina, en los que se decide cambiar el manejo a adefovir parece ser más útil para evitar las reactivaciones de la hepatitis B y evitar la inducción de la resistencia al adefovir, continuar el manejo con lamivudina y dar terapia de combinación (74).
9. ¿QUÉ TRATAMIENTO SE DEBE UTILIZAR EN LOS PACIENTES?
Para seleccionar el tratamiento ideal para un paciente con hepatitis B crónica, se debe tener en cuenta el perfil de seguridad, la efectividad, el riesgo de inducción de resistencia de los medicamentos y las preferencias del paciente.
En todos los pacientes candidatos a tratamiento para hepatitis B crónica los medicamentos preferidos como terapia de primera línea son: PEG-IFNa2a, adefovir, telvibudina, tenofovir o entecavir. La terapia de primera línea con lamivudina o telvibudina tiene la ventaja del costo pero la limitación de un mayor porcentaje de inducción de resistencia a corto plazo y menor efectividad. Las ventajas del PEGIFNa2a son: duración finita del tratamiento, una respuesta que perdura en el tiempo y la ausencia de mutantes resistentes. Las desventajas del IFN son: los costos y los efectos adversos. El adefovir presenta como principal ventaja su actividad frente a virus mutantes resistentes a lamivudina. El entecavir tiene como ventajas su mayor efectividad comparado con la lamivudina, y su baja inducción de resistencia en pacientes nuevos al tratamiento; su principal limitación es su alto costo y la menor efectividad en pacientes con previa resistencia a lamivudina. El tenofovir es un medicamento que no se encuentra disponible en nuestro país, que tiene como principal ventaja su adecuada actividad en los pacientes sin previo tratamiento para la hepatitis B, como en virus resistentes a lamivudina, eficacia que parece ser superior al adefovir.
Los pacientes con cirrosis compensada (Chile Pugh A y B) pueden ser tratados con entecavir o adefovir; no se recomienda el manejo con IFNa o PEG-IFN por el riesgo de producir exacerbaciones de la hepatitis. Los pacientes con cirrosis descompensada deben ser remitidos a los centros de trasplante hepático.
Correspondencia: Jorge Alberto Cortés, Universidad Nacional de Colombia, Carrera 30 Nº 45-03, edificio 471, oficina 317, Bogotá, D.C., Colombia. Teléfono: (571) 316 5000, extensión 15012; fax: (571) 316 5000, extensión 15011
Referencias
1. McMahon BJ. Epidemiology and natural history of hepatitis B. Semin Liver Dis. 2005; 25 (Suppl.1):3-7 [ Links ]
2. Ching L, Vlad R. Viral hepatitis B. Lancet. 2003;362:2089-94. [ Links ]
3. Broderick A, Maureen J. HB en niños. Semin Liver Dis. 2003;23:59-67. [ Links ]
4. Prieto F, Rojas D. Programa ITS/sida, Instituto Nacional de Salud. Situación semestral de la hepatitis B, Colombia, 2003. Bol Epidem Quincenal 2003;257-64. [ Links ]
5. Lok A, McMahon B. Chronic HB. Hepatology. 2001;24:1220-35. [ Links ]
6. Lok AS, McMahon BJ, Practice Guidelines Committee, American Association for the Study of Liver Diseases. Chronic HB. Hepatol. 2007;45:507-39. [ Links ]
7. EASL Jury. EASL International Consensus Conference on hepatitis. 13-14 September, 2002: Geneva, Switzerland. Consensus statement (short version). J Hepatol. 2003;38:533-40. [ Links ]
8. Hadziyannis SJ, Vassilopoulos D. Hepatitis B e antigen negative chronic hepatitis B. Hepatology. 2001;34:617-24. [ Links ]
9. Locarnini S. Molecular virology and the development of resistant mutants: implications for therapy. Semin Liver Dis. 2005;25(Suppl.1):9-19. [ Links ]
10. Chwla Y. Hepatitis B virus: inactive carriers. Virology Journal 2005;2:82-5. [ Links ]
11. Hsu YS, Chien RN, Yeh CT, Sheen IS, Chiou HY, Chu CM, Liaw YF. Long-term outcome after spontaneous HBeAg seroconversion in patients with chronic hepatitis B. Hepatol. 2002;35:1522-7. [ Links ]
12. de Franchis R, Meucci G, Vecchi M, Tatarella M, Colombi M, Del Ninno E, et al. The natural history of symptomatic hepatitis B surface antigen carriers. Ann Intern Med. 1993;118:191-4. [ Links ]
13. Bellentani S, Tiribelli C. The spectrum of liver disease in the general population: lesson from the Dionysos study. J Hepatol. 2001;35:531-7. [ Links ]
14. Bortolotti F, Cadrobbi P, Crivellaro C, Guido M, Rugge M, Noventa F, et al. Long-term outcome of chronic type B hepatitis in patients who acquire hepatitis B virus infection in childhood. Gastroenterol. 1990;99:805-10. [ Links ]
15. Hsu YS, Chien RN, Yeh CT, Sheen IS, Chiou HY, Chu CM, Liaw YF. Long-term outcome after spontaneous HBeAg seroconversion in patients with chronic hepatitis B. Hepatology.2002;35:1522-7. [ Links ]
16. Keeffe E, Dieterich D, Han SH, Jacobson I, Martin P, et al. A treatment algorithm for the management of chronic hepatitis B virus infection in the United States: an update. Clin Gastroenterol Hepatol. 2006;4:936-62. [ Links ]
17. Rakesh A, Piyush R. Preventing and treating HB infection. BMJ 2004;329;1080-6. [ Links ]
18. Perrillo R. Current treatment of chronic hepatitis: benefits and limitations. Semin Liver Dis. 2005;25(Suppl.1):20-7. [ Links ]
19. Lau DT, Everhart J, Kleiner DE, Park Y, Vergalla J, Schmid P, et al. Long-term follow up of patients with chronic hepatitis treated with interferon alfa. Gastroenterol. 1997;113:1660-7. [ Links ]
20. Niederau C, Heintges T, Lange S, Goldmann G, Niederau CM, Mohr L, et al. Long term follow up of HBeAg positive patients treated with IFN for chronic hepatitis. N Engl J Med. 1996;334:1422-7. [ Links ]
21. Wong DK, Cheung AM, O'Rourke K, Naylor CD, Detsky AS, Heathcote J. Effect of alpha-IFN treatment in patients with hepatitis e antigen-positive chronic hepatitis. Ann Intern Med. 1993;119:312-23. [ Links ]
22. Brook MG, Karayiannis P, Thomas HC. Which patients with chronic hepatitis B virus infection will respond to alpha-interferon therapy? Hepatol. 1989;10:761-3. [ Links ]
23. Perrillo RP, Schiff ER, Davis GL, Bodenheimer HC Jr, Lindsay K, Payne J, et al. A randomized, controlled trial of interferon-2b alone and after prednisone withdrawal for the treatment of chronic hepatitis. N Engl J Med. 1990;323:295-301. [ Links ]
24. Gregorio GV, Jara P, Hierro L, Diaz C, de la Vega A, Vegnente A, Iorio R, et al. Lymphoblastoid interferon with or without steroid pretreatment in children with chronic hepatitis: a multicenter controlled trial. Hepatol. 1996;23:700-7. [ Links ]
25. Sokal EM, Conjeevaram HS, Roberts EA, Alvarez F, Bern EM, Goyens P, et al. Interferon therapy for chronic hepatitis in children: a multinational randomized controlled trial. Gastroenterol. 1998;114:988-95. [ Links ]
26. Jara P, Bortolotti F. Interferon-alpha treatment of chronic HB in childhood: a consensus advice based on experience in European children. J Pediatr Gastroenterol Nutr. 1999;29:163-70. [ Links ]
27. Torre D, Tambini R. Interferon -alpha therapy for chronic hepatitis in children: a meta-analysis. Clin Infect Dis 1996;23:131-137. [ Links ]
28. Lampertico P, Del Ninno E, Manzin A, Donato MF, Rumi MG, Lunghi G, et al. A randomized, controlled trial of a 24-month course of Interferon alfa 2b in patients with chronic hepatitis who had hepatitis virus DNA without hepatitis e antigen in serum. Hepatol. 1997;26:1621-5. [ Links ]
29. Hadziyannis S, Bramou T, Makris A, Moussoulis G, Zignego L, Papaioannou C. Interferon-2b treatment of HBeAg negative/serum HBV DNA positive chronic active hepatitis type B. J Hepatol. 1990;11(Suppl.1):S133-6. [ Links ]
30. Pastore G, Santantonio T, Milella M, Monno L, Mariano N, Moschetta R, Pollice L. Anti-HBe-positive chronic hepatitis with HBV-DNA in the serum response to a 6-month course of lymphoblastoid Interferon. J Hepatol. 1992;14:221-5. [ Links ]
31. Oliveri F, Santantonio T, Bellati G, Colombatto P, Mels GC, Carriero L, Dastoli G, et al. Long term response to therapy of chronic anti-HBe-positive hepatitis is poor independent of type and schedule of Interferon. Am J Gastroenterol. 1999;94:1366-72. [ Links ]
32. Papatheodoridis GV, Manesis E, Hadziyannis SJ. The long-term outcome of interferon-alfa treated and untreated patients with HBeAg negative chronic hepatitis B. J Hepatol. 2001;34:306-13. [ Links ]
33. Wong JB, Koff RS, Tine F, Pauker SG. Cost-effectiveness of interferon-alpha 2b treatment for HB e antigen-positive chronic hepatitis. Ann Intern Med. 1995;122:664-75. [ Links ]
34. Lau GK, Piratvisuth YT, Luo KX, Marcellin P, Thongsawat S, Cooksley G, et al. Peg-interferon alfa-2a, lamivudine and the combination for HBeAg-positive chronic hepatitis B. N Engl J Med. 2005;352:2682-95 [ Links ]
35. Dienstag JL, Schiff ER, Wright TL, Perrillo RP, Hann HW, Goodman Z, et al. Lamivudine as Initial Treatment for Chronic Hepatitis B in the United States. N Engl J Med 1999;341:1256-1263. [ Links ]
36. Lai CL, Chien RN, Leung NW, Chang TT, Guan R, Tai DI, Ng KY, et al. A one-year trial of lamivudine for chronic Hepatitis B. Asia Hepatitis Lamivudine Study Group. N Engl J Med. 1998;339:61-8. [ Links ]
37. Chien RN, Liaw YF, Atkins M. Pretherapy alanine transaminase level as a determinant for hepatitis e antigen seroconversion during lamivudine therapy in patients with chronic hepatitis. Asian Hepatitis Lamivudine Trial Group. Hepatol. 1999;30:770-4. [ Links ]
38. Jonas MM, Kelley DA, Mizerski J, Badia IB, Areias JA, Schwarz KB, et al. Clinical trial of lamivudine in children with chronic hepatitis. N Engl J Med. 2002;346:1706-13. [ Links ]
39. Tassopoulos NC, Volpes R, Pastore G, Heathcote J, Buti M, Goldin RD, et al. Efficacy of lamivudine in patients with hepatitis e antigen negative/hepatitis B virus DNA-positive (precore mutant) chronic hepatitis B.Lamivudine Precore Mutant Study Group. Hepatol. 1999;29:889-96. [ Links ]
40. Santantonio T, Mazzola M, Iacovazzi T, Miglietta A, Guastadisegni A, Pastore G. Long-term follow-up of patients with anti-HBe/HBV DNA-positive chronic hepatitis B treated for 12 months with lamivudine. J Hepatol. 2000;32:300-6. [ Links ]
41. Hadziyannis SJ, Papatheodoridis GV, Dimou E, Laras A, Papaioannou C. Efficacy of long-term lamivudine monotherapy in patients with hepatitis B e antigen-negative chronic Hepatitis B. Hepatol. 2000;32:847-51. [ Links ]
42. Allen MI, Deslauriers M, Andrews CW, Tipples GA, Walters KA, Tyrrell DL, et al. Identification and characterization of mutations in HB virus resistant to lamivudine. Lamivudine Clinical Investigation Group. Hepatol. 1998;27:1670-7. [ Links ]
43. Liaw YF, Leung NWY, Chang TT, Guan R, Tai DI, Ng KY, Chien RN, et al. Effects of extended lamivudine therapy in Asian patients with chronic hepatitis B. Gastroenterol 2000;119:172-180. [ Links ]
44. Leung NWY, Lai CL, Chang TT, Guan R, Lee CM, Ng KY, Wu PC, et al. Extended lamivudine treatment in patients with chronic hepatitis B enhances Hepatitis B e antigen seroconversion rates: results after 3 years of therapy. Hepatol. 2001;33:1527-32. [ Links ]
45. Dienstag JL, Goldin RD, Heathcote EJ, Hann HWL, Woessner M, Stephenson SL, et al. Histological outcome during long-term lamivudine therapy. Gastroenterol. 2003:124:105-17. [ Links ]
46. Marcellin P, Chang TT, Lim SG, Tong MJ, Sievert W, Shiffman ML, et al. Adefovir dipivoxil for the treatment of HB e antigen-positive chronic hepatitis B. N Engl J Med. 2003;348:808-16. [ Links ]
47. Hadziyannis SJ, Tassopoulos NC, Heathcote EJ, Chang TT, Kitis G, Rizzetto M, Marcellin P, et al. Adefovir dipivoxil for the treatment of HB e antigen- negative chronic hepatitis B. N Engl J Med. 2003;348:800-7. [ Links ]
48. Hadziyannis S, Tassopoulos N, Heathcote J, Chang TT, Kitis G, Rizzetto M,Marcellin P, et al. Two year results from a double-blind, randomized, placebocontrolled study of adefovir dipivoxil (ADV) for presumed precore mutant chronic hepatitis B (abstract). J Hepatol. 2003;38(Suppl.2):143. [ Links ]
49. Xiong X, Flores C, Yang H, Toole JJ, Gibbs CS. Mutations in hepatitis B DNA polymerase associated with resistance to lamivudine do not confer resistance to adefovir in vitro. Hepatol. 1998;28:1669-73. [ Links ]
50. Schiff E, Lai CL, Neuhaus P, Terrault N, Colombo M, Samuel D, et al. Adefovir dipivoxil therapy for lamivudine-resistant hepatitis B in pre- and post-liver transplantation patients. Hepatol 2003; 38:1419-27. [ Links ]
51. Hadziyannis S, Tassopoulos N, Chang TT, et al. Long-term adefovir dipivoxil treatment induces regression of liver fibrosis in patients with HBeAg negative chronic hepatitis B: results after 5 years of therapy (abstr). Hepatol. 2005;42:754A. [ Links ]
52. Rivkin A. A review of entecavir in the treatment of chronic hepatitis B infection. Curr Med Res Opin. 2005;21:1845-56. [ Links ]
53. Chang TT, Gish RG, Hadziyannis SJ, BEHoLD Study Group. A dose-ranging study of the efficacy and tolerability of entecavir in Lamivudine-refractory chronic hepatitis B patients. Gastroenetrol. 2005;129:1198-209. [ Links ]
54. de Man R, Wolters L, Nevens F, Chua D, Sherman M, Lai CL, Gadano A, et al. Safety and efficacy of oral entecavir given for 28 days in patients with chronic HB virus infection. Hepatol. 2001;34:578-82. [ Links ]
55. Lai CL, Rosmawati M, Lao J, Van Vlierberghe, Anderson FH, Thomas N, Dehertogh D. Entecavir is superior to lamivudine in reducing HB virus DNA in patients with chronic HB infection. Gastroenterol. 2002;123:1831-8. [ Links ]
56. Chang TT, Gish RG, de Man R, Gadano A, Sollano J, Chao YC, et al. Comparison of entecavir and lamivudine for HBeAg-Positive chronic hepatitis B. N Engl J Med. 2006;354:1001-10. [ Links ]
57. Gish RG, Chang TT, De Man RA, et al. Entecavir results in substantial virologic and biochemical improvement and HBeAg seroconversion through 96 weeks of treatment in HBeAg (+) chronic hepatitis B patients (study ETV-022) (abstr). Hepatol. 2005;42:267A. [ Links ]
58. Sherman M, Yurdaydin C, Sollano J, Silva M, Liaw YF, Cianciara J, et al. Entecavir for treatment of lamivudine-refractory, HBeAg-positive chronic hepatitis B. Gastroenterol. 2006;130:2039-49. [ Links ]
59. Tenney DJ, Levine SM, Rose RE, Walsh AW, Weinheimer SP, Discotto L, et al. Clinical emergence of entecavir-resistant hepatitis B virus requires additional substitutions in virus already resistant to Lamivudine. Antimicrob Agents Chemother. 2004;48:3498-507. [ Links ]
60. Lai CL, Gane E, Liaw YF, Thongsawat S, Wang y, Chen Y, et al. Telbivudine (LDT) Vs. lamivudine for chronic hepatitis B: first-year results from the international phase III globe trial. Hepatol. 2005;42(Suppl.):748A. [ Links ]
61. Lai CL, Shouval D, Lok AS, Chang TT, Cheinquer H, Goodman Z, et al. Entecavir versus lamivudine for patients with HBeAg-negative chronic hepatitis B. N Engl J Med. 2006;354:1011-20. [ Links ]
62. Ristig MB, Crippin J, Aberg JA, Powderly WG, Lisker-Melman M, Kessels L, et al. Tenofovir disoproxil fumarate therapy for chronic hepatitis B in human immunodeficiency virus/hepatitis B virus-coinfected individuals for whom interferon-alpha and lamivudine therapy have failed. J Infect Dis. 2002;186:1844-7. [ Links ]
63. Peters MG, Anderson J, Lynch P, Tun L, Alston-Smith B, Carol L, et al. Randomized controlled study of tenofovir and adefovir in chronic hepatitis B virus and HIV infection: ACTG A5127. Hepatol. 2006;44:1110-6. [ Links ]
64. van Bommel F, Wunsche T, Mauss S, Reinke P, Bergk A, Schurmann D, et al. Comparison of adefovir and tenofovir in the treatment of lamivudine-resistant hepatitis B virus infection. Hepatol. 2004;40:1421-5. [ Links ]
65. Soriano V, Puoti M, Bonacini M, et al. Care of patients with chronic hepatitis B and HIV co-infection: recommendations from an HIVHBV international panel. AIDS 2005;19:221-40. [ Links ]
66. Schalm SW, Heathcote J, Cianciara J, Farrell G, Sherman M, Willems B, et al. Lamivudine and alpha interferon combination treatment of patients with chronic HB infection: a randomised trial. Gut 2000;46:562-68. [ Links ]
67. Schiff E, Dienstag JL, Karayalcin S, Grimm I, Perrillo RP, Husa P, et al. Lamivudine and 24 weeks of lamivudine/interferon combination therapy for HB e antigen positive chronic hepatitis B in Interferon nonresponders. J Hepatol. 2003;38:818-26. [ Links ]
68. Santantonio T, Niro A, Sinisi E, Leandro G, Insalata M, Guastadisegni A, et al. Lamivudine/interferon combination therapy in anti-Hbe positive chronic HB patients: a controlled pilot study. J Hepatol. 2002;36:799-804. [ Links ]
69. Lau G, Piratvisuth T, Luo KX, Marcellin P, Thongsawat S, Cooksley G, et al. Peginterferon a-2a (40KD) (Pegasys1) monotherapy and in combination with lamivudine is more effective than lamivudine monotherapy in HBeAg-positive chronic HB: Results from a large multinational study. N Eng J Med. 2005;352:2682-95. [ Links ]
70. Marcellin P, Lau GK, Bonino F, Farci P, Hadziyannis S, Jin R, et al. Peginterferon alfa-2a alone, lamivudine alone, and the two in combination in patients with HBeAg-negative chronic HB. N Engl J Med. 2004;351:1206-7. [ Links ]
71. Chan HL-Y, Leung NW-Y, Hui AY, Wong VW, Liew CT, Chin AM, et al. A randomized, controlled trial of combination therapy for chronic HB: comparing pegylated Interferon -a2b and lamivudine with lamivudine alone. Ann Intern Med. 2005;142:240-50. [ Links ]
72. Sung JJY, Lai JY, Zeuzem S, Chow WC, Heathcote E, Perrillo R, et al. A randomized double-blind phase II study of lamivudine compared to lamivudine plus adefovir dipivoxil for treatment naïve patients with chronic HB: week 52 analysis. J Hepatol. 2003;38(Suppl.2):25. [ Links ]
73. Lai C-L, Leung NWY, Teo E-K, et al. Results of a one-year international phase IIB comparative trial of telbivudine, lamivudine, and the combination in patients with chronic HB. Hepatol. 2003;38:262A. [ Links ]
74. Snow A, Thibault V, Qi X, Zhu Y, Westland C, Arterburn S, et al. Combination of adefovir dipivoxil (ADV) and lamivudine (LAM) prevented emergence of ADV resistance Mutations in chronic Hepatitis B (CHB) patients with LAM-Resistant HBV. Gastroenterol. 2005;128:M945. [ Links ]














