Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Infectio
Print version ISSN 0123-9392
Infect. vol.12 no.1 Bogotá Jan./Mar. 2008
1 Instituto de Investigaciones Clínicas-Fundación Universitaria Sánitas, Clínica Colsánitas, S. A., Bogotá, D.C., Colombia.
2 Instituto Nacional de Salud, Bogotá, D.C., Colombia.
Fecha de recepción: 2/08/2007; fecha de aceptación: 20/02/2008
Resumen
Objetivo: caracterización de un brote de infección por Acinetobacter baumannii y determinación de los factores asociados.
Diseño: estudio de casos y controles anidado en una cohorte de pacientes críticos entre octubre de 2003 y marzo de 2004.
Criterios de inclusión: haber estado hospitalizado en la unidad de cuidados intensivos en el mismo periodo y ser sometidos a procedimientos invasivos. Se excluyeron los pacientes que fallecieron en las primeras 24 horas de haber ingresado a la unidad de cuidados intensivos o que habían sido remitidos de otras instituciones.
Se evaluó edad, sexo, antecedentes de enfermedad crónica, índice de intervención terapéutica (therapeutic index score system, TISS), tiempo de uso de dispositivos invasivos, tipo de nutrición, exposición previa a antibióticos, procedimiento quirúrgico, tiempo de exposición y estancia. La investigación epidemiológica de los aislamientos incluyó la tipificación molecular mediante electroforesis en gel de campo pulsado.
Resultados: los aislamientos de A. baumannii provenientes de los pacientes infectados y de los cultivos de vigilancia fueron resistentes a múltiples antibióticos. Los aislamientos se encontraron relacionados genéticamente con un porcentaje de similitud mayor del 97%. Se encontró asociación estadísticamente significativa entre la infección de A. baumannii y un mayor puntaje de intervención terapéutica durante la hospitalización (p=0,030), uso de nutrición parenteral (p=0,030) y tiempo de exposición (p=0,02 super indice 2).
Conclusiones: la infección por A. baumannii se asoció a un mayor índice de intervención terapéutica, al uso de nutrición parenteral y al tiempo de exposición. Los aislamientos se encontraron relacionados genéticamente.
Palabras clave: Acinetobacter baumannii, resistencia, factores de riesgo, nutrición parenteral, estudio de casos y controles
Abstracts
Objective: Epidemiological and molecular characterization of an outbreak infection caused by Acinetobacter baumannii and the determination of the associated factors.
Design: Case-control study nested in a cohort of patients hospitalized in the intensive care unit (ICU) between October 2003 and March 2004.
Inclusion criteria: patients that had been hospitalized in the ICU during the same period of time and patients who underwent an invasive procedure. Patients who died during the first 24 hours of admission to the ICU or those submitted or referred from another institution were excluded. Age, gender, past medical history of chronic disease, therapeutic index score system (TISS), time of use of invasive devices, type of nutrition support, previous exposure to antibiotics, surgical procedure, time of exposition and length of stay at the ICU were assessed. The epidemiological research of the isolates included molecular typification through pulse-field gel electrophoresis.
Results: The isolates of A. baumannii obtained from infected patients and those from the surveillance cultures were resistant to multiple antibiotics. The isolates were found to be genetically related, with a similarity percentage of more than 97%. A significant statistic relationship was found between infections by A. baumannii, with a higher therapeutic intervention score system during the ICU hospitalization (p=0.030), parenteral nutrition support (p=0.030), and exposure duration (p=0.02).
Conclusions: Infection by A. baumannii was associated to a higher therapeutic intervention score system, parenteral nutrition support (p=0.030), and exposition duration (p=0.02). A. baumannii isolates were found to be genetically related.
Key words: Acinetobacter baumannii, resistance, risks factors, parenteral nutrition support, case and control study.
Introducción
Acinetobacter baumannii es un patógeno emergente de gran impacto en términos de salud pública. Es la causa de infecciones asociadas al cuidado de la salud y de numerosas epidemias en hospitales de varios continentes, y es responsable de 2% a 10% de todas las infecciones por gérmenes Gram negativos en unidades de cuidado crítico en Europa y Estados Unidos (1, 2, 3, 4).
Actualmente, A. baumannii es endémico en los hospitales dada su capacidad para permanecer en el medio ambiente inanimado por largos periodos y colonizar pacientes y personal de la salud, además de su habilidad para desarrollar resistencia antibiótica, principalmente por la adquisición de material genético a través de elementos móviles como plásmidos, transposones o integrones (5, 6) que, finalmente, se manifiestan por resistencia a múltiples antibióticos, incluso los carbapenémicos, considerados hasta hace poco tiempo como la terapia de elección (7, 8, 9).
En Latinoamérica el reporte de SENTRY informa que Acinetobacter spp. presenta las mayores tasas de resistencia antibacteriana, y la resistencia a los carbapenémicos es mayor que en Estados Unidos y Europa (10). En Colombia un estudio realizado en unidades de cuidados intensivos de 10 hospitales de tercer nivel, corroboró que, de todas las bacterias estudiadas, A. baumannii presentaba los porcentajes más elevados de resistencia antibiótica e incluso un aumento notable en la resistencia a los carbapenémicos (11), en consonancia con los resultados del estudio del Grupo para el Control de la Resistencia Antimicrobiana de Bogotá en el que se resalta un significativo incremento en la prevalencia de la resistencia al imipenem (48,1%) y al meropenem (52%) 12.
Los pacientes manejados en las unidades de cuidados intensivos tienen mayor riesgo de infección, en consideración a su necesidad de procedimientos invasivos (sonda gástrica, intubación orotraqueal, catéteres intravasculares, sonda vesical), uso de múltiples antibióticos, estancias prolongadas y enfermedades crónicas (13, 14, 15).
Hay poca información sobre los factores de riesgo asociados a la infección por A. baumannii y su caracterización genética en el ambiente hospitalario en Colombia. El propósito de esta investigación fue evaluar los factores asociados y describir la caracterización genética del brote de infección ocurrido en la unidad de cuidados intensivos de una institución hospitalaria.
Materiales y métodos
El estudio fue aprobado por el Comité de Ética institucional.
Estudio de casos y controles
Para determinar los probables factores asociados se realizó un estudio de casos y controles anidado en la cohorte de pacientes que estuvieron hospitalizados en la unidad de cuidados intensivos entre octubre de 2003 y marzo de 2004. La unidad de cuidados intensivos es una unidad polivante en una clínica general de tercer nivel que atiende pacientes con seguros privados y de accidente de tránsito.
Los casos fueron definidos como pacientes infectados por A. baumannii resistente a múltiples antibióticos. El grupo control fue constituido por los pacientes hospitalizados en la unidad de cuidados intensivos que no presentaron infección.
Los criterios de inclusión fueron haber estado hospitalizado en la unidad de cuidados intensivos en el mismo periodo y ser pacientes sometidos a procedimientos invasivos tales como catéter intravascular, tubo orotraqueal, sonda vesical, sonda nasogástrica, o cirugía mayor. Se excluyeron los pacientes que fallecieron en las primeras 24 horas de ingreso a la unidad de cuidados intensivos o los remitidos de otras instituciones. Se seleccionaron 4 controles por cada caso.
La selección de los controles se realizó a partir de la base de datos de la unidad de cuidados intensivos. De este listado, se hizo un muestreo aleatorio simple con base en una tabla de números aleatorios.
Definición de términos
Para hacer el diagnóstico de infección hospitalaria se utilizaron los criterios de los Centers for Disease Control and Prevention (CDC). (16) Para los casos de infección relacionada con catéter se siguieron los criterios de la Society of Critical Care Medicine. (17) Se consideró que las infecciones fueron adquiridas en la unidad de cuidados intensivos si se diagnosticaron 48 horas luego de la hospitalización del paciente.
El germen A. baumannii resistente a múltiples antibióticos fue definido por la resistencia a betalactámicos, aminoglucósidos, fluoroquinolonas y carbapenémicos.3
Factores de exposición
Se consideraron las siguientes variables: edad; sexo; antecedentes de enfermedad crónica; diagnóstico de ingreso o enfermedad del paciente que lo condujo a hospitalización en la unidad de cuidados intensivos (CIE 10); estado de la enfermedad crónica, según la clasificación de McCabe, clasificado en rápidamente fatal, últimamente fatal y no fatal; índice de intervención terapéutica (TISS), del cual se tomó el índice más alto previo al diagnóstico de infección en los casos y el índice más alto durante todo el periodo de estancia en la unidad de cuidados intensivos en los controles. Se clasificaron con un puntaje de I a IV, así: clase IV: mayor o igual a 40 puntos; clase III: 20 a 39 puntos; clase II: 10 a 19 puntos; clase I: menor de 10 puntos.
Además, se consideraron el tiempo de uso de dispositivos invasivos; la nutrición por sonda nasogástrica, yeyunostomía o gastrostomía o nutrición parenteral; uso de aminoglucósidos, fluoroquinonas, carbapenémicos, céfalosporinas de tercera o cuarta generación, antes de la infección para los casos y exposición total para los controles. Se midió el tiempo de exposición como el tiempo entre el ingreso y el diagnóstico de infección en los casos, y el tiempo entre el ingreso y la salida, en los controles. Además, se consignaron los días de estancia en la unidad de cuidados intensivos y los de la estancia total.
Estudio microbiológico clínico y de vigilancia
Las muestras se obtuvieron de cultivos de sangre, catéteres centrales, secreciones orotraqueales mediante aspirado traqueal por succión cerrada y procedimientos quirúrgicos.
Los aislamientos de A. baumannii se recuperaron en agar MacConkey a partir de las muestras clínicas enviadas al laboratorio de microbiología. Se utilizaron dos métodos para determinar la sensibilidad de las cepas: el método estandarizado VITEK® (Biomerieux) para determinar la concentración inhibitoria mínima (CIM) y el de Kirby Bauer para el antibiograma.
En febrero de 2004 se inició la búsqueda activa de pacientes colonizados a través de la toma de muestras (axila, recto, faringe, secreciones traqueo-bronquiales o lesiones dérmicas sospechosas). Además, se tomaron periódicamente muestras ambientales de superficies y material en contacto con el paciente y personal (circuitos de respiradores, bombas de infusión, succiones, torres de monitoreo, máquina de hemodiálisis, botiquín, estetoscopios, manijas de puertas, teléfono).
Los aislamientos fueron confirmados como A. baumannii por las pruebas de crecimiento en agar MacConkey, motilidad y oxidasa. (18) Se determinaron los patrones de susceptibilidad antimicrobiana a aztreonam, cefotaxima, ceftazidima, ceftriaxona, cefuroxima, imipenem y meropenem por medio del sistema automatizado MicroScan (autoSCAN-4, Rochem Biocare).
Pulsed field gel electrophoresis (PFGE)
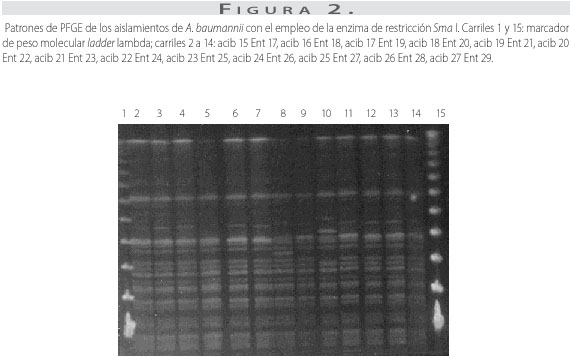
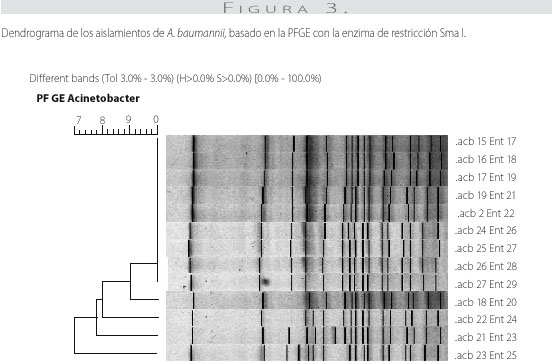
Los aislamientos se cultivaron en agar infusión-cerebro-corazón (Brain Heart Infusion) durante 18 horas a 37 oC. Las células se resuspendieron en solución tamponada de suspensión celular (TRIS-HCl 100mM, EDTA 100mM, pH 8,0) y se ajustó la concentración a una densidad óptica de 1,1 a 610 nm. La obtención del ADN y las condiciones de corrido electroforético se realizaron según los protocolos de R. K. Gautom (19) y Corbella et al. (20), respectivamente, utilizando la enzima de restricción SmaI (Promega). Los fragmentos de restricción se separaron en geles de agarosa al 1% (Seakem Gold, Cambrex) por electroforesis en gel de campo pulsado usando el equipo CHEFF II (Bio-Rad), con un tiempo inicial de 1 segundo, tiempo final de 30 segundos a 6 V/cm y 14 °C durante 21 horas. Los geles se colorearon con bromuro de etidio y se visualizaron con luz ultravioleta. Los patrones de las bandas se asignaron visualmente y se clasificaron según los criterios de Tenover (21); igualmente, se analizaron con el programa de cómputo Fingerprinting II (Bio-Rad) para determinar el porcentaje de similitud genética de los aislamientos y obtener los dendrogramas correspondientes.
Análisis estadístico
Se diseñó un formulario codificado para recolectar la información pertinente de las historias. clínicas de los casos y de los controles Se creó una base de datos en el programa EpiInfo 6.0; se depuró la información mediante programas de verificación automática utilizando el módulo check del Epi Info y, para el procesamiento, se utilizó el programa SPSS 10.0
Los resultados se presentan en tablas y gráficos. Las variables cuantitativas se presentan por medio de medidas de tendencia central (promedio y mediana) y de dispersión (rango y desviación estándar), y las variables categóricas por medio de distribuciones de frecuencias y porcentuales. Para evaluar la asociación de las variables cuantitativas con la infección por A. baumannii resistente a múltiples antibióticos, se utilizó la prueba t de Student para muestras independientes, cuando cumplía con los supuestos de normalidad (prueba de Kolmogorov-Smirnov) y la prueba exacta no paramétrica de Mann Whitney en caso de no cumplirse el supuesto de normalidad o cuando las variables eran ordinales; en las variables cualitativas se usó la prueba exacta de Fisher. Se evaluó la influencia de la morbilidad asociada por medio de estratificación. Estas pruebas se evaluaron a un nivel de significancia de 0,05.
Resultados
Descripción del brote
A. baumannii resistente a múltiples antibióticos fue identificado por primera vez en la unidad de cuidados intensivos en octubre 2003 en un caso de colonización y, posteriormente, en dos casos de bacteriemia asociada a catéter, circunstancia que motivó la instauración de medidas de vigilancia y control. En febrero y marzo de 2004 se detectó nuevamente A. baumannii resistente a múltiples antibióticos en tres casos, uno con infección quirúrgica de órgano o cavidad, una bacteriemia asociada a catéter y un paciente con dos infecciones, neumonía asociada a ventilación mecánica y bacteriemia asociada a catéter central.
Medidas de vigilancia y control de la infección
Durante octubre y diciembre de 2003, el Departamento de Vigilancia Epidemiológica de la institución realizó una evaluación del cumplimiento de las recomendaciones del lavado de manos, los procedimientos de asepsia y antisepsia, la limpieza y la desinfección terminal, entre otros. Además, se hizo evaluación diaria de la resistencia antibiótica de todos los aislamientos clínicos, restricción del uso de antibióticos e implementación inmediata de medidas estándar en los pacientes infectados o colonizados.
En febrero de 2004 se identificó nuevamente A. baumannii en pacientes colonizados, circunstancia que obligó a asignar con exclusividad una enfermera dedicada a la vigilancia estricta en la unidad de cuidados intensivos, haciendo particular énfasis en el lavado de manos, el control ambiental y la educación continua. Se realizo búsqueda activa de pacientes colonizados (por medio de la toma de muestras de axila, recto, faringe, secreciones traqueobronquiales o lesiones dérmicas sospechosas) semanalmente hasta el egreso o hasta que no se detectara el microorganismo en las muestras examinadas; de igual manera, se tomaron muestras ambientales de superficies, material en contacto con el paciente y personal (circuitos de respirador, colchones, bombas de infusión, succiones, torres de monitoreo, máquina de hemodiálisis, botiquín, estetoscopios, manijas de puertas, teléfono) antes y después de la desinfección.
Factores de riesgo
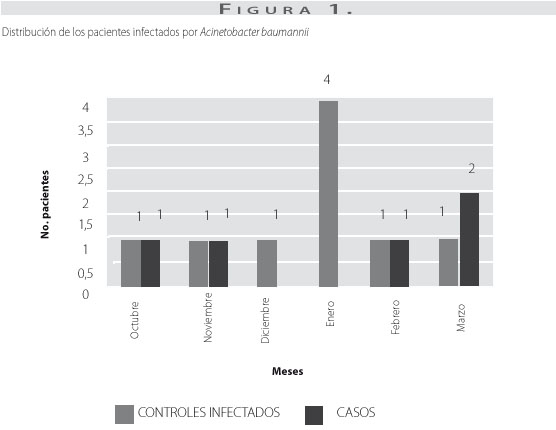
Durante el periodo comprendido entre octubre y noviembre de 2003 y febrero y marzo de 2004, de 73 pacientes hospitalizados en la unidad de cuidados intensivos, 66 cumplieron los criterios de selección, 5 pacientes presentaron infección por A. baumannii resistente a múltiples antibióticos, 4 pacientes presentaron infección hospitalaria por otro germen y 57 pacientes no presentaron infección alguna. Sin embargo, al analizar la distribución de los pacientes infectados en el tiempo (figura 1), se observó que la mayoría de los pacientes con infecciones por otros gérmenes estaban ubicados en los meses en los que no se presentaron casos de infección.
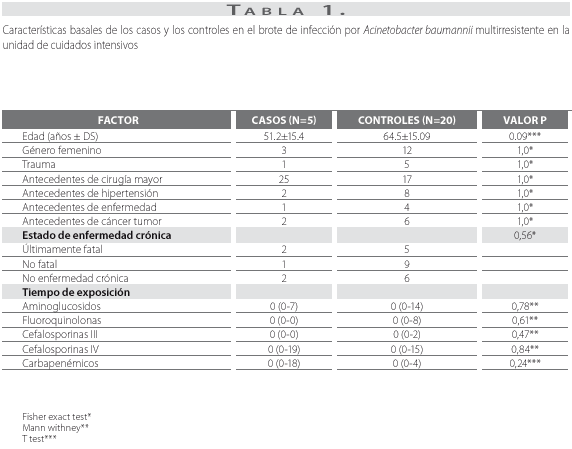
En relación con las características sociodemográficas, aunque la edad fue menor en los casos que en los controles, ninguna de las variables mostró diferencias estadísticamente significativas. Tampoco se encontraron diferencias en enfermedades de base, antecedentes de cirugía mayor o uso previo de aminoglicósidos, cefalosporinas de tercera o cuarta generación, quinolonas o carbapenémicos. No se encontraron diferencias entre los casos y controles por morbilidad asociada (tabla 1).
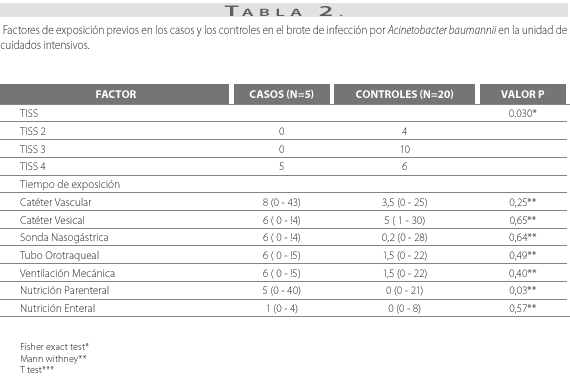
Se encontraron diferencias estadísticamente significativas en el índice de puntaje de intervención terapéutica durante la hospitalización (p=0,030) y el uso de nutrición parenteral (p=0,030) (tabla 2).
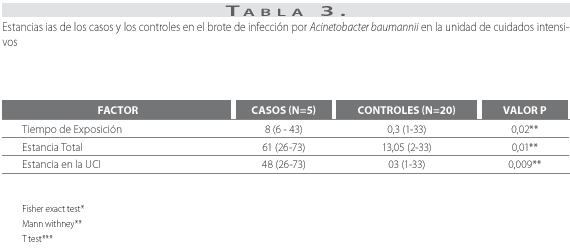
La estancia en la unidad de cuidados intensivos, la estancia total y el tiempo de exposición fueron significativamente mayores en el grupo de pacientes con infección por A. baumannii (tabla 3). La mortalidad asociada no mostró diferencias estadísticamente significativas (2/5 en los casos y 4/20 en los controles); sin embargo, estas muertes no fueron atribuibles a la infección.
El análisis fenotípico de los aislamientos de A. baumannii mostró que el 100% de las cepas tenían un patrón de resistencia a betalactámicos, aminoglucósidos, quinolonas y carbapenémicos.
Epidemiología molecular
Los 13 aislamientos recuperados durante el periodo de vigilancia (febrero-marzo de 2004) fueron remitidos al Grupo de Microbiología del Instituto Nacional de Salud. Los aislamientos se obtuvieron de frotis rectal (n=4), frotis faríngeo (n=3), catéter (n=2), respirador, axila, líquido peritoneal y secreción orotraqueal, uno de cada uno. Todos los aislamientos de A. baumannii mostraron resistencia a los 8 antibióticos evaluados.
Con la enzima de restricción Sma I, se obtuvieron de 15 a 17 fragmentos de ADN, con pesos moleculares de 21 a 730 kb para cada aislamiento. Nueve aislamientos presentaron el mismo patrón electroforético y 4 tenían 1 o 2 bandas de diferencia con respecto al patrón predominante de PFGE (figura 2). Los aislamientos se encontraron relacionados genéticamente con un porcentaje de similitud genética mayor del 97% (figura 3).
Discusión
Las especies del género Acinetobacter han emergido como importantes patógenos, que se caracterizan por producir infecciones hospitalarias de difícil control y manejo, en especial, en las unidades de cuidados intensivos, debido a su habilidad para desarrollar resistencia a los antibióticos y permanecer en el medio ambiente por largos periodos. (22,23)
Nuestras observaciones limitadas a un pequeño número de pacientes con bacteriemia, infección quirúrgica de órgano o espacio y neumonía asociada al respirador, sugieren que la presencia de A. baumannii se relaciona con un mayor grado de invasión terapéutica, uso de nutrición parenteral y tiempo de exposición. Los aislamientos de A. baumannii de los pacientes infectados mostraron resistencia a múltiples antibióticos; esta situación genera un verdadero problema de salud pública ya que dificulta el tratamiento y el control de la colonización y porque predispone a la rápida diseminación.(134) La implementación de sistemas activos de vigilancia evitó la reaparición de nuevos casos desde abril de 2004 a la fecha.
Nuestros hallazgos son consistentes con los informados por Fierobe et al. quienes realizaron en un estudio de casos y controles apareado por el periodo a exposición para controlar el efecto de la presión de colonización. Encontraron un mayor riesgo en pacientes de menor edad y mayor índice promedio de TISS; sin embargo, la infección por A. baumannii se asoció a un menor puntaje de Apache. (24) En un estudio de corte transversal en que compararon pacientes con bacteriemia por A. baumannii con bacteriemia causada por otra bacteria Gram negativa, Wisplinghoff et al. encontraron que el uso de línea arterial, previo cuidado en la unidad de cuidados intensivos, soporte respiratorio y antecedentes de trauma se asociaron a la infección por Acinetobacter sp. (25)
En cuanto a la aparición de cepas resistentes a múltiples antibióticos, Corbella et al. encontraron que la cirugía abdominal y la nutrición por sonda nasogástrica, yeyunostomía o gastrostomía incrementaron el riesgo de adquirir A. baumannii resistente a múltiples antibióticos, inclusive a carbapenémicos.(20) Por otra parte, Lee et al. encontraron que el tiempo de hospitalización previa en la unidad de cuidados intensivos, la mayor edad y la exposición a imipenem o cefalosporinas de tercera generación aumentaba el riesgo de infección. (26) Villers et al. informaron mayor riesgo en pacientes con accidentes de tránsito, cirugía previa, cirugía en urgencias y catéter arterial, para los casos epidémicos, y alcoholismo y exposición previa a fluoroquinolonas, para caso endémicos.(27)
Las infecciones por A. baumannii cursaron con mayor estancia en la unidad de cuidados intensivos y estancia general en comparación con los controles, como había sido previamente reportado. (28)
La selección de los controles es uno de los aspectos más relevantes en los estudios de brotes de infección, en especial, cuando se evalúa la aparición de cepas resistentes. (29) Las características más importantes en la selección de los controles son: que provengan de la misma base de población de los casos, que haya un ajuste por el tiempo de exposición definido como la duración entre la admisión y el aislamiento del germen resistente para gérmenes sensibles o el tiempo entre la admisión y la salida para aquéllos que no presentaron infección y, por último, que se ajuste por la morbilidad asociada.(15)
En este estudio, los controles provinieron de la misma base de población que los casos, ya que estuvieron en la unidad de cuidados intensivos en el mismo periodo y expuestos a los mismos procedimientos invasivos. Por otra parte, el muestreo aleatorio de la cohorte de pacientes que estuvieron expuestos ajustó el sesgo de selección en los controles.
Para evaluar el efecto de posibles sesgos de selección se pretendió ensamblar inicialmente un segundo grupo control, conformado por pacientes hospitalizados en la unidad de cuidados intensivos que presentaban infección hospitalaria por un germen diferente a A. baurmanii. Sin embargo, al analizar la distribución de los pacientes infectados en el tiempo (figura 1), se observó que la mayoría de los pacientes con infecciones por otros gérmenes estaban ubicados en los meses en los que no se presentaron casos de infección. Debido al reducido número de pacientes con infección por otros gérmenes durante el tiempo analizado, no fue posible constituir este segundo grupo control.
No se controló el efecto del tiempo de exposición por medio de un apareamiento individual o por medio de estratificación debido al pequeño número de casos; sin embargo, en ambos grupos fue medido y se encontró un mayor tiempo de exposición en los casos. El no controlar el efecto de esta variable pudo llevar a una estimación inadecuada de la asociación, dado que los casos pudieron estar más expuestos a antibióticos y esta estancia podría estar relacionada con la seriedad de la patología de base de los pacientes. Sin embargo, este efecto, al parecer, fue mínimo ya que los resultados son consistentes con los hallazgos antes mencionados de Fierobe et al. quienes aparearon por este factor y con base en el hecho de que al controlar por la morbilidad asociada no se encontraron diferencias estadísticamente significativas entre los dos grupos.
Por último, se hizo un análisis de sensibilidad de los resultados al incluir los pacientes con infección por otros gérmenes (4) en el grupo control. Persistió la asociación entre la infección por A. baumannii y el mayor puntaje de TISS previo a la infección (prueba exacta de Fisher, p=0,028), y desapareció el efecto de la nutrición parenteral aunque se encuentra cerca de ser significativo (p=0,09). El poder del estudio no fue alto debido al pequeño número de casos incluido.
Correspondencia: Instituto de Investigaciones Clínicas – Unisánitas, Clínica Colsánitas S.A., Carrera 31 N º 125 A-23, piso 5, Bogotá, D.C., Colombia Teléfono: 625 2111, extensión 15-03; fax: 428500. nyamayusa@colsanitas.com
2. Hanberger H, Garcia-Rodriguez JA, Gobernado M, Goossens H, Nilsson LE, Struelens MJ. Antibiotic susceptibility among aerobic gram-negative bacilli in intensive care units in 5 European countries. French and Portuguese ICU Study Groups. JAMA. 1999;281:67-71. [ Links ]
3. Abbo A, Navon Venezia S, Hammer Muntz O, Kritchell T, Slegman Igra Y, Carmell Y. Multidrug resistant Acinetobacter baumannii. Emerg Infect Dis. 2005;1:22-9. [ Links ]
4. Villegas MV, Hartstein AI. Acinetobacter outbreaks, 1977-2000. Infect Control Hosp Epidemiol. 2003;24:284-95. [ Links ]
5. Seifert H, Boullion B, Schulze A, Pulverer G. Plasmid DNA profiles of Acinetobacter baumannii: clinical application in a complex endemic setting. Infect Control Hosp Epidemiol. 1994;15:520-8. [ Links ]
6. Devaud M, Kayser FH, Bachi B. Transposon-mediated multiple antibiotic resistance in Acinetobacter strains. Antimicrob Agents Chemother. 1982;22:323-9. [ Links ]
7. Nordmann P, Poirel L. Emerging carbapenemases in Gram-negative aerobes. Clin Microbiol Infect. 2002;8:321-31. [ Links ]
8. Walsh TR, Toleman MA, Poirel L, Nordmann P. Metallo-β-lactamases: the quiet before the storm? Clin Microbiol Rev. 2005;18:306-25. [ Links ]
9. Giordano A, Varesi P, Bertini A, Villa L, Dionisi AM, Venditti M, Carfagna P, Luzzi I, Mancini C, Carattoli A. Outbreak of Acinetobacter baumannii producing the carbapenem-hydrolyzing oxacillinase OXA-58 in Rome, Italy. Microbial Drug Resistance. 2007;13:37-43 [ Links ]
10. Sader HS, Gales AC, Pfaller MA, Mendes RE, Zoccoli C, Barth A, et al. Pathogen frequency and resistance patterns in Brazilian hospitals: summary of results from three years of the SENTRY antimicrobial aurveillance program. Braz J Infect Dis. 2001;5:200-14. [ Links ]
11. Miranda MC, Pérez F, Zuluaga T, et al. Antimicrobial resistance in Gram negative bacteria isolated from intensive care units of Colombian hospitals, WHONET 2003, 2004 and 2005. Biomédica. 2006;26:424-33. [ Links ]
12. Álvarez C, Cortés J, Arango A, et al. Resistencia antimicrobiana en unidades de cuidado intensivo de Bogotá, Colombia, 2001-2003. Rev Salud Pública. 2006;8(Supl.1):86-101. [ Links ]
13. Bergogne-Bérézin E, Joly-Guillou ML. Hospital infection with Acinetobacter spp.: An increasing problem. J Hosp Infect. 1991;18(Suppl.A):250-5. [ Links ]
14. Lortholary O, Fagon JY, Buu Hoy A, Slama MA, Pierre J, Giral P, Rosenzweig R, Gutmann L, Safar M, Acar J. Nosocomial acquisition of multiresistant Acinetobacter baumannii: risk factors and prognosis. Clin Infect Dis. 1995;20:790-6. [ Links ]
15 Villegas MV, Harstein AI. Acinetobacter outbreaks, 1977-2000. Infect Control Hosp Epidemiol. 2003;24:284-95. [ Links ]
16. Garner JS, Jarvis WR, Emori TG, Horan TC, Hughes JM. CDC definitions for nosocomial infections. En: Olmsted RN, editor. APIC infection control and applied epidemiology: principles and practice. St. Louis: Mosby; 1996. p. A1-20. [ Links ]
17. Centers for Disease Control and Prevention. Guidelines for the prevention of intravascular catheter-related infection. MMWR 2002;51(RR-10):1-36. [ Links ]
18. Schreckenberger PC, Daneshuar MI, Weyath RS, Hollis G. Acinetobacter, Achromobacter, Chryseobacterium, Moraxella, and other non-fermentative Gram-negative rods. En: Murray PR, editor. Manual of clinical microbiology. 8th edition, Washington, D.C.: AMS Press; 2003. [ Links ]
19. Gautom RK. Rapid pulsed-field electrophoresis protocol for typing of Escherichia coli O157:H7 and other Gram-negative organisms in 1 day. J Clin Microbiol. 1997;35:2977-80. [ Links ]
20. Corbella X, Montero A, Pujol M, Domínguez MA, Ayats J, et al. Emergence and rapid spread of cabapenem resistance during a large and sustained hospital outbreak of multiresistant Acinetobacter baumannii. J Clin Microb. 2000;38:4086-94. [ Links ]
21. Tenover FC, Arbeit RD, Gaering RV, Mickelsen PA, Murray BE, Persing DH, et al. Interpreting chromosomal DNA restriction patterns produced by pulsed-field gel electrophoresis: criteria for bacterial isolate typing. J Clin Microb. 1995;33:2233-9. [ Links ]
22. Zarrilli R, Crispino M, Bagattini M, Barretta E, Di Popolo A, Triassi M, Villari P. Molecular epidemiology of sequential outbreaks of Acinetobacter baumannii in an intensive care unit shows the emergence of carbapenem resistance. J Clin Microbiol. 2004;42:946-53. [ Links ]
23. Cisneros JM, Reyes MJ, Pachón J, Becerril B, Caballero FJ, García-Garmendía JL, et al. Bacteremia due to Acinetobacter baumannii: epidemiology, clinical and prognostic features. Clin Infect Dis. 1996;22:1026-32. [ Links ]
24. Fierobe L, Lucet JC, Decre D, Muller-Serieys C, Deleuze A, Joly-Guillou ML, et al. An outbreak of imipenem-resistant Acinetobacter baumannii in critically ill surgical patients. Infect Control Hosp Epidemiol. 2001;22:35-40. [ Links ]
25. Wisplinghoff H, Perbix W, Seifert H. Risk factors for nosocomial bloodstream infections due to Acinetobacter baumannii: a case-control study of adult burn patients. Clin Infect Dis. 1999;28:59-66. [ Links ]
26. Lee SO, Kim NJ, Choi SH, Hyong Kim T, Chung JW, Woo JH. Risk factors for acquisition of imipenem-resistant Acinetobacter baumannii: a case-control study. Antimicrob Agents Chemother. 2004;48:224-8. [ Links ]
27. Villers D, Espaze E, Coste-Burel M, Giauffret F, Ninin E, Nicolas F, et al. Nosocomial Acinetobacter baumannii infections: microbiological and clinical epidemiology. Ann Intern Med. 1998;129:182-9. [ Links ]
28. Garcia-Garmendia JL, Ortiz-Leyba C, Garnacho-Montero J, Jimenez-Jimenez FJ, Monterrubio-Villar J, Gili-Miner M. Mortality and the increase in length of stay attributable to the acquisition of Acinetobacter in critically ill patients. Crit Care Med. 1999;27:1794-9. [ Links ]
29. Harris AD, Samore MH, Lipsitch M, Kaye KS, Perencevich E, Carmeli Y. Control-group selection importance in studies of antimicrobial resistance: examples applied to Pseudomonas aeruginosa, enterococci, and Escherichia coli. Clin Infect Dis. 2002;34:1558-63. [ Links ]














