Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Infectio
Print version ISSN 0123-9392
Infect. vol.12 no.1 Bogotá Jan./Mar. 2008
1 Residente de Toxicología Clínica, Departamento de Farmacología y Toxicología, Facultad de Medicina, Universidad de Antioquia, Medellín, Colombia
2 Docente, Departamento de Farmacología y Toxicología, Facultad de Medicina, Universidad de Antioquia, Medellín, Colombia
Fecha de recepción:23/07/2007;Fecha de aceptación:18/03/2008
Resumen
La ofidiotoxicosis permanece como un importante problema de salud pública, especialmente en los países tropicales. Aunque la mortalidad en el accidente ofídico se redujo notablemente con la introducción del suero antiofídico como tratamiento con antídotos, la incidencia de complicaciones, incluidas las infecciosas, no ha mejorado. Uno de los múltiples factores asociados a la persistencia de secuelas físicas y sicológicas es la controversia que aún existe en temas como la profilaxis antibiótica. En esta revisión se enfrentan las razones que usualmente esgrimen aquellos médicos que apoyan el uso de antibióticos profilácticos contra la evidencia experimental y clínica disponible que contraindica su utilización.
Palabras clave: mordeduras de serpiente, envenenamiento, quimioprevención, profilaxis antibiótica.
Abstract
Ophidism remains as an important public health problem, especially in tropical countries. Although the mortality related to snake bites was notably reduced with the introduction of antidote sera, the incidence of complications, including infectious diseases, is not better. One of the multiple factors associated with the high persistence of physical and psychological sequels is the ongoing controversy about topics like antibiotic prophylaxis. In this review, the reasons that are commonly exposed by some physicians to support the use of antibiotic prophylaxis in ophidism are confronted against the experimental and clinical evidence available contraindicating its use.
Keywords: snake bites, poisoning, chemoprevention, antibiotic prophylaxis.
Introducción
Las serpientes venenosas habitan en el agua y la tierra de todos los continentes, especialmente en climas tropicales o subtropicales. Aunque no hay exactitud en las cifras, se estima que, anualmente, 2,5 millones de personas sufren un accidente por mordedura de serpiente venenosa y mueren por esta causa, aproximadamente, 4,5% de los afectados; por lo anterior, la ofidiotoxicosis es un importante problema de salud pública (1, 2). En Colombia, el Ministerio de la Protección Social ha estimado la incidencia y mortalidad anuales por cada 100.000 habitantes en 6,97 y 0,2, respectivamente (3). La mayoría de los accidentes ofídicos afectan las extremidades inferiores de hombres en plena edad productiva, lo cual obliga también a pensar en la ofidiotoxicosis como una enfermedad ocupacional, especialmente si se consideran las potenciales complicaciones físicas y psicológicas que se pueden derivar, siendo la amputación las más grave de todas (4, 5). De las 3.000 especies de serpientes conocidas en el mundo, en nuestro país se ha descrito la presencia de más de 300, 47 de las cuales son venenosas y potencialmente letales (6, 7). En Colombia, la gran mayoría de accidentes se atribuyen a mordedura por Bothrops atrox (Llanos Orientales), B. asper (Antioquia) –ambas conocidas como mapaná– y Lachesis muta muta (verrugosa, surucucú) (3, 8).
La gravedad del accidente depende de las características de la serpiente y el paciente. Aunque no existe un consenso sobre el tratamiento que debe recibir una persona afectada, algunos autores proponen que, independiente del tipo de envenenamiento, la serpiente o la gravedad de los síntomas, se debe suministrar la triple A (antibióticos, antitoxina tetánica y antídoto), además del tratamiento de soporte clásico (compresas, analgésicos y sedantes) (9, 10). Las condiciones propias del paciente (por ejemplo, inmunosupresión o edades extremas) y la disrupción de la integridad de la epidermis junto con el edema, sangrado, miotoxicidad, hipoxia tisular y necrosis inducidos por los componentes del veneno, crean un ambiente apto para la proliferación de ciertos microorganismos provenientes de la boca de la serpiente, de la piel del afectado o del ambiente, que pudieran justificar la prescripción temprana de antibióticos (11). Aunque las infecciones bacterianas del sitio de la mordedura son una importante causa de morbilidad en este tipo de accidentes, aun en presencia simultánea de todos los factores comentados anteriormente, se estima que sólo 7% a 15% de los pacientes con ofidiotoxicosis desarrollan infecciones superficiales o profundas (12). Localmente, el problema podría agravarse debido a que, por lo general, estos accidentes ocurren en áreas rurales donde es usual la carencia de antivenenos, hasta 60% de los casos son atendidos inicialmente por curanderos, o el acceso a los servicios de salud es relativamente tardío, condiciones propicias para el desarrollo de complicaciones y secuelas graves que incluyen la amputación (13). Este sombrío panorama, sumado a la deficiente formación del médico general en el uso correcto de medicamentos y las limitaciones para el seguimiento clínico y paraclínico, suponen un respaldo a la administración temprana de antibióticos como agentes profilácticos. No obstante, se debe resaltar que a la fecha ningún estudio clínico ha demostrado las bondades de dicha profilaxis antibiótica en la ofidiotoxicosis y, este hecho, asociado a la relativa baja frecuencia de complicaciones infecciosas y a las reconocidas propiedades bactericidas o bacteriostáticas del veneno, hacen que la controversia aún persista (12, 14). Nuestro objetivo es hacer una revisión narrativa de la literatura respecto a la efectividad y seguridad del uso de los antibióticos profilácticos en el manejo del accidente ofídico.
Constituyentes del veneno favorecedores del desarrollo de infección
Usualmente, los miembros de la superfamilia Colubroidea se agrupan en dos familias, cada una de ellas con varios géneros (la familia Viperidae incluye los géneros Bothrops, Bothrocophias, Bothriechis, Porthidium, Lachesis y Crotalus; y la familia Elapidae incluye Micrurus –o corales– y Elapinae). La mayoría de los venenos de los miembros de las familias Viperidae y Elapidae son una mezcla de proteínas y péptidos (90% a 95%) con aminoácidos, nucleótidos, lípidos libres, carbohidratos y elementos metálicos unidos a proteínas (15, 16).
Por su diversidad biológica, las proteínas de los miembros de la familia Viperidae se clasifican en cinco grupos: proteasas de serina, metaloproteinasas, fosfolipasas A2, lectinas tipo C y desintegrinas. Aunque las manifestaciones clínicas del envenenamiento varían, todas estas proteínas modifican cooperativamente la homeostasis de uno o varios sistemas y favorecen el desarrollo de un ambiente apto para la proliferación de microorganismos.
Existen cuatro subtipos de proteasas de serina: 1) aquellas con actividad similar a la trombina; es decir, activan la degradación del fibrinógeno en monómeros de fibrina y, paralelamente, activan el factor XIII o factor estabilizante de la fibrina, e incluyen la batroxobina (B. atrox), LMTL (L. muta), crotalasa y giroxina (C. durissus); 2) proteasas activadoras del factor X y V, 3) activadores de protrombina, y 4) activadores de plaquetas (17, 18, 19, 20). Inicialmente, todas estas enzimas favorecen la activación de la cascada de la coagulación con el consecuente incremento de fibrina, promoviendo la trombosis de pequeños o grandes vasos sanguíneos pero, finalmente, el consumo masivo de factores termina por desencadenar cuadros hemorrágicos (coagulación intravascular diseminada) propios de los accidentes por Bothrops, Lachesis y Crotalus. La actividad proteolítica o necrosante propia del veneno de Bothrops y Lachesis, usualmente se ve favorecida por la presencia de sustancias vasodilatadoras como el factor potenciador de bradicinina (inhibidor de la cininasa II) que, además de estimular la hematotoxicidad, aumentan la permeabilidad vascular y explican el eritema local y la disminución del flujo sanguíneo por edema exagerado (5). La actividad de dichas sustancias facilita que las hidrolasas digestivas, metaloproteinasas dependientes de zinc, fosfolipasas A2 (PLA2) y hialuronidasas presentes en el veneno, se encarguen de la escisión (cleavage) de las membranas de los distintos tejidos (incluida la pared vascular), favoreciendo la extravasación de líquidos, el aumento de la expresión de los factores estimulantes de las fibras de percepción del dolor (por ejemplo, la prostaciclina) y el desarrollo de liponecrosis y mionecrosis. Esta cascada inflamatoria inducida, abrupta y excesiva, convierte el tejido afectado en un área ideal para el crecimiento de microorganismos (21, 22).Por otro lado, las lectinas dependientes de calcio (tipo C) son proteínas no enzimáticas unidoras de azúcar que se dividen en dos grupos dependiendo de si su dominio de reconocimiento de carbohidratos (carbohydrate recognition domain, CDR) está completo (grupo I) o incompleto (grupo II). Generalmente, se pueden encontrar en suero, matriz extracelular y membranas celulares de mamíferos, con la capacidad de reconocer y diferenciar los carbohidratos endógenos de aquellos que están presentes en microorganismos invasores. En particular, CDR-I está involucrado, además del reconocimiento celular, en la adhesión celular, endocitosis y neutralización de patógenos, ejemplos clásicos son la proteína unidora de manosa y las selectinas (23).
Sin embargo, la mayoría de las lectinas tipo C presentes en el veneno de serpiente tienen un CDR incompleto (no son capacez de unir carbohidratos); aunque inicialmente se pensó que carecían de función biológica, posteriormente se conocieron sus potentes efectos inhibidores de los factores de la coagulación y las plaquetas al demostrarse su capacidad de fijación a receptores específicos plaquetarios como GPIb y GPVI (24). Otros péptidos con actividad antiplaquetaria son las desintegrinas, también conocidas como péptidos RGD por su composición (Arg-Gly-Asp) (25, 26).Componentes del veneno que reducen el riesgo de desarrollar infección: péptidos antibióticos
Gracias a su variada composición, todas las enzimas de los venenos de serpientes conservan un potencial uso práctico y terapéutico. Uno de los usos mejor estudiados es la posibilidad de extracción, a partir del veneno, de nuevas moléculas con capacidad antibacteriana, por ejemplo, los péptidos antibióticos (27, 28, 29). Las demostradas propiedades bactericidas o bacteriostáticas del veneno y su capacidad para inducir la respuesta inmune mediada por células, incluso la liberación de citocinas (interferón alfa y beta) que favorecen ampliamente la fagocitosis de las bacterias por parte de los polimorfonucleares, contradicen la necesidad de emplear antibióticos en la mayoría de los casos de ofidiotoxicosis (12, 30). Aproximadamente 20 años atrás, se descubrió que la piel de las ranas, ganglios de insectos y los neutrófilos humanos contenían péptidos catiónicos que podían actuar como potentes antimicrobianos (31). Desde entonces se han descrito cerca de mil péptidos con estas características en casi todas las especies vivas de procariotes y eucariotes. Estas pequeñas moléculas (<5 kDa) usualmente constituidas de aminoácidos básicos e hidrofóbicos, tienden a exhibir un amplio espectro contra bacterias, hongos y parásitos, por mecanismos no muy bien establecidos. Su principal potencial se sustenta en la capacidad que tienen para afectar microorganismos multirresistentes (30, 31).En el caso de las serpientes venenosas, es llamativo que a pesar de la intensa contaminación de su cavidad oral con una amplia variedad de microorganismos patógenos, la ofidiotoxicosis es un proceso asociado con una baja incidencia de infecciones bacterianas (32). Esto sugiere que la presencia de péptidos antimicrobianos en el veneno de las serpientes es esencial para proteger al animal de infectarse durante la alimentación. De hecho, tanto en miembros de la familia Viperidae como Elapidae se han aislado potentes antimicrobianos capaces de destruir las membranas de Staphylococcus aureus, Escherichia coli y Mycobacterium tuberculosis (33, 34, 35).
Además de estos péptidos, otras enzimas que se encuentran en algunos venenos también pueden actuar favorablemente como antimicrobianos. Por ejemplo, la L-aminooxidasa tipo 1 (LAO-1) presente en el veneno de Crotalus adamenteus, Agkistrodon halys pallas, Pseudechis autralis y Bothrops alternatus entre otras, presenta una efectividad 70 veces mayor que las tetraciclinas contra Aeromonas sp. (36).
Consideraciones clínicas a favor del uso profiláctico de antibióticos
En Antioquia, las guías de la Dirección Seccional de Salud para el manejo de pacientes intoxicados no recomiendan el uso generalizado de antibióticos en el accidente ofídico por la relativa baja incidencia de complicaciones infecciosas y para evitar la selección de cepas resistentes. Sin embargo, conserva la posibilidad para emplearlos empíricamente cuando no exista el recurso diagnóstico para confirmar la sospecha de infección (37). Entre los gérmenes encontrados en la boca, colmillos y veneno de las serpientes se encuentran bacilos aerobios Gram negativos (Morganella morganii, Proteus retigeri, Klebsiella spp., Enterobacter spp., Aeromonas hydrophila), anaerobios estrictos como Clostridium spp., y una menor proporción de cocos Gram positivos; mientras que en la epidermis humana, predominan Staphylococcus epidermidis y S. aureus. Obviamente, cualquiera de estos agentes puede invadir tejidos blandos luego de la disrupción de la piel y asociarse con la formación de abscesos y pústulas. Otero y colaboradores identificaron algunas de las bacterias antes mencionadas en 10 de 39 pacientes con accidente ofídico moderado a serio, quienes aun recibiendo antibióticos se complicaron con infecciones de tejidos blandos. Según el patrón de susceptibilidad de los agentes aislados, los autores recomendaron la prescripción de antibióticos cuyo espectro cubriera Gram positivos, Gram negativos y anaerobiospostulando las siguientes alternativas: (a) ciprofloxacina más clindamicina o una cefalosporina de tercera generación y (b) ampicilina/sulbactam (38). Aunque la alta frecuencia de manipulación de la herida con incisiones indebidas, succión, emplastos de plantas, inyección de hidrocarburos, quemaduras u otras medidas populares de uso común, apoya el teórico beneficio de la prescripción temprana de antibióticos, debe resaltarse que la presencia de estos antecedentes de manipulación e, incluso, la presencia de signos clínicos de infección usualmente sólo son indicaciones clínicas de obtener muestras para cultivo microbiológico en aras de dirigir el tratamiento específico apropiado (12, 38, 39).
Es cierto que las infecciones de la piel, tejidos blandos y músculos son complicaciones comunes que pueden conllevar graves secuelas locales o sistémicas, incluida la amputación (40). Sin embargo, en términos generales, su incidencia en ofidiotoxicosis es baja, oscila entre 7% y 15% de los pacientes con mordedura por serpiente venenosa, y los abscesos cerrados alrededor del sitio de la mordedura son los que aportan hasta el 60% de estos casos (11). En un estudio prospectivo, Jorge y colaboradores puncionaron asépticamente abscesos cerrados de 40 pacientes con accidente botrópico y el material obtenido se cultivó para organismos aerobios y anaerobios; M. morganii fue el microorganismo aislado con mayor frecuencia (41). Entre los posibles factores de riesgo para la formación de abscesos se encuentran: (a) antecedente de mordedura por una serpiente del género Bothrops, (b) serpientes de más de 1 metro, (c) uso de torniquete en la extremidad afectada, (d) más de 6 horas de retraso en la atención hospitalaria, (e) fibrinógeno<100 g/dl, (f) presencia de bajo peso en la población infantil, (g) afección proximal de los miembros y (h) presencia de necrosis extensa (11, 12, 42). Como varios de esos factores están presentes en los casos de ofidiotoxicosis, algunos autores norteamericanos sostienen la necesidad de administrar antibióticos al momento mismo de la hospitalización, aun en ausencia de signos de infección (43,44). Aceptando esa observación, Jorge y colaboradores en un estudio prospectivo, doble ciego, controlado, evaluaron la utilidad en ofidiotoxicosis de la administración profiláctica de cloranfenicol por vía oral durante cinco días. En resumen, independiente del tipo de accidente, el uso temprano del medicamento no redujo la tasa de aparición de infecciones locales comparada con el grupo placebo (45).
Afecciones de piel y tejidos blandos en ofidiotoxicosis
La mayoría de las infecciones de piel y anexos en la ofidiotoxicosis son superficiales, localizadas en el sitio de la mordedura y sin compromiso sistémico, pero algunas alcanzan la fascia y los músculos (11, 46). Su origen se centra en la conjunción de la hipoxia y la isquemia en la vecindad de la mordedura que llevan a la desvitalización de los tejidos, alteración de la respuesta inmune y promoción del crecimiento bacteriano.
El absceso cerrado, complicación más frecuente, suele ser único, bien delimitado, eritematoso, doloroso, con fluctuación cutánea, incluso supuración, pero sin toxicidad sistémica. Otra complicación común es la celulitis; se caracteriza por ser una infección difusa que compromete desde la dermis hasta el tejido celular subcutáneo, usualmente ocurre entre 6 y 48 horas después de la mordedura y puede asociarse con adinamia, fiebre, escalofrío, hipotensión e, incluso, linfadenopatías, tromboflebitis y bacteriemia (46). La gangrena infecciosa es una entidad que agrupa una serie de diagnósticos caracterizados por la necrosis extensa del tejido celular subcutáneo y la piel subyacente. La fasciitis necrosante es un ejemplo de gangrena; usualmente se asocia con Streptococcus spp. del grupo A, C o G, anaerobios o flora mixta. Tiende a instaurarse abruptamente, adicionando a la sintomatología de la celulitis, el endurecimiento cutáneo y bulas de contenido amarillo o sanguinolento. La anestesia de la zona afectada, secundaria a la obstrucción de los vasos que irrigan las terminales nerviosas, suele ser el síntoma previo a la aparición de la necrosis y permite distinguir el cuadro inicial de la celulitis. El área afectada es demarcada y cubierta por una escara necrótica, rodeada por eritema, similar a lo observado en una quemadura de tercer grado. En ausencia de tratamiento, progresa rápidamente hasta comprometer seriamente la fascia completa asociándose con la aparición de abscesos metastásicos, tromboflebitis, mionecrosis, bacteriemia e, incluso, la muerte. A diferencia de la celulitis, cuyo manejo es farmacológico, el tratamiento de la fasciitis es esencialmente quirúrgico. Muchas de estas complicaciones infecciosas en ofidiotoxicosis son propiciadas por un manejo inicial inadecuado y el retraso en el manejo médico. No sobra resaltar que el cuidado de los tejidos es esencial, y debería iniciarse desde la escena del accidente. Una recomendación orientada a preservar los tejidos es evitar el uso de torniquetes. Aunque la oclusión venosa y arterial ayuda a controlar el posible sangrado, no previene la dispersión del veneno (47) y, por el contrario, la ausencia de cuantificación en la presión ejercida con dicha herramienta sobre la extremidad tiende a favorecer excesos en presión y reducción del flujo sanguíneo a niveles insuficientes, potenciando la hipoxia e isquemia tisular (48). Por otro lado, aceptando la reconocida capacidad de diseminación sistémica del veneno por la vía linfática, Sutherland y colaboradores han implementado una exitosa técnica de inmobilización y compresión linfática en Australia para el manejo del accidente ofídico (48). El fundamento es la oclusión amplia de la extremidad afectada con vendajes elásticos, de manera similar a lo empleado para la inmobilización de pacientes con luxaciones u otras lesiones traumáticas (49).Otra medida de primeros auxilios de utilidad para conservar la viabilidad de los tejidos es la limpieza con agua potable (o solución salina) y jabón antiséptico de la herida. La limpieza temprana reduce la posibilidad de infección. De hecho, las mordeduras puntiformes y profundas se consideran de alto riesgo de infección por la dificultad para realizar una adecuada irrigación y limpieza (50).
Quimioprofilaxis en ofidiotoxicosis
Las estrategias de prevención de las enfermedades infecciosas pueden dividirse en primarias, secundarias o terciarias. La magnitud de la población involucrada en cada estrategia varía ampliamente; la inmunoprofilaxis (activa o pasiva) es la de mayor impacto sobre la salud pública y el mejor ejemplo de prevención primaria, mientras que la profilaxis contra agentes oportunistas en los pacientes con infección por el virus de inmunodeficiencia humana (VIH) ejemplifica la prevención terciaria (51). La actividad clásica de prevención secundaria es la quimioprofilaxis, definida como el uso temprano de un agente antiinfeccioso (antibacterianos, antimicóticos, antiparasitarios y antivirales) para prevenir el potencial desarrollo de una infección. En general, la quimioprofilaxis está restringida a situaciones en las que se ha demostrado que la administración de antimicrobianos disminuye eficazmente la aparición de infecciones o secuelas infecciosas en personas con alto riesgo de adquirirlas, siendo el beneficio mucho mayor al riesgo que conlleva su uso. Usualmente se divide en profilaxis quirúrgica y no quirúrgica.
Algunos autores que aprueban el uso temprano de antibióticos en la ofidiotoxicosis sustentan que las lesiones cutáneas inducidas por el accidente se comportan como heridas contaminadas o sucias, aceptando de manera homóloga los criterios clasificatorios del National Research Council empleados para recomendar profilaxis según la clase de herida quirúrgica: (a) limpia, (b) limpia contaminada, (c) contaminada y (d) sucia. De acuerdo con dicha clasificación, el riesgo de infección para los dos últimos grupos es de 20% y 40%, respectivamente, incluyendo en ambas clases traumas penetrantes pero diferenciándolos según el tiempo transcurrido entre el accidente y el acceso quirúrgico (si es menor de 4 horas son contaminadas; mayor de 4 horas, sucias) (14). No obstante, nunca se ha establecido la confiabilidad de extrapolar una clasificación para profilaxis quirúrgica a un evento no quirúrgico como el accidente ofídico y, además, se debe recalcar que aun en ausencia de antibióticos, la incidencia de procesos infecciosos en la ofidiotoxicosis es muy inferior respecto a la reportada para heridas contaminadas o sucias (7% a 15% Vs. 20% a 40%). De hecho, la profilaxis antibiótica en pacientes con mordeduras por otros animales o mamíferos también está bastante cuestionada, especialmente cuando debe iniciarse pasadas 3 horas del accidente; por lo tanto, dicha duda sobre el beneficio de la terapia es perfectamente extrapolable a los casos de accidente ofídico (52, 53). Como se aprecia en la tabla 1, la elección racional de un antibiótico profiláctico se rige por seis principios básicos los cuales son difíciles de aplicar en los casos del accidente ofídico (54). De hecho, si consideramos otros factores farmacológicos como la ruta, la forma y el momento de administración, sería aún más difícil cumplir con dichos principios en ofidiotoxicosis. Por ejemplo, mientras que en la profilaxis quirúrgica se ha demostrado que la incidencia de infecciones asociadas con la herida quirúrgica se reduce a 0,6% con la administración de antibióticos intravenosos profilácticos máximo 2 horas antes de la ejecutarse la incisión operatoria (preoperatorio) y aumenta a 3,3% cuando se administran 3 horas después de la incisión (riesgo relativo=5,8), comparativamente, en los casos de mordedura por ofidios venenosos, considerando la accidentalidad del evento y la usual atención tardía, el desenlace obtenido con la quimioprofilaxis tendería a parecerse más al reportado para el último grupo qquirúrgico(55).
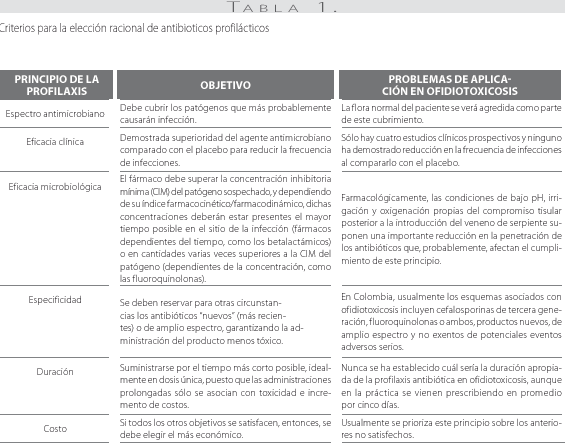
No obstante, el intento de asemejar la herida de la mordedura a una herida quirúrgica, la quimioprofilaxis en ofidiotoxicosis corresponde más al tipo de profilaxis no quirúrgica; entendida ésta como la administración de antibióticos con el fin de prevenir la colonización o su instauración terapéutica luego de la colonización o inoculación por patógenos pero antes de desarrollar la enfermedad. En general, existen algunas indicaciones bien establecidas de quimioprofilaxis no quirúrgica, como, por ejemplo, prevenir la infección inducida tras exposición a los agentes causales de carbunco, cólera, difteria, endocarditis, virus de influenza, paludismo, infección por Neisseria meningitidis, tuberculosis, tos ferina, peste bubónica, fiebre reumática, VIH, Mycobacterium avium-complex (MAC) y toxoplasmosis en pacientes positivos para VIH y para evitar las recurrencia de infecciones asociadas a herpes genital, estreptococos del grupo B, otitis media e infecciones del tracto urinario (54, 51). Nótese la ausencia del accidente ofídico como indicación.
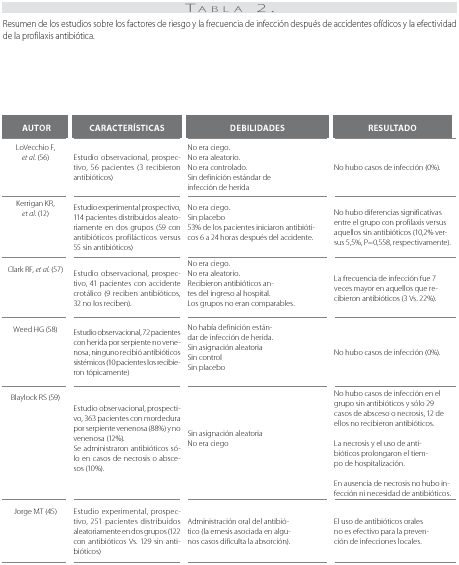
Criterios de búsqueda de literatura y resultados obtenidos sobre el tema los autores realizamos una revisión de la literatura disponible en la base de datos de TOXNET (Toxicology Data Network, National Health Institute, USA) desde 1960 hasta 2007, buscando identificar los artículos disponibles que trataban de establecer si los antibióticos profilácticos reducían la incidencia de infección en el accidente ofídico. Para la búsqueda se empleó la interfase proporcionada en el sitio web (http://toxnet.nlm.nih.gov/cgi-bin/sis/htmlgen?index.html) introduciendo el descriptor (snake OR snakes) AND (antibiotic OR anti (bacterial) OR agents) AND 1960:2007 [yr]). Se obtuvieron 142 artículos relacionados con el tema; 45 describían el manejo del accidente ofídico y sólo 6 presentaban como desenlace la determinación de la presencia de infección en los pacientes. Las características generales y debilidades de dichos estudios se exponen en la tabla 2.En resumen, aunque ningún estudio demuestra ventajas en el uso temprano de antibióticos (profilaxis) en el accidente ofídico, se requieren más y mejores datos sobre el tema para llegar a una conclusión válida (12, 45, 56, 57, 58, 59).
Panorama local
Retrospectivamente, analizamos descriptivamente una muestra aleatoria de 10 pacientes de 199 atendidos en el Hospital Universitario San Vicente de Paúl por accidente ofídico en el periodo comprendido entre febrero de 2003 y noviembre de 2005. La totalidad de los pacientes procedían de áreas rurales, siendo el nordeste antioqueño el origen de la mayoría de casos, 70% de los pacientes tenía menos de 30 años de edad y los miembros inferiores fueron las extremidades más afectadas (80%). El tiempo promedio transcurrido entre la mordedura y la atención hospitalaria inicial fue de 14 horas (rango: 1 a 72), mientras que 27 horas (rango: 4 a 144) adicionales se requirieron hasta ingresar al hospital. La estancia hospitalaria promedio en esta institución fue de 12 días (rango: 2 a 30). Todos los individuos analizados recibieron antibióticos (usualmente, betalactámicos) y suero antiofídico polivalente desde la admisión al hospital local; no obstante, a la postre muchos sufrieron complicaciones infecciosas (50%) o reacciones anafilácticas al antídoto (30%). Las complicaciones infecciosas se distribuyeron entre abscesos en la zona de la mordedura (60%), artritis séptica o sepsis (40%) y fasciitis necrosante (10%). Eventualmente, a pesar del uso de antibióticos (profilácticos o empíricos) el desenlace infeccioso supera abiertamente la incidencia mundial reportada para este tipo de complicaciones (10%, aproximadamente); sin embargo, los resultados presentados requieren ser confirmados con más y mejores estudios básicos y clínicos.
Conclusión
El accidente ofídico permanece como una importante causa de morbilidad en nuestro país. Las complicaciones infecciosas, aunque relativamente infrecuentes (<15%), tienden a ser las directas responsables de la consecuencia más seria del accidente, la amputación. Aunque no existe evidencia sólida a favor del uso de antibióticos profilácticos, también se carece de estudios confiables y concluyentes que demuestren la ausencia de beneficio al utilizarlos. Aunque las guías de la Seccional de Salud de Antioquia no recomiendan el uso profiláctico de antimicrobianos como medida general (63), éstos se emplean ampliamente en el manejo de la ofidiotoxicosis en nuestro medio. En ausencia de evidencia sólida sobre el punto, el uso temprano de antibióticos en accidentes por mordedura de serpiente venenosa pareciera obedecer más a temores médicos infundados o protocolos institucionales. Mientras se realizan más y mejores estudios en el tema la controversia se mantendrá, aunque en aras del uso racional de medicamentos de amplio impacto sobre la salud pública, como los antibióticos, el llamado de atención debería ser a reservarlos hasta demostrar clínica y microbiológicamente la presencia de infección.
Agradecimientos
A la unidad de investigaciones clínicas y la sección de registros médicos del Hospital Universitario San Vicente de Paúl por permitirnos acceder a la información recopilada en la prueba piloto presentada en este manuscrito, y a Carlos Rodríguez por la lectura crítica del manuscrito.
Correspondencia: Andrés F. Zuluaga, Calle 62 No. 52-59, oficina 630, GRIPE: Grupo Investigador de Problemas en Enfermedades Infecciosas, Sede de Investigación Universitaria (SIU), Universidad de Antioquia, Medellín, Colombia
Teléfonos: (574) 210 6542 y 210 6020: fax (574) 210 6021
1. Swaroop S, Grab B. Snakebite mortality in the world. Bull World Health Organ. 1954;10:35-76 [ Links ]
2. Chippaux JP. Snake-bites: appraisal of the global situation. Bull World Health Organ.1998;76:515-24 [ Links ]
3. Instituto Nacional de Salud [homepage on the Internet]. Bogotá: INS; c2006 [consultado: 2007 jul 3]; Ministerio de la Protección Social. Disponible en:http://www.minproteccionsocial.gov.co/VBeContent/library/documents/DocNewsNo551711.doc. [ Links ]
4.Wingert WA, Chan L. Rattlesnake bites in southern California and rationale for recommended treatment. West J Med. 1988;148:37-44. [ Links ]
5.Gold BS, Dart RC, Barish RA. Bites of venomous snakes. N Engl J Med. 2002;347:347-56. [ Links ]
6.Medem F. El desarrollo de la herpetología en Colombia. Revista Academia Colombiana de Ciencias. 1968;13:149-99. [ Links ]
7.Otero R, Valderrama R, Osorio RG, Posada LE. Programa de atención primaria del accidente ofídico: una propuesta para Colombia. Iatreia. 1992;5:96-102. [ Links ]
8.Saldarriaga MM, Otero R, Núñez V, Toro MF, Díaz A, Gutiérrez JM. Ontogenetic variability of Bothrops atrox and Bothrops asper snake venoms from Colombia. Toxicon. 2003;42:405-11. [ Links ]
9.Radonic V, Budimir D, Bradaric N, Luksic B, Sapunar D, Vilovic K. Envenomation by the horned viper (Vipera ammodytes L.). Mil Med. 1997;162:179-82. [ Links ]
10.Bubalo P, Curic I, Fister K. Characteristics of venomous snakebites in Herzegovina. Croat Med J. 2004;45:50-3. [ Links ]
11.Jorge MT, Ribeiro LA. Infections in the bite site after envenoming by snakes of the Bothrops genus. J Venom Anim Toxins. 1997;3:264-72. [ Links ]
12.Kerrigan KR, Mertz BL, Nelson SJ, Dye JD. Antibiotic prophylaxis for pit viper envenomation: prospective, controlled trial. World J Surg. 1997;21:369-73. [ Links ]
13.Otero R. Manual de diagnóstico y tratamiento del accidente ofídico. Medellín: Yuluka-Universidad de Antioquia; 1994. [ Links ]
14.Tagwireyi DD, Ball DE, Nhachi CF. Routine prophylactic antibiotic use in the management of snakebite. BMC Clin Pharmacol. 2001;1:4. [ Links ]
15.Tu AT. Venoms: Chemistry and molecular biology. New York: John Wiley and Sons; 1977. [ Links ]
16.Fry BG, Wüster W. Assembling an arsenal: origin and evolution of the snake venom proteome inferred from phylogenetic analysis of toxin sequences. Mol Biol Evol. 2004;21:870-83. [ Links ]
17.Markland FS. Snake venoms and the hemostatic system. Toxicon. 1998;36:1749-800. [ Links ]
18.Nahas L, Kamiguti AS, Barros MA. Thrombin-like and factor X-activator components of Bothrops snake venoms. Thromb Haemost. 1979;41:314-28. [ Links ]
19.Kini RM, Rao VS, Joseph JS. Procoagulant proteins from snake venoms. Haemostasis. 2001;31:218-224. [ Links ]
20.Niewiarowski S. Proteins secreted by the platelet. Thromb Haemost. 1977;38:924-38. [ Links ]
21.Kamiguti AS, Zuzel M, Theakston RD. Snake venom metalloproteinases and disintegrins: interactions with cells. Braz J Med Biol Res. 1998;31:853-62. [ Links ]
22.Clark DG, Macmurchie DD, Elliott E, Wolcott RG, Landel AM, Raftery MA. Elapid neurotoxins. Purification, characterization, and immunochemical studies of a-bungarotoxin. Biochemistry. 1972;11:1663-8. [ Links ]
23.Drickamer K, Taylor ME. Biology of animal lectins. Annu Rev Cell Biol. 1993;9:237-64. [ Links ]
24.Clemetson KJ, Navdaev A, Dörmann D, Du XY, Clemetson JM. Multifunctional snake C-type lectins affecting platelets. Haemostasis. 2001;31:148-54. [ Links ]
25.McLane MA, Marcinkiewicz C, Vijay-Kumar S, Wierzbicka-Patynowski I, Niewiarowski S. Viper venom disintegrins and related molecules. Proc Soc Exp Biol Med. 1998;219:109-19. [ Links ]
26.Morris VL, Schmidt EE, Koop S, MacDonald IC, Grattan M, Khokha R, McLane MA, Niewiarowski S, Chambers AF, Groom AC. Effects of the disintegrin eristostatin on individual steps of hematogenous metastasis. Exp Cell Res. 1995;219:571-8. [ Links ]
27.de Lima DC, Alvarez Abreu P, de Freitas CC, Santos DO, Borges RO, Dos Santos TC, Mendes Cabral L, Rodrigues CR, Castro HC. Snake venom: any clue for antibiotics and CAM? Evid Based Complement Alternat Med. 2005;2:39-47. [ Links ]
28.Marsh NA. Diagnostic uses of snake venom. Haemostasis. 2001;31:211-7. [ Links ]
29.Hancock RE, Chapple DS. Peptide antibiotics. Antimicrob Agents Chemother. 1999;43:1317-23. [ Links ]
30.Perumal Samy R, Pachiappan A, Gopalakrishnakone P, Thwin MM, Hian YE, Chow VT, Bow H, Weng JT. In vitro antimicrobial activity of natural toxins and animal venoms tested against Burkholderia pseudomallei. BMC Infect Dis. 2006;6:100. [ Links ]
30.Perumal Samy R, Pachiappan A, Gopalakrishnakone P, Thwin MM, Hian YE, Chow VT, Bow H , Weng JT. In vitro antimicrobial activity of natural toxins and animal venoms tested against Burkholderia pseudomallei. BMC Infect Dis. 2006;6:100.
31.Hancock RE. Cationic peptides: effectors in innate immunity and novel antimicrobials. Lancet Infect Dis. 2001;1:156-64. [ Links ]
32.Talan DA, Citron DM, Overturf GD, Singer B, Froman P, Goldstein EJ. Antibacterial activity of crotalid venoms against oral snake flora and other clinical bacteria. J Infect Dis. 1991;164:195-8. [ Links ]
33.Santamaría C, Larios S, Quirós S, Pizarro-Cerda J, Gorvel JP, Lomonte B, Moreno E. Bactericidal and antiendotoxic properties of short cationic peptides derived from a snake venom Lys49 phospholipase A2. Antimicrob Agents Chemother. 2005;49:1340-5. [ Links ]
34.Stocker JF, Traynor JR. The action of various venoms on Escherichia coli. J Appl Bacteriol. 1986;61:383-8. [ Links ]
35.Xie JP, Yue J, Xiong YL, Wang WY, Yu SQ, Wang HH. In vitro activities of small peptides from snake venom against clinical isolates of drug-resistant Mycobacterium tuberculosis. Int J Antimicrob Agents. 2003;22:172-4. [ Links ]
36.Lu QM, Wei Q, Jin Y, Wei JF, Wang WY, Xiong YL. L-amino acid oxidase from Trimeresurus jerdonii snake venom: purification, characterization, platelet aggregation-inducing and antibacterial effects. J Nat Toxins. 2002;11:345-52. [ Links ]
37.Dirección Seccional de Salud de Antioquia [homepage on the Internet]. Protocolo de vigilancia de los accidentes por animales ponzoñosos. Medellín: DSSA; c2004-2007 [consultado: 2007 jul 3]; Dirección Seccional de Salud de Antioquia. Disponible en: http://www.dssa.gov.co/htm/protocolo.htm [ Links ]
38.Otero R, Gutiérrez J, Mesa B, Duque E, Rodríguez O, Arango L, Gómez F, Toro A, Cano F, Rodríguez M, Caro E, Martínez J, Cornejo W, Gómez M, Uribe L, Cárdenas S, Núñez V, Díaz A. Complications of Bothrops, Porthidium, and Bothriechis snakebites in Colombia. A clinical and epidemiological study of 39 cases attended in a university hospital. Toxicon. 2002;40:1107-14. [ Links ]
39.Moellering RC, Eliopoulos GM. Principles of anti-infective therapy. En: Mandell GL, Bennett JE, Dolin R, editors. Mandell, Douglas, and Bennett's Principles and Practice of Infectious Diseases. Sixth edition. Philadelphia, Pennsylvania: Churchill Livingstone; 2005. p. 242-53. [ Links ]
40.Brook I. Soft tissue and muscular infections (including group A streptococci). Baillieres Best Pract Res Clin Rheumatol. 1999;13:95-114. [ Links ]
41.Jorge MT, Ribeiro LA, da Silva ML, Kusano EJ, de Mendonça JS. Microbiological studies of abscesses complicating Bothrops snakebite in humans: a prospective study. Toxicon. 1994;32:743-8. [ Links ]
42.Saborío P, González M, Cambronero M. Snake bite accidents in children in Costa Rica: epidemiology and determination of risk factors in the development of abscess and necrosis. Toxicon. 1998;36:359-66. [ Links ]
43.Forks TP. Evaluation and treatment of poisonous snakebites. Am Fam Physician. 1994;50:123-30. [ Links ]
44.Goldstein EJ, Citron DM, Gonzalez H, Russell FE, Finegold SM. Bacteriology of rattlesnake venom and implications for therapy. J Infect Dis. 1979;140:818-21. [ Links ]
45.Jorge MT, Malaque C, Ribeiro LA, Fan HW, Cardoso JL, Nishioka SA, Sano-Martins IS, França FO, Kamiguti AS, Theakston RD, Warrell DA. Failure of chloramphenicol prophylaxis to reduce the frequency of abscess formation as a complication of envenoming by Bothrops snakes in Brazil: a double-blind randomized controlled trial. Trans R Soc Trop Med Hyg. 2004;98:529-34. [ Links ]
46.Charalambous CP, Zipitis CS, Kumar R, Lipsett PA, Hirst P, Paul A. Soft tissue infections of the extremities in an orthopaedic centre in the UK. J Infect. 2003;46:106-10. [ Links ]
47.Tun-Pe, Tin-Nu-Swe, Myint-Lwin, Warrell DA, Than-Win. The efficacy of tourniquets as a first-aid measure for Russell's viper bites in Burma. Trans R Soc Trop Med Hyg. 1987;81:403-5. [ Links ]
48.Grenard S. Veno- and arterio-occlusive tourniquets are not only harmful, they are unnecessary. Toxicon. 2000;38:1305-6. [ Links ]
49.Queensland Poisons Information Centre [homepage on the Internet]. Pressure immobilisation technique. Australia: QPIC;c2007 [consultado: 2007 jul 3]; Queensland Government. Disponible en:http://www.health.qld.gov.au/poisonsinformationcentre/bites_stings/bs_pressure.asp [ Links ]
50.Reid HA, Theakston RD. The management of snake bite. Bull World Health Organ. 1983;61:885-95. [ Links ]
51.Osterholm MT, Hedberg CW. Epidemiologic principles. En: Mandell GL, Bennett JE, Dolin R, editors. Mandell, Douglas, and Bennett's Principles and Practice of Infectious Diseases. Sixth edition. Philadelphia, Pennsylvania: Churchill Livingstone; 2005. p. 161-73. [ Links ]
52.Goldstein EJ. Bite wounds and infection. Clin Infect Dis. 1992;14:633-8. [ Links ]
53.Broder J, Jerrard D, Olshaker J, Witting M. Low risk of infection in selected human bites treated without antibiotics. Am J Emerg Med. 2004;22:10-3. [ Links ]
54.Lampiris HW, Maddix DS. Clinical use of antimicrobial agents. En: Katzung BG, editor. Basic and clinical pharmacology. Ninth edition. New York: McGraw-Hill, 2004. p. 836-51. [ Links ]
55.Classen DC, Evans RS, Pestotnik SL, Horn SD, Menlove RL, Burke JP. The timing of prophylactic administration of antibiotics and the risk of surgical-wound infection. N Engl J Med. 1992;326:281-6. [ Links ]
56.LoVecchio F, Klemens J, Welch S, Rodriguez R. Antibiotics after rattlesnake envenomation. J Emerg Med. 2002;23:327-8. [ Links ]
57.Clark RF, Selden BS, Furbee B. The incidence of wound infection following crotalid envenomation. J Emerg Med. 1993;11:583-6. [ Links ]
58.Weed HG. Nonvenomous snakebite in Massachusetts: prophylactic antibiotics are unnecessary. Ann Emerg Med. 1993;22:220-4. [ Links ]
59.Blaylock RS. Antibiotic use and infection in snakebite victims. S Afr Med J. 1999;89:874-6. [ Links ]
60.Roberts NJ, Douglas RG. Gentamicin use and Pseudomonas and Serratia resistance: effect of a surgical prophylaxis regimen. Antimicrob Agents Chemother. 1978;13:214-20. [ Links ]
61.Archer GL, Armstrong BC. Alteration of staphylococcal flora in cardiac surgery patients receiving antibiotic prophylaxis. J Infect Dis. 1983;147:642-9. [ Links ]
62.Kernodle DS, Barg NL, Kaiser AB. Low-level colonization of hospitalized patients with methicillin-resistant coagulase-negative staphylococci and emergence of the organisms during surgical antimicrobial prophylaxis. Antimicrob Agents Chemother. 1988;32:202-8. [ Links ]
63.Dirección Seccional de Salud de Antioquia. Guías de manejo de pacientes intoxicados. Medellín: DSSA; c2004-2007 consultado: 2007 jul 3; DSSA - Universidad de Antioquia. Disponible en: www.dssa.gov.co/dowload/GuiasIntoxicados.pdf [ Links ]














