Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Infectio
Print version ISSN 0123-9392
Infect. vol.12 no.2 Bogotá Apr./June 2008
1 Grupo de Inmunológica molecular (GYMOL), Centro de Investigaciones Biomédicas, Facultad de Ciencias de la Salud, Universidad del Quindío, Armenia, Colombia.
2 Grupo de Inmunológica molecular (GYMOL), Centro de Investigaciones Biomédicas, Facultad de Ciencias de la Salud, Universidad del Quindío, Armenia, Colombia.
3 Grupo de Patogénesis Molecular (PATOMOL), Centro de Investigaciones Biomédicas, Facultad de Ciencias de la Salud, Universidad del Quindío, Armenia, Colombia.
Fecha recibido: 18/03/2008; fecha aceptado: 22/06/2008
Resumen
La enzima óxido nítrico sintetasa ha sido estudiada en mamíferos; en los últimos años se ha descrito que existe también en protozoos, pero se desconocen aspectos importantes de su función.
Se logró producir anticuerpos policlonales contra la proteína recombinante con actividad de óxido nítrico sintetasa (NOS-Tg-r) de Toxoplasma gondii y realizar marcación inmunológica en taquizoítos. Se usaron dos conejos Nueva Zelanda (Oryctolagus cuniculus)que se inmunizaron por vía intramuscular con NOS-Tg-r, y dos tipos de adyuvantes, hidróxido de aluminio y adyuvante de Freund. Se comprobó la presencia de anticuerpos policlonales con la técnica de ensayo inmunoenzimático indirecto.
Los resultados obtenidos mostraron que la NOS-Tg-r con adyuvante de Freund indujo mayor respuesta inmune que la de la NOS-Tg-r con hidróxido aluminio p 0,005). Para verificar si había reacción cruzada, se realizó una prueba ELISA utilizando como antígenos: metaloproteasa de T. gondii recombinante, cisteína proteasa 5 de Entamoeba histolytica recombinante, albúmina al 2%, hidróxido de aluminio y adyuvante de Freund.
Los valores obtenidos con sueros preinmunes y contra proteínas alternas no superaron el punto de corte (0,069), lo cual indica que los anticuerpos policlonales obtenidos son específicos para NOS-Tg-r.
Se realizó marcación inmunológica en taquizoítos de Toxoplasma gondii con inmunofluorescencia indirecta que mostró una marcación difusa a nivel de citoplasma y confirmó la presencia de esta proteína en los taquizoítos.
Palabras clave: Toxoplasma gondii , óxido nítrico sintetasa, anticuerpos policlonales, inmunoflorescencia indirecta, hidróxido de aluminio, adyuvante de Freund.
Abstract
The nitric oxide synthase (NOS)is an enzyme well described on mammals but little is known about the role of these enzymes on pathogenic parasites. We produced polyclonal antibodies against a recombinant NOS enzyme from Toxoplasma gondii nd e lso er formed n mmunol locali zation of the enzyme on tachyzoites.We used two New Zealand rabbits (Oryctolagus cuniculus) to perform intramuscular immunization and we used two types of adjuvant: aluminum hydroxide and Freund s adjuvant. We tested the generation of polyclonal antibodies by an indirect ELISA assay.
The results showed that levels of antibodies were higher in rabbits immunized with Freund s adjuvant than with aluminum hydroxide (p =0.005). In order to test cross reactions, we used a recombinant Toxoplasma metallooprotease, a recombinant cysteine protease from Entamoeba histolytica, albumin 2%, hydroxide aluminium and Freund s adjuvant as antigens on indirect ELISA assays for the polyclonal serum antibodies.
No serum showed absorbances higher than the cutoff level with these antigens, indicating that the polyclonal antibodies were specific for recombinant Toxoplasma NOS. Additionally, we performed immunodetection of the enzyme on Toxoplasma gondii tachyzoites and we obtained a diffuse labeling of the parasite
Key words: Toxoplasma gondii , nitric oxide synthase, policlonal antibodies, aluminum hydroxide, Freund´s adjuvant
Introducción
En Colombia la toxoplasmosis congénita se presenta cada año en 2 a 10 por cada 1.000 recién nacidos y, por falta de intervención terapéutica, cada año nacen entre 800 y 3.000 bebés infectados con Toxoplasma gondii 1). Como consecuencia del impacto sobre la salud ocular, la toxoplasmosis es la segunda causa de ceguera infantil en nuestro país (2) y, además, presenta un gran impacto sobre la población de inmunosuprimidos, ya que la toxoplasmosis cerebral es la causa más frecuente de lesiones cerebrales focales en las personas positivas para VIH (3).
Una de las principales causas de la permanencia de la infección en las poblaciones es que aún hay desconocimiento de la biología del parásito y su interacción con el hospedero. Un ejemplo de esto es la falta de información sobre la enzima óxido nítrico sintetasa en este protozoo. Esta enzima está presente en todos los organismos vivos y cumple diferentes funciones como segundo mensajero de diversas rutas metabólicas celulares (4).Aunque su estudio ha abarcado ampliamente a los mamíferos, en los últimos años se ha empezado a estudiar en algunos invertebrados, como moluscos y arácnidos, y en microorganismos unicelulares, como bacterias y protozoos. Existen reportes de las actividades de óxido nítrico sintetasa en protozoarios tales como Plasmodium falciparum (55, Trypanosoma cruzi(6), Leishmania amazonensis (7), Tetrahymena thermophila (8) Entamoeba histolytica 9).
Gutiérrez y colaboradores (10) identificaron un gen putativo para una óxido nítrico sintetasa atípica en el genoma de T. gondii y,posteriormente,obtuvieron una proteína recombinante a partir del ADN de T. gondii, la cual presentó actividad de óxido nítrico sintetasa (11). Por otro lado, la literatura cita que T. gondii se ve afectado por la exposición al óxido nítrico proveniente de la sintetasa de óxido nítrico inducible en los macrófagos del hospedero, llevándolo a un cambio de estado de taquizoíto a bradizoíto; este último es el estado de latencia del parásito (12). Sin embargo, no se conoce a profundidad el comportamiento biológico de dicha proteína dentro del parásito ni tampoco su inmunogenicidad.
La detección inmunoquímica, en general, se basa en la producción de anticuerpos específicos (policlonales o monoclonales) para una determinada especie, suponiendo que ésta contenga grupos antigénicos diferenciados. Estos anticuerpos son de gran interés en el diagnóstico y la investigación científica; por tanto, hoy en día se hace más exigente no sólo su calidad sino también la metodología empleada para su producción (13). Los conejos son los animales más empleados en la obtención de anticuerpos policlonales, debido a que son de fácil manejo y mantenimiento,generan un buen número de anticuerpos en suero y responden bien contra una gran variedad de antígenos (13).
En la actualidad, el hidróxido de aluminio continúa siendo el adyuvante inmunológico más ampliamente utilizado(14). En 1936, Freund desarrolló una emulsión de agua en aceite mineral que contiene micobacterias muertas,lo que actualmente se conoce como adyuvante completo de Freund (15). El adyuvante completo de Freund es uno de los adyuvantes más eficaces, pero genera muchas reacciones para ser usado con fines clínicos (14).
Los principales objetivos de este trabajo fueron la producción de anticuerpos policlonales contra la proteína NOS-Tg-r con el fin de observar la presencia o no de ella en los taquizoítos de T. gondii; además, observar la comparación de la actividad inmunogénica de ésta con dos tipos de adyuvantes: hidróxido de aluminio (Al(OH)3) y adyuvante completo e incompleto de Freund en conejos Nueva Zelanda y la realización de la marcación inmunológica con estos anticuerpos sobre taquizoítos de T. gondii.
Materiales y métodos
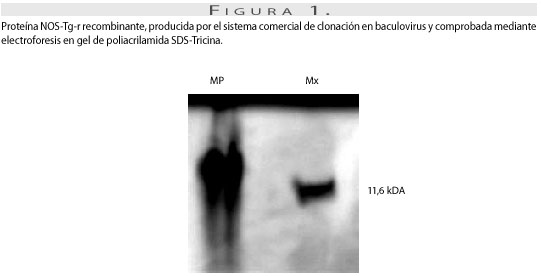
Proteína óxido nítrico sintetasa recombinante. La proteína recombinante óxido nítrico sintetasa de T. gondii (NOS-Tg-r) fue producida por clonación en sistema baculovirus. Esta proteína se obtuvo a partir de la secuencia putativa (GeneBank 16188255) para el gen de la enzima óxido nítrico sintetasa de T. gondii de 237 pb. La proteína NOS-Tg-r fue producida por el sistema comercial de clonación en baculovirus (Clontech ,CA) y purificada a una concentración de 339,75 µg/ml, comprobada mediante electroforesis en gel de poliacrilamida SDS-tricina y con un peso de 11,6 kDa (figura 1).
Inmunización de conejos Nueva Zelanda. Se trabajó con seis conejos de laboratorio (Oryctolagus cuniculus), machos, de la misma camada, de tres meses de edad, que pesaron 2,5 kg, aproximadamente, cada uno. Se usaron como controles negativos cuatro conejos.Se inmunizaron dos conejos, así:conejo 1, con la proteína NOS-Tg-r e hidróxido de aluminio, y conejo 2, con la proteína NOS-Tg-r y adyuvante de Freund (completo e incompleto). Los ensayos con los dos tipos de adyuvantes se realizaron de la siguiente manera: hidróxido de aluminio Al (OH)3 en PBS (tampón fosfato salino de pH 7,2) y coadyuvante completo e incompleto de Freund emulsionados en una mezcla de partes iguales de la proteína (500 µl de proteína y 500 µl de adyuvante) por sitio de inoculación. Para la primera inoculación se utilizó el adyuvante completo y en las siguientes inoculaciones el adyuvante incompleto. Para el trabajo con animales de laboratorio se siguió lo estipulado en el artículo 87 del Decreto N º 1969 del Ministerio del Medio Ambiente y del Ministerio de Salud, República de Colombia (Título V, la investigación biomédica con animales).
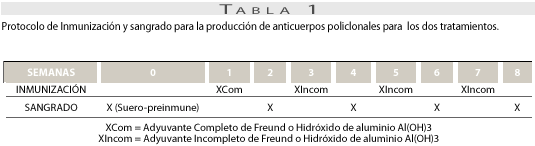
La emulsión se inyectó por vía intramuscular en distintos lugares del dorso del animal, siguiendo el método propuesto en Guide for the care and use of laboratory animals de la Oficina de Bienestar para Animales de Laboratorio (16). Dos semanas después se inocularon con adyuvante incompleto y dos veces más cada quince días. Igual procedimiento se realizó con el hidróxido de aluminio. Cada quince días se inmunizaron los conejos y se tomaron muestras de sangre para la extracción de suero de manera intercalada (tabla 1). La especificidad de la respuesta inmune de la proteína NOS-Tg-r se aumentó manteniendo los conejos en condiciones de esterilidad (alimento, agua y lecho de la jaula estériles).
Extracción y almacenamiento de los sueros. Se tomó una muestra de sangre de cada conejo de la vena principal de la oreja usando la técnica de máxima asepsia. La sangre se recolectó en tubos de ensayo sin anticoagulante, se dejó a temperatura ambiente durante 30 minutos para facilitar la formación del coágulo y se centrifugó durante 40 minutos a 4.000 rpm a –4ºC. El suero se dividió en alícuotas de 2 ml cada una, se almacenó en tubos de ensayo de 3 ml (Eppendorf) rotulados con fecha, tratamiento y semana, y se guardó a –4 ºC hasta su uso y a –20 °C para próximos ensayos.
Detección de anticuerpos por la prueba inmunoenzimática (ELISA) indirecta. Los sueros obtenidos contra la proteína NOS-Tg-r se analizaron mediante ELISA indirecta utilizando el protocolo descrito previamente (17). En resumen,el recubrimiento de los pozos de la microplaca (Maxisorp ® Nunc,Suiza)se realizó con 339,75 µg/ml de proteína NOS-Tg-r a una dilución 1:100 en tampón carbonato-bicarbonato 10 mM,pH 9,6 (STCB)y se incubó a 37 ºC por dos horas; se lavaron tres veces con solución fosfato salina (PBS) más Tween 20 al 0,05% (PBS-T). Como agente bloqueador se usó STCB-albúmina al 1%, y se incubaron a temperatura ambiente durante toda la noche. Enseguida se realizaron dos lavados con PBS-T.
Se adicionaron 200 µl de cada muestra (preinmune, segunda, cuarta, sexta y octava semana después de la inoculación) en diluciones 1:20, 1:50 y 1:100 en PBS-T. Se incubaron en cámara húmeda a 37 ºC por dos horas, al cabo de las cuales se realizaron dos lavados con PBS-T. Se agregó anticuerpo anti-IgG de conejo conjugado con fosfatasa alcalina (SIGMA, USA) a una dilución 1:10.000 en STCB. Se incubaron a 37 ºC por una hora y se lavaron, y posteriormente, se adicionó el sustrato p-nitrofenil fosfato pNpp SIGMA, USA). Finalmente, se incubaron a 37 ºC en la oscuridad y se detuvo la reacción con NaOH (1 M). Los tiempos de lecturas fueron a 30, 45 y 60 minutos, bajo una longitud de onda de 410 nm en lector de microplacas (Dynatech MR5000). Cada ensayo se realizó por duplicado.
Prueba de reacción cruzada. Se analizó si existía reacción cruzada de los sueros de los conejos inmunizados, utilizando como antígeno de recubrimiento de la placa distintas proteínas recombinantes obtenidas por el mismo método de clonación en sistema baculovirus, la metaloproteasa de Toxoplasma recombinante y la cisteína proteasa 5 de Entamoeba histolytica recombinante ambas con cola de histidina (EhCP5r). También se usaron como antígeno de recubrimiento de la placa, en otras reacciones, albúmina al 2%, hidróxido de aluminio y adyuvante de Freund. Se siguió el mismo protocolo de la ELISA indirecta descrito en la sección anterior.
Determinación del punto de corte. Los datos obtenidos fueron interpretados según su densidad óptica. El punto de corte se calculó tomando el promedio de los sueros negativos ± 3 desviaciones estándar,para todas las muestras. Se consideraron positivos aquellos sueros que presentaron valores de densidad óptica por encima del punto de corte. Los sueros de control negativos, o verdaderos negativos, fueron los sueros de conejo tomados previa inoculación de la proteína NOS-Tg-r.
Detección de anticuerpos por inmunofluorescencia indirecta. La marcación inmunológica se llevó a cabo mediante el proceso estándar descrito previamente (18). Se utilizaron los taquizoítos de la cepa de referencia RH de T. gondii obtenidos a partir de cultivo en ratón.Los taquizoítos de T. gondii se fijaron en metanol al 100% a -20 ºC por tres minutos en laminas de vidrio; se lavaron dos veces con BS más suero fetal bovino (PBS-SFB)al 1% por 5 minutos. Para permeabilizar la membrana de los taquizoítos y facilitar la entrada de los anticuerpos, se utilizó Tritón X-100 al 1% en PBS-SFB con pH 7,3 durante cinco minutos a –20 ºC. Se lavó con PBS-SFB al 1% durante cinco minutos.
Se adicionaron 50 µl de anticuerpo primario a diluciones de 1:10 y:50 en BS-SFB l%. Se incubaron 37 ºC en cámara húmeda por una hora. Luego se realizaron dos lavados con PBS más SFB al 1% por cinco minutos y se adicionó el conjugado anti-IgG de conejo marcado con isotiocianato de fluoresceína (FITC,SIGMA,USA)a una dilución 1:160 en PBS-azul de Evans (1:10,000). Finalmente, se lavaron con PBS-SFB por 10 minutos y se observó cada una de las placas en un microscopio de fluorescencia (Micromedica BA2000i) con luz ultravioleta, 0X y 100X.
Resultados
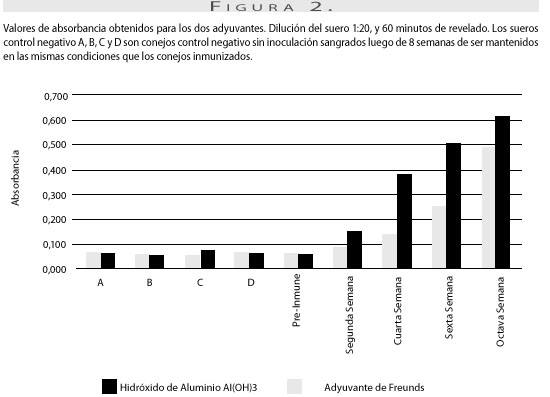
Determinación de la producción de anticuerpos policlonales contra NOS-Tg-r en conejo. Los resultados de ELISA en las muestras de suero revelaron la presencia de anticuerpos específicos para la proteína NOS-Tg-r (figura 2). En los cuatro conejos sin inmunizar los valores de absorbancia de los sueros obtenidos a las 8 semanas estuvieron por debajo del punto de corte para considerar la reacción positiva.
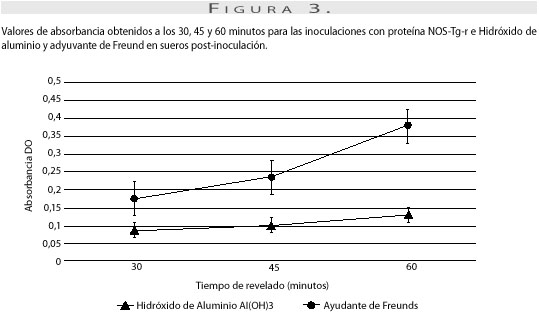
En relación con el tiempo de revelado, el mayor valor de absorbancia siempre se presentó después de 60 minutos para los dos tratamientos (figura 3). El punto de corte obtenido para las inoculaciones con proteína NOS-Tg-r e hidróxido de aluminio y adyuvante de Freund en dilución 1:20 y a 60 minutos, fue de 0,069 (figura 4).
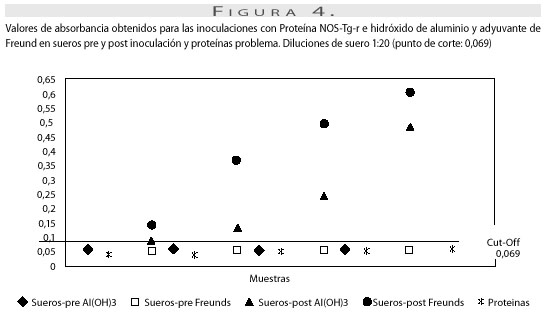
Prueba de reacción cruzada. La reactividad de los sueros de conejo con metaloproteasa de T. gondii recombinante (densidad óptica: 0,05 ± 0,03), cisteína proteasa 5 de E. histolyticarecombinante (EhCP5r) (densidad óptica: 0,057 ± 0,002), albúmina al 2%, (densidad óptica: 0,045 ± 0.06), hidróxido de aluminio, (densidad óptica:0,064 ± 0,003) y adyuvante de Freund (densidad óptica: 0,056 ± 0,002) mediante la prueba ELISA estuvo por debajo del punto de corte (densidad óptica: 0,069). El promedio de los resultados de densidad óptica para los sueros negativos fue de 0,054 ± 0,010 (figura 4).
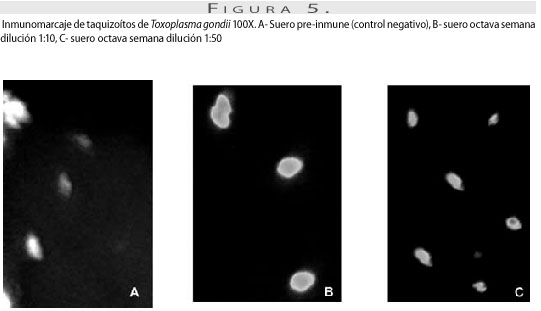
Determinación de la respuesta inmune por inmunofluorescencia indirecta. Para la marcación inmunológica de los anticuerpos policlonales en los taquizoítos se utilizaron los sueros con mayor absorbancia según los valores de ELISA (octava semana). Como control negativo se utilizó suero preinmune a las mismas concentraciones. En la dilución 1:10 se observó fluorescencia de 70/100 y,en dilución 1:50, de 30/100 (figura 5).
Discusión
Anteriormente se habían desarrollado anticuerpos policlonales dirigidos contra proteínas de T. gondii (19, 20) utilizando diferentes protocolos pero de difícil comparación y reproducibilidad.En este trabajo se logró estandarizar una metodología apropiada para la variedad correspondiente a antígenos recombinantes, para el sitio de inoculación y para diferentes tipos de adyuvantes.
Se han descrito resultados similares a los reportados en otros microorganismos,como Giardia duodenalis 21) Pythium insidiosum (22). La inducción de anticuerpos policlonales en conejo enera una gran cantidad de suero y estos anticuerpos responden bien a una variedad de antígenos, inclusive los de tipo recombinante (13). Los esquemas de inmunización con largos períodos y con refuerzos repetidos, incrementan el desarrollo de anticuerpos afines al antígeno inoculado (14). Por ello, se inmunizaron los conejos hasta la octava semana de acuerdo con lo reportado previamente por García y colaboradores (21), quienes sugieren inmunizar con antígeno más de seis semanas, aplicando cuatro inmunizaciones con intervalo de dos semanas entre cada una de ellas.
Los resultados obtenidos para los dos tipos de adyuvantes, muestran que los mayores valores de absorbancia detectados en la prueba ELISA indirecta, se obtuvieron con el adyuvante de Freund. El mecanismo de acción de este adyuvante se atribuye a la formación de un depósito en el sitio de inyección que posibilita la liberación lenta del antígeno, con lo que se estimulan las células productoras de anticuerpos. Aunque este adyuvante no se emplea actualmente en humanos debido a que ocasiona reacciones locales colaterales, como la formación de granulomas e inflamación local, es un buen adyuvante para animales de laboratorio en dosis moderada (13). Por el contrario, el hidróxido de aluminio es el único de aprobación general para uso clínico en humanos (14). Una posible causa de los bajos valores de absorbancia en el tratamiento con hidróxido de aluminio comparado con el adyuvante de Freund, es que los compuestos a base de aluminio, a pesar de ser considerados seguros, son adyuvantes a base de agua, débiles, y ligeros en su capacidad de estimular respuesta inmune (14).
Es posible comparar los valores de absorbancia en la prueba ELISA de los sueros después de inoculación de proteína NOS-Tg-r y adyuvantes (hidróxido de aluminio, adyuvante de Freund) con otros trabajos. Cuando se obtuvieron anticuerpos policlonales IgG contra Pythium insidiosum en conejos Nueva Zelanda (22), se encontraron valores de absorbancia en el tratamiento con adyuvante de Freund de 0,62 en la octava semana, mientras que para el tratamiento con hidróxido de aluminio fue de 0,47.
En el presente trabajo los valores de absorbancia fueron similares: 0,64 para el adyuvante de Freund y 0,47 con hidróxido de aluminio. Una conclusión similar se obtuvo al evaluar la antigenicidad de una vacuna para herpes labial en ratones, la cual mostró que el adyuvante de Freund indujo mayor respuesta inmune según los valores de absorbancia obtenidos (23).
Los valores de absorbancia para las proteínas de metalo proteasa de matriz de T. gondii recombinante o la cisteína proteasa 5 de E. histolytica recombinante, estuvieron por debajo del punto de corte, descartándose reacción cruzada contra la cola de histidina propia de los antígenos recombinantes obtenidos por el sistema comercial utilizado. Tampoco se encontró reacción cruzada contra los adyuvantes utilizados, como el hidróxido de aluminio, el adyuvante de Freund u otros reactivos como la albúmina 2%, lo cual indica que los anticuerpos policlonales fueron específicos para la proteína NOS-Tg-r.
En la actualidad, no se han reportado estudios en protozoarios de actividad inmunogénica de óxido nítrico sintetasas ni su localización en un estadio particular. Los estudios realizados en células eucariotas han descrito la proteína óxido nítrico sintetasa inducible localizada en forma granular en neutrófilos (24)o en el citoesqueleto de macrófagos coinfectados con Mycobacterium tuberculosis (25). La sintetasa neuronal de óxido nítrico se ha localizado en glándulas lagrimales de ratón y en filamentos nerviosos (26) y a nivel apical subcelular en células epiteliales (27,28), lo que demuestra el amplio rango de localización celular y subcelular de dicha proteína.
Los resultados obtenidos en la marcación inmunológica muestran a presencia de una proteína que contiene la misma secuencia que la proteína recombinante NOS-Tg-r, y que se halla dispersa en los taquizoítos de T. gondii; esto es de gran interés, puesto que se partió de encontrar la secuencia de la proteína mediante herramientas bioinformáticas (base curada ToxoDB versión 4.1) (10) para luego comprobar su inmunogenicidad y poder sugerir su presencia en el taquizoíto. Por otra parte, se comprobó la efectividad de la técnica en la detección de esta proteína.
En conclusión, la proteína con actividad de óxido nítrico sintetasa recombinante NOS-Tg-r de T. gondii tuvo actividad inmunogénica en conejos, para producción de anticuerpos policlonales específicos con dos tipos de adyuvantes. No hubo reacción cruzada con otras proteínas ni con los adyuvantes. Este suero policlonal permitirá realizar ensayos de localización inmunológica con microscopio confocal, en diferentes estadios del parásito T. gondii.
Agradecimientos
Este trabajo fue financiado en parte con fondos de la Universidad del Quindío, proyecto 291 y Colciencias, proyecto código 1113-04-18247; a la Clínica Veterinaria ZOOVET, a Luis Felipe Carmona, a los grupos GYMOL y GECAVYME, al laboratorio de Ciencias Biomédicas, a Jorge Enrique Gómez y Alejandra de la Torre y al Programa de Biología de la Universidad del Quindío.
Correspondencia: Néstor Iván Cardona, Centro de Investigaciones Biomédicas, Universidad del Quindío, Av. Bolívar 12N, Armenia, Colombia, Teléfono/fax (5767) 460 168 nestorivan@yahoo.com
Referencias
1. Gómez JE, Montoya MT, Castaño JC, Ríos MP. Epidemiología de infección por Toxoplasma gondii en gestantes de Armenia, Quindío, Colombia. Colombia Médica. 1993;24:14-8. [ Links ]
2. Zuluaga C, Sierra MV, Asprilla E. Causas de ceguera infantil en Cali, Colombia. Colombia Médica. 2005;36:235-8. [ Links ]
3. Gómez JE. Diagnóstico de la toxoplasmosis humana: nuevos conceptos y técnicas. Medicina & Laboratorio. 2000;9:167-85. [ Links ]
4. Moncada S, Palmer RM, Higgs EA. Nitric oxide: physiology, pathophysiology, and pharmacology. Pharmacol Rev. 1991;43:109-42. [ Links ]
5. Ghigo D, Todde R, Ginsburg H, Costamagna C, Gautret P, Bussolino F, et al. Erythrocyte stages of Plasmodium falciparum exhibit a high nitric oxide synthase (NOS) activity and release of an NOS- inducing soluble factor. J Exp Med. 1995;182:677-8. [ Links ]
6. Paveto C, Pereira C, Espinosa J, Montagna E, Farber M, Esteva M, et al . The nitric oxide transduction pathway in Trypanosoma cruzi. J Biol Chem 1995;270:16576-9. [ Links ]
7. Genestra M, Guedes-Silva D, Souza W, Cysne-Finkelstein L, Soares-Bezerra R, et al. Nitric oxide synthase (NOS) characterization in Leishmania amazonensis axenic amastigotes. Arch Med Res. 2006;37:328-33. [ Links ]
8. Cristensen ST, Kemp D, Quie H, et al. Cell death, survival and proliferation in Tetrahymena thermophila. Effects of insulin, sodium nitroprusside, 8- bromocyclic GMP, N-methyl-L-arginine and methylene blue. Cell Biol Intern. 1996;20:653-66. [ Links ]
9. Hernández-Campos M, Campos-Rodríguez R, Tsutsumi V, Shibayama M, et al. Nitric oxide synthase in Entamoeba histolytica: its effect on rat aortic rings. Exp Parasitol. 2003;1004:87-95. [ Links ]
10. Gutiérrrez-Escobar AJ, Gómez–Marín JE. Toxoplasma gondii :identification of a putative nitric oxide synthase motif DNA sequence. Exp Parasitol. 2005;111:211-8. [ Links ]
11. Gutiérrez-Escobar AJ, Arenas AF, Villoria-Guerrero Y, Padilla-Londoño JM, Gómez-Marín JE. Toxoplasma gondii: Molecular cloning and characterization of a nitric oxide synthase-like protein. Exp Parasitol. 2008;119:358-63. [ Links ]
12. Wolfgang B, Jurgen H, Gross U. Reduced replication of Toxoplasma gondii is necessary for induction of bradyzoite-specific antigens: a possible role for nitric oxide in triggering stage conversion. Infect Immun. 1994;62:1761-7. [ Links ]
13. Dumbar BS, Schwoebel ED. Preparation of polyclonal antibodies. En: Deustcher MP, editor. Methods in enzymology. Londres. Academic Press Inc.; 1990. p.663-7. [ Links ]
14. Vogel FR, Powell MF. A summary compendium of vaccine adjuvants and excipients. En: Powell MF, Newman MJ, editors. Vaccine design: the subunit and adjuvant approach. New York: Plenum Publishing Corp; 1995. p. 234-50. [ Links ]
15. Freund J, Casals J, Hosmer EP. Sensitization and antibody formation after injection of tubercle bacili and parafin oil. Proc Soc Exp Biol Med. 1937;37:509-13. [ Links ]
16. Commission on Life Sciences of the National Research Council and Institute of Laboratory Animal Resources. Guide for the Care and Use of Laboratory Animals. Washington, D.C.: National Academy Press; 1996. [ Links ]
17. Cardona NI, Lora F, Gómez JE. Estandarización del inmunoensayo ELISA para la detección de IgG anti-Toxoplasma gondii en ratón. Parasitol Latinoam. 2005;60:97-101. [ Links ]
18. López MC, Corredor A, Reyes P, et al. Estandarización de una prueba de inmunofluorescencia indirecta para IgG anti-Toxoplasma en ratón. Biomédica. 2001;21:79-82. [ Links ]
19. de Miguel N, Echeverría PC, Angel SO. Differential subcellular localization of members of the Toxoplasma gondii small heat shock protein family. Eukaryotic Cell. 2005;4:1990-7. [ Links ]
20. Achim JK, Keith AJ. Targeting and subcellular localization of Toxoplasma gondii catalase. J Biol Chem. 2000;275:2-14. [ Links ]
21. García DA, Nicholls RS, Arévalo A, Torres O, Duque S. Obtención, purificación y caracterización de anticuerpos policlonales IgY desarrollados en gallina, dirigidos contra aislamientos colombianos de Giardia duodenalis. Biomédica. 2005;25:451-63. [ Links ]
22. Trindade LA, Morais J, Monteiro AB, et al. Serological response in rabbits immunized with Pythium insidiosum antigens associated with different adjuvants. Alexandre Ciencia Rural. 2002;32:1027-32. [ Links ]
23. Thomson TA, Hilfenhaus JM, Morahan S. Comparison of effects of adjuvants on efficacy of virion envelope Herpes Simplex virus vaccine against labial infection of BALB/c mice. Infect Immun. 1983;41:55 62. [ Links ]
24. Evans TJ, Buttery LD, Carpenter A, Springall DR, Polakt JM, et al. Cytokine-treated human neutrophils contain inducible nitric oxide synthase that produces nitration of ingested bacteria. Proc Natl Acad Sci. 1996;93:9553-8. [ Links ]
25. Barbara HM, Rutilio AF, Jens FP, Graham ST, Sharon SM. Mycobacteria inhibit nitric oxide synthase recruitment to phagosomes during macrophage infection. Infect Immun. 2004;72:2872-8. [ Links ]
26. Ding C, Walcott B, Keyser KT. Neuronal nitric oxide synthase and the autonomic innervation of the mouse lacrimal gland. Invest Ophthalmol Vis Sci. 2001;42:2789-94. [ Links ]
27. Yago MD, Manas M, Ember Z, Singh J. Nitric oxide and the pancreas: morphological base and role in the control of the exocrine pancreatic secretion. Mol Cell Biochem. 2001;219:107-20. [ Links ]
28. Navarro-Lerida I, Martínez-Moreno M, Ventoso I, Álvarez-Barrientos A, Rodríguez-Crespo I. Binding of CAP70 to inducible nitric oxide synthase and implications for the vectorial release of nitric oxide in polarized cells. Mol Biol Cell. 2007;18:2768-77. [ Links ]














