Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Infectio
Print version ISSN 0123-9392
Infect. vol.12 no.3 Bogotá July/Sept. 2008
ARTICULO ORIGINAL
1 Universidad Cooperativa de Colombia, Facultad de Medicina, Villavicencio.
2 Instituto de Investigaciones Biológicas del Trópico, Universidad de Córdoba, Montería, Córdoba.
Fecha de recepción: 28/05/2008. Fecha de aceptación: 01/07/2008
Resumen
Objetivo. Determinar la presencia de betalactamasas de espectro extendido (BLEE) y su prevalencia en aislamientos de Escherichia coli y Klebsiella pneumoniae causa de infección hospitalaria en una clínica de Villavicencio.
Metodología. Se analizaron 50 aislamientos, 29 de E. coli y 21 de K. pneumoniae provenientes de pacientes hospitalizados en una clínica de segundo nivel de la ciudad de Villavicencio; se emplearon los métodos de difusión de disco de CLSI y el método confirmatorio para la detección de las BLEE de MicroScan® ESBL.
Resultados. De 50 aislamientos, 3 (6%) presentaban BLEE, 2 K. pneumoniae y 1 E. coli.
Estos aislamientos también mostraron resistencia con las fluoroquinolonas y el trimetoprim-sulfametoxazol. Los métodos de difusión de disco de CLSI y MicroScan® ESBL fueron concordantes en los resultados para la confirmación de la producción de BLEE.
Conclusiones. El estudio permitió demostrar la producción de BLEE en K. pneumoniae y E. coli en una clínica de Villavicencio. Aunque es baja la frecuencia de BLEE, se sugiere seguir el uso restringido de cefalosporinas de tercera generación y fortalecer los mecanismos de control de la infección.
Palabras clave: beta-lactamasas, espectro extendido, infección hospitalaria, Escherichia coli, Klebsiella pneumoniae, Villavicencio.
Abstract
Introduction: Multirresistant microorganisms that produce ESBL are one of the main problems in hospitals.
Objective: To establish the presence of extended spectrum β-lactamases (ESBL) in Klebsiella pneumonia and Escherichia coli that produce nosocomial infections in a clinic in Villavicencio, Colombia.
Methods: 50 strains were studied, 29 K. pneumoniae and 21 E. coli, from patients with nosocomial infections at a clinic in Villavicencio; CLSI disk diffusion of the test and ESBL MicroScan® as the confirmatory method were used.
Results: ESBL producers were determined in 3 of 50 (6%) isolates, 2 of 21 K. pneumoniae and 1 of 29 E. coli. The disk diffusion procedure recommended by CLSI and MicroScan ® ESBL were in agreement about production and confirmation of ESBL (p>0.05).
Conclusions: The study showed low ESBL producers in K. pneumoniae and E. coli in a second level clinic in Villavicencio. These results suggest restricting the use of broad spectrum β-lactamases cefalosporins to prevent ESBL dissemination at hospital level.
Key words: extended spectrum β-lactamases, nosocomial, Villavicencio, Escherichia coli, Klebsiella pneumoniae.
Introducción
En los últimos 20 años, se han desarrollado nuevos antibióticos beta-lactámicos, diseñados específicamente para ser resistentes a la acción hidrolítica de las β-lactamasas. Sin embargo, con cada nueva clase de antibiótico que se usa para tratar a los pacientes, emergen nuevas β-lactamasas que causan resistencia. No es sorprendente que aparezca resistencia a antibióticos beta-lactámicos de amplio espectro debido a β-lactamasas que emergen a gran velocidad; la primera de esas enzimas capaz de hidrolizar los nuevos antibióticos se encontró en una cepa de Klebsiella ozaenae y, debido a su amplio espectro de actividad, se le denominó β-lactamasa de espectro extendido (BLEE)1,2.
Actualmente, se han descrito más de 150 BLEE en diferentes géneros de Enterobacteriaceae, lo que genera la aparición de resistencia a las cefalosporinas de amplio espectro. Klebsiella pneumoniae y Escherichia coli son patógenos asociados a infecciones hospitalarias, especialmente en pacientes de la unidad de cuidados intensivos3-5. En estas bacterias, las BLEE son las responsables de la resistencia al aztreonam y a las cefalosporinas de tercera generación, como la cefotaxima, la ceftriazona y el ceftazidime6.
La prevalencia de la producción de las BLEE varía geográficamente y la administración in-discriminada de cefalosporinas de amplio espectro es un factor común en las instituciones. Existen factores de riesgo específicos para adquirir una cepa productora de BLEE, como una estadía prolongada en el hospital, la seriedad de la enfermedad, el tiempo de permanencia en la unidad de cuidados intensivos, la intubación y la respiración mecánica asistida, el uso de catéteres urinarios o arteriales y la exposición previa a los antibióticos. Muchos de los pacientes infectados con cepas productoras de BLEE se encuentran en la unidad de cuidados intensivos aunque la infección también puede ocurrir en la sala de cirugía y en otras áreas del hospital1.
Las BLEE pueden también ser codificadas por plásmidos, lo cual facilita la transferencia en-tre diferentes tipos de cepas y, además, se presume que pueda transferirse a la flora normal de los pacientes3.
En Colombia la aparición y diseminación de las BLEE han sido bien estudiadas. Sin embargo, en este proceso no se han incluido todas las ciudades. Por ello, la detección de BLEE en
E. coli y K. pneumoniae aisladas de infecciones en humanos en Villavicencio, se convierte en una necesidad que facilitaría el entendimiento de la resistencia antimicrobiana y su epidemiología en esta zona del país.
Materiales y métodos
Tipo de estudio, cálculo del tamaño de la muestra y tipo de muestra.
Se llevó a cabo un estudio descriptivo, prospectivo y observacional. Los pacientes incluidos en el estudio adquirieron infección hospitalaria por E. coli y K. pneumoniae durante el año 2007 en una clínica de Villavicencio. Se definió como infección hospitalaria aquélla que no estaba presente ni incubándose en el momento de la hospitalización y que se presentó entre 48 y 72 horas después de la admisión7.
Para el cálculo del tamaño de la muestra, se tuvo en cuenta que la clínica cuenta con 56 camas y pertenece al segundo nivel de atención. Se aislaron 1.600 gérmenes en el 2006; de ellos, 15% fueron bacterias Gram negativas hospitalarias. Con base en ello, se calculó el tamaño de la muestra con un error máximo permisible de 1% (EpiInfo, versión 6.04). Se debían analizar 55 gérmenes por año. El análisis estadístico se hizo con un error del 5% para considerarlo significativo.
Los gérmenes provenían de muestras de urocultivo (n=24), hemocultivo (n=6), abscesos (n=4), heridas quirúrgicas (n=9), secreción oro-traqueal (n=2) y líquido peritoneal (n=5). Todos los microorganismos se identificaron por el sistema API 20E (Biomerieux SA, Marcy I´Etoile, France). La información clínica y microbiológica de los pacientes se registró en un formulario diseñado para tal efecto.
Estudio microbiológico. Las muestras se cultivaron en medios estándar de cultivo y se transportaron en sistemas de recolección y transporte para bacterias aerobias con carbón activado BBLTM Cultura swab plus TM (Becton Dickinson Microbiology Systems, France SA), al Instituto de Investigaciones Biológicas del Trópico de la Universidad de Córdoba en Montería, para la realización de las pruebas correspondientes. Durante el estudio, las bacterias se mantuvieron a -70°C en leche des-cremada.
Determinación de la susceptibilidad. Se realizo el método de difusión de disco en placas de agar Mueller-Hinton para 9 antibióticos (cefotaxima [30 µg], ceftazidima [30 µg], cefpodioxima [10 µg], aztreonam [30 µg], imipenem [10 µg], ciprofloxacina [5 µg], gentamicina [10 µg], netilmicina [30 µg] y trimetoprim-sulfametoxazol [25 µg]. También se utilizaron discos con cefalosporinas combinadas (cefpodoxima/clavulonato [10/1 µg], cefatzidime /clavulonato [30/10 µg]) (Oxoid, Basingstoke, Reino Unido).
Concentración inhibitoria mínima. Se realizó mediante el sistema MicroScan® Neg Combo Panel Type 32 (Dade Behring, USA). La interpretación de los resultados se hizo con base en las indicaciones del Clinical and Laboratory Standards Institute (CLSI)8,9.
Detección de BLEE por difusión de disco. Como estrategia de tamización para la detección de BLEE se utilizó el método de difusión de disco con los siguientes antibióticos: ceftazidima [30 µg], cefotaxima [30 µg], y aztreonam [30 µg], siguiendo las normas del CLSI8,9.
Detección de BLEE por MicroScan®. La confirmación de las cepas productoras de BLEE se llevó a cabo por el método de MicroScan®ESBL plusTM (Dade Behring, CA, USA) que contiene concentraciones dobles seriadas de amikacina [4 -32 µg/ml] , ampicilina/sulbactam [8/4-16/8 µg/ml], ampicilina [8-16 µg/ml], aztreonam [8-16 µg/ml], cefazolina [4-16 µg/ ml], cefepime [2-16 µg/ml], cefotaxima [4-32 µg/ml], cefotetan [16-32 µg/ml], ceftazidima [2-16 µg/ml], ceftriaxona [8-32 µg/ml], cefuroxima [4-16 µg/ml], ciprofloxacina [1-2 µg/ ml], gentamicina [1-8 µg/ml], imipenem [4-8 µg/ml], levofloxacina [2-4 µg/ml], meropenem [4-8 µg/ml], moxifloxacina [2-4 µg/ml], piperacilina/tazobactam [8/4-16/4 µg/ml], ticarcilina/ ácido clavulánico [16/2 -64/2 µg/ml], tobramicina [1-8 µg/ml], trimetoprim/sulfametoxazol [2/38 µg/ml]; para este método se siguieron las recomendaciones del CLSI8,9.
Cepas control. Como control de calidad para todos los métodos se empleó la cepa ATCC 700603 de K. pneumoniae productora de BLEE y la cepa no productora ATCC 25922 de E. coli.
Análisis estadístico. Se creó una base de datos en el programa Excel® en la cual se registraron los datos de la información clínica y microbiológica. Para analizar los datos y resultados se usó el programa EpiInfo, versión 6.04. Se utilizó la prueba de ji al cuadrado para analizar las diferencias encontradas entre los gérmenes aislados.
Resultados
Durante el periodo de estudio se detectaron 50 episodios de infecciones por E. coli (n=29) y K. pneumoniae (n=21) aislados de diferentes pacientes. El porcentaje de resistencia de K. pneumoniae frente a cada uno de los antibióticos evaluados fue el siguiente: cefotaxima (2/21, 9,52%), ceftazidima (2/21, 9,52%), aztreonam (3/21, 14,28%), ciprofloxacina (4/21, 19,04%), netilmicina (1/21, 4,76%), trimetoprim-sulfametoxazol (5/21, 23,8%), gentamicina (1/21, 4,76%); para E. coli, cefotaxima (1/29, 3,44%), ceftazidima (1/29, 3,44%), aztreonam (2/29, 6,89%), ciprofloxacina (2/29, 6,89%), netilmicina (1/29,,3,44%), trimetoprim-sulfametoxazol (8/29, 27,5%), gentamicina (2/29, 6,89%), con imipenem hubo 100% de sensibilidad (tabla 1). El método de MicroScan® ESBL plus demostró que dos aislamientos de K. pneumoniae y 1 de E. coli eran productores de BLEE.
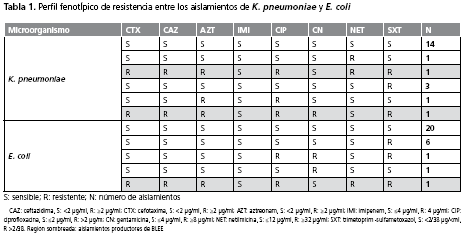
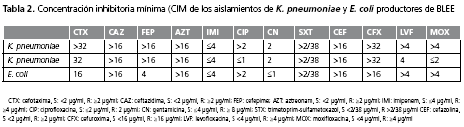
Los dos aislamientos de K. pneumoniae productores de BLEE mostraron resistencia a ampicilina/sulbactam, ampicilina, cefazolina, cefepime, cefotaxima, ceftazidima, ceftriaxona, cefuroxima, aztreonam y trimetoprim-sulfametoxazol; uno de los aislamientos mostró sensibilidad a ciprofloxacina, levofloxacina y moxifloxacina. El aislamiento de E. coli productor de BLEE demostró resistencia a aztreonam, cefazolina, cefotaxima, ceftazidima, cefuroxima, ciprofloxacina, levofloxacina, moxifloxacina y trimetoprim-sulfametoxazol. En la tabla 2 se presentan las CIM de los aislamientos productores de BLEE. Los tres aislamientos productores de BLEE se aislaron de orina, secreción oro-traqueal y líquido peritoneal que correspondieron al 33,3% cada uno.
Al comparar los dos métodos de susceptibilidad antimicrobiana, no se encontraron diferencias significativas (p>0,05) entre la prueba de tamización y el método de MicroScan® ESBL plus.
Discusión
La producción de BLEE por diversos patógenos de importancia clínica constituye un importante problema en los pacientes hospitalizados debido a las implicaciones clínicas, terapéuticas y económicas. Los factores de riesgo para la aparición de bacterias productoras de BLEE incluyen la administración previa de cefalosporinas de amplio espectro y aminoglucósidos, la estancia hospitalaria prolongada, la estancia en la unidad de cuidados intensivos, el uso de catéteres urinarios y la seriedad de las infecciones10-12.
Las BLEE son un problema de salud pública con proporciones alarmantes de prevalencia en Latinoamérica, que alcanza tasas preocupantes en Colombia, Guatemala, Perú, México, Venezuela, Ecuador, Argentina, Chile, Panamá y Brasil13,14. La producción de BLEE en estos países mostró importantes variaciones de un país a otro, con rangos entre 5% y 73%14. En Colombia, la prevalencia de BLEE, según Villegas et al.15 se encuentra por enzima del 40%. En los estudios realizado por Mendes et al.14, se informó 27% de BLEE en E. coli y 44% en K. pneumoniae. En un estudio más reciente, Martínez et al.16 encontraron 43% de BLEE en K. pneumoniae y 20,5% en E. coli. Villanueva et al.17 en hospitales de la Costa Atlántica reportaron 40% de K. pneumoniae productoras de BLEE y 17,6% en E. coli. En la zona andina colombiana se han encontrados prevalencias más bajas, entre 10% y 13% para E. coli y de 30% para K. pneumoniae18. El presente estudio encontró 6% de BLEE en todos los aislamientos, 9,52% para K. pneumoniae y 3,44% para E. coli.
La utilización de cefalosporinas de tercera generación ejerce una presión importante en las bacterias Gram negativas. Esto último genera un problema en Latinoamérica, ya que el 50% de las infecciones hospitalarias son tratadas con antibióticos beta-lactámicos y cerca del 70% de las infecciones de los pacientes extrahospitalarios son tratadas con cefalosporinas, lo cual sugiere la existencia de una fuerte presión selectiva en esta zona de América19,20.
En un estudio de Paterson21 se informó que más del 50% de las bacteriemias causadas por
K. pneumoniae tratadas con cefalosporinas de tercera generación presentaron fallas terapéuticas en la respuesta clínica. Los reportes en la literatura no son concluyentes para determinar si la restricción de las cefalosporinas de tercera generación es suficiente para controlar las infecciones causadas por organismos productores de BLEE22. Variables como la capacidad de endemia de los microorganismos productores de BLEE en los hospitales pueden incrementar los índices de mortalidad cuando se usan antibióticos β-lactámicos22.
Otros autores23 consideran que es útil el uso de cefepime como estrategia eficaz en el tratamiento de las infecciones causadas por gérmenes productores de BLEE como E. coli y K. pneumoniae ya que, desde el punto de vista farmacodinámico, mantiene mejor actividad que la piperacilina y el tazobactam. No obstante, el reemplazo de las cefalosporinas de tercera generación por el cefepime24 podría en cierta forma cambiar de problema y en corto tiempo se tendría una epidemia de microorganismos productores de AmpC.
Cabe anotar que el número de muestras analizadas en nuestro estudio fue limitado y no permite obtener conclusiones definitivas. Sin embargo, este estudio detectó la presencia de cepas productoras de β-lactamasas, lo cual constituye una alarma debido al riesgo que constituyen y a la posibilidad del comienzo de un problema de resistencia ya que es una clínica de segundo nivel, lo que podría suponer que el tercer nivel ya se encuentra amenazado por las BLEE. Se necesita realizar más estudios en otros centros de Villavicencio con el fin de hacer un análisis más profundo de la situación.
En conclusión, la presencia de BLEE en K. pneumoniae y E. coli en una clínica de segundo nivel, sugiere, entre otras cosas, restringir el uso de β-lactámicos de amplio espectro e implementar medidas rigurosas de higiene para el control de las infecciones y la prevención de la diseminación de microorganismos productores de BLEE en el ambiente hospitalario.
Agradecimientos
A Sandra Gordillo y al personal del laboratorio de microbiología de la clínica de Villavicencio, por permitirnos llevar a cabo este estudio. A la Facultad de Medicina de la Universidad Cooperativa de Colombia y al Instituto de Investigaciones Biológicas y del Trópico de la Universidad de Córdoba.
Correspondencia: Salim Máttar, Instituto de Investigaciones Biológicas del Trópico, Universidad de Córdoba, Montería, Córdoba. mattarsalim@hotmail.com
Referencias.
1. Bradford P. Extended spectrum ß-lactamases in the 21st century: characterizacion, epidemiology, and detection of this important resistant Threat. Clin Microbiol Rev. 2001;14:933-51. [ Links ]
2. Paterson D, Bonomo R. Extended spectrum ß-lactamases: a clinical update. Clin Microbiol Rev. 2005;18:657-86. [ Links ]
3. Martínez PJ, Espinal P, Bustos A, Máttar S. Prevalencia de Klebsiella pneumoniae y Escherichia coli productoras de ß-lactamasas de espectro extedido (BLEE), en el Hospital San Jerónimo de Montería. Med UNAB. 2005;8:15-22. [ Links ]
4. Yan JJ, Wu SM, Tsai SH, Wu JJ, Su JJ. Prevalence of SHV12 among clinical isolates of Klebsiella pneumoniae producing extended spectrum ß-lactamases and identification of a novel AmpC enzyme (CMY-8) in Southern Taiwan. Antimicrobial Agents Chemother. 2000;44:1438-42. [ Links ]
5. Jacoby GA, Han P. Detection of extended spectrum ß-lactamases in clinical isolates of Klebsiella pneumoniae and E. coli. J Clin Microbiol. 1996;34:908-11. [ Links ]
6. Lee SO, Lee ES, Park SY, Kim SY, Seo YH, Cho YK. Reduced use of third-generation cephalosporins decreases the acquisition of extended spectrum ß-lactamases producing Klebsiella pneumoniae. Infect Control Hosp Epidemiol. 2004;25:832-37. [ Links ]
7. Garner JS, Jarvis WR, Emori TG, Horau TC, Hughes JM. CDC definitions for nosocomial infections. Am J Infect Control. 1988;16:128-40. [ Links ]
8. National Committee Clinical Laboratory Standards 2002. Performance Standards for antimicrobial susceptibility testing. Informational supplement M100-S12. Wayne: National Committee for Clinical Laboratory Standards; 2002. [ Links ]
9. National Committee for Clinical Laboratory Standards 2000. Methods for dilution antimicrobial susceptibility test for bacteria that grow aerobically. NCCLS document M7-A5. Wayne: National Committee for Clinical Laboratory Standards; 2000. [ Links ]
10. Pfaller M, Sagreti J. Overview of the epidemiological profile and laboratory detection of extended spectrum ß-lactamasas. Clin Infect Dis. 2006;42:S153-63. [ Links ]
11. Máttar S, Martínez P. Emergencia de la resistencia antibiótica debida a las ß-lactamasas de espectro extendido (BLEE): detección, impacto clínico y epidemiología. Infectio. 2007;11:23-35. [ Links ]
12. Ramphal R, Ambrose P. Extended-spectrum ß-lactamases and clinical outcomes: current data. Clin Infect Dis. 2006;42:S164-72. [ Links ]
13. Winokur P, Canton R, Casellas J, Legakis N. Variations in the prevalence of strains expressing an extended-spectrum beta-lactamase phenotype of isolates from Europe the Americas and the Western Pacific Region. Clin Infect Dis. 2001;32(Suppl.2):S94-105. [ Links ]
14. Mendes C, Rossi A, Prado V, Zurita J, Robledo J, Guzman M, et al. Comparative evaluation of the susceptibility to the antimicrobials of Escherichia coli, Klebsiella pneumoniae, Salmonella and Shiguella isolates from clinical specimens in Latin-America. The Resisnet Group. Summaries, IDSA 37 Annual Meeting, Philadelphia, PA; 1999. p. 57 Abstract 99. [ Links ]
15. Villegas M, Correa A, Pérez F, Miranda M, Zuluaga T, Quinn J. Colombian Nosocomial Resistance Study Group. Prevalence and characterization of extended-spectrum beta-lactamases in Klebsiella pneumoniae and Escherichia coli isolates from Colombian hospitals. Diagn Microbiol Infect Dis. 2004;49:217-22. [ Links ]
16. Martínez P, Mercado M, Máttar S. Determinación de ß-lactamasas de espectro extendido en gérmenes nosocomiales del Hospital San Jerónimo, Montería. Colomb Med. 2003;34:130-9. [ Links ]
17. Villanueva A, Martínez P, Máttar S, Urbina D. Prevalencia de ß-lactamasas de espectro extendido (BLEE) en el Hospital San Jerónimo de Montería y la Clínica General del Norte de Barranquilla. Infectio. 2003;7:103. [ Links ]
18. Villegas MV. Epidemiology of nosocomial Gram (-) bacteria in Colombia: an update. 3rd International Symposium on Antimicrobial Resistance, Cartagena; 2004. [ Links ]
19. Bhavnani S, Hammel J, Forrest A, Jones R, Ambrose P. Relationships between patient- and institution-specific variables and decreased antimicrobial susceptibility of gram-negative pathogens. Clin Infect Dis. 2003;37:344-50. [ Links ]
20. Cosgrove S, Carmeli Y. The impact of antimicrobial resistance on health and economic outcomes. Clin Infect Dis. 2003;36:1433-7. [ Links ]
21. Paterson D. Outcome of cephalosporin treatment for serious infections due to apparently susceptible organisms producing extended spectrum ß-lactamases. Implications for the clinical microbiology laboratory. J Clin Microbiol. 2001;39:2206-12. [ Links ]
22. Rahal J, Urban C, Horn D, Freeman K, Segal S, Maurer J, et al. Class restriction of cephalosporin use to control total cephalosporin resistance in nosocomial Klebsiella. JAMA. 1998;280:1233-7. [ Links ]
23. Petros A, O´Connell M, Roberts C, Wade P, Hendrick K, Sacne V. Systemic antibiotics fail to clear multi-drug resistant Klebsiella pneumoniae from a pediatric ICU. Chest. 2001;119:862-6.
[ Links ]24. Owens R, Rice L. Hospital-based strategies for combating resistance. Clin Infect Dis. 2006;42:S173-81. [ Links ]














