Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Infectio
Print version ISSN 0123-9392
Infect. vol.12 no.4 Bogotá Oct./Dec. 2008
Artículo original
1 Universidad Industrial de Santander, Grupo de Epidemiología Clínica, Bucaramanga, Colombia
Fecha de recepción: 22/5/2008 Fecha de aceptación: 24/11/2008
Resumen
El dengue es la enfermedad ocasionada por un arbovirus de mayor incidencia en el mundo y su impacto económico sobre la productividad de los países afectados es muy importante. Sin embargo, hasta el momento no existe una terapia específica para la enfermedad y hay muy pocos estudios sobre el tema.
Esta revisión pretende recopilar los resultados de los trabajos originales que existen en la literatura sobre las intervenciones utilizadas en humanos para el tratamiento del dengue durante la etapa aguda de la enfermedad. Se abordaron los siguientes temas: reemplazo de líquidos, antipiréticos, tratamiento de las hemorragias, tratamiento de la trombocitopenia, uso de corticoides y otras medidas terapéuticas.
Palabras clave: dengue, tratamiento, fármacos, corticoides, hemorragias, choque.
Abstract
Dengue is the disease caused by arbovirus of greater incidence in the world and its economic impact on the productivity of the affected countries is very important. Nevertheless, until the moment there is not any specific therapy for this disease and there are very few studies on the subject. This review compiles the results of the original studies that exist in literature about medicine interventions in humans to treat dengue during the acute phase of the disease. The following topics were included: fluid replacement, antipyretics, treatment of bleeding, treatment of thrombocytopenia, use of corticoids and other therapeutic interventions.
Key words: Dengue, shock, treatment, drugs, hemorrhage.
Introducción
El dengue es la enfermedad ocasionada por un arbovirus de mayor incidencia en el mundo; cerca de la mitad de la población mundial vive en países donde es endémico y se estima que anualmente ocurren, aproximadamente, 100 millones de casos de dengue (1,2).
En nuestro país, el dengue es una enfermedad endemo-epidémica (3,4). Entre los años 2004 y 2006, Colombia fue el país de América con más casos de dengue hemorrágico y muertes por esta causa (4). Asimismo, Santander ha estado en los últimos años entre los cinco departamentos más afectados del país, con tasas de hasta 268,73 casos por 100.000 habitantes, y en el 2001 reportó la mayor mortalidad en Colombia. De igual forma, Bucaramanga, Girón, Floridablanca y Piedecuesta (área metropolitana de Bucaramanga) son cuatro de los trece municipios hiperendémicos del país (3,5).
El espectro de la infección por el virus del dengue incluye desde casos asintomáticos (52% de las infecciones) (6) hasta su complicación más grave, el síndrome de choque por dengue, que tiene una alta mortalidad. En los casos sintomáticos, el dengue suele cursar como un síndrome febril autolimitado, acompañado de cefalea, malestar general, artralgia, mialgias, dolor retroocular y exantema, que puede durar entre 2 y 10 días; en algunas ocasiones puede acompañarse de hemorragias espontáneas o prueba de torniquete positiva. También, la infección puede producir trombocitopenia, leucopenia y alteración de las enzimas hepáticas (ALAT y ASAT), entre otros (7).
El impacto económico del dengue sobre la productividad de los países afectados es muy importante. Esta enfermedad produce pérdidas tan grandes como las ocasionadas por otras enfermedades tropicales como tuberculosis, poliomielitis, tétanos, enfermedad de Chagas, leishmaniasis, hepatitis y paludismo, entre otras (8-10).
Por ejemplo, en Tailandia durante el año 2001 se estimaron 427 años de vida perdidos por discapacidad (AVPD) (disability-adjusted live year, DALY) por millón de habitantes. En Puerto Rico entre 1984 y 1994, el dengue causó en promedio 658 DALY por año y por millón de habitantes, con un máximo estimado durante el año 1994 de 2.153 DALY/millón de habitantes. Además, se observó que la carga más importante de la enfermedad era generada por el dengue clásico (8-10).
Actualmente, el tratamiento recomendado por la Organización Mundial de la Salud (OMS) consiste en el manejo de los síntomas y medidas de soporte, que incluyen el control de la fiebre con acetaminofén, la hidratación oral o endovenosa si se requiere, reposo, vigilancia médica y, en casos de sangrado masivo y coagulopatía, transfusión de plaquetas o plasma fresco congelado (11).
Sin embargo, hasta el momento no se encuentra disponible una terapia antiviral específica para la enfermedad ni se tienen medidas terapéuticas que disminuyan las complicaciones del dengue. Consecuentemente, el objetivo del presente artículo es revisar los trabajos originales publicados sobre el tratamiento del dengue durante la fase aguda de la enfermedad.
Búsqueda
La búsqueda está actualizada hasta el 11 de noviembre de 2008.
Para la revisión se realizó una búsqueda en PubMed empleando la siguiente combinación de términos: “Dengue AND (treatment OR management OR drugs OR methylprednisolone OR prednisolone OR steroids OR NSAIDs OR acetaminophen) not vaccine”; Limits: Clinical Trial, Meta-Analysis, Practice Guideline, Randomized Controlled Trial. Se obtuvieron 34 referencias, de las cuales, 14 no correspondían al objetivo de la revisión (5 de manejo del vector, 2 sobre sintomatología, 1 estudio de costos de la enfermedad, 1 estudio de comportamientos de búsqueda de asistencia médica, 2 de respuesta inmune, 1 de bioterrorismo, 1 de evaluación de la IgM para dengue, 1 de tratamiento en sepsis) y 2 fueron excluidas (1 artículo de tratamiento homeopático donde sólo se confirmó el dengue en tres casos, 1 revisión sobre el uso del factor VII recombinante).
También, se buscó en la base de datos Scielo bajo los términos dengue and (tratamiento or manejo or drogas or medicamentos or esteroides or corticoides or AINES or acetaminofén). Se encontraron 5 referencias, pero ninguna correspondía al objetivo del estudio (3 de control de vectores, 1 de seroprevalencia y 1 de perspectiva de la vacuna).
Además, se realizó una búsqueda en la base Bireme con los términos dengue and tratamiento con article como tipo de estudio. Se encontraron 94 referencias, de las cuales, 81 no correspondían al objetivo del estudio y 10 estaban incluidas en la búsqueda en PubMed.
En total se revisaron 23 referencias, 21 encontradas en las bases de datos y dos referencias adicionales conocidas por el autor (referencias 12 y 30). Se excluyeron los artículos que, habiendo estado en la búsqueda, no evaluaban ningún tipo de intervención (no correspondían al objetivo del estudio), no presentaban datos originales (revisiones sobre tratamiento), eran reporte de casos tratados por una complicación en la fase convaleciente del dengue y en los que no confirmaban la infección por dengue.
A continuación se aborda el tema agrupando los artículos encontrados en los siguientes seis tópicos: reemplazo de líquidos, antipiréticos, tratamiento de las hemorragias, tratamiento de la trombocitopenia, uso de corticoides y, por último, otras medidas terapéuticas que se han evaluado en pacientes con dengue.
Reemplazo de líquidos
Uno de los dos pilares en el tratamiento del dengue es el reemplazo de los líquidos, pues la fiebre, la anorexia y el vómito que se presentan durante la etapa aguda del dengue generan deshidratación. Algunas veces esta situación se empeora con el incremento de la permeabilidad vascular que ocurre en el dengue hemorrágico o en el síndrome de choque por dengue (11).
Con respecto a este tema, se reportan en la literatura cuatro artículos. El primero es un estudio de corte transversal realizado en Nicaragua, en pacientes con dengue de manejo médico ambulatorio u hospitalario, en el cual se encontró que la ingestión de más de cinco vasos de cualquier tipo de líquido durante las 24 horas previas a la consulta estuvo asociada a menor hospitalización, con un OR ajustado por la distancia para acceder a asistencia médica, el día de inicio de los síntomas y la trombocitopenia, de 0,19 (IC 95% 0,09-0,39) en menores de 15 años y de 0,2 (IC 95% 0,070,57) en mayores de 15 años (12).
Los tres estudios adicionales reportados en la literatura son ensayos clínicos de líquidos endovenosos con doble enmascaramiento, realizados en población pediátrica de Vietnam por el mismo grupo de investigación. No se encontraron en la literatura ensayos clínicos con líquidos endovenosos en población adulta.
El primer ensayo con líquidos endovenosos se realizó en 55 niños entre los 5 y 15 años con síndrome de choque por dengue (presión de pulso ≤20 mm Hg) hospitalizados en la unidad de cuidados intensivos. Se compararon, administrados a 20 ml/kg en la primera hora y seguido por 10 ml/kg en la segunda hora, el dextrán 70, el gelafundín (gelatina al 3%), el lactado de Ringer y la solución salina normal, y se encontró que el dextran se asoció con una más rápida normalización del hematocrito al compararlo con los otros tres, al igual que la restauración del índice cardiaco (L/min/m2) al compararlo con lactato de Ringer.
Cuando se compararon los cristaloides con los coloides, estos últimos mostraron un aumento significativamente mayor de la presión de pulso, la presión sistólica y diastólica, y el índice cardiaco; y una mayor disminución del hematocrito. Sin embargo, durante el seguimiento no hubo diferencias entre estos dos grupos, en el número o las horas del choque ni en la necesidad de más líquidos endovenosos, así como tampoco en las variables hematológicas o el sangrado (13).
El segundo estudio comparó cuatro soluciones endovenosas en la primera hora de resucitación a una dosis de 20 ml/kg (dextrán 70, gelatina al 3%, lactado de Ringer o solución salina normal) en 222 pacientes entre 1 y 15 años de edad con dengue hemorrágico grado II,I atendidos en la unidad de cuidado intensivo. Se encontró que la principal variable de confusión fue la presencia de una presión de pulso ≤10 mm Hg, que se asoció con un aumento en el riesgo de no recuperación del choque en la primera hora de tratamiento (OR 9,7; IC 95% 3,4-27,7), de desarrollar nuevamente choque y de requerir dextrán después de la primera hora de tratamiento, así como a un mayor volumen de dextrán utilizado (14).
En este estudio, el lactato de Ringer mostró el periodo más largo para la recuperación de la presión de pulso (mediana 0,75 horas, p=0,03), tuvo el mayor porcentaje de pacientes que se demoraron más de una hora para normalizar este parámetro (p=0,022) y, al compararlo con la gelatina, presentó para este desenlace un OR de 5,7 (IC 95% 1,4-23,6) ajustado por la presión de pulso al ingreso ≤10 mm Hg (14).
Al comparar los cristaloides con los coloides no se evidenciaron diferencias en el grupo que tenían una presión de pulso >10 mm Hg, pero en el grupo de ≤10 mm Hg encontraron que los pacientes tratados con cristaloides se demoraban más en recuperar la presión de pulso (mediana: 1 hora, rango: 0,25-7) que aquéllos que recibieron coloides (0,75 por hora, rango de 0,25-2, p=0,01). También reportaron que el porcentaje de pacientes que demoraron más de una hora en recuperar la presión de pulso fue mayor en el grupo de cristaloides (40% y 9,5%, respectivamente, p=0,037) (14).
Sin embargo, cabe anotar que durante este estudio se presentaron seis reacciones alérgicas, todas en el grupo de pacientes tratados con coloides (5 del grupo del gelafundín y 1 del dextrán). Con respecto a la necesidad de furosemida, no hubo diferencia entre los cuatro grupos de tratamiento (14).
El tercer estudio se llevó a cabo en niños entre los 2 y los 15 años con síndrome moderado de choque por dengue (383 en el grupo 1: >10 y ≤20 mm Hg) o grave (129 en el grupo 2: ≤10 mm Hg). En el primer grupo se comparó el lactato de Ringer con dos coloides, dextran e hidroxietil (starch 200/0,5), y en el grupo grave sólo se intervinieron los pacientes con uno de los coloides (15).
En este estudio no se encontraron diferencias entre los tratamientos en cuanto a la necesidad de utilización de coloides como medida de rescate en ninguno de los dos grupos y, aunque los pacientes que recibieron lactato de Ringer se demoraron más tiempo en iniciar la estabilidad cardiovascular, finalmente esta diferencia no fue significativa (15).
En la categoría de choque moderado se encontró diferencia en la mediana del porcentaje de reducción del hematocrito; el lactato de Ringer presentó 9% de disminución en comparación con 22% del starch y 25% del dextrán (p<0,001). Sin embargo, el grupo de pacientes tratados con coloides presentó un nuevo aumento del hematocrito entre 2 y 6 horas después del tratamiento (mediana de 5% comparado con 0% en el grupo de lactato, p<0,001) (15).
Además, reportaron una diferencia en la frecuencia de reacciones alérgicas; los pacientes tratados con dextrán presentaron más reacciones que los del grupo de starch (p<0,001, grupo1, y p=0,03, grupo 2) (15).
En síntesis, la evidencia sugiere que en los pacientes ambulatorios se debe prescribir el consumo de más de cinco vasos de líquido al día para disminuir la probabilidad de hospitalización. Asimismo, que la utilización de coloides en el manejo inicial en menores de 15 años con síndrome de choque por dengue y presión de pulso ≤10 mm Hg, genera una recuperación más rápida del estado de choque. No obstante, se debe tener en cuenta que esta medida puede generar reacciones alérgicas y que no ha tenido impacto sobre la mortalidad.
En pacientes con choque y presión de pulso >10 mm Hg, el manejo inicial con cristaloides es la opción más adecuada.
Antipiréticos y antiinflamatorios no esteroideos (AINE)
El otro pilar del tratamiento del dengue son los antipiréticos-analgésicos; esto se debe a que la fiebre, la cefalea, las mialgias, las artralgias y el dolor retroocular son los síntomas más frecuentes de la enfermedad (72% a 97%) (16).
Paradójicamente, aunque la OMS recomienda no utilizar AINE o ASA porque debido a su mecanismo de acción podrían causar gastritis, sangrado, acidosis o precipitar el síndrome de Reye, y aunque también el acetaminofén es el único antipirético recomendado para el manejo del dengue, no hay estudios publicados que comparen su efectividad para disminuir los síntomas o que evalúen los efectos adversos que se puedan desarrollar.
Sólo se encontró un estudio de cohorte prospectiva que evaluó el uso de la dipirona en 110 pacientes con dengue. Los autores reportan que la administración de este medicamento (intramuscular o intravenoso) en las primeras 96 horas de enfermedad se asoció con un aumento del riesgo de desarrollar dengue hemorrágico (RR=7,29; IC95% 1,79-29,34) y que los pacientes tratados con dipirona presentaron un recuento de plaquetas significativamente menor (diferencia promedio: 40.110 plaquetas/mm3; IC95% 1.597-78,624/mm3, p=0,04). Además, en este estudio no se encontró asociación entre el riesgo de desarrollar dengue hemorrágico y el uso previo de diclofenaco (RR=0,67; IC95% 0,14-3,31) o ibuprofeno (RR=0, p=0,26) (17).
Tratamiento de hemorragias
Las hemorragias espontáneas son uno de los signos de alarma por los cuales un paciente debe consultar inmediatamente (11,16). Al respecto, en dos estudios en Tailandia se evaluó el uso del factor VII recombinante activado para controlar el sangrado en niños con dengue grave.
En el primero, un reporte de casos de 15 niños con síndrome de choque por dengue y sangrado activo tratados con el factor, se encontró una respuesta favorable en 53,3% de los casos, pero estos pacientes también se habían manejado con hemoderivados (18). El otro estudio fue un ensayo clínico controlado, doble ciego, en el que se intervinieron 28 niños con dengue hemorrágico, sangrado activo y necesidad de tratamiento con hemoderivados (18 con el factor y 10 con placebo). Se observó resolución del sangrado a las 2 horas después del tratamiento en 75% de los pacientes tratados con el factor, en contraposición a 44,4% del grupo placebo. Sin embargo, la eficacia para el control del sangrado a las 6, 12 y 24 horas después del tratamiento, no mostró diferencia estadísticamente significativa entre los dos grupos. Tampoco hubo diferencia en la cantidad de hemoderivados que se transfundieron (19).
Tratamiento de la trombocitopenia
Sobre este tema se encontraron cuatro estudios. El primero, uno retrospectivo que evaluó el papel de la transfusión de plaquetas en pacientes pediátricos con dengue hemorrágico y recuentos plaquetarios menores de 20.000/ mm3. En éste no se evidenció diferencia en la mortalidad entre los pacientes que recibieron plaquetas (n=18) y el grupo que no fue transfundido (n=19) (OR=3,6; IC95% 0,25 -199,25) (20).
En el segundo y el tercer estudios se evaluó el efecto de inmunoglobulina sobre el recuento plaquetario en pacientes con dengue. Uno de ellos es un análisis interino de dos ensayos clínicos aleatorios que comparan la globulina inmune anti-D endovenosa (250 IU/kg) contra el placebo. En un grupo de 24 pacientes con dengue hemorrágico y con trombocitopenia grave (plaquetas ≤50.000/mm3), se encontró que el aumento del recuento plaquetario a las 48 horas fue mayor en el grupo de la globulina (91.500/mm3) que en el grupo con placebo (69.333/mm3). De igual forma, en 75% de los pacientes tratados con la globulina se aumentaron, a las 48 horas después del tratamiento, al menos 20.000 plaquetas/mm3, en comparación con 58% en el grupo placebo (21).
En el otro grupo de 23 pacientes con recuentos plaquetarios >50.000 y ≤100.000 plaquetas/mm3, no se encontraron diferencias en los promedios de plaquetas a las 48 horas después del tratamiento (147.308 plaquetas/mm3 en el grupo de globulina y 158.400 plaquetas/mm3 en el grupo placebo), ni en el porcentaje de respuesta, 92% y 90%, respectivamente (21).
En el otro ensayo publicado sobre el tema se evaluó la aplicación de inmunoglobulina endovenosa a dosis diarias de 0,4 g/kg durante tres días, comparada con placebo en 31 pacientes con infección secundaria por dengue y trombocitopenia (20.000 a 80.000 plaquetas/ mm3). En este trabajo no se encontraron diferencias en los recuentos plaquetarios posteriores al tratamiento, en la duración de la trombocitopenia ni en los niveles de anticuerpos antiplaquetarios (22).
Recientemente, en un ensayo clínico aleatorio se evaluó, en 109 pacientes con dengue y recuentos plaquetarios menores de 40.000 mm3, el uso de 600 ml de plasma fresco con-gelado comparado con solución salina normal en infusión durante 90 minutos. Aunque a las 12 horas después del tratamiento el promedio del recuento plaquetario fue mayor en el grupo de plasma fresco congelado, el efecto no se mantuvo a las 24 y 48 horas (23).
En resumen, los datos encontrados sugieren que la transfusión de hemoderivados y el uso de inmunoglobulina tienen un efecto temporal a muy corto plazo sobre el recuento de plaquetas. Sin embargo, es un tema potencial de investigación pues, debido a los pequeños tamaños de muestra de estos estudios, no se ha evaluado el potencial efecto que podrían tener sobre el sangrado, el choque y la mortalidad, especialmente en el caso de la inmunoglobulina.
Uso de corticoides en dengue
La respuesta inflamatoria mediada por células T y la inmunopotenciación generada por anticuerpos contra el virus del dengue hacen parte de los mecanismos por los cuales, tras la infección viral, se desarrollan las complicaciones más importantes: dengue hemorrágico, síndrome de choque por dengue y muerte (24). Por lo anterior, teniendo en cuenta la acción inmunomoduladora de los corticoides, desde 1975 se han adelantado estudios para evaluar su utilidad en el manejo de los pacientes con dengue grave.
Uno de los artículos encontrados fue un reporte de caso en Malasia, de un paciente con dengue hemorrágico y trombocitopenia prolongada que respondió al manejo con prednisolona oral (25). Sin embargo, recientemente se publicó un metanálisis sobre el uso de corticoides en el tratamiento del síndrome de choque por dengue (26). Éste incluyó 4 ensayos clínicos realizados en población pediátrica (27-30) (tabla 1). En el estudio no se encontró disminución de la mortalidad (RR=0,68; IC95% 0,42-1,11), de la necesidad de transfusiones (RR=1,08; IC95% 0,52-2,24), de las complicaciones (RR=6,79; IC95% 0,36-126,24) ni de los días de hospitalización (RR=1,1; IC95% -1,83-4,03), en los pacientes tratados con corticoides comparados con aquéllos con placebo.
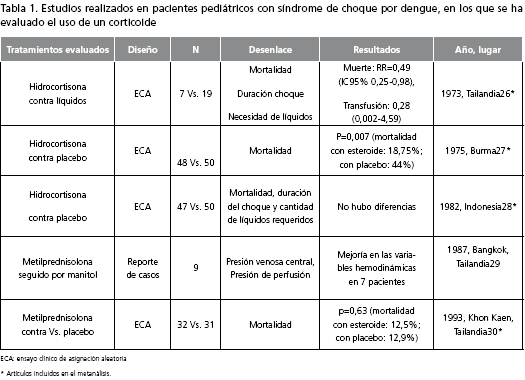
Asimismo, sus autores recomiendan que no se utilicen los corticoides en pacientes con dengue, a menos que se haga bajo el contexto de un ensayo clínico (25). No se encontraron publicaciones de ensayos clínicos con corticoides en dengue, posterior a este metanálisis.
Otras medidas evaluadas
Otras medidas de soporte, como el oxígeno y el carbazocromo, también se han evaluado en pacientes con complicaciones por dengue.
En un estudio en niños con dengue hemorrágico se observó disminución de la frecuencia respiratoria como resultado del soporte con oxígeno (31). Asimismo, en un ensayo clínico aleatorio en niños con síndrome de choque por dengue y falla respiratoria, se comparó la administración de oxígeno por dos sistemas: máscara (6 a 8 L/minuto) y cánula nasal con presión positiva continua (presión de 6 cm de agua y FiO2 de 60%). Después de 30 minutos de tratamiento, se encontró aumento de la saturación de oxígeno en ambos grupos y disminución de la frecuencia respiratoria en el grupo con cánula (p<0,05) (32).
Otra intervención probada en ensayos clínicos aleatorios ha sido el sulfonato de carbazocromo de sodio (AC-17) endovenoso, cuyo mecanismo de acción se pensaba disminuiría la extravasación plasmática capilar. En un primer estudio con 77 pacientes con dengue hemorrágico grado II, 38 asignados al medicamento y 39 al grupo placebo, se observó diferencia en la presencia de derrame pleural (33). Pero, en un ensayo clínico posterior, en 95 niños con dengue hemorrágico o síndrome de choque por dengue (45 con AC-17 y 50 con vitamina B como placebo), no se encontraron diferencias estadísticamente significativas para la presencia de choque (4/45 Vs. 3/50, p=0,44) o derrame pleural (33,3% Vs. 30%, p=0,89) y tampoco, en la intensidad del derrame ni en los días de hospitalización (34).
Por otra parte, en la búsqueda se encontró una correspondencia que hace referencia a 4 casos pediátricos de dengue hemorrágico con choque tratados con desmopresina en infusión por 30 minutos (0,3 µg/kg diarios por 3 días) quienes presentaron una menor necesidad de líquidos para el manejo del choque y para el mantenimiento. También, comentan los autores que, de una serie de 19 casos con dengue hemorrágico grado III o IV, 1 niño de 16 tratados con este medicamento murió, mientras que 2 niños de los 3 no tratados murieron (35). Sin embargo, se debe tener en cuenta que no hay un número suficiente de pacientes y que no es un ensayo clínico; por lo tanto, no se puede recomendar su uso rutinario hasta que exista mejor evidencia que lo apoye.
Conclusión
A pesar de la gran carga producida por la morbimortalidad por dengue, pocos estudios han tratado de establecer la utilidad de algunas intervenciones sobre la enfermedad, lo que se ha traducido en la actual inexistencia de una terapia específica contra este virus.
Aunque es posible que existan otros estudios que no fueron captados en la búsqueda bajo las palabras utilizadas, de acuerdo con la evidencia encontrada, en la etapa temprana de la enfermedad cuando aún no se han presentado las complicaciones, se debe evitar el uso de la dipirona como analgésico y se debe recomendar al paciente el consumo de, al menos, cinco de vasos de líquido al día.
En cuanto al manejo del choque, se ha demostrado que en la población pediátrica (menores de 15 años) la presión de pulso es el principal factor asociado con la respuesta al tratamiento con líquidos endovenosos. Por lo anterior, en aquellos pacientes con presión de pulso menor o igual a 10 mm Hg, la utilización de un coloide podría ser la primera opción debido a que hay una recuperación más rápida del choque; aunque, en lugares donde no esté disponible este recurso, podría utilizarse el cristaloide pues la evidencia no ha mostrado diferencias en la mortalidad.
Por otro lado, en aquellos pacientes con presión de pulso >10 mm Hg, la reanimación puede iniciarse con cristaloides, pues no se ha evidenciado que el uso de coloides tenga beneficios adicionales. Cabe resaltar que no se encontraron ensayos clínicos que evalúen el reemplazo de líquidos en adultos; por tal motivo, éste es un amplio campo de investigación para los países donde el dengue es endémico.
Finalmente, no existen resultados suficientes para incorporar otras medidas, como el uso de corticoides, de hemoderivados o de factores de coagulación, en el manejo estándar del paciente con dengue. Sin embargo, suponen una perspectiva de investigación puesto que, al no contar aún con una vacuna efectiva, la búsqueda de alternativas terapéuticas para el manejo de la enfermedad y la prevención de sus complicaciones se convierte en una prioridad de estudio en dengue.
Agradecimientos
A Luis Angel Villar, profesor titular de la Escuela de Medicina de la Universidad Industrial de Santander, por su orientación en esta línea de trabajo.
Correspondencia: Carrera 32 Nº 29-31, oficina 304, Centro de Investigaciones Epidemiológicas, Facultad de Salud, Universidad Industrial de Santander, La Aurora, Bucaramanga. rutharam@yahoo.com
Referencias
1. Guha-Sapir D, Schimmer B. Dengue fever: new paradigms for a changing epidemiology. Emerg Themes Epidemiol. 2005;2:1. [ Links ]
2. Stephenson JR. The problem with dengue. Trans R Soc Trop Med Hyg. 2005; 99: 643-6. [ Links ]
3. SIVIGILA. Enfermedades de notificación obligatoria. Informe primer semestre de 2003. Boletín Epidemiológico Semanal. Semana epidemiológica No. 26. junio 22-28 de 2003. Disponible en: http://www.col.ops-oms.org/sivigila/2002/BOLE02_02.pdf [ Links ]
4. Pan American Health Organization. 2004: number of reported cases of dengue & dengue hemorrhagic fever (DHF), Region of the Americas (by country and subregion). last update: 1 June 2005. Disponible en: http://www.paho.org/English/ad/dpc/cd/dengue.htm [ Links ]
5. SIVIGILA. Comportamiento por regiones del dengue en el 2001. Boletín Epidemiológico Semanal. Semana epidemiológica No. 2. Enero 6 a 12 de 2002. Disponible en: http://www.col.ops-oms.org/sivigila/2002/BOLE02_02.pdf [ Links ]
6. Endy T, Chunsuttiwat S, Nisalak A, Lebraty D, Green S, Rothman A, et al. Epidemiology of inapparent and symptomatic acute dengue virus infection: A prospective study of primary school children in Kamphaeng Phet, Thailand. Am J Epidemiol. 2002;156:40-50. [ Links ]
7. Díaz FA, Martínez RA, Villar LA. Criterios clínicos para diagnosticar el dengue en los primeros días de enfermedad. Biomédica. 2006;26:22-30. [ Links ]
8. Clark DV, Mammen MP Jr, Nisalak A, Puthimethee V, Endy TP. Economic impact of dengue fever/dengue hemorrhagic fe-ver in Thailand at the family and population levels. Am J Trop Med Hyg. 2005;72:786-91. [ Links ]
9. Cho-Min-Naing. Assessment of dengue hemorrhagic fe-ver in Myanmar. Southeast Asian J Trop Med Public Health. 2000;31:636-41. [ Links ]
10. Meltzer MI, Rigau-Perez JG, Clark GG, Reiter P, Gubler DJ. Using disability-adjusted life years to assess the economic impact of dengue in Puerto Rico: 1984-1994. Am J Trop Med Hyg. 1998;59:265-71. [ Links ]
11. Organización Panamericana de la Salud. Dengue y dengue hemorrágico en las Américas: guías para su prevención y control. Publicación Científica 548. Washington, D.C.: Organización Panamericana de la Salud; 1995. p. 100. [ Links ]
12. Harris E, Perez L, Phares CR, Perez Mde L, Idiaquez W, Rocha J, et al. Fluid intake and decreased risk for hospitalization for dengue fever, Nicaragua. Emerg Infect Dis. 2003;9:1003-6. [ Links ]
13. Dung NM, Day NP, Tam DT, Loan HT, Chau HT, Minh LN, et al. Fluid replacement in dengue shock syndrome: a randomized, double-blind comparison of four intravenous-fluid regimens. Clin Infect Dis. 1999;29:787-94. [ Links ]
14. Ngo NT, Cao XT, Kneen R, Wills B, Nguyen VM, Nguyen TQ, et a . Acute management of dengue shock syndrome: a randomized double-blind comparison of 4 intravenous fluid regimens in the first hour. Clin Infect Dis. 2001;32:204-13. [ Links ]
15. Wills BA, Nguyen MD, Ha TL, Dong TH, Tran TN, Le TT, et al. Comparison of three fluid solutions for resuscitation in dengue shock syndrome. N Engl J Med. 2005;353:877-89. [ Links ]
16. Martínez RA, Díaz FA, Villar LA. Evaluación de la definición clínica de dengue sugerida por la Organización Mundial de la Salud. Biomédica. 2005;25:412-6. [ Links ]
17. Díaz-Quijano FA, Villar-Centeno LA, Martínez-Vega RA. Efecto de la administración temprana de dipirona sobre la gravedad del dengue en una cohorte prospectiva. Enferm Infecc Microbiol Clin. 2005;23:593-7. [ Links ]
18. Chuansumrit A, Tangnararatchakit K, Lektakul Y, Pongthanapisith V, Nimjaroenniyom N, Thanarattanakorn P, et al. The use of recombinant activated factor VII for controlling lifethreatening bleeding in dengue shock syndrome. Blood Coagul Fibrinolysis. 2004;15:335-42. [ Links ]
19. Chuansumrit A, Wangruangsatid S, Lektrakul Y, Chua MN, Zeta Capeding MR, Bech OM; Dengue Study Group. Control of bleeding in children with dengue hemorrhagic fever using recombinant activated factor VII: a randomized, doubleblind, placebo-controlled study. Blood Coagul Fibrinolysis. 2005;16:549-55. [ Links ]
20. Kabra SK, Jain Y, Madhulika, Tripathi P, Singhal T, Broor S, et al. Role of platelet transfusion in dengue hemorrhagic fever. Indian Pediatr. 1998;35:452-5. [ Links ]
21. De Castro RA, de Castro JA, Barez MY, Frias MV, Dixit J, Genereux M. Thrombocytopenia associated with dengue hemorrhagic fever responds to intravenous administration of anti-D (Rh(0)-D) immune globulin. Am J Trop Med Hyg. 2007;76:737-42. [ Links ]
22. Dimaano EM, Saito M, Honda S, Miranda EA, Alonzo MT, Valerio MD, et al. Lack of efficacy of high-dose intravenous immunoglobulin treatment of severe thrombocytopenia in patients with secondary dengue virus infection. Am J Trop Med Hyg. 2007;77:1135-8. [ Links ]
23. Sellahewa KH, Samaraweera N, Thusita KP, Fernando JL. Is fresh frozen plasma effective for thrombocytopenia in adults with dengue fever? A prospective randomised double blind controlled study. Ceylon Med J. 2008;53:36-40. [ Links ]
24. Stephenson J. Understanding dengue pathogenesis: implications for vaccine design. Bulletin of the World Health Organization. 2005;83:308-14. [ Links ]
25. Leong KW, Srinivas P. Corticosteroid-responsive prolonged thrombocytopenia following dengue haemorrhagic fever. Med J Malaysia. 1993;48:369-72. [ Links ]
26. Panpanich R, Sornchai P, Kanjanaratanakorn K. Corticosteroids for treating dengue shock syndrome. Cochrane Database Syst Rev. 2006;3:CD003488. [ Links ]
27. Min M, U T, Aye M, Shwe TN, Swe T. Hydrocortisone in the management of dengue shock syndrome. Southeast Asian J Trop Med Public Health. 1975;6:573-9. [ Links ]
28. Sumarmo SP, Talogo W, Asrin A, Isnuhandojo B, Sahudi A. Failure of hydrocortisone to affect outcome in dengue shock syndrome. Pediatrics. 1982;69:45-9. [ Links ]
29. Sumarmo. The role of steroids in dengue shock syndrome. Southeast Asian J Trop Med Public Health. 1987;18:383-9. [ Links ]
30. Tassniyom S, Vasanawathana S, Chirawatkul A. Failure of high-dose methylprednisolone in established dengue shock syndrome: a placebo-controlled, double-blind study. Pediatrics. 1993;92:111. [ Links ]
31. Kasim YA, Anky Tri Rini KE, Sumarmo SP. Hyperventilation in children with dengue hemorrhagic fever (DHF). Paediatr In-dones. 1991;31:245-52. [ Links ]
32. Cam BV, Tuan DT, Fonsmark L, Poulsen A, Tien NM, Tuan HM, et al. Randomized comparison of oxygen mask treatment Vs. nasal continuous positive airway pressure in dengue shock syndrome with acute respiratory failure. J Trop Pediatr. 2002;48:335-9. [ Links ]
33. Funahara Y, Sumarmo SP, Shirahata A, Harun SR, Setiabudy-Dharma R, Nathin MA, et al. Protection against marked plasma leakage in dengue haemorrhagic fever by infusion of carbazochrome sodium sulfonate (AC-17). Southeast Asian J Trop Med Public Health. 1987;18:356-61. [ Links ]
34. Tassniyom S, Vasanawathana S, Dhiensiri T, Nisalak A, Chirawatkul A. Failure of carbazochrome sodium sulfonate (AC17) to prevent dengue vascular permeability or shock: a randomized, controlled trial. J Pediatr. 1997;131:525-8. [ Links ]
35. Pea L, Roda L, Moll F. Desmopressin treatment for a case of dengue hemorrhagic fever/dengue shock syndrome. Clin Infect Dis. 2001;33:1611-2. [ Links ]














