Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Infectio
Print version ISSN 0123-9392
Infect. vol.13 no.1 Bogotá Jan./Mar. 2009
1. Laboratorio de Ecología Microbiana de Alimentos, Departamento de Ciencias Biológicas, Universidad de los Andes, Bogotá, D.C., Colombia.
Recibido: 09/09/2008; Aceptado: 17/02/2009
Resumen
Introducción. Enterobacter sakazakii es un patógeno oportunista emergente de alto riesgo, responsable de meningitis grave y enterocolitis necrosante. El principal vehículo de transmisión de esta bacteria son los productos infantiles deshidratados, debido a su contaminación después del tratamiento térmico.
Objetivo. Identificar cepas de E. sakazakii en muestras de lactarios recolectadas en la ciudad de Bogotá, D.C.
Materiales y métodos. Se analizaron 222 muestras de 9 lactarios, de superficies estériles y no estériles, utensilios empleados para la preparación de biberones y operarios. Se realizó recuento de coliformes totales y detección de E. sakazakii utilizando el protocolo propuesto por la Food and Drug Administration y por el Sistema Automático Bax® Dupont Qualicon.
Resultados. De las 222 muestras recolectadas en las clínicas de Bogotá, se reportó que 27,4% (61) de las muestras analizadas presentaban coliformes totales; se detectó la presencia de E. sakazakii en 3,6% por el método automatizado de PCR BAX Dupont a partir de muestras de biberones y superficies.
Conclusiones. Se demostró la presencia de E. sakazakii en lactarios en Colombia. Debido a que este microorganismo es un patógeno oportunista de alto riesgo para neonatos y que está asociado a las prácticas higiénicas en los lactarios, la información de este estudio puede ser útil para la toma de medidas profilácticas que reduzcan el riesgo de contaminación con este patógeno para la población infantil y, también, aporta información importante para la salud pública.
Palabras clave: Enterobacter sakazakii, productos deshidratados de fórmula infantil, neonatos e infantes, coliformes totales, Bogotá, D.C.
Abstract
Introduction: Enterobacter sakazakii is an emergent opportunistic pathogen of high risk responsible of severe meningitis and necrotizing enterocolitis in neonates and infants with underlying medical conditions. One of the principal transmission vehicles for the transmission of these bacteria, is the infant dehydrated formula after exposing them to the heating treatment.
Objective: To identify strains of E. sakazakii in milk feeders samples from Bogotá.
Materials and methods: 222 samples from 9 milk feeders including sterile and non sterile surfaces, utensils used for the formula preparation and food handlers were analyzed. Total coliforms counts and identification of E. sakazakii was done using the FDA protocol and the automatic system Bax ® Dupont Qualicon.
Results: From de 222 samples collected from hospitals in Bogotá, it was reported that 27.4% (61) had total coliforms, and the presence of E. sakazakii was detected in 3.6% (8) from one feeding bottle and surfaces.
Conclusion: The presence of E. sakazakii strains was reported in Colombian milk feeders. Because this microorganism is a high risk opportunistic pathogen for newborn infants, usually associated with hygiene practices in milk feeders, the information of this research could be useful to develop preventive measurements to reduce the risk of contamination in the infant population and provides important public health information.
Key words: Enterobacter sakazakii, infant dehydrated formula products, milk feeders, neonates, total coliforms, Bogotá, D.C.
Introducción
Enterobacter sakazakii es un bacilo Gram negativo, aerobio facultativo y móvil, que hace parte de la familia Enterobacteriacea. Esta bacteria se conoció en 1980 como Enterobacter cloacae y, debido a las diferencias genéticas, hoy en día se denomina Enterobacter sakazakii (1). E. sakazakii produce enterotoxinas, aerobactinas y hemaglutininas; sin embargo, se desconoce su mecanismo de patogenicidad (2). En la actualidad, se considera un patógeno oportunista emergente de alto riesgo en salud pública a nivel mundial, el cual puede causar meningitis y enterocolitis necrosante, especialmente en neonatos e infantes de riesgo, con una mortalidad entre 20% y 50%; asimismo, puede generar secuelas de tipo neurológico (2).
Se ha reportado E. sakazakii como agente causal de meningitis en países como Suiza, España y Estados Unidos (3). Muytjens Simmons Et al., en 1983, identificaron a E. sakazakii como agente etiológico asociado a un brote ocurrido en Holanda, donde los utensilios empleados para la preparación de la fórmula infantil estuvieron implicados en su origen. De igual manera, se reportó en un estudio en el Hospital de Baltimore, Estados Unidos, en el cual los utensilios utilizados para la preparación de las fórmulas infantiles estaban contaminados con E. sakazakii; debido a esto el hospital tomó medidas de control con el fin de evitar la presencia de este microorganismo (3). En Latinoamérica, esta problemática está poco documentada. Por ejemplo, en Argentina recientemente se demostró la presencia de este microorganismo en productos infantiles deshidratados (4) y, en Colombia, no existe información disponible sobre su presencia en alimentos, debido a que no existen normas nacionales que exijan su búsqueda y vigilancia en alimentos; tampoco hay reportes epidemiológicos, ya que esta bacteria no es de notificación obligatoria (5). Este patógeno podría estar implicado en casos de meningitis y enterocolitis necrosante en nuestro medio; sin embargo, no se han realizado investigaciones en este tema y, por lo tanto, se desconoce su importancia en el sector clínico y de alimentos. Uno de los principales vehículos de transmisión de esta bacteria son los productos infantiles deshidratados debido a su contaminación después del tratamiento térmico, aunque cada vez es mayor el tipo de alimentos que se han identificado como vehículos de esta bacteria (3). Diversos estudios han descrito la correlación existente entre el consumo de fórmulas infantiles deshidratadas y la infección con E. sakazakii (2). Esta correlación ha sido sustentada por brotes ocurridos a nivel mundial. Por ejemplo, un estudio en Holanda encontró E. sakazakii en 23% de las muestras recolectadas en 9 industrias y hospitales. De igual manera, otros autores han encontrado este microorganismo en 24% de las muestras analizadas (6).
En la actualidad, debido a los brotes reportados de E. sakazakii en recién nacidos y a la dificultad de detección de esta bacteria, la Organización de las Naciones Unidas para la Agricultura y la Alimentación/Organización Mundial de la Salud (FAO/OMS) y la Comisión Técnica de Peligros Biológicos de la European Food Safety Authority (EFSA) emitieron un dictamen (Regulación 1441/2007) sobre las enterobacterias como indicadoras de E. sakazakii y Salmonella spp.; por lo tanto, se deroga el Regulación No. 2073/2005. En Colombia no hay referencias de búsqueda de E. sakazakii en lactarios, alimentos, ambientes y en formulas infantiles (7). Además, en nuestro país no se realizan recuentos de enterobacterias en las muestras de alimentos.
En Colombia no es obligatoria la notificación de E. sakazakii en pacientes con meningitis o enterocolitis necrosante (5). Por lo tanto, se desconoce la frecuencia de este patógeno en el país. En algunos casos de estas enfermedades no de determina el agente etiológico, ya que se han reportado más de 169 casos de meningitis en neonatos sin agente etiológico identificado, lo cual nos lleva a preguntarnos sobre la importancia de esta bacteria como agente de meningitis o de enterocolitis necrosante en niños en nuestro medio.
Por lo anterior, se hace necesario realizar un estudio exploratorio que aporte información que sirva de base para futuras investigaciones sobre esta problemática. El objetivo de este trabajo fue detectar la presencia de E. sakazakii en los lactarios de Bogotá, D.C., utilizando métodos de microbiología tradicional para el aislamiento e identificación de este microorganismo y el método automatizado BAX Dupont para determinar su presencia o ausencia. De igual manera y con el fin de tener un indicador de calidad higiénica en los lactarios, se realizó recuento de coliformes totales para evaluar las buenas prácticas de manufactura utilizadas en cada uno de ellos.
Mundialmente, E. sakazakii se determina siguiendo protocolos reconocidos de microbiología clásica, como los de la Food and Drug Administration (FDA), pero cada vez incursionan en el mundo científico nuevas herramientas para la detección de bacterias, como los métodos automatizados de PCR BAX de Dupont.
Materiales y métodos
Como controles positivos para la realización de este trabajo, se utilizaron la cepa de E. sakazakii (ATCC 29004), donada por A. Lehner y R. Sthepan, de la Universidad de Zurich, y la cepa E. sakazakii ATCC 51329, adquirida comercialmente en Annar, Diagnostica Import, Ltda. Las cepas se mantuvieron en agar nutritivo a 4°C y en glicerol al 50% a -70°C.
Se recolectaron 222 muestras de superficies de trabajo de lactarios, utensilios, manos de operarios y preparaciones de leche en polvo de 9 lactarios, 8 de Entidades Promotoras de Salud (EPS), ubicados en Bogotá, y un lactario de situado en las afueras de de la ciudad, entre julio y diciembre de 2006. Debido a que se trató de un estudio exploratorio, las muestras se tomaron al azar y en un número diferente en cada caso, como se puede observar en la tabla 1. Según el lactario y las condiciones de cada uno, la disponibilidad de las muestras fue diferente. Una vez tomadas, se,transportaron en 10 ml de agua con peptona bajo condiciones de refrigeración y se procesaron tan pronto como llegaron al laboratorio.
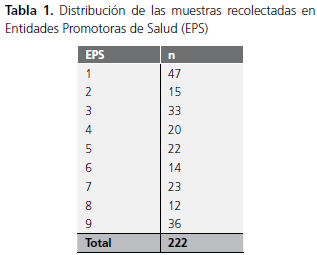
Recuento de coliformes totales en lactarios
Las muestras fueron homogenizadas en caldo de sulfato de lauril (Oxoid) e incubadas por 22 horas a 37°C. Posteriormente, y para evaluar la calidad microbiológica, se realizaron diluciones en agua con peptona (10-1 y 10-2), y se sembraron en agar violeta cristal rojo neutro bilis (VRBA, Oxoid), a 37°C por 24 horas. Se hizo el recuento de coliformes totales (7).
Aislamiento e identificacion de Enterobacter sakazakii en lactarios
Para el aislamiento y la identificación de E. sakazakii, se analizaron 222 muestras siguiendo el método microbiológico tradicional (FDA) (2), en el cual las muestras se enriquecieron en 90 ml de caldo de enriquecimiento para enterobacterias (EE, Oxoid) y se incubaron a 37°C por 24 horas. Las colonias sospechosas, es decir, las que fermentan la lactosa, se inocularon en agar VRBA (Oxoid). Además, para evidenciar la producción del pigmento amarillo, característica típica de esta bacteria, de cada muestra se tomaron cinco colonias típicas, las cuales fueron inoculadas en agar tripticasa de soya (TSA, Oxoid) a 25°C por 72 horas. Posteriormente, las colonias sospechosas se identificaron con el kit comercial Crystal (BBL) y Oxidasa (Merck).
Detección de Enterobacter sakazakii por el método automatizado BAX® DuPont El método de PCR automatizado (DuPont) se basa en la detección de un gen conservado y específico de E. sakazakii, del cual la casa comercial no suministra mayor información, pero que se sabe que es específico, debido a que el sistema tiene controles positivos y negativos internos que aseguran al especificidad de la prueba (BAX DuPont Guide). Para la realización de la PCR, las muestras se sembraron en el medio de enriquecimiento, caldo de sulfato de lauril con vancomicina (Oxoid), en dilución 1:10, por 24 horas a 45°C. Después se realizó una dilución 1:50, agregando 10 µl de la muestra enriquecida a 500 µl de BHI. El cultivo enriquecido se incubó a 37°C por 3 horas. Posteriormente, se realizó la lisis en solución tampón-proteasa a 37°C por 20 minutos, 95°C por 10 minutos y 4°C por 5 minutos, según instrucciones del fabricante. Finalmente, para la detección de E. sakazaki, se tomaron 50 µl de solución de lisis para la hidratación de las tabletas de PCR, las cuales se llevaron al termociclador (BAX DuPont) por cuatro horas. Las lecturas se realizaron con el programa del sistema de Dupont (8, 9).
Resultados y discusión
Recuento de coliformes totales
Se encontraron coliformes totales en las superficies de preparación de 61 de las 222 muestras, que corresponden a 27,4%, lo cual evidencia fallas en los programas de limpieza y desinfección, o deficiencias en las prácticas de manufactura. De los 9 lactarios muestreados, en 5 se detectaron coliformes totales. Según el anexo técnico Nº 1 de la Resolución 1043 de 2006, por el cual se establece cuáles son las condiciones que deben cumplir los prestadores de servicios de salud, el servicio de lactarios debe estar aislado del área de hospitalización y de la circulación de pacientes y de personal, y, a su vez, debe poseer un área sucia y otra limpia, con el fin de evitar la contaminación cruzada que pueda afectar a la población que está utilizando el servicio (11).Aislamiento e identificación de Enterobacter sakazakii por el método tradicional
Para la identificación de E. sakazakii se utilizó el protocolo de microbiología clásica descrita por la FDA (2). Con este método se aislaron dos cepas de Pantoea agglomerans (0,90%), recuperadas de las superficies de los lactarios. Las bacterias se aislaron y, una vez en cultivo puro, se confirmaron por el método de identificación miniaturizado de microbiología, Crystal (BBL).
Estos resultados concuerdan con los de otros estudios en los cuales también se isló esta bacteria en muestras similares (10). P. agglomerans es una bacteria entérica que normalmente interfiere con el aislamiento y la identificación de E. sakazakii y, de acuerdo con el análisis genético del 16S ARNr, presenta 97,1% de homología con E. sakazakii (2,10). Lo anterior es importante desde el punto de vista microbiológico, porque se pueden dar reportes falsos positivos o negativos en las muestras estudiadas.
Estas bacterias patógenas emergentes pueden estar involucradas en casos clínicos, pues son poco competidoras cuando se enfrentan a la microbiota acompañante, en los medios de cultivo in vitro, y resulta difícil su recuperación, como se evidenció en este estudio al recuperar a P. agglomerans y no E. sakazakii. Por lo anterior, para la identificación de los patógenos se recomienda, además de los métodos tradicionales, utilizar alternativas como los métodos moleculares, los cuales pueden dar información importante en el diagnóstico, de una manera rápida y específica (2).
Detección de Enterobacter sakazakii por el sistema BAX® Dupont
E. sakazakii se detectó en 8 (3,6%) muestras por el método PCR automatizado BAX®, y se aisló e identificó a partir de superficies y biberones con fórmula infantil deshidratada listos para el consumo, entre otros (figura 1). Siete de las muestras que presentaban E. sakazakii se obtuvieron en EPS de municipios aledaños a Bogotá y la muestra restante se aisló de un chupo de biberón en un lactario de una EPS de Bogotá. A diferencia de los resultados obtenidos con PCR automatizada, por el método tradicional no se aisló la bacteria de ninguna de las muestras.
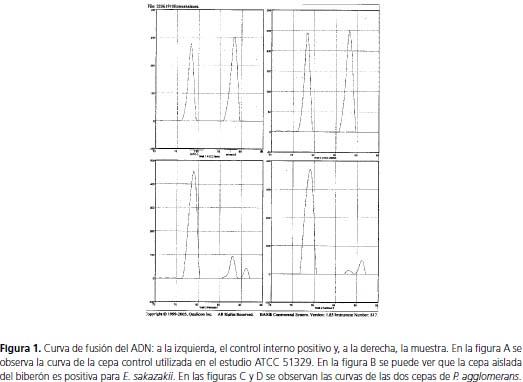
Las diferencias entre los resultados obtenidos por el método tradicional y por PCR automatizada, se deben a la baja especificidad y sensibilidad del método de microbiología clásica frente al automatizado; estos resultados son similares a los de numerosos estudios en los que se reporta baja especificidad y sensibilidad de los protocolos clásicos utilizados para el aislamiento (11). Por el contrario, el sistema PCR automatizado BAX, tiene 98% de especificidad y sensibilidad para la identificación de E. sakazakii. Estos resultados muestran la importancia de usar métodos moleculares para determinar e identificar E. sakazakii de una forma rápida, sensible y especifica, con el fin de establecer un diagnóstico oportuno y certero.
Los resultados de este estudio coinciden con otras investigaciones, que mostraron que los equipos utilizados para la preparación de las fórmulas infantiles deshidratadas, las superficies y los ambientes fueron la fuente de contaminación de E. sakazakii (6). De lo anterior se puede concluir que la implementación de las prácticas higiénicas es indispensable y debe ser óptima en los lactarios.
Este estudio es el primer reporte donde se determina la presencia de E. sakazakii en algunos lactarios de nuestro medio. A pesar de las limitaciones por costos o disponibilidad de las técnicas de biología molecular a nivel masivo, y de la posibilidad de tener amplificaciones positivas por PCR a partir de ADN de células muertas o de microorganismos no viables, para futuras investigaciones y para el diagnóstico de este patógeno, se recomienda utilizar métodos moleculares para una detección rápida y oportuna; esto se puede complementar con la microbiología tradicional y, de esta manera, establecer el agente etiológico y un tratamiento efectivo.
No se conoce a ciencia cierta el papel de este patógeno como agente etiológico de meningitis y enterocolitis en nuestro medio, ya que no es un microorganismo de notificación obligatoria en Colombia. Por lo tanto, es importante realizar estudios para determinar los agentes etiológicos de estas enfermedades y su grado de importancia. Por último, es importante aclarar que en este estudio no se relacionaron casos clínicos de las EPS con la presencia del patógeno en los lactarios: este fue un estudio exploratorio. Se recomienda realizar investigaciones para relacionar todos los factores involucrados en esta problemática y poder determinar la importancia real de este patógeno en nuestro medio.
Correspondencia:
María Consuelo Vanegas, Laboratorio de Ecología Microbiana de Alimentos, LEMA, Universidad de los Andes,Carrera 1A Nº 18A-70 J209, Bogotá, D.C., Colombia. Teléfono 339-4949, extensión 2784; fax: extensión 3339. mvanegas@uniandes.edu.co.
Financiación: el trabajo fue financiado por la Facultad de Ciencias de la Universidad de los Andes y por el Laboratorio de Ecología Microbiana y Alimentos, LEMA,de la Universidad de los Andes.
Referencias
1. Kandhal MC, Reij MW, van Puyvelde K, Guillaume-Gentil O, Beumer, Schothorst. A new protocol for the detection of Enterobacter sakazakii applied to environmental samples, Wageningen University. J Food Prot. 2003;67:1267-70. [ Links ]
2. Lehner A, Stephan R. Microbiological, epidemiological and food safety aspects of Enterobacter sakazakii. J Food Prot. 2004;67:2850-7. [ Links ]
3. Iversen C, Forsythe S, Risk profile of Enterobacter sakazakii, an emergent pathogen associated with infant milk formula. T in Food Science 2003;14:443-54. [ Links ]
4. La Nación Líen. Fecha de consulta: 20 de septiembre de 2006, Disponible en: http://www.lanacion.com.ar/nota.asp?nota_id=725151 [ Links ]
5. Instituto Nacional de Salud. Fecha de consulta: 10 de octubre de 2006. Disponible en: http://www.ins.gov.co/?idcategoria=6117&download=Y. [ Links ]
6. Gurtler J, Kornacki J, Beuchat L. Enterobacter sakazakii: a coliform of increased concern to infant health. Int J Food Microbiol. 2005;34:2-27. [ Links ]
7. Holguín M, Higuera M, Rubio B, Muñoz A, Figueroa G. Manual de técnicas de análisis para control de calidad microbiológica de alimentos para consumo humano. Bogotá:INVIMA; 1998. p. 11-111. [ Links ]
8. DuPont Qualicon, Bax ® System PCR assay with automated detection for bacterial screening. User guide; 2005; 5. [ Links ]
9. Government of Canada. The DuPont Qualicon BAX system method for the detection of Enterobacter sakazakii in selected foods. Ottawa; 2003. p. 1-4. [ Links ]
10. Drudy D, ORourke M, Murphy M, Mullane N, O Mahony R, Lorraine K, Et al. Characterization of a collection of Enterobacter sakazakii isolates from environmental and food sources. Int J Food Microbiol. 2006;110:1-8. [ Links ]
11. Ministerio de Protección Social. Anexo técnico No. 1 de la Resolución No. 1043. Por lo cual se establecen las condiciones que deben cumplir los prestadores de servicios de salud para habilitar sus servicios e implementar el componente de la auditoría para el mejoramiento de la calidad de la atención y se dictan otras disposiciones. Bogotá: Ministerio de Protección Social; 2006. p. 1-240. [ Links ]
12. Nazarowec-White M, Farber JM. Enterobacter sakazakii: a review. Int J Food Microbiol. 1997;34:103-13. [ Links ]
13. Edelson G, Buchanan R. Thermal inactivation of Enterobacter sakazakii in rehydrated infant formula. J Food Protection. 2003;67:60-3. [ Links ]
14. FAO. Fecha de consulta: 3 de octubre de 2006. Disponible en http://www.belt.es/legislacion/reciente/pdf/regl2_doce_22_dic_05.pdf [ Links ]
15. Guillaume-Gentil O, Sonnard V, Kandhal MC, Marugg JD, Joosten H. A simple and rapid cultural method for detection of Enterobacter sakazakii in environmental samples. J Food Prot. 2004;678:64-9. [ Links ]
16. Iversen C, Druggan P, Forsythe S. A selective differential medium for Enterobacter sakazakii, a preliminary study. Int J Food Microbiol. 2004;96:133-9. [ Links ]
17. Nair M, Joy J, Venkitanarayanan K. Inactivation of Enterobacter sakazakii in reconstituted infant formula by monocaprylin. Int J Food Microbiol. 2004;67:2815-9. [ Links ]














