Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Infectio
Print version ISSN 0123-9392
Infect. vol.13 no.1 Bogotá Jan./Mar. 2009
Reporte de caso
1 Sanatorio San José, Infectología Institucional SRL, Buenos Aires, Argentina
2 Instituto Cardiovascular de Buenos Aires e Instituto Médico de Alta Complejidad Buenos Aires, Argentina
3 Instituto Médico de Alta Complejidad, Buenos Aires, Argentina
Recibido: 25/08/2008 | Aceptado: 10/03/2009
Resumen
La mediastinitis es una complicación grave entre los pacientes sometidos a cirugía cardiaca. Los agentes etiológicos más frecuentes son los cocos Gram positivos y los Gram negativos son una causa poco común en la mayoría de las series publicadas. Presentamos nuestra experiencia con cuatro pacientes con mediastinitis debida a bacilos Gram negativos multirresistentes, los cuales fueron tratados con tigeciclina.
Palabras clave: tigeciclina, mediastinitis, Acinetobacter spp., Pseudomonas aeruginosa.
Abstract
Mediastinitis is a life-threatening complication among patients undergoing cardiac surgery. Gram-positives cocci are the most frequent pathogens associated with post-surgical mediastinitis, being the Gram-negative etiology uncommon in most of the published series. We present our experience with four patients with mediastinitis due to multidrug-resistant Gram-negative bacilli, who have been treated with tigecycline.
Palabras claves: tigecicline, mediastinitis, Acinetobacter spp., Pseudomonas aeruginosa
Introducción
La mediastinitis posterior a esternotomía, también llamada infección profunda de la esternotomía, es la complicación más temida en pacientes sometidos a cirugía cardiovascular central.
La incidencia de mediastinitis varía de 0,15% a 8%, con una media de 1% a 2%(1), mientras que la mortalidad por esta enfermedad permanece alta (10% a 47%), a pesar de los avances en el tratamiento, tanto en el aspecto quirúrgico como en los esquemas antibióticos adyuvantes(1).
Desde el punto de vista anatómico, esta infección compromete el espacio del mediastino, con compromiso esternal o sin él, y su tratamiento es combinado, con el empleo de antimicrobianos y diferentes estrategias quirúrgicas, que van desde la limpieza de la cavidad del mediastino hasta la realización de complejos procedimientos plásticos para reconstruir la cavidad torácica (2).
Los microorganismos más frecuentemente asociados a la mediastinitis son las bacterias Gram positivas en 77% de los casos. Entre ellas, Staphylococcus aureus y Staphylococcus epidermidis corresponden a 49% y 28% de los casos, respectivamente; en más de la mitad de los casos, son resistentes a la meticilina (3-4).
La mayor incidencia entre los bacilos Gram negativos se observa en Pseudomonas aeruginosa (inclusive cepas productoras de ß-lactamasas de espectro extendido, BLEE), Pseudomonas aeruginosa, Serratia spp., Enterobacter spp, y Acinetobacter spp., entre otros (3).
La tigeciclina (Tygacil ®, Wyeth) es el primer miembro de una nueva clase de antibióticos, las glucilciclinas, cuyo espectro de acción comprende cepas de S. aureus, tanto sensibles a la meticilina como resistentes a la misma, y cepas con resistencia intermedia a glucopéptidos (SAMS, SAMR y SARIG, respectivamente), S. epidermidis sensibles y resistentes a meticilina, Streptococcus pneumoniae, incluso resistentes a la penicilina, Enterococcus faecalis y Enterococcus faecium, incluso cepas resistentes a vancomicina, enterobacterias productoras de BLEE y portadoras de cefalosporinasas derivadas del gen AmpC, especies de Acinetobacter multirresistente, incluso con resistencia a carbapenemes, bacterias atípicas y anaerobias, Bacteroides, Clostridia y cocos anaerobios. No se incluye dentro de su espectro K. pneumoniae (5).
La tigeciclina ha sido aprobada para el tratamiento de infecciones moderadas a graves de la piel y los tejidos blandos, e infecciones intraabdominales complicadas (5); no obstante, su potencia, su perfil farmacológico y su actividad frente a bacterias multirresistentes, intrahospitalarias y extrahospitalarias, le confieren a este nuevo antibiótico un promisorio papel potencial en el tratamiento de infecciones graves cuando se sospeche o demuestre la presencia de bacterias resistentes.
Métodos
En el período de noviembre 2006 a marzo 2007, desarrollamos en Argentina el Registro de uso inicial de tigeciclina, un estudio multicéntrico que incluyó 12 instituciones y cuyo objetivo fue caracterizar el tipo de indicación en la cual se utilizó tigeciclina, los patógenos aislados y los resultados clínicos de las mismas (6).
El objetivo del presente estudio es describir cuatro casos de mediastinitis posterior a esternotomía por bacilos Gram negativos multirresistentes que recibieron tratamiento antibiótico con tigeciclina.
Resultados
Las características de los pacientes se encuentran detalladas en la tabla 1. Tres de los cuatro pacientes fueron mujeres (75%); la media general de edad fue 75 años (rango 73 a 79) y el nivel de gravedad de los enfermos al momento de la admisión, medido por la escala Mortality Probability Model-(MPM) II (7) fue de 40 (rango, 21 a 51,73), con una media de probabilidad de muerte de 27% (rango, 5% a 52%). Todos los pacientes habían tenido una estancia previa prolongada en la unidad de cuidados intensivos antes del diagnóstico de mediastinitis (media de 24,25 días y rango de 13 a 32 días) y habían recibido antibióticos previos en los últimos días (media de 17 días y rango de 7 a 27 días).
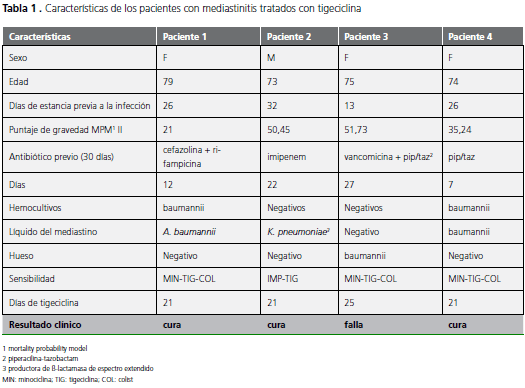
Tres pacientes presentaron infección de los tejidos profundos retroesternales, con documentación microbiológica en líquido del mediastino de Acinetobacter spp., sólo sensible a minociclina, tigeciclina y colistina en dos casos, y de K. pneumoniae productora de BLEE en el caso restante. Ambos pacientes con infección profunda por Acinetobacter spp. tuvieron hemocultivos positivos por el mismo microorganismo.
El cuarto paciente reportado presentó una infección de los tejidos preesternales con osteomielitis del esternón y con aislamiento en hueso de Acinetobacter spp. sólo sensible a minociclina, tigeciclina y colistina.
Todos los pacientes recibieron tigeciclina a las dosis estándar (100 mg de dosis de carga y luego 50 mg cada 12 horas) por una media de 22 días (rango de 21 a 25 días), además de la limpieza quirúrgica. Un paciente recibió tratamiento concomitante con caspofungina y metronidazol.
Tres pacientes (75%) cumplieron los criterios de curación clínica al final del tratamiento (resolución completa de los signos y síntomas de infección) y fueron dados de alta.
Discusión
En la mayoría de las series publicadas, los bacilos Gram negativos multirresistentes no constituyen la etiología más frecuente en mediastinitis (3). La estancia hospitalaria previa y la administración previa de antibióticos, por tiempo prolongado (más de dos semanas), son dos de los factores que pudieron influir en los aislamientos de nuestros enfermos (8,9). En este sentido, Raymond et al. han publicado que las infecciones por bacilos Gram negativos multirresistentes se asocian con mayor mortalidad en los pacientes hospitalizados (10). En nuestra serie, la mortalidad fue la esperable de acuerdo con la predicción de la escala MPM II; sin embargo, el escaso número de pacientes incluidos no nos permite ser concluyentes en esta observación.
La mediastinitis es una indicación no aprobada (off label) para el uso de tigeciclina; no obstante, su perfil farmacológico y microbiológico ha animado a los médicos a utilizarla en este grupo de enfermos, cuando las alternativas disponibles no son las más apropiadas.
En el tratamiento de infecciones complicadas de la piel y de los tejidos blandos, es crítico lograr una adecuada concentración del antibiótico en el sitio de infección. A las dosis usuales, la tigeciclina alcanza una concentración mayor de 70% en la piel, medido esto en estudios experimentales en el fluido ampollar (11). Respecto de la concentración ósea, al igual que otros antibióticos con base tetraciclínica, los estudios en animales han indicado una alta concentración de tigeciclina en hueso y plasma (12).
En la actualidad, no se dispone de datos sobre la concentración de tigeciclina en el tejido y los fluidos del mediastino, tal como ocurre con otros fármacos que se emplean en el manejo de esta enfermedad potencialmente mortal. En ese sentido, existen datos limitados con antimicrobianos tales como vancomicina, teicoplanina, ceftriaxona, ciprofloxacina y ofloxacina. La tigeciclina ha mostrado una excelente actividad in vitro frente a los patógenos asociados frecuentemente con mediastinitis, en aislamientos de países de Latinoamérica (incluso los bacilos Gram negativos multirresistentes): SAMS (n=161 cepas, CIM90 0,25 mg/L), SAMR (n=157 cepas, CIM90 0,25 mg/L), K. pneumoniae BLEE+ (n=124 cepas, CIM90 2 mg/L), Enterobacter spp. (n=295 cepas, CIM90 2 mg/L), Serratia marcescens (n=124 cepas, CIM90 2 mg/L) y Acinetobacter baumannii (n=188 cepas, CIM90 1 mg/L) (13). Teniendo en cuenta las concentraciones inhibitorias mínimas (CIM) descritas, las concentraciones de tigeciclina en piel, tejidos blandos y hueso asegurarían un índice terapéutico adecuado en la mayoría de estos casos.
Dos de los enfermos descritos tuvieron hemocultivos positivos (Acinetobacter spp.mulrirresistente) y en ambos casos el resultado clínico fue favorable. Está bien determinado que la tigeciclina alcanza concentraciones séricas modestas (0,4 a 0,6 mg/L) (5), las cuales son inferiores a las CIM de la mayoría de los bacilos Gram negativos multirresistentes (13). La reducción de la carga bacteriana en la fuente primaria de la infección debido a la alta concentración de tigeciclina en los tejidos (mitigación del foco primario de la bacteriemia), podría explicar en parte la razón del éxito clínico en estos enfermos a pesar de la bacteriemia documentada (14).
Lachanas et al. publicaron el caso de una mediastinitis por A. baumannii, tratada exitosamente con debridamiento quirúrgico, reconstrucción y tratamiento antibiótico con ampicilina-sulbactam (15). En el mismo sentido, Rouveix et al. refirieron,, en una serie de infecciones graves en pacientes de la unidad de cuidados intensivos, casos de mediastinitis por A. baumannii tratados con imipenem-cilastatina, antibiótico que los autores consideran y sugieren como de elección en estos casos (16).
La realidad epidemiológica de Acinetobacter spp. en Argentina (77% de resistencia a ampicilina-sulbactam y 54% a carbapenemes) (17) limita la posibilidad de utilizar estas opciones terapéuticas en enfermos graves. Probablemente ésta sea una de las causas principales del uso masivo de colistina en Argentina (18); sin embargo, la introducción de este antibiótico en el mercado, sin cumplir los procesos de regulación que se exigen en la actualidad para la aprobación de nuevos fármacos (investigaciones preclínicas y clínicas), hacen que la información disponible sobre las polimixinas en general (eficacia clínica, parámetros farmacodinámicos) sea muy escasa (19).
En el caso particular del paciente con mediastinitis por K. pneumoniae productora de BLEE, la tigeciclina constituye una alternativa válida que brinda la posibilidad de preservar el uso de carbapenemes en el hospital, habida cuenta de la creciente tasa de resistencia a los mismos, sobre todo en microorganismos como K. pneumoniae, para la cual el desarrollo de nuevos antibióticos es limitado (20).
En síntesis, la proporción de éxito clínico obtenido en esta pequeña serie de enfermos proporciona una evidencia inicial de que tigeciclina puede ser una opción aceptable para la terapia adyuvante de pacientes con mediastinitis por bacilos Gram negativos multirresistentes.
Por otra parte, su actividad frente a los cocos Gram positivos, con bajas CIM, aun en SAMR (0,12 a 0,50 mg/L), sumado a la presencia de determinados parámetros farmacológicos de importancia en el tratamiento antibiótico de los pacientes críticos (no requiere ajuste de la dosis según la función renal; la ausencia de interacciones medicamentosas y la falta de antagonismo con otros antibióticos), hacen que tigeciclina tenga un rol potencial en el tratamiento de esta enfermedad.
Sin embargo, se debe tener en cuenta que los estudios observacionales con escaso número de casos son sólo descriptivos y no son adecuados para soportar esta conclusión. Sólo los ensayos clínicos controlados proporcionan la evidencia suficiente para considerar la aprobación de nuevas indicaciones.
Conflicto de intereses
Daniel Curcio es conferencista para Wyeth, S.A., Argentina.; Francisco Nacinovich, Martín Christin y Claudia Tosello no refieren ningún conflicto.
Correspondencia al autor
Daniel Curcio, MD, Sánchez de Bustamante 1674 (1425), Capital Federal, Argentina. Teléfono: (5411) 4822-2748;djcurcio@gmail.com fax: (5411) 4822-2748
djcurcio@gmail.com e infectologia.institucional@gmail.com
Bibliografía
1. El Gamel A, Yonan NA, Hassan R, Jones MT, Campbell CS, Deiraniya AK, Lawson RA. Treatment of mediastinitis: early modified robicsek closure and pectoralis major advancement flaps. Ann Thorac Surg. 1998;65:41-7. [ Links ]
2. Oakley RM, Wright JE. Postoperative mediastinitis: classification and management. Ann Thorac Surg. 1996;61:1030-6. [ Links ]
3. Gardlunda B, Bitkoverb CY, Vaageb J. Postoperative mediastinitis in cardiac surgery - microbiology and pathogenesis. Eur J Cardiothorac Surg. 2002;22:825-30. [ Links ]
4. Tegnell A, Aren C, Ohman L. Coagulase-negative staphylococci and sternal infections after cardiac operation. Ann Thorac Surg. 2000;69:1104-9. [ Links ]
5. Noskin GA. Tigecycline: a new glycylcycline for treatment of serious infections. Clin Infect Dis. 2005;41(Suppl.5):S303-14. [ Links ]
6. Curcio D, Fernández F, Cané A, Barcelona L, Stamboulian D. Indications of a new antibiotic in clinical practice: results of the tigecycline initial use registry. Braz J Infect Dis. 2008;12:198-201. [ Links ]
7. Lemeshow S, Teres D, Klar J, Avrunin JS, Gehlbach SH, Rapoport J. Mortality probability models (MPM II) based on an international cohort of intensive care patients. JAMA. 1993;270:2478-86. [ Links ]
8. Baran G, Erbay A, Bodur H, Ongürü P, Akinci E, Balaban N, Cevik MA. Risk factors for nosocomial imipenem-resistant Acinetobacter baumannii infections. Int J Infect Dis. 2008;12:16-21. 9. Bradford PA. Extended-spectrum beta-lactamases in the 21st century: characterization, epidemiology, and detection of this important resistance threat. Clin Microbiol Rev. 2001;14:933-51. [ Links ] [ Links ]
10. Raymond DP, Pelletier SJ, Crabtree TD, Evans HL, Pruett TL, Sawyer RG. Impact of antibiotic-resistant Gram-negative bacilli infections on outcome in hospitalized patients. Crit Care Med. 2003;31:1035-41. [ Links ]
11. Sun HK, Ong CT, Umer A, Harper D, Troy S, Nightingale CH, Nicolau DP. Pharmacokinetic profile of tigecycline in serum and skin blister fluid of healthy subjects after multiple intravenous administrations. Antimicrob Agents Chemother. 2005;49:1629-32. [ Links ]
12. Tombs NL. Tissue distribution of GAR-936, a broad-spectrum antibiotic in male rats. En: Abstracts of the Thirty-ninth Interscience Conference on Antimicrobial Agents and Chemotherapy, San Francisco, CA. Washington, D.C.: American Society for Microbiology; 1999. Abstract P302. [ Links ]
13. Reinert RR, Low DE, Rossi F, Zhang X, Wattal C, Dowzicky MJ. Antimicrobial susceptibility among organisms from the Asia/Pacific Rim, Europe and Latin and North America collected as part of TEST and the in vitro activity of tigecycline. J Antimicrob Chemother. 2007;60:1018-29. [ Links ]
14. Ellis-Grosse. European Congress in Clinical Microbiology and Infectious Diseases 2206. Programs and Abstracts: P1783. [ Links ]
15. Lachanas E, Tomos P, Sfyras N, Miyakis S, Kostakis A. Acinetobacter baumannii mediastinitis after cardiopulmonary bypass: case report and literature review. Surg Infect (Larchmt). 2008;9:201-4. [ Links ]
16. Rouveix E, Bure AM, Regnier B, Wolff M, Pangon B, Laisne MJ, Vachon F. Experience with imipenem/cilastatin in the intensive care unit. J Antimicrob Chemother. 1986;18(Suppl.E):153-60. [ Links ]
17. Quinteros M, Radice M, Famiglietti A, et al. Análisis de la sensibilidad a los antimicrobianos en los aislamientos de pacientes internados, años 2004-2005. Boletín de la Asociación Argentina de Microbiología. 2006;172:13-6. [ Links ]
18. Levy Hara G, Vasen W, Pryluka D, et al.Red de infectología GCABA: estudio de prescripción-indicación de antibióticos (ATB) de mayor espectro en unidades de terapia intensiva (UTI) [abstract 90]. En: Programas y Resúmenes del VI Congreso Argentino de Infectología, (Mar del Plata). Buenos Aires, Argentina: Sociedad Argentina de Infectología; 2006. [ Links ]
19. Li J, Nation RL, Turnidge JD, Milne RW, Coulthard K, Rayner CR, et al. Colistin: the re-emerging antibiotic for multidrugresistant Gram-negative bacterial infections. Lancet Infect Dis. 2006;6:589-601. [ Links ]
20. Spellberg B, Powers JH, Brass EP, Miller LG, Edwards JE Jr. Trends in antimicrobial drug development: implications for the future. Clin Infect Dis. 2004;38:1279-86. [ Links ]














