Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Infectio
Print version ISSN 0123-9392
Infect. vol.13 no.2 Bogotá Apr./June 2009
1 Grupo de Inmunovirología, Sede de Investigación Universitaria, Universidad de Antioquia, Medellín, Colombia.
Recibido: 21/07/2008; Aceptado: 24/03/2009
Resumen
La historia natural de la infección por el virus de la inmunodeficiencia humana tipo 1 (VIH-1) es un proceso variable que ha permitido identificar individuos con diferentes patrones de progresión de la infección. Entre estos individuos, existe un grupo de personas catalogadas como, sin progresión a largo plazo, las cuales se caracterizan por permanecer asintomáticas por largos periodos, sin evidencia de deterioro inmunológico y con cargas virales bajas o indetectables, en ausencia de tratamiento antirretroviral. Diferentes factores inmunológicos, genéticos y virales se han asociado con el patrón de progresión exhibido por estos individuos. Los factores inmunológicos contemplan mecanismos tanto de la inmunidad innata como de la adaptativa; los factores genéticos están relacionados con los genes que codifican los receptores de quimiocinas y sus ligandos naturales y genes del complejo mayor de histocompatibilidad. Por otro lado, los factores virales están relacionados con la variabilidad genética del virus y con su capacidad de replicación.
De la forma en que estos factores se interrelacionen, dependen la capacidad infecciosa del virus, la respuesta inmune anti-VIH que pueda establecer el hospedero y, por consiguiente, el patrón de progresión que se establezca.
Palabras clave: VIH-1; progresión a largo plazo; resistencia natural
Summary
The natural history of type one human immunodeficiency virus infection (HIV-1) is a variable process that has allowed identifying different patterns of progression. Among them, there is a group of individuals known as long-term non-progressors (LTNP). LTNP are characterized for being asymptomatic for long periods of time, showing no evidence of immune deterioration and having low or undetectable viral loads in absence of antiretroviral treatment. Different immunologic, genetic and viral factors have been associated with the pattern of progression. Immunological factors include both, innate and adaptive mechanisms; genetic factors are related with genes of the chemokines family as well as genes of the major histocompatibility complex. On the other hand, viral factors are related to the genetic variability and replication ability of the virus. The disease pattern that is established depends on the interrelations of all these factors, which finally account for the type of anti- HIV-1 immune response developed and the infectious capacity of the virus.
Key words: HIV-1; long-term non-progressors; natural resistance
Introducción
La historia natural de la infección por el virus de la inmunodeficiencia humana, tipo 1/síndrome de inmunodeficiencia adquirida (VIH-1/ sida) es un proceso variable y complejo. Los individuos infectados exhiben diferentes patrones de progresión, hasta el desarrollo del sida (1). Los de evolución típica representan alrededor de 80% a 85% de los individuos infectados por el VIH-1, y se caracterizan porque progresan a sida en un periodo promedio de 8 a 10 años. Los de evolución rápida representan entre el 10% y el 15% de los individuos infectados, los cuales desarrollan sida entre 1 y 5 años. Por su parte, los de evolución lenta y los que no evolucionan, que en conjunto se conocen como sin evolución a largo plazo (long-term non-progressors, LTNP), representan entre 5% y 10% de los infectados (2).
Los de evolución lenta se caracterizan por permanecer asintomáticos por un periodo mayor de 10 años; el deterioro inmunológico se va desarrollando en forma muy lenta y la carga viral es baja en ausencia de tratamiento antirretroviral. En contraste, los que no evolucionan se caracterizan porque, a pesar de llevar más de 15 años de haber adquirido la infección, no exhiben deterioro clínico ni inmunológico y ejercen un control eficiente sobre la replicación viral (3).
La identificación de estos dos últimos grupos de individuos ha hecho evidente la existencia de mecanismos de resistencia a la evolución de la infección; diversos factores virales, inmunológicos y genéticos se han asociado con este fenómeno. Estos factores pueden actuar individualmente o en conjunto y afecta la compleja relación que se establece entre el virus y el huésped, ya sea influenciando la respuesta inmune de éste, la tasa de replicación del virus o ambas (4). Los factores responsables de la resistencia al progreso de la infección han despertado gran interés en los últimos años, dado que su identificación permite profundizar en el conocimiento que se tiene sobre la patogénesis de esta infección y puede ser el fundamento para el desarrollo de nuevas estrategias terapéuticas (3).
Para el desarrollo de esta revisión, se hizo una búsqueda en las bases de datos Pubmed, Medline, Ovid, utilizando los siguientes términos: HIV-1 infection, long-term non-progressors, natural resistance, immunological factors, genetic factor, viral factors. Se combinaron los términos, y se restringió la bibliografía a artículos originales y a algunas revisiones en todos los grupos etarios.
Individuos con evolución lenta y sin evolución a largo plazo.
La definición de este grupo de sujetos ha variado considerablemente debido a que existen contradicciones en cuanto a los parámetros que se deben tener en cuenta para establecer una definición con aceptación universal. Sin embargo, la definición óptima para aquéllos sin evolución a largo plazo generalmente incluye los siguientes parámetros: permanecer asintomáticos por largos periodos en ausencia de tratamiento antirretroviral, generalmente más de 10 años después de la infección; habitualmente la carga viral en el plasma de estos individuos se encuentra por debajo del límite de detección y la recuperación del virus de las células mononucleares de sangre periférica es difícil (5). Aunque la replicación viral es continua en los ganglios linfáticos, su arquitectura está preservada generalmente (6). El número y la función de los linfocitos T CD4+ en estos individuos también se preserva, con conteos superiores a 500 células/μl (2).
Factores que influyen en el curso de la infección en pacientes sin evolución a largo plazo
Factores inmunológicos
Actualmente, existe evidencia clara que sustenta que los pacientes sin evolución a largo plazo presentan una vigorosa respuesta inmune innata y adaptativa en contra del VIH-1, la cual contribuye en gran medida a la prolongada fase asintomática que presenta este grupo de individuos (figura 1).
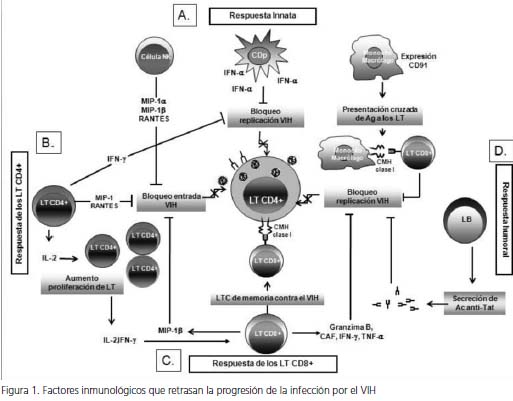
Respuesta inmune innata. En los individuos sin evolución a largo plazo, se ha observado una importante respuesta funcional de diferentes poblaciones celulares, comparados con individuos control no infectados, así como con individuos que sí evolucionan. Entre estas poblaciones, se encuentran las siguientes células. Las células asesinas naturales, las cuales mediante la producción de quimiocinas, como MIP-1α, MIP-1β y RANTES, ejercen una fuerte respuesta inmune en contra del VIH-1, debido en gran parte a que la unión de estas quimiocinas a su respectivo receptor (CCR5) bloquea la entrada del virus a las células blanco (7).
Las células dendríticas plasmacitoides (CDp) tienen gran capacidad de producir interferón α (IFN-α) en respuesta a diferentes estímulos; esta citocina suprime la replicación viral por diferentes mecanismos. De hecho, se observa una fuerte correlación inversa entre la frecuencia y la función de las células dendríticas plamacitoides y la producción de IFN-α, con la carga viral de VIH, con la aparición de infecciones oportunistas y con la progresión de la infección (8).
Finalmente, la expresión del receptor para proteínas de choque térmico, CD91, en monocitos se ha asociado con la evolución lenta, debido a su papel en la presentación cruzada de antígenos (virales a los linfocitos T CD8+, así como al efecto que tiene en la interiorización de péptidos antimicrobianos, como las α defensinas (9), las cuales exhiben actividad directa e indirecta anti-VIH.
En general, el aspecto más importante de la inmunidad innata que influye en la progresión lenta de la infección, lo constituye la producción de diferentes factores solubles, los cuales pueden inhibir la replicación viral directamente o mediante la modulación de la respuesta inmune y la posterior activación de diferentes poblaciones celulares. Se ha establecido una relación inversa entre el grado de secreción de estos factores y la progresión de la infección (10).
La forma como la respuesta inmune logra retrasar el progreso de la infección por el VIH, está dada por la manera en que interactúan los mecanismos efectores de la inmunidad. De un lado, las diferentes poblaciones de la inmunidad innata (A) pueden bloquear la replicación del VIH mediante diferentes mecanismos: las células NK mediante la producción de quimiocinas, como RANTES, MIP-1α y MIP- 1β, impiden la unión de cepas virales R5 a la célula blanco. Las células dendríticas plasmacitoides (CDp) bloquean la replicación del VIH mediante la producción de IFN-α, la cual exhibe actividad antiviral. Además, la expresión en monocitos del receptor CD91, participa en la inhibición de la replicación viral, puesto que tiene un papel importante en la presentación cruzada de antígenos virales y, por ende, la potenciación de la inmunidad adaptativa. De otro lado, los linfocitos T CD4+ (B) ejercen control de la replicación viral por medio de la producción de IFN-γ, RANTES, MIP-1α y MIP-1β. La activación de esta población celular potencia la actividad de los linfocitos CD8+ (C), los cuales activan mecanismos efectores citotóxicos y no citotóxicos en respuesta al estímulo antigénico, mediante la acción de diversos factores solubles, como CAF, IFN-γ y FNT-α, MIP-1β. Las células B (D), por su parte, mediante la producción de anticuerpos IgG específicos para la proteína viral Tat, colaboran en el bloqueo de la replicación del VIH.
VIH: virus de inmunodeficiencia humana; células NK: células asesinas naturales; CDp: células dendríticas plasmacitoides; LT: linfocito T; LB: linfocito B; Ag: antígeno; CMH: complejo mayor de histocompatibilidad; CAF: factor antiviral de los linfocitos T CD8+; Ac: anticuerpos.
Respuesta de los linfocitos T CD4+.
El papel de los linfocitos T CD4+ en el control de la replicación del VIH ha sido claramente comprobado durante la infección de macacos con el virus de la inmunodeficiencia de los simios (VIS). Para evaluar el papel de estas células en la progresión de la infección, se han infectado macacos con el VIS y, posteriormente, se han Figura 1. Factores inmunológicos que retrasan la progresión de la infección por el VIH obtenido muestras de tejido linfático asociado al sistema gastrointestinal (GALT), las cuales se han analizado con el fin de evaluar el número y la función de estas células cuando son estimuladas con diferentes antígenos virales.
Estos análisis han demostrado que, a diferencia de la mayoría de los animales infectados, un pequeño grupo exhibe un considerable aumento en el número y en la función de estas células, lo cual se ha relacionado directamente con el control de la replicación viral y, por consiguiente, con la progresión lenta de la infección (11). En forma similar, varios estudios en humanos han demostrado que los individuos sin evolución a largo plazo presentan una fuerte respuesta de linfocitos T CD4+ específica del VIH (12). En estos individuos, se observa una respuesta de proliferación de linfocitos T CD4+ específicos de los antígenos virales p24 y gp160, lo cual se ha correlacionado inversamente con la carga viral (13). Además, también se ha demostrado que la capacidad de los linfocitos T CD4+ de producir interleucina-2 (IL- 2) en respuesta a diferentes antígenos virales se encuentra preservada en estos individuos, así como la capacidad de estas células de proliferar al ser estimuladas con esta citocina (14).
Por otro lado, otros estudios han hecho evidente que los linfocitos T CD4+ de los pacientes sin evolución a largo plazo, exhiben una acentuada capacidad de producir factores solubles con actividad antiviral, como las quimiocinas RANTES, MIP1-α, MIP1-β, y el interferón γ, los cuales podrían, en algún grado, limitar la evolución de la infección (13). Estos hallazgos sugieren que los linfocitos T CD4+ tienen un papel importante en el control de la progresión de la infección, y contribuyen con el mantenimiento de una respuesta inmune adecuada contra el virus.
Respuesta de los linfocitos T CD8+. En el modelo animal de la infección por el VIS, se ha destacado claramente el papel de los linfocitos T CD8+ en el control de la replicación viral, puesto que la eliminación de estas células con el uso de anticuerpos monoclonales en grupos de macacos infectados conduce a la replicación incontrolada del virus (15). A diferencia de lo observado en macacos infectados, con evolución de la enfermedad, las biopsias de tejido linfático proveniente de macacos sin evolución de la enfermedad muestran un aumento en el número de linfocitos T CD8+ y en la expresión del ARN mensajero de IFN-γ y de granzima B (16), lo cual destaca el papel que tienen los linfocitos T CD8 en el control de la replicación viral y la progresión de la infección.
En el curso natural de la infección por el VIH- 1, la importancia de la respuesta antiviral por parte de los linfocitos T CD8+ se ha hecho evidente en los estadios iniciales de la infección. Sin embargo, dicha respuesta no es suficiente, como consecuencia de la replicación viral activa en órganos linfáticos, así como de la alteración funcional de los linfocitos T CD4+ y la aparición de nuevas cepas virales que no son reconocidas por los linfocitos T CD8+ (17). No obstante, en estudios longitudinales realizados en pacientes sin evolución a largo plazo se ha observado una frecuencia alta de linfocitos T citotóxicos CD8+ específicos del virus, lo cual se ha asociado con las cargas virales bajas (18). Además, la capacidad de los linfocitos T CD8+ de tejidos linfáticos para controlar la replicación viral se ha demostrado al estudiar grupos de pacientes con diferentes patrones de evolución, por lo que el papel de estas células se ha descrito como determinante en la progresión de la infección (19).
Los linfocitos T CD8+ también pueden controlar la replicación del VIH por medio de mecanismos no citotóxicos; así, la actividad de estos mecanismos no citotóxicos se ha relacionado con un estado asintomático prolongado y con la progresión lenta de la infección que exhiben los individuos sin evolución a largo plazo (20). Esta actividad fue descrita por primera vez en pacientes asintomáticos infectados por el VIH, en los cuales se observó que la eliminación de linfocitos T CD8+ de células mononucleares de sangre periférica favorecía la recuperación del virus a partir de estas células, mientras que la adición de esta población celular suprimía la replicación viral, sin evidencia de efecto citotóxico sobre las células infectadas (21). La actividad de estos mecanismos no citotóxicos es mediada por diferentes factores solubles, como el factor antiviral de los linfocitos T CD8+, las citocinas IFN-γ, el FNT-α y la quimiocina MIP-1β, en respuesta al estímulo viral (22,23).
Respuesta humoral. La evaluación de la respuesta humoral inmune en los pacientes sin evolución a largo plazo, se ha enfocado en la búsqueda de anticuerpos neutralizantes; sin embargo, los resultados obtenidos no han sido totalmente concluyentes (24). Se ha evaluado la producción in vitro de anticuerpos específicos del VIH-1 en cultivos de células mononucleares de sangre periférica de pacientes sin evolución a largo plazo, pero los resultados obtenidos muestran que, aunque las células de estos individuos producen diversos anticuerpos específicos para VIH, dicha producción no es significativamente diferente a la observada en los pacientes con otros patrones de evolución (25).
Por otro lado, en un estudio realizado in vivo en una cohorte de individuos infectados con diferentes patrones evolutivos de la infección, se observó que en contraste con los de evolución rápida, el grupo de los que no evolucionan presentaba títulos más altos de anticuerpos séricos IgG específicos para la proteína Tat; debido a que esta proteína es importante para la transcripción del virus, este evento fue relacionado con el control de la replicación viral y con la falta de evolución de estos individuos (26).
Factores genéticos
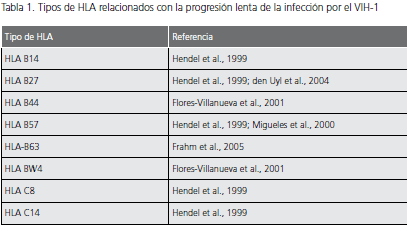
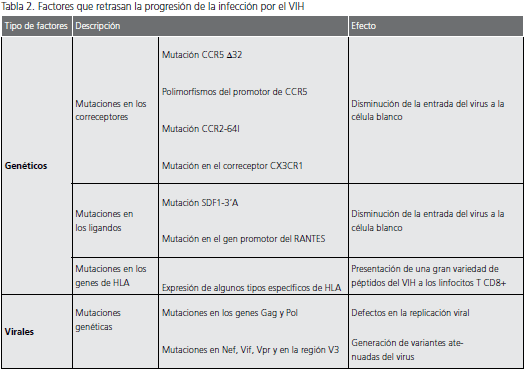
Los principales factores genéticos asociados con la evolución lenta de la infección por el VIH, están relacionados con tres familias de genes del huésped: genes que codifican los receptores de quimiocinas y para los ligandos naturales de estos receptores y genes del complejo mayor de histocompatibilidad (tabla 1 y tabla 2).
Mutaciones en los correceptores
Mutación CCR5 Δ32. Esta mutación consta de una eliminación de 32 pares de bases (pb) que se presenta en el gen que codifica para el correceptor CCR5 y que se traduce en la formación de una proteína defectuosa que no se expresa en la membrana celular; estas células son muy resistentes a la infección por las cepas virales R5 (27). Cuando esta mutación se presenta de manera heterocigota, se asocia con la evolución lenta de la infección, como consecuencia de la disminución en membrana de la expresión de CCR5 en las células blanco, lo cual restringe la entrada y, por ende, la replicación y propagación del virus (28,29).
Polimorfismos del promotor de CCR5. Entre las alteraciones más comunes descritas para el promotor de CCR5, se encuentra el polimorfismo A/G que se presenta en la posición 59029 de este promotor (30). Dado que la actividad de dicho promotor con el polimorfismo G/G es aproximadamente 45 veces inferior al compararla con la actividad del promotor con polimorfismo A/A, la presencia de dicho polimorfismo se ha asociado con una evolución lenta de la infección, a consecuencia de una menor expresión de la molécula CCR5 en la membrana de las células blanco (31).
Mutación CCR2-64I. Esta alteración es producida por una variante alélica del correceptor CCR2 y ocurre por la sustitución de una valina por una isoleucina (V-I) en la posición 64 de dicha molécula, lo cual se ha asociado con una evolución lenta a sida (32). No está muy claro cómo esta mutación retrasa la progresión de la infección, puesto que la valina y la isoleucina tienen las mismas características funcionales y químicas, pero se cree que esta mutación Tabla 1. Tipos de HLA relacionados con la progresión lenta de la infección por el VIH-1 Tipo de HLA Referencia HLA B14 Hendel et al., 1999 HLA B27 Hendel et al., 1999; den Uyl et al., 2004 HLA B44 Flores-Villanueva et al., 2001 HLA B57 Hendel et al., 1999; Migueles et al., 2000 HLA-B63 Frahm et al., 2005 HLA BW4 Flores-Villanueva et al., 2001 HLA C8 Hendel et al., 1999 HLA C14 Hendel et al., 1999 Tabla 2. Factores que retrasan la progresión de la infección por el VIH Tipo de factores Descripción Efecto Genéticos Mutaciones en los correceptores Mutación CCR5 Δ32 Disminución de la entrada del virus a la célula blanco Polimorfismos del promotor de CCR5 Mutación CCR2-64I Mutación en el correceptor CX3CR1 Mutaciones en los ligandos Mutación SDF1-3’A Disminución de la entrada del virus a la célula blanco Mutación en el gen promotor del RANTES Mutaciones en los genes de HLA Expresión de algunos tipos específicos de HLA Presentación de una gran variedad de péptidos del VIH a los linfocitos T CD8+ Virales Mutaciones genéticas Mutaciones en los genes Gag y Pol Defectos en la replicación viral Mutaciones en Nef, Vif, Vpr y en la región V3 Generación de variantes atenuadas del virus puede influenciar indirectamente la afinidad de CCR5 por la gp120 del VIH-1, debido a que puede presentarse ligada a una mutación en la región reguladora de CCR5 (32).
Mutación en el correceptor CX3CR1.
Este polimorfismo es causado por el cambio de un nucleótido de guanina por uno de adenina (G-A), lo que se traduce en el cambio de una isoleucina por una valina en la posición 249 (V249I) de este correceptor. Aunque esta mutación se ha encontrado en algunos pacientes sin evolución a largo plazo y se ha asociado con la progresión lenta de la infección, el mecanismo por el cual actúa permanece desconocido (33).
Mutaciones en los ligandos
Mutación SDF1-3’A.La SDF-1 es la quimiocina que actúa como el ligando natural de CXCR4; es producida por células del estroma de la médula ósea, órganos linfáticos y diversas células de diferentes tejidos, con la excepción de los leucocitos (34). Hasta el momento, se ha descrito una mutación para el gen que codifica esta quimiocina, que involucra el cambio de una guanina por una adenina (G-A) en la posición 801 de la región no traducida 3’. Cuando esta mutación se presenta de forma homocigota, se asocia con una evolución lenta de la enfermedad, debido a que dicha mutación induce la producción de grandes cantidades de SDF-1, que estaría limitando la disponibilidad de CXCR4 y, por consiguiente, la infección por el VIH-1, específicamente por las cepas virales X4 (35).
Mutación en el gen promotor de RANTES. Se han descrito diversas variantes polimórficas en el gen promotor de RANTES, de las cuales sobresale la sustitución de una citosina por una guanina (C-G) en la posición 28 de dicho promotor. Esta mutación se correlaciona con una elevada actividad de este promotor, lo cual se refleja en el aumento de la producción de RANTES; este aumento en la producción se asocia con una evolución más lenta de la infección, debido a que esta quimiocina puede competir con el virus por el correceptor CXCR5, y restringir la entrada del virus R5 a su célula blanco (36).
Mutaciones en los genes de los antígenos de los leucocitos humanos (HLA). La capacidad de las células presentadoras de antígeno (CPA) para presentar un péptido específico a los linfocitos T, depende del tipo de moléculas HLA que expresen en su superficie, lo que explica la importancia de dichas moléculas en la respuesta inmune contra el VIH, así como en la evolución de la infección por VIH. La expresión de diferentes tipos de HLA se ha relacionado con la progresión lenta de la infección que exhiben los pacientes sin evolución a largo plazo (tabla 1). Aunque no está completamente clara la forma en que estos tipos de HLA pueden influir en la evolución de la infección, se cree que su expresión en las CPA se relaciona con la presentación de una gran variedad de péptidos del VIH-1 a los linfocitos T CD8+, lo cual controlaría la replicación del virus, al desarrollarse adecuadamente una respuesta específica de VIH-1, durante la fase asintomática de la infección (37,38).
Factores virales
Estos factores se encuentran relacionados, principalmente, con la variabilidad genética del virus y con la formación de cuasiespecies del mismo, que influyen en la replicación viral (tabla 2). Los cambios surgen principalmente por una serie de “hipermutaciones” que se presentan a causa de la sustitución de nucleótidos de guanina por nucleótidos de adenina (G-A) en los genes Gag (p17 y p24) y Pol (RT), lo cual conlleva a la introducción de ciertos codones de parada en estos genes y afecta la Volumen 13 No 2 - Junio de 2009 119 viabilidad del virus (39). En cohortes de pacientes sin evolución a largo plazo, se ha reportado un gran número de deleciones en el gen Nef (40), mutaciones en los genes accesorios Vif y Vpr (41), y alteraciones en la región V3 (42). Estas alteraciones generan variantes atenuadas del virus, relacionadas con una evolución lenta de la infección.
Conclusiones
Aunque son muchos los factores virales, inmunológicos y genéticos que influyen en la falta de evolución o en la evolución lenta de la infección por el VIH-1, es indiscutible que dichos factores no influyen de forma individual en el curso de la infección, dado que la evolución de la infección es un proceso complejo y de múltiples causas, que depende de la interacción de estos factores y del efecto que tengan dichas interacciones sobre la fisiopatología y el comportamiento de la infección. En conclusión, la condición de falta de evolución a largo plazo que presenta cierto grupo de individuos, debe ser una condición dada por la asociación de varios eventos que conducen principalmente al control de la replicación viral y, en cierto modo, pueden limitar o retrasar el progreso de la infección hasta el desarrollo del sida.
Correspondencia: María Teresa Rugeles, Calle 62 Nº 52-59, Laboratorio 532, SIU, Medellín, Colombia. mtrugel@udea.edu.co
Referencias
1. Soriano V, Martin R, Del Romero J, et al. Rapid and slow progression of the infection by the type 1 human immunodeficiency virus in a population of seropositive subjects in Madrid. Med Clin (Barc). 1996;107:761-6. [ Links ]
2. Soto LE. Mecanismos patogénicos de la infección por VIH. Rev Invest Clin. 2004;56:143-52. [ Links ]
3. Easterbrook PJ. Non-progression in HIV infection. AIDS. 1994;8:1179-82. [ Links ]
4. Levy JA. HIV pathogenesis and long-term survival. AIDS. 1993;7:1401-10. [ Links ]
5. Cao Y, Qin L, Zhang L, Safrit J, Ho DD. Virologic and immunologic characterization of long-term survivors of human immunodeficiency virus type 1 infection. New Engl J Med. 1995;332:201-8. 6. Pantaleo G, Fauci AS. New concepts in the immunopathogenesis of HIV infection. Annu Rev Immunol. 1995;13:487-512. [ Links ] [ Links ]
7. Oliva A, Kinter AL, Vaccarezza M, Rubbert A, Catanzaro A, Moir S. Natural killer cells from human immunodeficiency virus (HIV) -infected individuals are an important source of CC-chemokines and suppress HIV-1 entry and replication in vitro. J Clin Invest. 1998;102:223-31. [ Links ]
8. Soumelis V, Scott I, Gheyas F, Bouhour D, Cozon G, Cotte L. et al Depletion of circulating natural type 1 interferon- producing cells in HIV-infected AIDS patients. Blood. 2001;98:906-12. [ Links ]
9. Stebbing J, Gazzard B, Kim L, Portsmouth S, Wildfire A, Teo I. et al. The heat-shock protein receptor CD91 is upregulated in monocytes of HIV-1-infected true long-term nonprogressors. Blood. 2003;101:4000-4. [ Links ]
10. Ullum H, Cozzi Lepri A, Victor J, Aladdin H, Phillips AN, Gerstoft J. et al. Production of beta-chemokines in human immunodeficiency virus (HIV) infection: evidence that high levels of macrophage inflammatory protein-1beta are associated with a decreased risk of HIV disease progression. J Infect Dis. 1998;177:331-6. [ Links ]
11. Li Q, Duan L, Estes Jd, Ma ZM, Rourke T, Wang Y et al.Peak SIV replication in resting memory CD4+ T cells depletes gut lamina propria CD4+ T cells. Nature. 2005;434:1148-52. [ Links ]
12. Barker E, Mackewicz CE, Reyes-Teran G, Sato A, Stranford SA, Fujimura SH, et al. Virological and immunological features of long-term human immunodeficiency virus-infected individuals who have remained asymptomatic compared with those who have progressed to acquired immunodeficiency syndrome. Blood. 1998;92:3105-14. [ Links ]
13. Rosenberg ES, Billingsley JM, Caliendo AM, Boswell SL, Sax PE, Kalams SA et al. Vigorous HIV-1-specific CD4+ T cell responses associated with control of viremia. Science. 1997;278:1447-50. [ Links ]
14. Imami N, Pires A, Hardy G, Wilson J, Gazzard B, Gotch F. A balanced type 1/type 2 response is associated with longterm nonprogressive human immunodeficiency virus type 1 infection. J Virol. 2002;76:9011-23. [ Links ]
15. Jin X, Bauer DE, Tuttleton SE, Lewin S, Gettie A, Blanchard J, et al. Dramatic rise in plasma viremia after CD8(+) T cell depletion in simian immunodeficiency virus-infected macaques. JEM. 1999;189:991-8. [ Links ]
16. Nilsson J, Boasso A, Velilla PA, Zhang R, Vaccari M, Franchini G, et al. HIV-1-driven regulatory T-cell accumulation in lymphoid tissues is associated with disease progression in HIV/AIDS. Blood. 2006;108:3808-17. [ Links ]
17. Paroli M, Propato A, Accapezzato D, Francavilla V, Schiaffella E, Barnaba V. The immunology of HIV-infected long-term non-progressors -a current view. Immunol Lett. 2001;79:127-9. [ Links ]
18. Betts MR, Krowka JF, Kepler TB, Davidian M, Christopherson C, Kwok S et al. Human immunodeficiency virus type 1-specific cytotoxic T lymphocyte activity is inversely correlated with HIV type 1 viral load in HIV type 1-infected long-term survivors. AIDS Res Hum Retroviruses. 1999;15:1219-28. [ Links ]
19. Blackbourn DJ, Mackewicz CE, Barker E, Hunt TK, Herndier B, Haase AT, et al. Suppression of HIV replication by lymphoid tissue CD8+ cells correlates with the clinical state of HIV-infected individuals. PNAS. 1996;93:13125-30. [ Links ]
20. Mackewicz CE, Ortega HW, Levy JA. CD8+ cell anti-HIV activity correlates with the clinical state of the infected individual. J Clin Invest. 1991;87:1462-6. [ Links ]
21. Mackewicz CE, Yang LC, Lifson JD, Levy JA. Non-cytolytic CD8 T-cell anti-HIV responses in primary HIV-1 infection. Lancet. 1994;344:1671-3. 22. Zapata W, Montoya CJ, Rugeles MT. Soluble factors with inhibitory activity against type 1 human immunodeficiency virus. Biomédica. 2006;26:451-66. [ Links ] [ Links ]
23. Kamin-Lewis R, Abdelwahab SF, Trang C, Baker A, DeVico AL, Gallo RC et al. Perforing-low memory CD8+ cells are the predominant T cells in normal humans that synthesize the beta -chemokine macrophage inflammatory protein-1beta. PNAS. 2001;98:9283-8. [ Links ]
24. Montefiori DC, Pantaleo G, Fink LM, Zhou JT, Zhou JY, Bilska M et al. Neutralizing and infection-enhancing antibody responses to human immunodeficiency virus type 1 in longterm nonprogressors. J Infect Dis. 1996;173:60-7. [ Links ]
25. Rusconi S, Berlusconi A, Papagno L, Colombo MC, De Maddalena C, Riva A et al. Patterns of in vitro anti-human immunodeficiency virus type 1 antibody production in long-term nonprogressors. Clin Immunol Immunopathol. 1997;85:320-3. [ Links ]
26. Richardson MW, Mirchandani J, Duong J, Grimaldo S, Kocieda V, Hendel H et al. Antibodies to Tat and Vpr in the GRIV cohort: differential association with maintenance of long-term non-progression status in HIV-1 infection. Biomed Pharmacother. 2003;57:4-14. [ Links ]
27. Furci L, Scarlatti G, Burastero S, et al. Antigen-driven C-C chemokine-mediated HIV-1 suppression by CD4(+) T cells from exposed uninfected individuals expressing the wild-type CCR-5 allele. JME. 1997;186:455-60. [ Links ]
28. Dean M, Carrington M, Winkler C, Huttley GA, Smith MW, Allikmets R et al. Genetic restriction of HIV-1 infection and progression to AIDS by a deletion allele of the CKR5 structural gene. Hemophilia Growth and Development Study, Multicenter AIDS Cohort Study, Multicenter Hemophilia Cohort Study, San Francisco City Cohort, ALIVE Study. Science. 1996;273:1856-62. [ Links ]
29. Reynes J, Portales P, Segondy M, Baillat V, André P, Réant B et al. CD4+ T cell surface CCR5 density as a determining factor of virus load in persons infected with human immunodeficiency virus type 1. J Infect Dis. 2000;181:927-32. [ Links ]
30. Martin MP, Dean M, Smith MW, Winkler C, Gerrard B, Michael NL, et al. Genetic acceleration of AIDS progression by a promoter variant of CCR5. Science. 1998;282:1907-11. [ Links ]
31. Clegg AO, Ashton LJ, Biti RA, Badhwar P, Williamson P, Kaldor JM, et al. CCR5 promoter polymorphisms, CCR5 59029A and CCR5 59353C, are under represented in HIV- 1-infected long-term non-progressors. The Australian Long- Term Non-Progressor Study Group. AIDS. 2000;14:103-8. [ Links ]
32. Kostrikis LG, Huang Y, Moore JP, Wolinsky SM, Zhang L, Guo Y, et al. A chemokine receptor CCR2 allele delays HIV-1 disease progression and is associated with a CCR5 promoter mutation. Nat Med. 1998;4:350-3. [ Links ]
33. Vidal F, Vilades C, Domingo P, Broch M, Pedrol E, Dalmau D, et al. Spanish HIV-1-infected long-term nonprogressors of more than 15 years have an increased frequency of the CX3CR1 249I variant allele. J Acquir Immune Defic Syndr. 2005;40:527-31. [ Links ]
34. Aiuti A, Webb IJ, BleuL C, Springer T, Gutierrez-Ramos JC. The chemokine SDF-1 is a chemoattractant for human CD34+ hematopoietic progenitor cells and provides a new mechanism to explain the mobilization of CD34+ progenitors to peripheral blood. JEM. 1997;185:111-20. [ Links ]
35. Winkler C, Modi W, Smith MW, Nelson GW, Wu X, Carrington M, et al. Genetic restriction of AIDS pathogenesis by an SDF-1 chemokine gene variant. ALIVE Study, Hemophilia Growth and Development Study (HGDS), Multicenter AIDS Cohort Study (MACS), Multicenter Hemophilia Cohort Study (MHCS), San Francisco City Cohort (SFCC). Science. 1998;279:389-93. [ Links ]
36. Liu H, Chao D, Nakayama EE, Taguchi H, Goto M, Xin X, et al. Polymorphism in RANTES chemokine promoter affects HIV-1 disease progression. PNAS. 1999;96:4581-5. [ Links ]
37. Macdonald KS, Fowke KR, Kimani J, Dunand VA, Nagelkerke NJ, Ball TB, et al. Influence of HLA supertypes on susceptibility and resistance to human immunodeficiency virus type 1 infection. J Infect Dis. 2000;181:1581-9. [ Links ]
38. O Brien SJ, Nelson GW. Human genes that limit AIDS. Nat Genet. 2004;36:565-74. [ Links ]
39. Wang B, Mikhail M, Dyer WB, Zaunders JJ, Kelleher AD, Saksena NK.First demonstration of a lack of viral sequence evolution in a nonprogressor, defining replication-incompetent HIV-1 infection. Virology. 2003;312:135-50. [ Links ]
40. Crotti A, Neri F, Corti D, Ghezzi S, Heltai S, Baur A, et al. Nef alleles from human immunodeficiency virus type 1-infected long-term-nonprogressor hemophiliacs with or without late disease progression are defective in enhancing virus replication and CD4 down-regulation. J Virol. 2006;80:10663-74. [ Links ]
41. Zhang L, Huang Y, Yuan H, Tuttleton S, Ho DD. Genetic characterization of vif, vpr, and vpu sequences from longterm survivors of human immunodeficiency virus type 1 infection. Virology. 1997;228:340-9. [ Links ]
42. Menzo S, Sampaolesi R, Vicenzi E, Santagostino E, Liuzzi G, Chirianni A, et al. Rare mutations in a domain crucial for V3-loop structure prevail in replicating HIV from long-term non-progressors. AIDS. 1998;12:985-97. [ Links ]














