Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Infectio
Print version ISSN 0123-9392
Infect. vol.13 no.4 Bogotá Oct./Dec. 2009
ARTICULOS ORIGINALES
1 Laboratorio de Parasitología Molecular, Pontificia Universidad Javeriana, Bogotá, D.C., Colombia
2 Grupo de Inmunobiología y Biología Celular, Pontificia Universidad Javeriana, Bogotá, D.C., Colombia
3 Fundación Clínica Abood Shaio, Bogotá, D.C., Colombia
Recibido: 09/11/2009; Aceptado: 19/10/2009
Resumen
Dada la cronicidad y persistencia del parásito Trypanosoma cruzi en la enfermedad de Chagas, el control homeostático de la respuesta inmunitaria para prevenir el daño tisular y limitar la duración del proceso inflamatorio involucra células con potencial regulador como las células dendríticas y los linfocitos T reguladores. Es por tal motivo que el objetivo de este estudio fue evaluar la proporción de células dendríticas totales, subpoblaciones de células dendríticas mieloides y plasmacitoides y los linfocitos T reguladores naturales en pacientes con enfermedad de Chagas y controles sanos.
Las células mononucleares de sangre periférica de 18 pacientes con enfermedad crónica de Chagas y 16 controles sanos se sometieron a marcación para células dendríticas mieloides Lin- HLA-DR+ CD11c+, CD plasmacitoides Lin- HLA-DR+ CD123+ y linfocitos T reguladores naturales CD3+ CD4+ CD25+ Foxp3+ CD127bajo. Las proporciones celulares se calcularon mediante el porcentaje obtenido por citometría de flujo.
Se encontró que la proporción de células dendríticas plasmacitoides es menor que la de las mieloides, tanto en pacientes con enfermedad crónica de Chagas como en controles sanos, sin diferencias significativas entre ambos grupos. En contraste, se encontró una proporción significativamente mayor de linfocitos T reguladores naturales en los pacientes con enfermedad de Chagas al comparar con los controles sanos. En conclusión, la mayor proporción de linfocitos T reguladores naturales en pacientes con enfermedad crónica de Chagas sugiere que estas células pueden estar contribuyendo en la patogénesis de la enfermedad.
Palabras clave: enfermedad de Chagas, Trypanosoma cruzi, células dendríticas, linfocitos T reguladores.
Abstract
Given the chronicity and persistence of the parasite Trypanosoma cruzi in the Chagas disease victims, the homeostatic control of immune response to prevent tissue damage and limit the duration of the inflammatory process involves cells with regulatory potential as dendritic cells (DC) and regulatory T cells. For this reason, the objective of this study is to evaluate the proportion of total DC, myeloid and plasmacytoid DC subpopulations and natural regulatory T cells in chronic chagasic patients and healthy control subjects. Peripheral blood mononuclear cells (PBMC) from 18 chronic chagasic patients and 16 healthy control subjects were staining to myeloid DC Lin- HLA-DR+ CD11c+, plasmacytoid DC Lin-, HLA-DR+, CD123+ and natural regulatory T lymphocytes CD3+ CD4+ CD25+ Foxp3+ CD127low. Cellular proportions were calculated using the percentage obtained by flow cytometry. It was found that plasmacytoid CD proportion was lower than myeloid CD in both, chronic chagasic patients and healthy control subjects, without significant differences between the two groups. On the contrary, it was found that the proportion of natural regulatory T cells was significantly higher in chronic chagasic patients than in healthy control subjects upon comparing the two. These results suggest that the higher proportion of natural regulatory T cells in chronic chagasic patients might contribute to the disease pathogenesis.
Key words: Chagas disease, Trypanosoma cruzi, dendritic cells, regulatory T lymphocytes.
Introducción
Frente a la estimulación antigénica por un patógeno, se lleva a cabo la expansión y diferenciación de los linfocitos con el fin de controlar la infección y lograr la eliminación del antígeno. Posteriormente, ocurre un proceso de contracción debido a la muerte de la mayoría de los linfocitos, y permanece una pequeña población de células de memoria que provee inmunidad por largos periodos y brinda protección frente a nuevos encuentros con el patógeno (1).
Esta dinámica de la respuesta inmunitaria se encuentra bajo un estricto control de células que pueden estimular la activación de la respuesta o regularla negativamente con el fin de evitar el daño tisular. Sin embargo, dado que la naturaleza del estímulo antigénico, el microambiente y la proporción de poblaciones celulares, determinan el perfil de activación y la cinética de la respuesta inmunitaria (2), en el caso de las infecciones crónicas, la persistencia del antígeno afecta de manera importante la actividad de los componentes del sistema inmunitario.
La enfermedad de Chagas, causada por el hemoflagelado Trypanosoma cruzi, representa un problema de salud pública en América Latina (3,4). En Colombia, se estima que 700.000 personas están infectadas y 23% de la población se encuentra en riesgo de contraer la enfermedad, con 30.000 a 40.000 nuevos casos por año (5). La enfermedad se presenta con una fase aguda asociada a la inducción de la respuesta inmunitaria que no logra la eliminación total del antígeno. Debido a lo anterior, los individuos infectados progresan a la fase crónica indeterminada, caracterizada por ausencia de sintomatología.
De estos individuos, alrededor de 30% a 40% desarrollan la fase crónica sintomática con manifestaciones cardiacas o digestivas (6,7,8).
El control homeostático de la respuesta inmunitaria para prevenir el daño tisular y limitar la duración del proceso inflamatorio, involucra células con potencial regulador que forman parte de la inmunidad innata y adaptativa tales como las células dendríticas (9,10) y los linfocitos T reguladores (11).
Las celulas dendriticas (CD) humanas se han dividido clasicamente en dos grupos, de acuerdo con la expresion de marcadores de superficie. Las celulas dendriticas mieloides que expresan el marcador CD11c+ y marcadores mieloides como CD13+ y CD33+, y requieren del factor estimulador de colonias granulo-monociticas (granulocyte-macrophage colony-stimulating factor, GM-CSF) para sobrevivir (12,13,10). Las celulas dendriticas plasmacitoides que son CD11c-, expresan la cadena ¿ del receptor de IL-3 (CD123) y requieren de IL-3, pero no de GM-CSF, para sobrevivir (14,15,16).
Los linfocitos T reguladores involucran dos grupos principales, los linfocitos T reguladores naturales (LTreg) y los linfocitos T reguladores periféricos. Los linfocitos T reguladores naturales, caracterizados por la expresión de CD25 y el factor de transcripción Foxp3, se generan en el timo y, aun cuando poseen un repertorio enfocado a antígenos propios, también son capaces de responder a antígenos extraños (17). Los linfocitos T reguladores periféricos, o adaptativos, incluyen varias poblaciones que, en general, se generan bajo la estimulación antigénica y expresan CD25, pero son negativos para Foxp3 en ausencia de estímulo (18,19).
Debido a la importancia de estas células en el control de la respuesta inmunitaria frente a patógenos persistentes, el objetivo del presente trabajo fue evaluar la proporción de células dendríticas totales, subpoblaciones de células dendríticas mieloides (CDm) y plasmacitoides (CDp). Además, debido a que se ha observado que se encuentra un gran infiltrado de linfocitos T reguladores naturales en los sitios de infección, que dependen de la presencia del patógeno para sobrevivir (17), se evaluó la proporción de estas células en pacientes con enfermedad crónica de Chagas y controles sanos.
Materiales y métodos
Población en estudio
Para establecer la proporción de las poblaciones celulares, se seleccionaron 18 pacientes con enfermedad crónica de Chagas y 16 individuos sanos control, quienes firmaron el respectivo consentimiento informado. Los pacientes, con un promedio de edad de 56±11 años, fueron seropositivos para las pruebas de IFI (inmunofluorescencia indirecta) y ELISA (enzyme-linked immunosorbent assay) frente al parásito T. cruzi (20). Los individuos sanos, con un promedio de edad de 27±9 años, provenían de áreas no endémicas; sus pruebas serológicas para T. cruzi fueron negativas y su examen clínico, normal.
El presente estudio fue evaluado y aprobado por el Comité de Ética de la Facultad de Ciencias de la Pontificia Universidad Javeriana y la Fundación Clínica Abood Shaio.
Determinación de poblaciones celulares por citometría de flujo
A partir de muestras de sangre anticoagulada con heparina, se obtuvieron células mononucleares de sangre periférica con gradientes de Ficoll-Hypaque (Sigma Aldrich, St. Louis, MO, USA). Se realizó marcación de superficie de 1x106 células mononucleares de sangre periférica para las poblaciones de células dendríticas mieloides y plasmacitoides con conjugados para linaje-1 (CD3, CD14, CD16, CD19, CD20, CD56) FITC, HLA-DR-Pe-Cy7, CD11c-APC y CD123-PerCP-Cy5,5 (BD Biosciences, San José, CA, USA), durante 30 minutos a 4°C.
Para las poblaciones de linfocitos T reguladores naturales, se realizó marcación de superficie de 1x106 células mononucleares de sangre periférica para CD3-FITC, CD4- PerCP, CD25-Pe-Cy7 y CD127-Biotina (BD Biosciences, San José, CA, USA), durante 30 minutos a 4°C, seguido del anticuerpo SAV APC-Cy7 por 30 minutos a 4°C para revelar el marcador CD127. Posteriormente, se fijó y permeabilizó con el amortiguador de fijación y permeabilización del estuche comercial Human regulatory T cell staining (eBioscience, San Diego, CA, USA), durante 45 minutos a 4°C, para la marcación intracelular del factor de transcripción Foxp3-PE.
La población CD3+ CD4+ CD25+ se seleccionó utilizando como parámetro negativo para la expresión de CD25 la población CD3+ CD4- CD25+ obtenida en el análisis de cada una de las muestras. Las células fueron adquiridas en un citómetro de flujo FACS Canto (BD Bioscience, San José, CA, USA) y analizadas con el programa FlowJo v 7.2.5 (Tree star, Ashland, OR, USA).
Análisis estadístico
Las diferencias entre los grupos de estudio se determinaron mediante la prueba t de Student, utilizando el software GraphPad Prism 5.0. Se consideraron diferencias estadísticamente significativas cuando p<0,05.
Las diferencias entre los grupos de estudio se determinaron mediante la prueba t de Student, utilizando el software GraphPad Prism 5.0. Se consideraron diferencias estadísticamente significativas cuando p<0,05.
Resultados
El análisis de las células dendríticas se realizó sobre la población total de células mononucleares de sangre periférica, seleccionando la población sin expresión de marcadores de linaje y con alta expresión de la molécula del complejo mayor de histocompatibilidad de clase II HLA-DR, que corresponde a las células dendríticas totales (figura 1A).
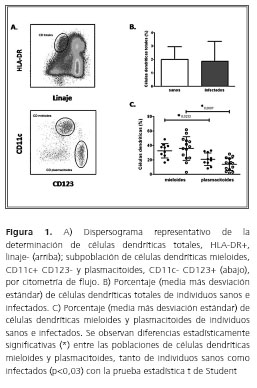
La comparación entre las poblaciones de células dendríticas totales en el grupo de pacientes con enfermedad crónica de Chagas y controles sanos, no mostró diferencia (figura 1B). Sobre esta población se analizó la expresión de los marcadores CD11c y CD123, para la determinación de subpoblaciones de células dendríticas mieloides y plasmacitoides, respectivamente (figura 1A). Se encontró una mayor población de células dendríticas mieloides al comparar con las plasmacitoides, sin diferencia entre pacientes con enfermedad crónica de Chagas y controles sanos (figura 1C).
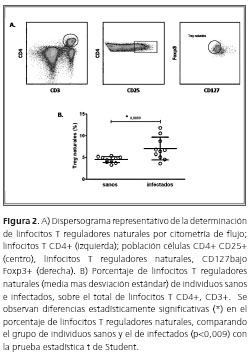
Para el análisis de linfocitos T reguladores, se seleccionaron los linfocitos T (LT) CD3+ CD4+, sobre los cuales se determinaron aquellos que expresaron el marcador CD25. Sobre esta región, se seleccionó la población de células con baja expresión del marcador CD127 positivas para la expresión del factor de transcripción Foxp3, correspondientes a linfocitos T reguladores naturales (figura 2A). La comparación de estas células mostró una proporción significativamente mayor en los pacientes con enfermedad de Chagas, al comparar con los controles sanos (figura 2B).
Discusión
Las celulas dendriticas perifericas reconocen senales de peligro por medio de receptores que incluyen la familia de los receptores TLR (toll-like receptors), lectinas de union a manosa y receptores ß-glucano como dectina-1 (21). En general, una vez las celulas dendriticas que se encuentran en los tejidos perifericos se activan y fagocitan el antigeno, migran por la linfa a los ganglios linfaticos, en donde activan las celulas T especificas de antigeno. Durante esta migracion, ocurre un proceso de maduración que involucra la pérdida de la capacidad fagocítica y el aumento de sus propiedades estimuladoras para células T CD4+ y T CD8+ vírgenes (22,9).
Ademas del papel estimulador de las celulas dendriticas, se ha descrito su papel en el control de la respuesta inmunitaria. Uno de los factores criticos en esta regulacion mediada por las celulas dendriticas, es la secrecion de la interleucina 10 (IL-10), que actua como citocina inhibitoria de la liberacion de citocinas proinflamatorias, como IFN-γ (interferon gama), IL-1ß, IL-6 y TNF∝ (factor de necrosis tumoral alfa) (23). De igual forma, se han descrito mecanismos reguladores que involucran alteracion metabolica e induccion de linfocitos T reguladores (24,25,26,27).
La determinación de la frecuencia de células dendríticas en infecciones crónicas ha mostrado resultados contradictorios. Por ejemplo, en la infección crónica por los virus de la hepatitis B (HBV) o la hepatitis C (HCV), se ha reportado disminución de la frecuencia de células dendríticas plasmacitoides asociada a alteraciones de su actividad funcional (28,29,30). Sin embargo, otros grupos han reportado valores similares de células dendríticas totales circulantes y las subpoblaciones CDm y CDp en pacientes con infección crónica por HBV y controles normales sanos (31).
Las investigaciones sobre células dendríticas en enfermedad de Chagas, han demostrado que T. cruzi infecta células dendríticas derivadas de monocitos humanos, dentro de las cuales puede replicarse e interferir con su proceso de maduración inducido por lipopolisacárido (32). Otros estudios han elucidado el efecto de antígenos derivados de T. cruzi sobre células dendríticas. Es así como la proteína Tc52, liberada por el parásito, induce
maduración de células dendríticas humanas, las cuales adquieren propiedades coestimuladoras potentes (33). En trabajos realizados por nuestro grupo, se ha demostrado que, mientras la proteína 11 de membrana de los cinetoplástidos (KMP-11) no afecta la maduración de células dendríticas (34), un fragmento de la proteína de choque térmico de 70 kDa (HSP-70) del parásito puede inducir maduración de células dendríticas y tiene un efecto diferencial en la secreción de citocinas, como IL-10 e IL-12, en pacientes con enfermedad de Chagas y controles sanos (35).
Los resultados obtenidos en este trabajo muestran que hay una mayor proporción de CDm que de CDp, sin diferencia para estas subpoblaciones o para células dendríticas totales, al comparar los pacientes con enfermedad de Chagas con los controles sanos. Estos hallazgos y lo reportado previamente, sugieren que la participación de las células dendríticas en la patogénesis de la enfermedad de Chagas puede relacionarse más con cambios en la actividad funcional de estas células que con la cantidad de las mismas.
Los linfocitos T reguladores naturales constituyen de 5% a 10% de las células T CD4+ en ratones y seres humanos, y se ha demostrado que tienen un papel especializado en el control de la respuesta inmunitaria (18,19). Estas frecuencias de linfocitos T reguladores naturales se han reportado para la población adulta en general y, aunque se han demostrado cambios inmunitarios relacionados con la edad, los cambios abruptos en la frecuencia de las células, tanto de la inmunidad innata como adaptativa, ocurren en individuos sanos alrededor de los 75 años de edad (36).
La importancia de los linfocitos T reguladores en la patogénesis de las enfermedades infecciosas crónicas se ha demostrado en varios modelos. En infección crónica por HBV y HCV, se ha demostrado un incremento de linfocitos T reguladores en enfermos al compararlos con controles sanos (37,38). En infección con HIV-1, los altos niveles de linfocitos T reguladores se asocian con una rápida progresión de la enfermedad (39).
En sangre de pacientes con mononucleosis infecciosa, la proporcion de linfocitos T reguladores se ha encontrado significativamente mas baja que en donantes seropositivos para el virus de Epstein-Barr sin manifestacion clinica. Sin embargo, se encontro aumento de las citocinas reguladoras IL-10 y TGFß(transforming growth factor beta), asociado a una disminucion en la produccion de IFNγ(40).
En el modelo en ratón de la enfermedad de Chagas, se ha propuesto que los linfocitos T reguladores no son necesarios para la evasión de la respuesta immune por T. cruzi durante la infección aguda o crónica (41). Sin embargo, los datos reportados en la infección humana muestran que la mayoría de pacientes en fase crónica indeterminada (asintomática) presentan un perfil predominante de citocinas reguladoras, al compararlos con pacientes crónicos con la forma cardiaca de la enfermedad, siendo los linfocitos T CD4+ la principal fuente de citocinas (42). La cuantificación de linfocitos T reguladores CD4+ CD25alto Foxp3+ en sangre periférica mostró una mayor frecuencia de estas células en pacientes con la forma indeterminada de la enfermedad, al compararlos con pacientes crónicos sintomáticos (43).
Aunque clásicamente los linfocitos T reguladores se han identificado por la expresión del factor de transcripción Foxp3+, se ha demostrado que en humanos la expresión de este factor puede presentarse en poblaciones de células T CD4+ bajo condiciones de activación, por lo cual se ha sugerido que el fenotipo de linfocitos T reguladores naturales en humanos es CD3+ CD4+ CD25+ Foxp3+ CD127bajo (44).
En el presente trabajo se determinó la proporción de esta población celular, que representa los linfocitos T reguladores naturales. Nuestros hallazgos demuestran que hay una mayor proporción de esta población en pacientes con enfermedad crónica de Chagas al compararlos con controles sanos. En conclusión, estos resultados sugieren que el aumento en la frecuencia de linfocitos T reguladores naturales puede contribuir a la patogénesis de la enfermedad crónica de Chagas, como efecto secundario a un mecanismo de control para evitar el daño tisular.
Agradecimientos
Este trabajo fue financiado por la Vicerrectoría Académica de la Pontificia Universidad Javeriana, proyecto número 000267. Paola Lasso fue financiada como joven investigadora de la convocatoria de 2008, Colciencias y Pontificia Universidad Javeriana.
Financiación
Departamento de Microbiología, Facultad de Ciencias, Pontificia Universidad Javeriana
Bibliografía
1. Hand TW, Kaech SM. Intrinsic and extrinsic control of effector T cell survival and memory T cell development. Immunol Res. 2009;45:46-61. [ Links ]
2. Langenkamp A, Messi M, Lanzavecchia A, Sallusto F. Kinetics of dendritic cell activation impact on priming of Th1, Th2 and non polarized T cells. Nat Immunol. 2000;1:311-6 [ Links ]
3. Schmunis GA. Epidemiology of Chagas disease in non-endemic countries: the role of international migration. Mem Inst Oswaldo Cruz. 2007;102(Suppl.1):75-85 [ Links ]
4. World Health Organization. Control of Chagas disease.WHO Technical Report Series 2002;905:1-120. [ Links ]
5. Moncayo A. Chagas disease: current epidemiological trends after the interruption of vectorial and transfusional transmission in the Southern Cone countries. Mem Inst Oswaldo Cruz. 2003;98:577-91 [ Links ]
6. Tanowitz HB, Kirchhoff LV, Simon D, Morris SA, Weiss LM, Wittner M. Chagas disease. Clin Microbiol Rev. 1992;5:400-19. [ Links ]
7. Tarleton RL, Zhang L. Chagas disease etiology: autoimmunity or parasite persistence? Parasitol Today. 1999;15:94-9 [ Links ]
8. Tarleton RL. Parasite persistence in the aetiology of Chagas disease. Int J Parasitol. 2001;31:550-4 [ Links ]
9. Lanzavecchia A, Sallusto F. The instructive role of dendritic cells on T cell responses: lineages, plasticity and kinetics. Curr Opin Immunol. 2001;13:291-8 [ Links ]
10. Steinman RM, Turley S, Mellman I, Inaba K. The induction of tolerance by dendritic cells that have captured apoptotic cells. J Exp Med. 2000;191:411-6 [ Links ]
11. Fontenot JD, Gavin MA, Rudensky AY. Foxp3 programs the development and function of CD4+CD25+ regulatory T cells. Nat Immunol. 2003;4:330-6 [ Links ]
12. Albert ML, Jegathesan M, Darnell RB. Dendritic cell maturation is required for the cross-tolerization of CD8+ T cells. Nat Immunol. 2001;2:1010-7 [ Links ]
13. Fonteneau JF, Larsson M, Somersan S, Sanders C, Mbr>ünz C, Kwok WW, et al. Generation of high quantities of viral and tumor-specific human CD4+ and CD8+ T-cell clones using peptide pulsed mature dendritic cells. J Immunol Methods. 2001;258:111-26 [ Links ]
14. Grouard G, Rissoan MC, Filgueira L, Durand I, Banchereau J, Liu YJ. The enigmatic plasmacytoid T cells develop into dendritic cells with interleukin (IL)-3 and CD40-ligand. J Exp Med 1997;185:1101-11 [ Links ]
15. Kohrgruber N, Halanek N, Gröger M, Winter D, Rappersberger K, Schmitt-Egenolf M, et al. Survival, maturation, and function of CD11c- and CD11c+ peripheral blood dendritic cells are differentially regulated by cytokines. J Immunol. 1999;163:3250-9 [ Links ]
16. Robinson SP, Patterson S, English N, Davies D, Knight SC, Reid CD. Human peripheral blood contains two distinct lineages of dendritic cells. Eur J Immunol. 1999;29:2769-78 [ Links ]
17. Suffia IJ, Reckling SK, Piccirillo CA, Goldszmid RS, Belkaid Y. Infected site-restricted Foxp3+ natural regulatory T cells are specific for microbial antigens. J Exp Med. 2006;203:777-88 [ Links ]
18. Sakaguchi, S. Naturally arising CD4+ regulatory T cells for immunologic self-tolerance and negative control of immune responses. Annu Rev Immunol. 2004;22:531-62 [ Links ]
19. Vignali DA, Collison LW, Workman CJ. How regulatory T cells work. Nat Rev Immunol. 2008;8:523-32 [ Links ]
20. Beltrán M, Duque S, Guhl F, Herrera CP, López MC, Moreno AL, et al. Prueba de ELISA y prueba de inmunofluorescencia indirecta (IFI), En: Guhl F, Nicholls RS, editores. Manual de procedimientos para el diagnóstico de la enfermedad de Chagas. Bogotá: Ministerio de Salud; 2001. p. 32-48 [ Links ]
21. Sato K, Fujita S. Dendritic cells: nature and classification. Allergol Int. 2007;56:183-91. [ Links ]
22. Russo V, Tanzarella S, Dalerba P, Rigatti D, Rovere P, Villa A, et al. Dendritic cells acquire the MAGE-3 human tumor antigen from apoptotic cells and induce a class I-restricted T cell response. Proc Natl Acad Sci USA. 2000;97:2185-90 [ Links ]
23. Jonuleit H, Schmitt E, Steinbrink K, Enk AH. Dendritic cells as a tool to induce anergic and regulatory T cells. Trends Immunol. 2001;22:394-400 [ Links ]
24. Brenk M, Scheler M, Koch S, Neumann J, Takikawa O, Häcker G, et al. Tryptophan deprivation induces inhibitory receptors ILT3 and ILT4 on dendritic cells favoring the induction of human CD4+CD25+ Foxp3+ T regulatory cells. J Immunol. 2009;183:145-54. [ Links ]
25. Cools N, Ponsaerts P, van Tendeloo VF, Berneman ZN. Balancing between immunity and tolerance: an interplay between dendritic cells, regulatory T cells, and effector T cells. J Leukoc Biol. 2007;82:1365-74 [ Links ]
26. Dhodapkar MV, Steinman RM, Krasovsky J, Munz C, Bhardwaj N. Antigen-specific inhibition of effector T cell function in humans after injection of immature dendritic cells. J Exp Med. 2001;193:233-8 [ Links ]
27. Gilliet M, Liu YJ. Generation of human CD8 T regulatory cells by CD40 ligand-activated plasmacytoid dendritic cells. J Exp Med. 2002;195:695-704 [ Links ]
28. Dolganiuc A, Chang S, Kodys K, Mandrekar P, Bakis G, Cormier M, et al. Hepatitis C virus (HCV) core proteininduced, monocyte-mediated mechanisms of reduced IFN-alpha and plasmacytoid dendritic cell loss in chronic HCV infection. J Immunol. 2006;177:6758-68 [ Links ]
29. Szabo G, Dolganiuc A. Subversion of plasmacytoid and myeloid dendritic cell functions in chronic HCV infection. Immunobiology. 2005;210:237-47 [ Links ]
30. Xie Q, Shen HC, Jia NN, Wang H, Lin LY, An BY, et al. atients with chronic hepatitis B infection display deficiency of plasmacytoid dendritic cells with reduced expression of TLR9. Microbes Infect. 2009;11:515-23 [ Links ]
31. Tavakoli S, Mederacke I, Herzog-Hauff S, Glebe D, Grün S, Strand D, et al. Peripheral blood dendritic cells are phenotypically and functionally intact in chronic hepatitis B virus (HBV) infection. Clin Exp Immunol. 2008;151:61-70 [ Links ]
32. van Overtvelt L, Vanderheyde N, Verhasselt V, Ismaili J, De Vos L, Goldman M, et al., Trypanosoma cruzi infects human dendritic cells and prevents their maturation: inhibition of cytokines, HLA-DR, and coestimulatory molecules. Infect Immun. 1999;67:4033-40 [ Links ]
33. Ouaissi A, Guilvard E, Delneste Y, Caron G, Magistrelli G, Herbault N, et al. The Trypanosoma cruzi Tc52-released protein induces human dendritic cell maturation, signals via Toll-like receptor 2, and confers protection against lethal infection. J Immunol. 2002;168:6366-74. [ Links ]
34. Santander SP, Cuéllar A, Thomas M del C, Guzmán F, Gómez A, López MC, et al. Expression of markers on dendritic cells from chronic chagasic patients stimulated with the KMP-11 protein and the K1 peptide from Trypanosoma cruzi. Biomédica. 2007;27(Suppl.1):18-27 [ Links ]
35. Cuéllar A, Santander SP, Thomas M del C, Guzmán F, Gómez A, López MC, et al. Monocyte-derived dendritic cells from chagasic patients Vs. healthy donors secrete differential levels of IL-10 and IL-12 when stimulated with a protein fragment of Trypanosoma cruzi heatshock protein-70. Immunol Cell Biol. 2008;86:255-60 [ Links ]
36. Faria AM, de Moraes SM, de Freitas LH, Speziali E, Soares TF, Figueiredo-Neves SP, et al. Variation rhythms of lymphocyte subsets during healthy aging. Neuroimmunomodulation. 2008;15:365-79 [ Links ]
37. Itose I, Kanto T, Kakita N, Takebe S, Inoue M, Higashitani K, et al. Enhanced ability of regulatory T cells in chronic hepatitis C patients with persistently normal alanine aminotransferase levels than those with active hepatitis. J Viral Hepat. 2009 May 26 Epub ahead of print. [ Links ]
38. Peng G, Li S, Wu W, Sun Z, Chen Y, Chen Z. Circulating CD4+ CD25+ regulatory T cells correlate with chronic hepatitis B infection. Immunology. 2008;123:57-65 [ Links ]
39. Cao W, Jamieson BD, Hultin LE, Hultin PM, Detels R. Regulatory T cell expansion and immune activation during untreated HIV type 1 infection are associated with disease progression. AIDS Res Hum Retroviruses. 2009;25:183-91 [ Links ]
40. Wingate PJ, McAulay KA, Anthony IC, Crawford DH. Regulatory T cell activity in primary and persistent Epstein-Barr virus infection. J Med Virol. 2009;81:870-7 [ Links ]
41. Kotner J, Tarleton R. Endogenous CD4(+) CD25(+) regulatory T cells have a limited role in the control of Trypanosoma cruzi infection in mice. Infect Immun. 2007;75:861-9 [ Links ]
42. Vitelli-Avelar DM, Sathler-Avelar R, Teixeira-Carvalho A, Pinto-Dias JC, Gontijo ED, Faria AM, et al. Strategy to assess the overall cytokine profile of circulating leukocytes and its association with distinct clinical forms of human Chagas disease. Scand J Immunol. 2008;68:516-25 [ Links ]
43. Araujo FF, Gomes JA, Rocha MO, Williams-Blangero S, Pinheiro VM, Morato MJ, et al. Potential role of CD4+CD25high regulatory T cells in morbidity in Chagas disease. Front Biosci. 2007;12:2797-806 [ Links ]
44. Dunham RM, Cervasi B, Brenchley JM, Albrecht H, Weintrob A, Sumpter B, et al. CD127 and CD25 expression defines CD4+ T cell subsets that are differentially depleted during HIV infection. J Immunol. 2008;180:5582-92. [ Links ]














