Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Infectio
Print version ISSN 0123-9392
Infect. vol.13 no.4 Bogotá Oct./Dec. 2009
ARTICULOS ORIGINALES
1 Grupo de Inmunología Molecular, Facultad Ciencias de la Salud, Universidad del Quindío, Armenia, Colombia
2 Programa de Química, Facultad de Ciencias Básicas y Tecnologías, Universidad del Quindío, Armenia, Colombia
Recibido: 24/03/2009; Aceptado: 19/10/2009
Resumen
A los extractos etanólico y etéreo de hojas y frutos de Ficus obtusifolia Kunth ( Moraceae), se les evaluó la actividad antiparasitaria contra Toxocara canis y Toxocara catis, y la antimicrobiana, contra Staphylococcus aureus, Streptococcus pyogenes, Escherichia coli y Proteus vulgaris. Asimismo, se les realizó tamización fitoquímica para determinar algunos metabolitos secundarios y se midió su toxicidad con Artemia salina.
El extracto etanólico del fruto mostró mayor mortalidad para parásitos adultos in vivo y presentó mayor inhibición embrionaria en huevos de T. canis. Ningún extracto exhibió halo de inhibición en el agar Mueller-Hinton, lo cual indica que no hay actividad antimicrobiana. Se observó mayor toxicidad frente a la A. salina a las 24 horas, para el extracto etanólico de hojas y frutos.
Palabras clave:Ficus obtusifolia Kunth, Toxocara catis, Toxocara canis, etnofarmacia.
Abstract
The antiaparatsitic activity of ether and ethanol extract in Ficus obtusifolia Kunth ( Moraceae) leaves and fruits was assessed against Toxocara canis and Toxocara catis and the antimicrobial activity against Staphylococcus aureus, Streptococcus pyogenes, E-coli and Proteus vulgaris. Likewise, phytochemical screening was conducted to determine some secondary metabolites, and their toxicity was measured with Arthemia saline.
Ethanol fruit extract showed a better mortality rate for adult parasites in vivo and showed higher embryonic inhibition in eggs of T. canis. No extract showed an inhibition halo in the Mueller-Hinton agar, which indicates that there is no antimicrobial activity. Increased toxicity was observed in contact with Arthemia saline at 24 hours for the ethanol extract of leaves and fruit.
Key Words: Ficus obtusifolia Kunth, Toxocara catis y Toxocara canis, etnopharmacy.
Introducción
Desde tiempos inmemoriales se han utilizado las plantas para el tratamiento de diversas enfermedades (1). Colombia posee una de las más grandes reservas de flora de la Tierra, en la cual se encuentran miles de plantas con propiedades curativas, muchas de las cuales deben sus efectos farmacológicos a taninos, flavonoides, alcaloides y lactonas triterpénicas, entre otros metabolitos secundarios (2,3).
Entre estas plantas se encuentra el género Ficus; por ejemplo, Ficus carica se utiliza en el control de la diabetes (4) y presenta actividad antihelmíntica (5); de Ficus glabrata se ha identificado una enzima que se usa como antiparasitaria (6).
Otra especie perteneciente a este género es Ficus obtusifolia, sobre la cual no se encontró ningún reporte científico, pero es reconocida popularmente para el tratamiento de los parásitos (7-9).
Objetivo: Es evaluar la posible actividad antihelmíntica de los extractos vegetales de F. obtusifolia Kunth ( Moraceae).
Para verificar lo anteriormente expuesto, se determinó el efecto antiparasitario de los extractos etanólico y etéreo de hojas y frutos de F. obtusifolia Kunth ( Moraceae) frente a Toxocara catis y Toxocara canis; además, se realizaron algunos ensayos de bioactividad en bacterias y Artemia salina.
Materiales y métodos
Recolección del material vegetal y obtención de los extractos
La tamización fitoquímica se llevó a cabo según la metodología de Sanabria (10). El material vegetal se recolectó en el municipio de Armenia y su clasificación taxonómica se realizó en el herbario de la Universidad del Quindío.
Se procesaron 350 g de hojas y 350 g de fruto, por separado, y se secó a 40°C durante 5 días, al cabo de los cuales se procedió a moler y tamizar.
Luego, se realizó el desengrase en extractor soxhlet con éter de petróleo (Merck®). El extracto etéreo crudo se saponificó con KOH por 5 horas y se hizo extracción con éter de petróleo. Al extracto no saponificable se le practicó un análisis fitoquímico, en el cual se evaluó la presencia de terpenos, esteroles, flavonoides, quinonas no hidroxiladas, aglicones cardiotónicos, sapogeninas pentacíclicas y lactonas terpénicas (11).
El marco restante del desengrase se lixivió con etanol al 95%, obteniendo el extracto etanólico crudo, del cual se aisló la clorofila con etanol-agua 1:7 (v/v). Seguidamente, se hizo el análisis fitoquímico para determinar la presencia de taninos, flavonoides, quinonas hidroxiladas, glicósidos cardiotónicos, saponinas, lactonas terpénicas y cumarinas (12).
Para la lectura de los resultados de estos métodos, se tuvo en cuenta la siguiente simbología:
+++: presencia en concentración abundante del metabolito,
++: presencia en concentración moderada,+: presencia en poca concentración, resultado dudoso o falso positivo y
-: ausencia del metabolito.
Recolección y obtención de los huevos de parásito
Siguiendo los procedimientos de rutina manejados en el grupo de investigación, se recolectaron parásitos adultos de T. canis y T. catis a partir de la disección del intestino delgado y grueso de los perros y gatos sacrificados mediante sobredosis de anestésicos, en la central de zoonosis de Armenia, dentro del programa de control de animales callejeros.
Los parásitos adultos obtenidos se lavaron tres veces con solución de PBS y lactato de Ringer. Posteriormente, se mantuvieron a 37°C en lactato de Ringer con suplemento de RPMI 10% (v/v), antibióticos y antimicóticos al 1% (100 unidades de penicilina, 0,1 mg estreptomicina, 0,25 µg anfotericina por ml).
Por último, se recolectaron los huevos eliminados por las hembras y se determinó su viabilidad, mediante la visualización microscópica de larvas en el interior de los huevos.
Determinación del efecto antiparasitario
El efecto antiparasitario de los extractos etanólicos y etéreos se determinó a diferentes concentraciones (100, 250, 500 y 1.000 ppm) sobre los huevos obtenidos anteriormente, por medio de un cultivo en caja de 24 pozos (Nunc®) y haciendo observaciones a los 5 días para determinar qué cantidad de huevos no tenían embrión. Cada ensayo se repitió seis veces, usando un control negativo de medio de cultivo, un control positivo de albendazol a 1.000 ppm y uno de DMSO al 5%. Después, se hizo un análisis estadístico con el programa Statgraphics Plus 5.1®, para conocer cuál causaba el mayor efecto antiparasitario sobre los huevos de los nematodos ( T. canis y T. catis).
Determinación del efecto antibacteriano de los extractos
La observación de la respuesta de las bacterias Gram positivas (Streptococos pyogenes y Staphylococcus aureus) y aislados clínicos, Gram negativas ( Proteus vulgaris y Escherichia coli DH5a) sobre los medios (base sangre, Mac- Conkey, LB sólido, Muller Hilton), en una concentración de 50.000 ppm de los extractos, se realizó por los métodos de concentración inhibitoria mínima (CIM) y por difusión con disco, usando un control positivo de cefalotina y ciprofloxacina, respectivamente; se hizo siguiendo el protocolo de los Centers for Disease Control and Prevention (CDC) de los Estados Unidos (13).
Determinación de la dosis letal media (DL50) de los extractos sobre Artemia salina
Para evaluar la respuesta de A. salina frente a F. obtusifolia, se determino la toxicidad o dosis letal media (DL50) de los extractos etanólicos se usaron a ocho concentraciones (10, 25, 50, 100, 250, 500, 750, 1.000 ppm) y un control con DMSO al 5%; se hizo por triplicado, colocando en cada vial diez artemias salinas, facilitadas por el laboratorio de principios activos de la Universidad del Quindío. Se hicieron observaciones a las 24 y 48 horas, y luego se analizó estadísticamente por el método probit para hallar la concentración de la dosis letal media de la especie (14).
Resultados y discusión
Análisis fitoquímico
El análisis fitoquímico de los extractos de F. obtusifolia Kunth reveló la presencia de taninos, flavonoides, glucósidos cardiotónicos, saponinas, sapogeninas, lactonas, cumarinas, esteroles e isoprenoides (tabla 1). Esto está de acuerdo con el artículo de Sandabe (15), quien reporta que los ficus tienen compuestos característicos, como taninos, azúcares reductores, saponinas y agliconas de flavonas. Sin embargo, en el análisis realizado por nosotros no encontramos alcaloides ni quinonas.
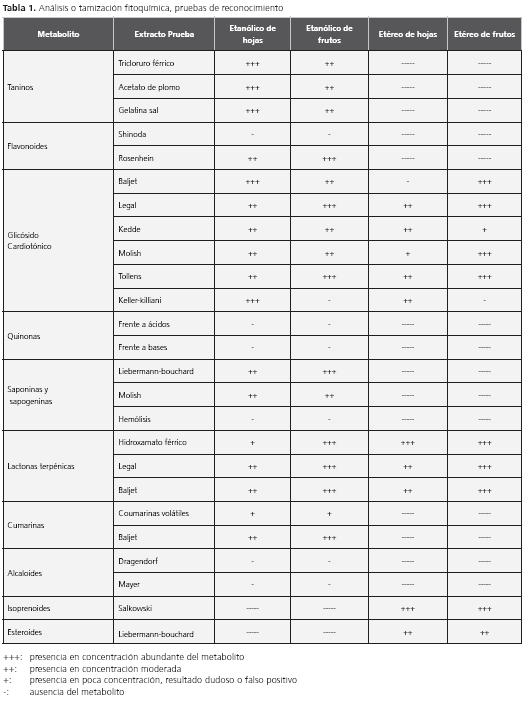
La presencia de flavonoides y cumarinas en los extractos etanólicos, y sesquiterpenlactonas en los extractos etanólicos y etéreos, presenta correlación con la actividad antibacteriana reportada por Kuete et al. para las cepas estudiadas (S. aureus, E. coli, P. vulgaris) y otras de gran interés (Streptococcus faecalis, Shigella flexneri, Pseudomonas aeruginosa), con las cuales se manejaron extractos metanólicos que contenían metabolitos secundarios, como flavonoides y terpenoides, a concentraciones variadas entre 78 y 156 µg/ml (16-18).
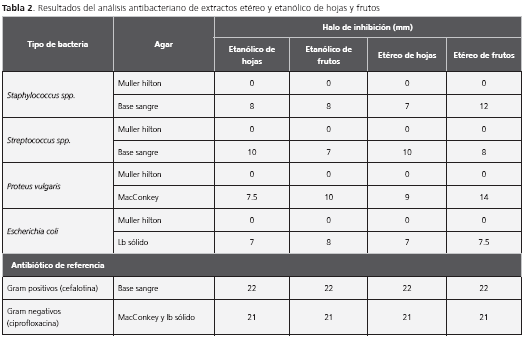
Actividad bactericida a una concentración de 50.000 ppm
Para el control, se usaron antibióticos como la cefalotina en las bacterias Gram positivas Artemia salina y S. pyogenes, las cuales mostraron un halo de inhibición de 22 mm. Para los Gram negativos E. coli y P. vulgaris, el antibiótico fue ciprofloxacina y se presentó un halo de 21 mm.
El halo de inhibición de mayor diámetro en los extractos se observó a las 24 horas y, en todos los casos, los halos fueron menores de los obtenidos con los antibióticos de referencia.
En el caso de los ensayos en Muller-Hilton, no hubo halo de inhibición en ningún sensidisco de los que contenían los extractos, pero sí apareció un halo para el antibiótico, lo cual indicaba la ausencia de actividad bactericida de los extractos. Contrario a lo reportado en otras especies, como los frutos de F. barteri; donde se reportó actividad bactericida usando compuestos como flavonoides sobre el método de MIC para las bacterias (S. aureus, B. subtilis, E. coli, P aeruginosa), encontrando distintas concentraciones de inhibición para cada cepa 19 (tabla 2).
Actividad antihelmíntica
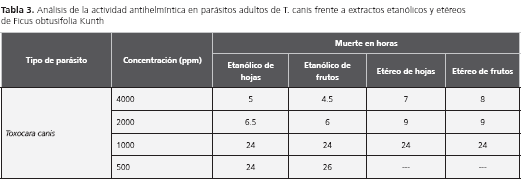
El sostenimiento de T. catis y T. canis bajó los costos del medio de cultivo RPMI, al ser reemplazado en su totalidad por lactato de Ringer con 10% de suplemento de RPMI, antibióticos y antimicótico al 1% (100 unidades de penicilina, 0,1 mg de estreptomicina, 0,25 µg de anfotericina por ml). Los ensayos de la especie vegetal frente a los helmintos se realizaron al sumergir los adultos en medio con suplemento de extracto etanólico y etéreo de hojas y frutos secos a 4.000, 2.000, 1.000 y 500 ppm, con patrones de comparación como el DMSO al 5% y el medio de cultivo.
Los resultados mostraron que la actividad antihelmíntica frente a parásitos adultos de T. canis fue más efectiva antes de las 12 horas, con los extractos etanólicos y etéreos de hojas y frutos a concentraciones de 4.000 ppm y 2.000 ppm. Las siguientes concentraciones de 1.000 ppm y 500 ppm mostraron actividad pero en un rango de tiempo más largo. En tanto, los mantenidos con DMSO al 5% y en medio de cultivo, no presentaron ningún daño en un tiempo de 62 horas. Los parásitos en medio de cultivo (ATM, lactato de Ringer y RPMI) se mantienen vivos máximo ocho días, cambiando el medio cada 48 horas (tabla 3).
Se siguen reportando excelentes avances en las investigaciones sobre plantas medicinales para estas enfermedades, con el uso de compuestos naturales. En las especies Sarothamnus scoparius y Lupinus ballianus se han encontrado alcaloides, flavonoides, saponinas y taninos, que son compuestos polares y han demostrado una considerable eficacia sobre otros helmintos como oxiuros (Enterovius vermicularis) (20).
Se ha reportado una marcada actividad antihelmíntica de los extractos metanolicos y acuosos de Euphorbia thymifolia Linn contra Pheretima posthuma y Ascardia galli en bioensayo donde se evaluó la presencia de parálisis y tiempo de muerte de los gusanos, dicha actividad antihelmíntica se ha atribuido a la presencia de taninos que son compuestos polifenólicos que pueden interactuar con las glicoproteínas de la cutícula del parásito causando la parálisis y muerte del mismo (21, 22).
Actividad ovicida frente a huevos con embrión de Toxocara canis y Toxocara catis
En la figura 1 (a), se indica que el porcentaje de ausencia de embrión en huevos de parásito de perro fue de 39,2%, mientras que para los huevos de parásito de gato dicho porcentaje fue de 38,4%.
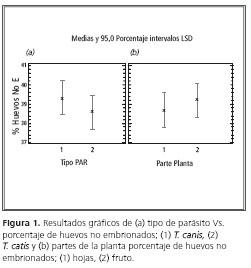
En la figura 1 (b), se indica el porcentaje de huevos sin embrión, con respecto a la parte de la planta: es mayor para los frutos (39,25%) y menor para las hojas (38,6%).
Esta gráfica permite observar que no hay una diferencia significativa entre las variables comparadas (extracto, parte de la planta), debido a que el porcentaje es casi el mismo.
En la figura 2 (a) se muestran los valores del extracto y el porcentaje de huevos sin embrión, el cual es mayor para la fase etanólica (39,6%) y menor para la fase etérea (38,2%).
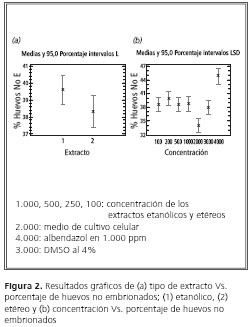
En la figura 2 (b) se observa la concentración con respecto a los huevos sin embrión, la cual muestra valores positivos para los 4.000 ppm, con un valor de 45%; el menor valor es para la concentración de 2.000 ppm (33,5%) y la de 3.000 ppm (37%), y las siguientes concentraciones están por el mismo rango.
Las variables de concentración (100, 250, 500, 1.000) presentan actividad inhibiendo la formación de embrión en los huevos; es importante observar que la concentración de 250 se aproxima más al resultado del antiparasitario (albendazol) y que para las otras el resultado es un poco más bajo.
Debido a esto se encontró que la disminución de embriones en los huevos se debe al extracto usado y no a sus concentraciones. Estos hallazgos permiten proponer que los metabolitos responsables de esta actividad son los flavonoides y lactonas terpénicas presentes.
Eguale et al. (2009) encontraron metabólitos semejantes en estudios sobre la actividad antihelmíntica de tres plantas medicinales, Lawsonia inermis L (Lythraceea), Jatropha curcas L (Euphorbiaceae) y Chenopodium ambrosioide L (Chenopodiaceae), utilizadas tradicionalmente por la comunidad como antihelmínticos contra Haemonchus contortus, helminto de rumiantes que causa una alta mortalidad en ovejas y cabras en África. Encontraron una excelente actividad contra la formación de embriones en los huevos en los extractos acuosos e hidroalcohólicos de J. curcas y C. ambbrosioide, atribuidos a la presencia del monoterpeno ascaridole en esta última planta, así como polifenoles en J. curcas. Igualmente, aunque L. inermis fue la planta que exhibió menor efecto como vermífugo y sobre la formación de embriones en los huevos, se demostró la presencia de flavonoides y glicósidos fenólicos que han mostrado actividad contra los helmintos (23).
Determinación de toxicidad frente a Artemia salina
El análisis tipo probit para la medición de la concentración letal media (CL50) de F. obtusifolia sobre A. salina, permitió obtener la figura 3a para el extracto etanólico de hojas y la figura 3b para el extracto etanólico de frutos. De este análisis se obtuvó el una CL50: 878,466 mg/ml para los extractos de F. obtusifolia. Debido a la excesiva diferencia entre las concentraciones necesarias para disminuir en 50% la población de A. salina, se propone que los metabolitos no comunes a los dos extractos evaluados son los principales responsables de la actividad citotóxica de F. obtusifolia.
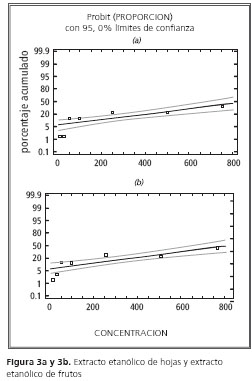
Los ensayos de esta actividad se confirman debido a la alta toxicidad que produce la leche de higuerón sobre el crustáceo Daphnia magna, que es semejante a la A. salina y muestra un porcentaje de mortalidad semejante, según lo describieron Iannacone y Alvariño 24 en el 2007 sobre la especie estudiada.
Conclusiones
La especie F. obtusifolia Kunth (Moraceae) presenta, en hojas y frutos, glucósidos cardiotónicos, saponinas, cumarinas, taninos, sesquiterpeclactonas, carotenoides y esteroles.
No se encuentran quinonas, alcaloides ni flavonoides del benzoperhidrofenantreno, en el extracto etanólico de hojas y ni en el de frutos.
Ningún extracto presenta actividad bactericida contra las bacterias estudiadas.
El extracto etanólico presenta actividad antihelmíntica contra T. canis y la concentración más efectiva en un menor tiempo es de 4.000 ppm.
Con las diferentes concentraciones de los extractos etanólico y etéreo de las partes de la planta, no se presenta una diferencia muy alta en el porcentaje de huevos sin embrión, en el tiempo en que se evaluó.
La DL50 a las 24 horas es de 784,1 µg/ml para el extracto etanólico de hojas y de 67.1387 µg/ml para el de frutos.
Agradecimientos
A la Universidad del Quindío, al Programa de Química y al Centro de Investigaciones Biomédicas.
Conflictos de interés: ninguno
Correspondencia:
Jhon Carlos Castaño Osorio. Grupo Inmunología Molecular(GYMOL). Facultad Ciencias de la Salud. Universidad del Quindío. Teléfono: +(57)6 7460168. Carrera 15 Calle 12 Norte. Armenia, Quindío, Colombia. Correo electrónico: jhoncarlos@uniquindio.edu.co.
Bibliografía
1. Norscia I, Borgognini-Tarli SM. Ethnobotanical reputation of plant species from two forests of Madagascar: A preliminary investigation. S Afr J Bot. 2006;72:656-60. [ Links ]
2. Lin YM. In vitro anti-HIV activity of biflavonoids isolated from Rhus succedanea and Garcinia multiflora. J Nat Prod. 1997;60:884-8. [ Links ]
3. Vanden Berghe, D.A., A. Haemers and A.J.Vlietinck, 1993. Antiviral agents from higher plants and an example of structureactivity relationship of 3-methoxyflavones. In: Colegate, S.M. and Molyneux (Eds.). Bioactive Natural Products.Detection, Isolation and Structual Determination. p. 405-40. [ Links ]
4. Serraclara, A., F. Hawkins, et al. Hypoglycemic action of an oral fig-leaf decoction in type-I diabetic patients. Diabetes Research and Clinical Practice. 1998; 39 ( 1): 19-22. {a} Dep. Physiol., Fac. Med., Badajoz and Serv. Endocrinol.,Univ. Hosp., 12 Octubre, Madrid, Spain. [ Links ]
5. Amorin A, Helcio R, Carauta J, Lopes D, Kaplan M. Anthelmintic activity of the latex of Ficus species. J Ethnopharmacol. 1999;64:255-8. [ Links ]
6. Hansson A, Veliz G, Naquira C, Amren M, Arroyo M And Arevalo G. Preclinical and clinical studies with latex from Ficus glabrata hbk, a traditional intestinal anthelminthic in the Amazonian area. J Ethnopharmacol. 1986;17:105-38. [ Links ]
7. Botero D, Restrepo M. Parásitosis humanas. Medellín: Corporación para Investigaciones Biológicas: 2003. p. 13, 14, 90, 93, 17, 1053. [ Links ]
8. Lanusse C, Bases moleculares de la resistencia antihelmíntica. Tandil, Argentina: Laboratorio de Farmacología, Facultad de Ciencias Veterinarias UNCPBA; 2006. [ Links ]
9. Waller P, Echevarria F, Eddi C, Maciel S, Nari A, Hansen W. The prevalence of anthelmintic resistance in nematode parasites of sheep in southern Latin America. Vet Parasitol. 1999;62:181-7. [ Links ]
10. Sanabria A. G. Análisis fitoquímico preliminar: metodología y su aplicación en la evaluación de 40 plantas de la familia compositae. Universidad Nacional de Colombia., Facultad de Ciencias, Departamento de Farmacia. Bogotá. 1988. [ Links ]
11. Bilbao MR. Análisis fitoquímico preliminar.: Universidad del Quindío. Armenia.1997. p. 6, 26, 37, 46, 51,57, 58, 59, 61- 62, 66-67 74-75, 82. [ Links ]
12. Domínguez XA. Métodos de investigación fitoquímica. México, D.F.: Editorial Limusa; 1973. p. 195-207. [ Links ]
13. INEI – ANLIS "Dr. Carlos G. Malbrán".Manual de procedimientos para la determinación de la sensibilidad a los antimicrobianos en bacterias aisladas de humanos. Fecha de consulta: 25 de mayo de 2007. Disponible en: http://http://www.cdc.gov/ncidod/dbmd/gss/publications/documents/Argentina-LevelI/Manual_procedimientos.pdf [ Links ]
14. Osorio J. Análisis del procedimiento para la determinación de la DL50 (dosis letal media) a través del método de probit en un bioensayo. Fecha de consulta: 15 de octubre de 2007. Disponible en: http://www.monografias.com/ [ Links ]
15. Sandabe U.K, Onyeyili P.A, Chibuzo G.A.Phytochemical screening and effect of aqueous extractof Ficus sycomorus L. ( Moraceae) stembark on muscular activity in laboratory animals. J Ethnopharmacol. 2005;104:283-5. [ Links ]
16. Martínez A. Flavonoides. Farmacognosia y fitoquímica. Medellín: Universidad de Antioquia. Fecha de consulta: 16 de diciembre de 2007. Disponible en: http://www.bing.com/search?srch=106&FORM=AS6&q=Mart%c3%adnez+A.+Flavonoides.+Farmacognosia [ Links ]
17. Martínez A. Esteroles. Farmacognosia y fitoquímica. Medellín: Universidad de Antioquia. Fecha de consulta: 16 de diciembre de 2007. Disponible en: http://docs.google.com/viewer?a=v&q=cache:-wFPXJegu0AJ:farmacia.udea.edu.co/~ff/esteroles2001.pdf+esteroles&hl=es&gl=co&pid=bl&srcid=ADGEESjqVKyuwrk1q6zimFf0I6b8HM6rV8STqCGnoFEDklfWwCqQFxQaTV81FyWZbPJDExDqN0XgdnBGYKyqQ0iVnkw-oEhTW1N3gbMROm_SmifFjdDOAlShVE7rxhEugBQh8ji-6yNs&sig=AHIEtbTrsUNHHerHW6_G5ihoREFVwjWwPw de 2007 [ Links ]
18. Kuete V, Metuno R, Ngameni B, Mbaveng A, Ngandeu F, Bezabih M, Etoa F, Ngadjui B, Abegaz B, Beng V. Antimicrobial activity of the methanolic extracts and compounds from Treculia africana and Treculia acuminata ( Moraceae). S Afr J Bot.2008;74:111-5. [ Links ]
19. Ogungbamila FO, Onawunmi GO, Ibewuike JC, Funmilayo KA. Antibacterial constituents of Ficus barteri fruits. Faculty of Pharmacy, Obafemi Awolowo University, Nigeria. 1997; 35: 185-9. [ Links ]
20. Salazar W, Cárdenas J, Villafuerte S, Fernández I, Villegas L, Pacheco L, Untiveros G. Estudio fitoquímico y de la actividad antihelmíntica de los extractos de Sarothamnus scoparius y Lupinus ballianus. Rev Soc Quím Perú. 2008;74: 100-7. [ Links ]
21. Kane S, Mohite S, Shete J. Antihelmintic activity of aqueous and methanolic extracts of Euphorbia thymifolia Linn. Int J Pharm Tech Res. 2009;1:666-9. [ Links ]
22. Akinmoladun A, Ibukun E, Afor E, Obuotor E, Farombi E. Phytochemical constituent and antioxidant activity of extract from the leaves of Ocimum gratissimum. Scientific Research and Essay. 2007;5:163-6. [ Links ]
23. Eguale T, Giday M. In vitro anthelmintic activity of three medicinal plants against Haemonchus contortus. Int J Green Pharm. 2009;3:29-34. [ Links ]
24. Iannacone J, Alvariño L. Ecotoxicidad acuática de dos colorantes y de tres antiparasitarios de importancia en acuicultura en Daphnia magna. Ecología Aplicada. 2007;6:1-2. [ Links ]














