Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Infectio
Print version ISSN 0123-9392
Infect. vol.13 no.4 Bogotá Oct./Dec. 2009
ARTICULOS ORIGINALES
1. Grupo de Inmunovirología, Sede de Investigación Universitaria, Universidad de Antioquia, Medellín, Colombia
Recibido: 25/07/2009; Aceptado: 19/10/2009
Resumen
Durante las infecciones crónicas la regulación inmune constituye un mecanismo esencial para controlar los procesos inflamatorios; sin embargo, la excesiva regulación impide el desarrollo de una respuesta efectora adecuada. Las células T reguladoras, las células dendríticas y algunas moléculas inhibitorias, como CTLA-4, PD-1, IL-10, TGF-ß dioxigenasa, participan en la modulación de la respuesta inmune contra el virus de la inmunodeficiencia humana (VIH) y Mycobacterium tuberculosis.
La mayoría de los hallazgos sustentan un efecto negativo de la regulación durante ambas infecciones, debido a que permiten la replicación de los patógenos. La acumulación de células T reguladoras funcionales y la expresión de estas moléculas se han asociado a un mecanismo compensador, en respuesta a la hiperactivación celular y a una inducción directa por parte de los microorganismos.
En la coinfección, el VIH favorece la reactivación de M. tuberculosis y el desarrollo de formas extrapulmonares de la enfermedad.
La infección por M. tuberculosis facilita la entrada del virus a la célula blanco y su replicación. Asimismo, se evidencia un aumento del estado de hiperactivación inmune, junto a una menor respuesta efectora. Aunque la inmunopatogénesis durante la coinfección ha sido poco estudiada, es probable que el estado proinflamatorio y de hiperactivación, característico de ambas infecciones, facilita el desarrollo de mecanismos de regulación que alteren aún más el equilibrio de la respuesta protectora durante la coinfección y facilitan la gravedad de la enfermedad.
Palabras clave: VIH, Mycobacterium tuberculosis, coinfección, regulación inmune.
Abstract
During chronic infections, the immune regulation is an important mechanism to control inflammatory processes; however, the excessive regulation prevents the development of an appropriate effector immune response. The regulatory T cells (Treg), dendritic cells (DC) and some inhibitory molecules such as CTLA- 4, PD-1, IL-10, TGF-ß e IDO take part in the modulation of the immune response against the human immunodeficiency virus (HIV) and the Mycobacterium tuberculosis (M.tb).
Most of the evidence supports a negative effect of the immune regulation during both infections, due to the fact that they allow the active replication of the pathogens. The accumulation of functional Treg cells and the expression of these molecules have been associated with a compensating mechanism, in response to a cellular hyper-activation and to these microorganisms direct induction.
During the co-infection, the HIV favors the reactivation of M.tb and the development of extra-pulmonary TB forms. The M.tb infection promotes the entry of the virus into target cells and its replication. Likewise, an increase of the immune hyper-activation state has been reported along with low effector responses. Although the immune-pathogenesis during the co-infection has not been extensively studied, most likely the pro-inflammatory and immunological hyper-activation state, typical of both infections, promotes the development of immune regulatory mechanisms that further disturb the balance between the protective and pathogenic responses during co-infection, favoring the illness severity.
Key words: HIV, Mycobacterium tuberculosis, co-infection, immune regulation.
Introducción
La infección por el virus de inmunodeficiencia humana tipo 1 (VIH-1) y la tuberculosis representan los principales problemas de salud pública en el mundo. En nuestro país, la prevalencia de la infección por el VIH-1 es de 0,6% (1), para la tuberculosis, entre 0% y 4% (2) y para la coinfección, de 2% (3).
El panorama de ambas infecciones es poco alentador, particularmente sí se tienen en cuenta las complicaciones de los individuos que se encuentran coinfectados. Entre estas infecciones existe un sinergismo; el VIH-1 es, quizá, el principal factor que facilita el desarrollo de tuberculosis activa en individuos con infección reciente o latente, mientras que M. tuberculosis incrementa la suseptibilidad al VIH-1, aumentando la morbimortalidad de estos individuos (4).
Para el desarrollo de esta revisión, se realizó una búsqueda en las bases de datos Pubmed, Medline y Ovid, combinando los términos: HIV-1 and M. tuberculosis infection, regulatory T and dendritic cells, cytokine, inhibitory molecules.
Patogénesis de la infección por VIH y por Mycobacterium tuberculosis
El daño que se produce durante el curso de la infección por estos agentes, más que un efecto directo ocasionado por el microorganismo sobre los tejidos, es debido a la respuesta inmune específica que se genera. De hecho, la patogénesis de estas infecciones es compleja y se caracteriza por disfunciones en células, tanto de la inmunidad innata como de la adaptativa.
En esta revisión se hará énfasis en las alteraciones descritas durante cada una de las infecciones y durante la coinfección, en células T relacionadas con la regulación inmune, la cual es mediada principalmente por células T reguladoras, células dendríticas y por moléculas inmunorreguladoras como son: el factor de transformación de crecimiento beta (transforming growth factor b, TGF-ß), la interleucina (IL)-10, la enzima indolamina 2,3-dioxigenasa (IDO), el receptor de muerte programada 1 (programmed death 1, PD-1) y el antígeno 4 asociado a linfocito T citotóxico (cytotoxic T-lymphocyte antigen 4, CTLA-4).
Inmunopatogénesis del VIH-1
Desde la fase aguda de la infección, las células dendríticas plasmacitoides participan en el control viral mediante la producción de interferones tipo I (5); estas citocinas inducen un ambiente hostil para la replicación viral, debido al incremento de la degradación del ácido ribonucleico (ARN) y la interrupción del ciclo celular (6). Igualmente, durante esta fase se activa la respuesta inmune adaptativa contra el virus (7), lo cual conduce a la disminución de la viremia y a un incremento de las células T CD4+ de sangre periférica durante los primeros meses de la infección. Las células T CD8+ son la población celular más importante en el control de la infección; sin embargo, la completa maduración de la maquinaria citotóxica mediada por perforinas/granzimas y muchas de sus funciones dependen de la colaboración de señales inducidas por las células T CD4+, razón por la cual la capacidad funcional de las células T CD8+ y otras poblaciones celulares se deterioran gradualmente durante el curso de la infección (8). Si bien es cierto, que muchos de estos mecanismos inmunes controlan parcialmente la replicación viral, en realidad, ninguno es completamente efectivo para eliminar el virus, debido a las distintas estrategias virales desarrolladas para evadir el sistema inmune.
El principal tejido afectado durante la infección aguda por el VIH, es el tejido linfoide asociado a la mucosa gastrointestinal (gutassociated lymphoid tissue, GALT). Durante la primoinfección las células T CD4+ de memoria efectora CCR5+ son eliminadas rápidamente como efecto directo de la replicación o por la muerte inducida por activación (9). La eliminación de células T CD4+, la replicación viral, la activación excesiva y la pérdida irreversible de la capacidad regenerativa de los órganos linfoides son eventos progresivos (9), que conllevan a un estado de inmunosupresión grave que predispone a la aparición de infecciones oportunistas, como es el caso de la infección por M. tuberculosis; en este momento es cuando el individuo infectado desarrolla el síndrome de inmunodeficiencia adquirida (sida), que, finalmente, puede llevar a la muerte del paciente.
Inmunopatogénesis por M. tuberculosis
Durante las fases iniciales de la infección, las bacterias son fagocitadas principalmente por fagocitos mononucleares residentes en los alvéolos pulmonares, los cuales modulan mecanismos efectores para controlar la replicación micobacteriana (10). Las células presentadoras de antígeno activadas liberan IL-12, citocina crítica para la expansión y diferenciación de las células T específicas de antígeno (11).
Posteriormente, entre las semanas 2 y 4, se hace evidente la respuesta específica de las células T CD4+ y CD8+ (12) las cuales, por medio de la producción de interferón gamma (IFN-γ) y el factor de necrosis tumoral (TNF-α), potencian los mecanismos efectores innatos.
A continuación, el reclutamiento de células T CD4+ activadas y la producción de citocinas proinflamatorias, median reacciones de hipersensibilidad retardada que favorece la migración de macrófagos, células T αß y γδ, células asesinas naturales (natural killer) y fibroblastos. Los fibroblastos rodean la lesión y secretan proteínas de matriz extracelular que provee una barrera física que evita la diseminación de la micobacteria (12). La consolidación de esta estructura, llamada granuloma, mantiene a la micobacteria en un estado no replicativo persistente (12).
La mayoría de los individuos infectados desarrollan una respuesta inmune capaz de contener el microorganismo, pero sin lograr su completa eliminación, lo que resulta en una infección latente (13). En este estado, la infección es controlada por un proceso dinámico y activo de la respuesta inmune; sin embargo, la activación de la micobacteria y la pérdida de este control pueden ocurrir años después de haber sido infectado, por razones aún desconocidas (14). Se estima que la reactivación ocurre en 5% a 10% de los individuos infectados, los cuales desarrollan una tuberculosis activa (14).
Alteraciones en el sistema inmune durante la infección por VIH-1 y por M. tuberculosis
Las alteraciones funcionales de las poblaciones de células T CD4+ y CD8+ y en células presentadoras de antígeno, son las más frecuentes durante el curso de la infección por el VIH-1 y la tuberculosis pulmonar activa.
Alteraciones inmunes en la infección por el VIH
Durante la infección se observa disminución de la proliferación de células T, de la producción de citocinas como IL-2 e IFNγ, y de la actividad citotóxica en respuesta a antígenos y mitógenos (8). Otras poblaciones de células, como las células dendríticas mieloides y las plasmacitoides, se encuentran disminuidas en sangre periférica por ser blanco de la infección y por su migración a ganglios linfáticos (15); las células dendríticas exhiben una disminución en la maduración, así como una alteración funcional evidenciada por una baja producción de IL-12 e IFNα (8).
Además, desde el inicio de la infección se establece un estado de hiperactivación inmunológica crónico que se observa en todos los componentes del sistema inmune (9). Las manifestaciones de esta activación inmune incluye una activación policlonal de linfocitos B (16), y un incremento en la expresión de las moléculas HLA-DR, CD-38, y en la producción de citocinas proinflamatorias (17). Este estado facilita la activación de diferentes mecanismos de regulación inmunológica, entre los que se encuentra la activación/expansión de las células T reguladoras (18), así como un aumento en las moléculas IDO, IL-10 y TGF- ß (19,20). De hecho, en células T CD4+ y CD8+, la coexpresión del HLA-DR y CD38 se correlaciona positivamente con el aumento en la activación/expansión de células T reguladoras y se asocia con una progresión más rápida de la infección (21).
Alteraciones inmunes en la infección por M. tuberculosis
En pacientes con tuberculosis activa se ha descrito la disminución en la producción de IFN-γ e IL-2, así como en la respuesta de proliferación de células T en respuesta a antígenos micobacterianos, comparado con células de individuos sanos (22). Al igual que durante la infección por el VIH-1, se ha observado un aumento de moléculas asociadas al estado de hiperactivación inmunológica durante la tuberculosis activa (17,23). Asimismo, se ha observado un incremento en la frecuencia de células T reguladoras (24) y de citocinas asociadas a la regulación inmune, como el TGF-β y la IL- 10 derivada de macrófagos y células T (25), las cuales generan un ambiente permisivo para la replicación de la micobacteria por medio de la supresión funcional de células T efectoras.
Hiperactivación y regulación inmune durante la infección por VIH-1 y por M. tuberculosis
Hiperactivación inmune
La activación persistente de todos los componentes celulares del sistema inmune innato y adaptativo, crea un ambiente pro-inflamatorio que mantiene la activación inmune. Como se comentó previamente, en este estado de hiperactivación las células expresan los marcadores CD38, HLA-DR y Ki67, y producen citocinas como TNF-α, IL-6 e IL-1 (26). Una de las consecuencias del estado de hiperactivación es la inducción de apoptosis por medio de un mecanismo conocido como la muerte inducida por activación, el cual es mediado por señales inducidas por moléculas como Fas/FasL y por citocinas pro-apoptóticas liberadas durante la activación (27). La muerte inducida por activación de células T ha sido considerada como una alteración de la respuesta inmune celular y se desarrolla como consecuencia de la estimulación repetida de las células T por antígenos persistentes.Durante la infección por el VIH-1, la eliminación masiva de los linfocitos T CD4+ es consecuencia de diferentes mecanismos, entre los cuales predomina la muerte inducida por activación (28). En pacientes con tuberculosis pulmonar, los hallazgos sugieren que la eliminación de células por la muerte inducida por activación es la causa de que exista un bajo número de células T productoras de IFN-γ (29). Este mecanismo explicaría, por lo menos parcialmente, el estado de escasa respuesta característico de la infección por M. tuberculosis, que se ha hecho evidente por la baja capacidad de proliferación y de producción de citocinas consideradas protectoras, como el IFN-γ y la IL-2 (30).
Entre los mecanismos fisiológicos del sistema inmune que controlan este estado de hiperactivación que se genera durante las infecciones crónicas, se encuentran la activación/ expansión de diferentes subpoblaciones celulares con función reguladora, como las células T reguladoras (31) y las células dendríticas, así como el aumento en la expresión de moléculas que ejercen esta misma función mediante diferentes mecanismos (31), los cuales serán revisados a continuación.
Regulación inmune
La regulación inmune constituye un mecanismo esencial para controlar la activación del sistema inmune, una vez se ha eliminado el reto antigénico; de esta manera, se previene el desarrollo de procesos inflamatorios exacerbados. Sin embargo, en las infecciones crónicas la excesiva respuesta reguladora impide el desarrollo de una respuesta inmune efectora adecuada, lo que facilita el establecimiento de la infección (32). Por lo tanto, debe existir un cuidadoso equilibrio entre los mecanismos efectores y los reguladores, para evitar el daño tisular sin que se altere el desarrollo de una respuesta inmune protectora anti-microbiana.
Las células T reguladoras y las células dendríticas participan en la modulación de la respuesta inmune contra diferentes agentes patógenos. Las células T reguladoras son una subpoblación de células T CD4+ caracterizadas por ser potentes inhibidores de la actividad funcional de diferentes poblaciones celulares, como células T efectoras y células presentadoras de antígeno, entre otras (31). Las células T reguladoras se caracterizan por expresar el receptor CD25 y el factor de transcripción FOXP3 (forkhead box protein 3). Estas células alteran el umbral de activación, y la capacidad de proliferar y de producir citocinas involucradas en la función efectora.
Las células dendríticas inmaduras se caracterizan por la baja producción de citocinas y la deficiente expresión de moléculas estimuladoras; tienen capacidad tolerogénica disminuyendo la respuesta efectora por medio de la conversión de células T efectoras en células T reguladora (33). Las células dendríticas plasmacitoides también pueden regular el sistema inmune mediante la producción de moléculas como IDO, IL-10 y TGF-β, que regulan la respuesta efectora (34,35).
La IDO es una enzima que cataliza la degradación del triptófano en la vía metabólica de la quinurenina, que resulta en la acumulación de catabolitos inmunosupresores en el ambiente extracelular (36). Estos metabolitos suprimen la proliferación e inducen apoptosis de células T (36). La IL-10 regula negativamente la producción de citocinas pro-inflamatorias,particularmente IL-12, así como la expresión de moléculas coestimuladoras y del complejo mayor de histocompatibilidad (CMH) clase II en células presentadoras de antígeno (37), comprometiendo, de esta manera, su habilidad para estimular células T. El TGF-ß, por su parte, interfiere con la proliferación, la secreción de citocinas y la actividad citotóxica de células T (38-41).
Hallazgos recientes sugieren que la interacción entre las células T reguladoras y las dendríticas es necesaria para mantener el sistema inmune en equilibrio. Por medio de la IL-10, las células T reguladoras pueden afectar el desarrollo de las células dendríticas, previniendo su maduración (33) o bien induciendo la expresión de moléculas inmunosupresoras como la B7-H4 (42), molécula involucrada en la regulación negativa de la activación celular, la progresión del ciclo celular, la citotoxidad y la producción de citocinas como IL-2 e IFN-γ (43).
Otras moléculas inhibitorias con función reguladora son el PD-1 y el CTLA-4, pertenecientes a la familia de la molécula del CD28. El PD-1 disminuye la activación e induce la apoptosis en células T (44,45), mientras que el CTLA-4 disminuye la activación celular y promueve la producción de IDO en células presentadoras de antígeno (46).
Regulación inmune durante la infección por VIH y por M. tuberculosis
Infección por VIH
En los últimos años se ha acumulado información que sugiere que las células T reguladoras juegan un papel importante en la patogénesis de la infección por el VIH. Durante la infección aguda es probable que estas células tengan un efecto benéfico al controlar el estado de hiperactivación inmunológica, mecanismo responsable de la destrucción masiva de linfocitos T CD4+ (47); por otro lado, la mayor parte de la información sustenta un efecto perjudicial durante la fase crónica de la infección, debido a que afecta el desarrollo de la respuesta específica contra el virus, lo que permite la replicación viral descontrolada y, por ende, el progreso de la infección (48).
En GALT y otros órganos linfoides, la frecuencia y la actividad funcional de las células T reguladoras están aumentadas (49), lo cual se ha correlacionado positivamente con la carga viral (50). La acumulación de células T reguladoras funcionales se debe tanto a un mecanismo de compensación, en respuesta a la excesiva activación celular que se observa en este tejido, como también a un efecto directo del virus sobre esta población celular mediado por interacciones CD4-glucoproteína120 (gp120), que promueven la supervivencia y expansión de células T reguladoras (51).
En individuos con replicación viral activa que no han recibido tratamiento antirretroviral, la frecuencia de células T reguladoras se encuentra incrementada en la mucosa duodenal a pesar de la gran eliminación de células T CD4+ efectoras que se observa en este tejido (50). En amígdala, se ha observado una mayor expresión de ARN mensajero (ARNm) de proteínas asociadas con la supresión inmune de células T reguladoras, como FOXP3, CTLA-4, TGF-ß y la IDO 2,3-dioxigenasa (52).
Por el contrario, en individuos catalogados como los que no progresan, la frecuencia de células T reguladoras en estos tejidos es baja, similar a lo que se observa en individuos no infectados, lo que sugiriere que las células T reguladoras afectan el desarrollo de respuestas inmunes efectoras, favoreciendo la replicación viral y la subsecuente progresión de la infección (51). A nivel funcional, la remoción in vitro de la subpoblación CD4+CD25+ de células mononucleares de sangre periférica de pacientes positivos para VIH incrementa la respuesta inmune específica contra el virus, aumenta la expresión de citocinas como IFN-ß y la citotoxicidad de células T CD8+ (53).
Los individuos positivos para VIH tienen un incremento en el catabolismo del triptófano y en la expresión de IDO en sangre periférica y órganos linfoides (20); esto se ha asociado con la acumulación de células dendríticas plasmacitoides en estos órganos y con la inducción en la producción de IDO por interacción directa con la gp120 del virus (20,54). La frecuencia de células dendríticas inmaduras en ganglios linfáticos es significativamente mayor en pacientes sin tratamiento antirretroviral y se asocia con la inducción directa o indirecta de células T reguladoras (55), esta última por medio del TGFß y la IDO producida por las células dendríticas plasmacitoides (34,35).
Otras moléculas con actividad inhibitoria, asociadas a la disfunción de la respuesta efectora y expresadas durante la infección por el VIH, son el PD-1 y el CTLA-4. El PD-1 se expresa en mayor proporción en células T específicas de VIH (56), lo que se asocia con alteraciones funcionales en esta población celular y progresión de la enfermedad (56). La expresión del PD-1 se correlaciona positivamente con el aumento en la carga viral y negativamente con el conteo de células T CD4+ (56,57). La expresión de esta molécula es mayor en células T CD4+ de ganglio linfático que en sangre periférica y disminuye con la terapia antirretroviral (57).
El CLTA-4 es expresado en mayor proporción en células T CD4+ comparado con células T CD8+ de individuos positivos para VIH (58); la expresión de esta molécula se correlaciona negativamente con la capacidad de las CD4+ de producir IL-2 en respuesta a antígenos virales y, positivamente, con la progresión de la enfermedad, hallándose una baja expresión en individuos que no progresan que controlan la viremia en ausencia de terapia antirretroviral (58).
La relevancia de los mecanismos de regulación durante la patogénesis de la infección se ha hecho evidente claramente en modelos animales de Macaca mulatta (monos rhesus) infectados con el virus de inmunodeficiencia simiana (VIS), en los cuales el tratamiento con anticuerpos bloqueadores anti-CTLA-4 y anti- PD-1 aumenta la respuesta inmune específica contra el virus, disminuye los niveles de carga viral, aumenta el recuento de células T CD4+ en sangre periférica e incrementa la supervivencia de los monos infectados (59,60); estos resultados abren nuevas posibilidades para la búsqueda de futuras estrategias terapéuticas que controlen la regulación inmune exacerbada durante la infección por el VIH, modulando la expresión de estas moléculas.
Infección por M. tuberculosis
Se ha demostrado que durante la tuberculosis pulmonar la frecuencia de células T reguladoras y la expresión de las moléculas asociadas a la regulación inmune, como CTLA-4, FOXP3 y TGF-ß, se encuentran elevadas en sangre periférica cuando se compara con los valores obtenidos de los controles sanos (25,61,62). Igualmente, las células T reguladoras de pacientes con tuberculosis pulmonar tienen mayor capacidad supresora sobre las células productoras de IFN-γ que la de los controles sanos (61).
En pacientes con tuberculosis pulmonar, las células T reguladoras se acumulan en los sitios de replicación micobacteriana, por lo que estas células son más frecuentes en tejido pulmonar en comparación con los niveles de sangre periférica (61,63). Esto indica que la acumulación de células T reguladoras está influenciando la capacidad de las células T efectoras para generar la respuesta inmune, directamente en los sitios de infección activa. El comportamiento de las células T reguladoras durante la tuberculosis se relaciona con el estado clínico o la gravedad de la enfermedad; la frecuencia de esta población celular disminuye a niveles similares a los de de Mycobacterium tuberculosis durante la infección por el virus de inmunodeficiencia humana. Infectio. 2009 13 (4) los controles sanos cuando el paciente ha sido tratado con la terapia anti-tuberculosa (61). Además, se ha descrito una mayor expresión de los ARNm de FOXP3 en células mononucleares de sangre periférica en pacientes con tuberculosis extrapulmonar comparados con pacientes con tuberculosis pulmonar (64). Aunque aún no es claro el comportamiento de las células T reguladoras durante la tuberculosis latente, se ha postulado que la baja expresión de FOXP3 y la baja frecuencia de células T reguladoras en sangre periférica comparada con la de pacientes con tuberculosis activa (65,66) y controles sin infectar (66), probablemente se deban a un secuestro gradual de células T reguladoras en el pulmón (66).
Es posible que la expansión de células T reguladoras por M. tuberculosis se realice de una forma indirecta mediante la modulación de la función de las células dendríticas, debido a que la interacción del receptor de manosa y el lipoarabinomanan manosa (ManLam) de M. tuberculosis reduce la producción de IL-12 y TNFα, e incrementa la producción de IL-10 (67). Otros antígenos, como los de la región de diferenciación 1 (RD-1), modulan la maduración de células dendríticas regulando negativamente la respuesta proinflamatoria de células T por el incremento de respuesta reguladora, mecanismo que fue asociado al aumento de la secreción de IL-10 y TGFß, y a la inducción de células T reguladoras (68).
Las moléculas PD-1 y CTLA-4 también participan en la inmunopatogénesis de M. tuberculosis. La estimulación con antígenos micobacterianos incrementa el número de células CD3+PD-1+ en sangre periférica y fluido pleural de pacientes con tuberculosis (69); el bloqueo con anticuerpos para el PD-1 y sus ligandos aumenta la desgranulación de células T CD8+ y el porcentaje de células T específicas contra el patógeno, productoras de IFN-γ (69). El CTLA-4 expresado en células de pacientes con tuberculosis reduce la proliferación, la producción de IFN-gamma; y de IL-2 de células T (70), así como la actividad citotóxica de células T CD4+ contra células presentadoras de antígeno infectadas con M. tuberculosis (71).
La gran mayoría de los hallazgos anteriores han sido corroborados en experimentos con modelos de ratón, en los cuales se acumulan células T reguladoras funcionales en los órganos de mayor replicación; allí, estas células ejercen su función supresora por medio de la expresión del receptor inhibitorio PD-1 (72). Por otro lado, la neutralización de moléculas inhibidoras con anticuerpos bloqueadores para TGF-β, IL-10 e CTLA-4 incrementa la respuesta inmune antimicobacteriana con liberación de IFN-γ y la proliferación de células T en los ratones infectados (70,73). La eliminación de las células T reguladoras en estos animales se correlacionó con una carga bacteriana baja y altos niveles de activación (72). Estos resultados sugieren que la acumulación de células T reguladoras en estos órganos evita la erradicación del bacilo por la supresión de una respuesta inmune efectora de las células T (74).
Impacto de la coinfección en el curso de la infección por VIH y M. tuberculosis
En la coinfección VIH/tuberculosis ocurre un sinergismo en el cual la replicación de ambos microorganismos se favorece, aumentando la progresión y gravedad de ambas infecciones. El excesivo daño causado por el VIH en el sistema inmune favorece la reactivación de la tuberculosis en personas con infección latente, así como la progresión hacia la enfermedad diseminada en aquéllas con primoinfección o reinfección (75). Los individuos con sida son muy sensibles aun a las micobacterias normalmente no patógenas, como Mycobacterium avium (76), y presentan infecciones progresivas, con frecuentes reactivaciones y reinfecciones (77). En estos individuos se desarrollan granulomas atípicos que son incapaces de controlar la carga bacteriana o prevenir la diseminación, lo que demuestra que las células T CD4+ son importantes para la formación de los granulomas (78) (figura 1).
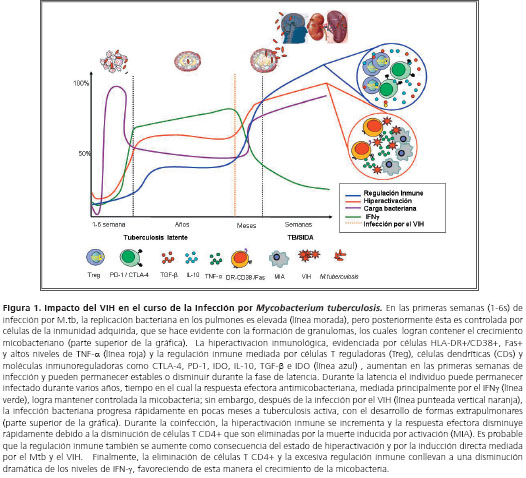
El riesgo de desarrollar la tuberculosis activa en individuos positivos para VIH es mayor comparado con individuos negativos para VIH; este riesgo oscila alrededor de 15% al año y 10% durante toda su vida, en individuos con infección por VIH y sin ella, respectivamente (79). La probabilidad de desarrollar tuberculosis depende del grado de inmunosupresión del individuo; cuando el conteo de células T CD4+ es menor de 200 células/mm3 el riesgo es mayor, comparado con individuos con conteos superiores (80). A diferencia de lo que se observa en individuos sin VIH, en quienes la tuberculosis extrapulmonar ocurre sólo entre 15% y 20% de los casos, en individuos con VIH es la forma más común y representa más de 50% de los casos (81). Además del hecho de que la infección por el VIH facilita las formas extrapulmonares de tuberculosis, el VIH también dificulta su diagnóstico, lo cual se evidencia por la bajos resultados positivos en la baciloscopia, los hallazgos radiológicos atípicos y la anergia a la tuberculina que exhiben los individuos coinfectados (75).
Otra de las dificultades en el manejo de los pacientes coinfectados es establecer el esquema de tratamiento. El uso del tratamiento antirretroviral en un paciente con tratamiento antimicobacteriano no es aconsejable, ya que interfiere y aumenta los efectos secundarios debido a las interacciones medicamentosas. Además, es frecuente que se alteren los esquemas terapéuticos tradicionales, lo cual incrementa la generación y transmisión de cepas resistentes de M. tuberculosis resistentes a diferentes medicamentos (75).
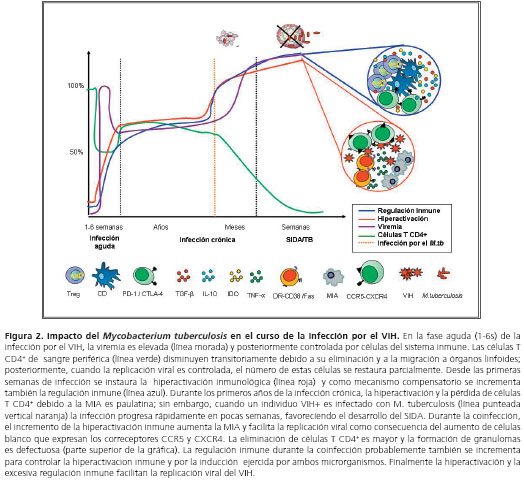
Así como la coinfección tiene un efecto en la reactivación de la tuberculosis, esta última acelera la progresión de la infección por el VIH, pues genera un microambiente adecuado que favorece la entrada del virus a la célula blanco y su replicación (82). De hecho, la infección por M. tuberculosis se considera un cofactor para la replicación del VIH; esto se ha hecho evidente en ensayos clínicos en los cuales la replicación viral durante la tuberculosis activa es mayor al compararla con pacientes sin tuberculosis (83). La replicación del VIH es inducida por la activación celular en monocitos y células T CD4+, y por los altos niveles de citocinas proinflamatorias en el microambiente (84,85), principalmente por medio de la activación del factor de transcripción NF-kB (86,87). El ManLam, uno de los componentes estructurales de la pared micobacteriana, es uno de los principales inductores de este proceso (87).
El incremento de la expresión de los correceptores virales CXCR4 y CCR5 durante la infección micobacteriana en individuos positivos para VIH, facilita la entrada del virus a su célula blanco (88). En controles sanos, la expresión de estos correceptores en células T CD4+ aumenta alrededor de 4 a 6 veces cuando se inyectan diferentes componentes bacterianos, como el ManLam (89). La regulación positiva de los correceptores también depende de las citocinas producidas durante la infección bacteriana; el TNF-α incrementa la expresión de CCR5 y CXCR4 (89) (figura 2). En un trabajo realizado por nuestro grupo de investigación, se mostró que los individuos positivos para VIH y con infección activa por M. tuberculosis exhibían mayores deficiencias cuantitativas en varias subpoblaciones de leucocitos, mayores cargas virales y mayores porcentajes de células T HLA-DR+ y CD38+ que los pacientes con VIH sin tuberculosis activa (90).
Regulación inmune durante la coinfección VIH y M. tuberculosis
En pacientes con VIH que inician tratamiento antirretroviral, la respuesta inmune específica es restaurada gradualmente durante los 6 a 12 meses de haber iniciado el tratamiento. Sin embargo, en un pequeño grupo de individuos, el síndrome inflamatorio de reconstitución inmune se manifiesta como un efecto adverso observado durante las primeras semanas del tratamiento antirretroviral en pacientes con infecciones oportunistas subclínicas, enmascaradas o parcialmente tratadas (91). Los pacientes con VIH y con síndrome inflamatorio de reconstitución inmune, generalmente, se encuentran coinfectados por M. tuberculosis (92) y desarrollan reacciones inflamatorias, junto con la reactivación de la tuberculosis pulmonar, extrapulmonar o ambas (93). Los hallazgos obtenidos hasta el momento indican que probablemente el desequilibrio de la respuesta inmune efectora y reguladora es la causa principal de la patogénesis del síndrome inflamatorio de reconstitución inmune. Este síndrome se caracteriza por una rápida reconstitución inmune, medida por el aumento de células T CD4+ de sangre periférica, el cambio del perfil de citocinas tipo Th2 a Th1, el incremento de IFN-γ y de IL-2, y la restauración de la hipersensibilidad retardada (tuberculina positiva) (94-96).
Uno de los hallazgos más relevantes durante la coinfección es el aumento del estado de hiperactivación inmune en células T y en la producción de TNF-&alfa;, comparado con individuos con VIH o tuberculosis (17,97,98). Auque no existe un conocimiento claro sobre la relación entre hiperactivación inmunológica y la respuesta reguladora en la coinfección, se podría llegar a especular que este estado podría promover el desarrollo de diferentes mecanismos de regulación inmune que afectaría el equilibrio de la respuesta efectora durante la coinfección (figura 1 y figura 2).
Es claro que durante el curso de ambas infecciones se observa un aumento en la respuesta reguladora que mantiene suprimida la respuesta efectora anti-VIH y anti-M. tuberculosis, lo cual aumenta la sensibilidad a ambas infecciones y se gravedad. Inicialmente, se planteó la posibilidad de que el mecanismo de supresión inespecífico de las células T reguladoras y de las diferentes citocinas y moléculas asociadas con la regulación de la respuesta inmune durante la infección por el VIH y M. tuberculosis, favorecería la infección por otros microorganismos oportunistas (99,100). Sin embargo, el papel de la regulación inmune en la inmunopatogénesis de la coinfección VIH/tuberculosis no se ha esclarecido.
Algunos hallazgos que intentan aproximarse a lo que sucede en la coinfección VIH/ tuberculosis sugieren que, además del aumento en la hiperactivación inmune, estos pacientes exhiben una menor respuesta efectora medida en términos de proliferación y de producción de citocinas tipo Th1, en comparación con los pacientes con VIH y los pacientes con tuberculosis sin coinfección (101,102). La disminución de estos parámetros es revertida in vitro por la adición de anticuerpos neutralizantes para la molécula IL-10 en los células mononucleares de sangre periférica de individuos con tuberculosis y VIH (101). Estos resultados sugieren que la supresión mediada por moléculas con función reguladora podría estar jugando un papel importante en la inmunopatogénesis de la coinfección que aún falta por explorar.
Conclusiones
Durante la infección por el VIH y la tuberculosis los pacientes presentan alteraciones funcionales en las células T y las células presentadoras de antígeno, entre las que se destaca la disminución en la proliferación, en la producción de IL-2 y en el IFNγ por el contrario, estas células aumentan la expresión de los marcadores de activación, como HLA-DR y CD38, así como la expresión de moléculas asociadas a la regulación inmune, como PD-1, CTLA-4, TGF-&beta e IL-10. En sangre periférica, y especialmente en los órganos de mayor replicación de estos microorganismos, se evidencia la acumulación de células T reguladoras que se relaciona con la disminución de la respuesta efectora. Estos mecanismos de regulación inmune actúan de forma inespecífica, de tal forma que no sólo afectan la respuesta efectora contra cada uno estos microorganismos, sino contra cualquier otro agente.
El sinergismo que ocurre entre el VIH y M. tuberculosis genera un ambiente que favorece la replicación, aumentando la gravedad y la progresión de ambas infecciones. Sin embargo, los procesos inmunopatogénicos asociados al control inmune ejercido por las células T reguladoras, células dendríticas y moléculas inhibitorias durante la coinfección, no están establecidos. La potenciación de estos mecanismos debido tanto al estado de hiperactivación que exhiben los individuos coinfectados, así como a la inducción de la regulación debido al efecto directo de los microorganismos, resultaría en el desarrollo a una respuesta efectora alterada, que favorecería la replicación y la subsecuente progresión de ambas infecciones.
La modulación de la función reguladora representaría una estrategia importante para el control inmune durante la coinfección VIH/tuberculosis. Teniendo en cuenta que el equilibrio entre la respuesta efectora y la reguladora puede influenciar el desenlace de ambas infecciones, la comprensión de los mecanismos de regulación inmune durante la coinfección permitirá diseñar nuevas estrategias terapéuticas que tengan como fin restablecer la respuesta inmune y, por ende, el control de la replicación de ambos microorganismos.
Agradecimientos
A Colciencias (111540820490-1) y a la Universidad de Antioquia (Programa de sostenibilidad 2009-2010), por su financiación.
Correspondencia:
María Teresa Rugeles, Calle 62 Nº 52- 59, Laboratorio 532, SIU, Medellín, Colombia mtrugel@udea.edu.co
Referencias
1. ONUSIDA. Informe sobre la epidemia mundial de sida. Catalogación por la Biblioteca de la OMS. 2008;08:25S. [ Links ]
2. WHO. Global tuberculosis control: surveillance, planning, financing. WHO Library Cataloguing-in-Publication Data. 2008; 393:1-291. [ Links ]
3. WHO. Global TB database. 2006. [ Links ]
4. WHO. TB/HIV a clinical manual. WHO Library Cataloguing-in- Publication Data. 2005; 329:1-205. [ Links ]
5. Colonna M, Trinchieri G, Liu YJ. Plasmacytoid dendritic cells in immunity. Nat Immunol. 2004;5:1219-26. [ Links ]
6. Grandvaux N, tenOever BR, Servant MJ, Hiscott J. The interferon antiviral response: from viral invasion to evasion. Curr Opin Infect Dis. 2002;15:259-67. [ Links ]
7. Rosenberg ES, Billingsley JM, Caliendo AM, Boswell SL, Sax PE, Kalams SA, et al. Vigorous HIV-1-specific CD4+ T cell responses associated with control of viremia. Science. 1997;278:1447-50. [ Links ]
8. Montoya CJ, Moreno ME, Rugeles MT. Reacciones y alteraciones del sistema inmune durante la infección por el VIH-1. Infectio. 2006;10:250-65. [ Links ]
9. Grossman Z, Meier-Schellersheim M, Paul WE, Picker LJ. Pathogenesis of HIV infection: what the virus spares is as important as what it destroys. Nat Med. 2006;12:289-95. [ Links ]
10. Kaufmann SH. Protection against tuberculosis: cytokines, T cells, and macrophages. Ann Rheum Dis. 2002;61(Suppl.2):ii54-8. [ Links ]
11. Flynn JL. Immunology of tuberculosis and implications in vaccine development. Tuberculosis (Edinb). 2004;84:93-101. [ Links ]
12. Co DO, Hogan LH, Kim SI, Sandor M. Mycobacterial granulomas: keys to a long-lasting host-pathogen relationship. Clin Immunol. 2004;113:130-6. [ Links ]
13. Kaufmann SHE. New issues in tuberculosis. Ann Rheum Dis. 2004;63:ii50-6. [ Links ]
14. Kaufmann SHE. Protection against tuberculosis: cytokines, T cells, and macrophages. Ann Rheum Dis. 2002;61:54ii-8. [ Links ]
15. Foussat A, Bouchet-Delbos L, Berrebi D, Durand-Gasselin I, Coulomb-L'Hermine A, Krzysiek R, et al. Deregulation of the expression of the fractalkine/fractalkine receptor complex in HIV-1-infected patients. Blood. 2001;98:1678-86. [ Links ]
16. Lane HC, Masur H, Edgar LC, Whalen G, Rook AH, Fauci AS. Abnormalities of B-cell activation and immunoregulation in patients with the acquired immunodeficiency syndrome. N Engl J Med. 1983;309:453-8. [ Links ]
17. Hertoghe T, Wajja A, Ntambi L, Okwera A, Aziz MA, Hirsch C, et al. T cell activation, apoptosis and cytokine dysregulation in the (co)pathogenesis of HIV and pulmonary tuberculosis (TB). Clin Exp Immunol. 2000;122:350-7. [ Links ]
18. Lim A, Tan D, Price P, Kamarulzaman A, Tan HY, James I, et al. Proportions of circulating T cells with a regulatory cell phenotype increase with HIV-associated immune activation and remain high on antiretroviral therapy. AIDS. 2007;21: 1525-34. [ Links ]
19. Wiercinska-Drapalo A, Flisiak R, Jaroszewicz J, Prokopowicz D. Increased plasma transforming growth factor-beta1 is associated with disease progression in HIV-1-infected patients. Viral Immunol. 2004;17:109-13. [ Links ]
20. Boasso A, Herbeuval JP, Hardy AW, Anderson SA, Dolan MJ,Fuchs D, et al. HIV inhibits CD4+ T-cell proliferation by inducing indoleamine 2,3-dioxygenase in plasmacytoid dendritic cells. Blood. 2007;109:3351-9. [ Links ]
21. Cao W, Jamieson BD, Hultin LE, Hultin PM, Detels R. Regulatory T cell expansion and immune activation during untreated HIV type 1 infection are associated with disease progression. AIDS Res Hum Retroviruses. 2009;25:183-91. [ Links ]
22. Sánchez FO, Rodríguez JI, Agudelo G, García LF. Immune responsiveness and lymphokine production in patients with tuberculosis and healthy controls. Infect Immun. 1994;62:5673-8. [ Links ]
23. Rodrigues DS, Medeiros EA, Weckx LY, Bonnez W, Salomao R, Kallas EG. Immunophenotypic characterization of peripheral T lymphocytes in Mycobacterium tuberculosis infection and disease. Clin Exp Immunol. 2002;128:149-54. [ Links ]
24. Boussiotis VA, Tsai EY, Yunis EJ, Thim S, Delgado JC, Dascher CC, et al. IL-10-producing T cells suppress immune responses in anergic tuberculosis patients. J Clin Invest. 2000;105:1317-25. [ Links ]
25. Roberts T, Beyers N, Aguirre A, Walzl G. Immunosuppression during active tuberculosis is characterized by decreased interferon- gamma production and CD25 expression with elevated forkhead box P3, transforming growth factor- beta , and interleukin-4 mRNA levels. J Infect Dis. 2007;195:870-8. [ Links ]
26. Boasso A, Shearer GM. Chronic innate immune activation as a cause of HIV-1 immunopathogenesis. Clin Immunol. 2008;126:235-42. [ Links ]
27. Varadhachary AS, Salgame P. CD95 mediated T cell apoptosis and its relevance to immune deviation. Oncogene. 1998;17: 3271-6. [ Links ]
28. Hazenberg MD, Otto SA, van Benthem BH, Roos MT, Coutinho RA, Lange JM, et al. Persistent immune activation in HIV-1 infection is associated with progression to AIDS. AIDS. 2003;17:1881-8. [ Links ]
29. Bhattacharyya S, Singla R, Dey AB, Prasad HK. Dichotomy of cytokine profiles in patients and high-risk healthy subjects exposed to tuberculosis. Infect Immun. 1999;67:5597-603. [ Links ]
30. Hirsch CS, Toossi Z, Vanham G, Johnson JL, Peters P, Okwera A, et al. Apoptosis and T cell hyporesponsiveness in pulmonary tuberculosis. J Infect Dis. 1999;179:945-53. [ Links ]
31. Miyara M, Sakaguchi S. Natural regulatory T cells: mechanisms of suppression. Trends Mol Med. 2007;13:108-16. [ Links ]
32. Belkaid Y. Regulatory T cells and infection: a dangerous necessity.Nat Rev Immunol. 2007;7:875-88. [ Links ]
33. Mahnke K, Johnson TS, Ring S, Enk AH. Tolerogenic dendritic cells and regulatory T cells: a two-way relationship. J Dermatol Sci. 2007;46:159-67. [ Links ]
34. Sun CM, Hall JA, Blank RB, Bouladoux N, Oukka M, Mora JR, et al. Small intestine lamina propria dendritic cells promote de novo generation of Foxp3 T reg cells via retinoic acid. J Exp Med. 2007;204:1775-85. [ Links ]
35. Sharma MD, Baban B, Chandler P, Hou DY, Singh N, Yagita H, et al. Plasmacytoid dendritic cells from mouse tumor-draining lymph nodes directly activate mature Tregs via indoleamine 2,3-dioxygenase. J Clin Invest. 2007;117:2570-82. [ Links ]
36. Munn DH, Mellor AL. Indoleamine 2,3-dioxygenase and tumor- induced tolerance. J Clin Invest. 2007;117:1147-54. [ Links ]
37. Taylor A, Verhagen J, Blaser K, Akdis M, Akdis CA. Mechanisms of immune suppression by interleukin-10 and transforming growth factor-beta: the role of T regulatory cells. Immunology. 2006;117:433-42. [ Links ]
38. Piccirillo CA, Shevach EM. Cutting edge: control of CD8+ T cell activation by CD4+CD25+ immunoregulatory cells. J Immunol. 2001;167:1137-40. [ Links ]
39. Lin CY, Graca L, Cobbold SP, Waldmann H. Dominant transplantation tolerance impairs CD8+ T cell function but not expansion. Nat Immunol. 2002;3:1208-13. [ Links ]
40. Ghiringhelli F, Menard C, Terme M, Flament C, Taieb J, Chaput N, et al. CD4+CD25+ regulatory T cells inhibit natural killer cell functions in a transforming growth factor-beta-dependent manner. J Exp Med. 2005;202:1075-85. [ Links ]
41. Nakamura K, Kitani A, Strober W. Cell contact-dependent immunosuppression by CD4(+) CD25(+) regulatory T cells is mediated by cell surface-bound transforming growth factor beta. J Exp Med. 2001;194:629-44. [ Links ]
42. Kryczek I, Wei S, Zou L, Zhu G, Mottram P, Xu H, et al. Cutting edge: induction of B7-H4 on APCs through IL-10: novel suppressive mode for regulatory T cells. J Immunol. 2006;177:40-4. [ Links ]
43. Sica GL, Choi IH, Zhu G, Tamada K, Wang SD, Tamura H, et al. B7-H4, a molecule of the B7 family, negatively regulates T cell immunity. Immunity. 2003;18:849-61. [ Links ]
44. Dong H, Strome SE, Salomao DR, Tamura H, Hirano F, Flies DB, et al. Tumor-associated B7-H1 promotes T-cell apoptosis: a potential mechanism of immune evasion. Nat Med. 2002;8: 793-800. [ Links ]
45. Chen L. Co-inhibitory molecules of the B7-CD28 family in the control of T-cell immunity. Nat Rev Immunol. 2004;4:336-47. [ Links ]
46. Fallarino F, Grohmann U, Hwang KW, Orabona C, Vacca C, Bianchi R, et al. Modulation of tryptophan catabolism by regulatory T cells. Nat Immunol. 2003;4:1206-12. [ Links ]
47. Kared H, Lelievre JD, Donkova-Petrini V, Aouba A, Melica G, Balbo M, et al. HIV-specific regulatory T cells are associated with higher CD4 cell counts in primary infection. AIDS. 2008;22:2451-60. [ Links ]
48. Rueda CM, Velilla PA, Rugeles MT. Células T reguladoras naturales durante la infección por el VIH: el tejido linfoide como blanco primario de la replicación viral. Iatreia. 2009;22: 159-68. [ Links ]
49. Kinter A, McNally J, Riggin L, Jackson R, Roby G, Fauci AS. Suppression of HIV-specific T cell activity by lymph node CD25+ regulatory T cells from HIV-infected individuals. Proc Natl Acad Sci U S A. 2007;104:3390-5. [ Links ]
50. Epple HJ, Loddenkemper C, Kunkel D, Troger H, Maul J, Moos V, et al. Mucosal but not peripheral FOXP3+ regulatory T cells are highly increased in untreated HIV infection and normalize after suppressive HAART. Blood. 2006;108:3072-8. [ Links ]
51. Nilsson J, Boasso A, Velilla PA, Zhang R, Vaccari M, Franchini G, et al. HIV-1-driven regulatory T-cell accumulation in lymphoid tissues is associated with disease progression in HIV/AIDS. Blood. 2006;108:3808-17. [ Links ]
52. Andersson J, Boasso A, Nilsson J, Zhang R, Shire NJ, Lindback S, et al. The prevalence of regulatory T cells in lymphoid tissue is correlated with viral load in HIV-infected patients. J Immunol. 2005;174:3143-7. [ Links ]
53. Kinter AL, Hennessey M, Bell A, Kern S, Lin Y, Daucher M, et al. CD25(+) CD4(+) regulatory T cells from the peripheral blood of asymptomatic HIV-infected individuals regulate CD4(+) and CD8(+) HIV-specific T cell immune responses in vitro and are associated with favorable clinical markers of disease status. J Exp Med. 2004;200:331-43. [ Links ]
54. Fantuzzi L, Purificato C, Donato K, Belardelli F, Gessani S. Human immunodeficiency virus type 1 gp120 induces abnormal maturation and functional alterations of dendritic cells: a novel mechanism for AIDS pathogenesis. J Virol. 2004;78: 9763-72. [ Links ]
55. Krathwohl MD, Schacker TW, Anderson JL. Abnormal presence of semimature dendritic cells that induce regulatory T cells in HIVinfected subjects. J Infect Dis. 2006;193:494-504. [ Links ]
56. Day CL, Kaufmann DE, Kiepiela P, Brown JA, Moodley ES, Reddy S, et al. PD-1 expression on HIV-specific T cells is associated with T-cell exhaustion and disease progression. Nature. 2006;443:350-4. [ Links ]
57. D'Souza M, Fontenot AP, Mack DG, Lozupone C, Dillon S, Meditz A, et al. Programmed death 1 expression on HIV-specific CD4+ T cells is driven by viral replication and associated with T cell dysfunction. J Immunol. 2007;179:1979-87. [ Links ]
58. Kaufmann DE, Kavanagh DG, Pereyra F, Zaunders JJ, Mackey EW, Miura T, et al. Upregulation of CTLA-4 by HIV-specific CD4+ T cells correlates with disease progression and defines a reversible immune dysfunction. Nat Immunol. 2007;8:1246-54. [ Links ]
59. Hryniewicz A, Boasso A, Edghill-Smith Y, Vaccari M, Fuchs D, Venzon D, et al. CTLA-4 blockade decreases TGF-beta, dioxigenasa, and viral RNA expression in tissues of SIVmac251-infected macaques. Blood. 2006;108:3834-42. [ Links ]
60. Velu V, Titanji K, Zhu B, Husain S, Pladevega A, Lai L, et al. Enhancing SIV-specific immunity in vivo by PD-1 blockade. Nature. 2009;458:206-10. [ Links ]
61. Chen X, Zhou B, Li M, Deng Q, Wu X, Le X, et al. CD4(+) CD25(+) FoxP3(+) regulatory T cells suppress Mycobacterium tuberculosis immunity in patients with active disease. Clin Immunol. 2007;123:50-9. [ Links ]
62. Li L, Lao SH, Wu CY. Increased frequency of CD4(+) CD25 (high) Treg cells inhibit BCG-specific induction of IFN-gamma by CD4(+) T cells from TB patients. Tuberculosis (Edinb). 2007;87:526-34. [ Links ]
63. Ribeiro-Rodrigues R, Resende T, Rojas R, Toossi Z, Dietze R, Boom WH, et al. A role for CD4+ CD25+ T cells in regulation of the immune response during human tuberculosis. Clin Exp Immunol. 2006;144:25-34. [ Links ]
64. Guyot-Revol V, Innes JA, Hackforth S, Hinks T, Lalvani A. Regulatory T cells are expanded in blood and disease sites in patients with tuberculosis. Am J Respir Crit Care Med. 2006;173:803-10. [ Links ]
65. Hougardy JM, Place S, Hildebrand M, Drowart A, Debrie AS, Locht C, et al. Regulatory T cells depress immune responses to protective antigens in active tuberculosis. Am J Respir Crit Care Med. 2007;176:409-16. [ Links ]
66. Burl S, Hill PC, Jeffries DJ, Holland MJ, Fox A, Lugos MD, et al. FOXP3 gene expression in a tuberculosis case contact study. Clin Exp Immunol. 2007;149:117-22. [ Links ]
67. Chieppa M, Bianchi G, Doni A, Del Prete A, Sironi M, Laskarin G, et al. Cross-linking of the mannose receptor on monocytederived dendritic cells activates an anti-inflammatory immunosuppressive program. J Immunol. 2003;171:4552-60. [ Links ]
68. Latchumanan VK, Balkhi MY, Sinha A, Singh B, Sharma P, Natarajan K. Regulation of immune responses to Mycobacterium tuberculosis secretory antigens by dendritic cells. Tuberculosis (Edinb). 2005;85:377-83. [ Links ]
69. Jurado JO, Álvarez IB, Pasquinelli V, Martínez GJ, Quiroga MF, Abbate E, et al. Programmed death (PD)-1:PD-ligand 1/PDligand 2 pathway inhibits T cell effector functions during human tuberculosis. J Immunol. 2008;181:116-25. [ Links ]
70. Kirman J, McCoy K, Hook S, Prout M, Delahunt B, Orme I, et al. CTLA-4 blockade enhances the immune response induced by mycobacterial infection but does not lead to increased protection. Infect Immun. 1999;67:3786-92. [ Links ]
71. Merlo A, Saverino D, Tenca C, Grossi CE, Bruno S, Ciccone E. CD85/LIR-1/ILT2 and CD152 (cytotoxic T lymphocyte antigen 4) inhibitory molecules down-regulate the cytolytic activity of human CD4+ T-cell clones specific for Mycobacterium tuberculosis. Infect Immun. 2001;69:6022-9. [ Links ]
72. Scott-Browne JP, Shafiani S, Tucker-Heard G, Ishida-Tsubota K, Fontenot JD, Rudensky AY, et al. Expansion and function of Foxp3-expressing T regulatory cells during tuberculosis. J Exp Med. 2007;204:2159-69. [ Links ]
73. Mason CM, Porretta E, Zhang P, Nelson S. CD4+ CD25+ transforming growth factor-beta-producing T cells are present in the lung in murine tuberculosis and may regulate the host inflammatory response. Clin Exp Immunol. 2007;178:2661-5. [ Links ]
74. Kursar M, Koch M, Mittrucker HW, Nouailles G, Bonhagen K, Kamradt T, et al. Cutting Edge: Regulatory T cells prevent efficient clearance of Mycobacterium tuberculosis. J Immunol. 2007;178:2661-5. [ Links ]
75. Sharma SK, Mohan A, Kadhiravan T. HIV-TB co-infection: epidemiology, diagnosis & management. Indian J Med Res. 2005;121:550-67. [ Links ]
76. Murcia-Aranguren MI, Gómez-Marín JE, Alvarado FS, Bustillo JG, de Mendivelson E, Gómez B, et al. Frequency of tuberculous and non-tuberculous mycobacteria in HIV infected patients from Bogotá, Colombia. BMC Infect Dis. 2001;1:21. [ Links ]
77. Flynn JL, Goldstein MM, Triebold KJ, Koller B, Bloom BR. Major histocompatibility complex class I-restricted T cells are required for resistance to Mycobacterium tuberculosis infection. Proc Natl Acad Sci U S A. 1992;89:12013-7. [ Links ]
78. Saunders BM, Frank AA, Orme IM, Cooper AM. CD4 is required for the development of a protective granulomatous response to pulmonary tuberculosis. Cell Immunol. 2002;216: 65-72. [ Links ]
79. OMS. Nota descriptiva. Tuberculosis e infección por el VIH OMS 2008. [en línea] 2008. [Fecha de acceso noviembre 30 de 2009]. URL disponible en : http://www.stoptb.org/wg/ tb_hiv/assets/documents/VIH%20Translation_ES0397_fin08%20fact%20sheet%20TB%20HIV%20-%20SPANISH.pdf [ Links ]
80. Markowitz N, Hansen NI, Hopewell PC, Glassroth J, Kvale PA, Mangura BT, et al. Incidence of tuberculosis in the United States among HIV-infected persons. The Pulmonary Complications of HIV Infection Study Group. Ann Intern Med. 1997;126:123-32. [ Links ]
81. Sharma SK, Mohan A. Extrapulmonary tuberculosis. Indian J Med Res. 2004;120:316-53. [ Links ]
82. Goletti D, Weissman D, Jackson RW, Graham NM, Vlahov D, Klein RS, et al. Effect of Mycobacterium tuberculosis on HIV replication. Role of immune activation. J Immunol. 1996;157: 1271-8. [ Links ]
83. Toossi Z, Mayanja-Kizza H, Hirsch CS, Edmonds KL, Spahlinger T, Hom DL, et al. Impact of tuberculosis (TB) on HIV-1 activity in dually infected patients. Clin Exp Immunol. 2001;123:233-8. [ Links ]
84. Poli G, Kinter A, Justement JS, Kehrl JH, Bressler P, Stanley S, et al. Tumor necrosis factor alpha functions in an autocrine manner in the induction of human immunodeficiency virus expression. Proc Natl Acad Sci U S A. 1990;87:782-5. [ Links ]
85. Garrait V, Cadranel J, Esvant H, Herry I, Morinet P, Mayaud C, et al. Tuberculosis generates a microenvironment enhancing the productive infection of local lymphocytes by HIV. J Immunol. 1997;159:2824-30. [ Links ]
86. Zhang Y, Nakata K, Weiden M, Rom WN. Mycobacterium tuberculosis enhances human immunodeficiency virus-1 replication by transcriptional activation at the long terminal repeat. J Clin Invest. 1995;95:2324-31. [ Links ]
87. Bernier R, Barbeau B, Olivier M, Tremblay MJ. Mycobacterium tuberculosis mannose-capped lipoarabinomannan can induce NF-kappaB-dependent activation of human immunodeficiency virus type 1 long terminal repeat in T cells. J Gen Virol. 1998;79:1353-61. [ Links ]
88. Juffermans NP, Speelman P, Verbon A, Veenstra J, Jie C, van Deventer SJ, et al. Patients with active tuberculosis have increased expression of HIV coreceptors CXCR4 and CCR5 on CD4(+) T cells. Clin Infect Dis. 2001;32:650-2. [ Links ]
89. Juffermans NP, Paxton WA, Dekkers PE, Verbon A, de Jonge E, Speelman P, et al. Up-regulation of HIV coreceptors CXCR4 and CCR5 on CD4(+) T cells during human endotoxemia and after stimulation with (myco)bacterial antigens: the role of cytokines. Blood. 2000;96:2649-54. [ Links ]
90. Ramírez Z, Catano JC, Román A, Rugeles MT, Montoya CJ. Efecto de las infecciones oportunistas sobre las subpoblaciones de leucocitos en individuos infectados con el virus de inmunodeficiencia humana tipo 1. Biomédica. 2008;28:64-77. [ Links ]
91. French MA. Disorders of immune reconstitution in patients with HIV infection responding to antiretroviral therapy. Curr HIV/AIDS Rep. 2007;4:16-21. [ Links ]
92. Manabe YC, Campbell JD, Sydnor E, Moore RD. Immune reconstitution inflammatory syndrome: risk factors and treatment implications. J Acquir Immune Defic Syndr. 2007;46:456-62. [ Links ]
93. Michailidis C, Pozniak AL, Mandalia S, Basnayake S, Nelson MR, Gazzard BG. Clinical characteristics of IRIS syndrome in patients with HIV and tuberculosis. Antivir Ther. 2005;10: 417-22. [ Links ]
94. Vecchiet J, Dalessandro M, Travasi F, Falasca K, Di Iorio A, Schiavone C, et al. Interleukin-4 and interferon-gamma production during HIV-1 infection and changes induced by antiretroviral therapy. Int J Immunopathol Pharmacol. 2003;16:157-66. [ Links ]
95. Brazille P, Dereuddre-Bosquet N, Leport C, Clayette P, Boyer O, Vilde JL, et al. Decreases in plasma TNF-alpha level and IFN-gamma mRNA level in peripheral blood mononuclear cells (PBMC) and an increase in IL-2 mRNA level in PBMC are associated with effective highly active antiretroviral therapy in HIV-infected patients. Clin Exp Immunol. 2003;131:304-11. [ Links ]
96. Schluger NW, Perez D, Liu YM. Reconstitution of immune responses to tuberculosis in patients with HIV infection who receive antiretroviral therapy. Chest. 2002;122:597-602. [ Links ]
97. Vanham G, Edmonds K, Qing L, Hom D, Toossi Z, Jones B, et al. Generalized immune activation in pulmonary tuberculosis: co-activation with HIV infection. Clin Exp Immunol. 1996;103:30-4. [ Links ]
98. Schon T, Wolday D, Elias D, Melese E, Moges F, Tessema T, et al. Kinetics of sedimentation rate, viral load and TNF-alpha in relation to HIV co-infection in tuberculosis. Trans R Soc Trop Med Hyg. 2006;100:483-8. [ Links ]
99. Bocchino M, Sanduzzi A, Bariffi F. Mycobacterium tuberculosis and HIV co-infection in the lung: synergic immune dysregulation leading to disease progression. Monaldi Arch Chest Dis. 2000;55:381-8. [ Links ]
100. Silveira H, Ordway D, Dockrell H, Jackson M, Ventura F. Cellmediated immune responses to mycobacterial antigens in patients with pulmonary tuberculosis and HIV infection. Clin Exp Immunol. 1997;110:26-34. [ Links ]
101. Zhang M, Gong J, Iyer DV, Jones BE, Modlin RL, Barnes PF. T cell cytokine responses in persons with tuberculosis and human immunodeficiency virus infection. J Clin Invest. 1994;94: 2435-42. [ Links ]
102. Gong JH, Zhang M, Modlin RL, Linsley PS, Iyer D, Lin Y, et al. Interleukin-10 downregulates Mycobacterium tuberculosis- induced Th1 responses and CTLA-4 expression. Infect Immun. 1996;64:913-8. [ Links ]














