Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Infectio
Print version ISSN 0123-9392
Infect. vol.14 no.1 Bogotá Jan./Mar. 2010
1 Universidad de Córdoba, Instituto de Investigaciones Biológicas del Trópico, Facultad de Medicina Veterinaria y Zootecnia, Montería, Córdoba.
Los resultados preliminares de este estudio se publicaron en los resúmenes del VI Encuentro de Enfermedades Infecciosas en Infectio. 2008;12:67
Recibido: 08/11/2008; Aceptado: 25/01/2010
Resumen
Objetivo: Identificar y establecer la suceptibilidad antimicrobiana de bacterias patógenas halladas en el sistema gastrointestinal y el respiratorio de animales en cautiverio en el zoológico de Barranquilla.
Materiales y métodos: Se tomaron muestras de cloacas y glotis de 30 aves, y frotis rectales y nasales de 29 mamíferos, los animales fueron inmovilizados mecánicamente y, luego, anestesiados. Las bacterias se identificaron con pruebas bioquímicas como: urea, SIM (sulfide-indole-motility medium), TSI (triple sugar iron), LIA (line immunoassay) y citrato. Algunos aislamientos se confirmaron con el sistema API 20E (Biomerieux, S.A., Marcy IEtoile, France) o Microscan® Neg combo panel type 32 (Dade behring, CA, USA). La sensibilidad a los antimicrobianos se evaluó con el método de Bauer y Kirby, teniendo en cuenta las normas del Clinical and Laboratory Standards Institute (CLSI).
Resultados: Se obtuvieron 89 cepas de bacterias; 45 de aves y 44 de mamíferos. Las más frecuentes fueron: Escherichia coli (n=31), K. pneumoniae (n=20), Enterobacter cloacae (n=10), Pseudomonas aeruginosa (n=5), Staphylococcusaureus (n=5) y P. stutzeri (n=4). Las bacterias Gram negativas y Staphylococci fueron resistentes respectivamente a las siguientes familias de antibióticos: tetraciclinas (28% y 57,1%), cloramfenicol (14,6% y 57,1%) y β-lactámicos (54,2% y 42,8%). El porcentaje de resistencia de las bacterias Gram negativas a las fluoroquinolonas fue de 6,1% y, a los aminoglucósidos, de 2,4%; el de los estafilococos a los macrólidos fue de 64,2%. Veinticuatro cepas (27%) fueron multiresistentes a múltiples antibióticos: 16 en aves (36%) y 8 en mamíferos (18%).
Conclusión: La resistencia a uno o a varios antibióticos en las bacterias aisladas de los animales cautivos del zoológico de Barranquilla, es un factor de riesgo para su salud. A su vez, estos animales son reservorios de bacterias y de genes de resistencia, potencialmente importantes en la diseminación de estos factores de resistencia. Las similitudes en la resistencia bacteriana hallada en cepas animales y en cepas humanas, hacen presumir una movilidad de los clones de resistencia entre la especie Homo sapiensy las especies animales.
Palabras clave: zoológico, antibióticos, resistencia bacteriana, animales cautivos, Colombia.
Abstract
Objective: The objective is to determine respiratory and enteric bacterial pathogens and antimicrobial susceptibility in captive animals at Barranquilla Zoo.
Materials and methods: Samples were taken from rectus and glottis in 30 birds and nasal and rectal swabs from 29 mammals, which were restricted mechanically and then anesthetized. Bacteria were identified by using biochemical tests such as: Urea, SIM, TSI, LIA and Citrate, some bacteria isolates were confirmed with API 20E (Biomerieux SA, Marcy IEtoile, France) or Micro scan® Neg combo panel type 32 (Dade Behring, CA, USA). Antimicrobial susceptibility was assessed using the Bauer and Kirby method and taking into account CLSI regulation. Results Eighty-nine strains were obtained, 45 from birds and 44 from mammals. The most frequent bacteria were: E. coli (n = 31), Klebsiella pneumoniae (n = 20), Enterobacter cloacae (n = 10), Pseudomonas aeruginosa (n = 5), Staphylococcusaureus(n = 5) and Pseudomonas stuzeri (n = 4). Gram negative bacteria and Staphylococciwere respectively resistant to the following antibiotics: tetracycline (28% and 57.1%), chloramphenicol (14.6% and 57.1%) and β-lactam (54.2% and 42.8); Gram-negative was (6.1%) resistant to Fluorquinolones and (2.4%) resistant to aminoglycosides; and Staphylococci were (64.2%) resistant to macrolides. Twenty-four (27%) were multi-resistant: 16 (36%) in birds and 8 (18%) in mammals.
Conclusion: Resistance to one or more antibiotics in bacteria isolated from captive animals Barranquilla Zoo, is a risk factor for health for the animals themselves. The zoo animals are potential reservoirs for bacteria and resistance genes clinically important in the spread of these resistance factors. The resistance similarities found in animal and human strains suggest clone mobility between the sapiens species and the animals.
Key words: zoological, antibiotics, resistance, animals, Colombia
Introducción
La resistencia bacteriana es un fenómeno que sucede tanto en humanos como en animales y su estudio en Colombia es importante, porque hay muy poca información sobre el tema. Existen reportes (1) de bacterias de importancia clínica, como Escherichia coli, Pseudomonsa aeruginosa, Klebsiella pneumoniae y Staphylococcus aureus, que han sido aisladas de animales silvestres en cautiverio, como, por ejemplo en el azor (Accipiter gentilis), ardillas (Sciurus granatensis), en los búhos (Bubo virginianus) y en las gaviotas (Larus spp.) (1-4). También se han reportado E. coli enterohemorrágica en ciervos (Mazama spp.) y E. coli enteropatógena en aves silvestres5.
Las bacterias encontradas en los animales y en los alimentos de origen animal (6-11), al igual que las aisladas de humanos (12-14), también codifican complejos mecanismos de resistencia antimicrobiana como enzimas de hidrólisis y modificantes, bombas de flujo, mutaciones en porinas de membrana, biofilms y elementos genéticos móviles.
El hecho de que algunos países usen más de la mitad de su producción de compuestos antimicrobianos en el sector agroalimentario y que se administren antibióticos a los animales para promover su crecimiento, puede llevar a la selección de bacterias resistentes en poblaciones animales. Los microorganismos a su vez, pueden diseminarse fácilmente a los humanos a través de la cadena alimentaria (11). Esta situación ha llevado al incremento y la diseminación de bacterias multirresistentes, que involucra tanto a las patógenas como a las comensales, y se constituyen en reservorio de genes de resistencia a los antibióticos para las bacterias patógenas no resistentes (4,5,7,8).
La fauna silvestre ha sido afectada por factores socioeconómicos, políticos y ambientales, y por el crecimiento demográfico. Esto ha llevado a que el ser humano y a sus animales domésticos invadan los sistemas ambientales nativos. El efecto de esta convivencia entre animales silvestres, domésticos y los humanos, relacionado con la resistencia antimicrobiana y sus consecuencias han sido muy poco estudiados.
Los animales que permanecen ex situ en zoológicos, no pueden ser liberados o reintroducidos a la vida silvestre porque han perdido la adaptabilidad a las condiciones naturales a sus características etológicas, físicas y habitos nutricionales. Por lo tanto, los centros de conservación ex situ se convierten en importantes áreas educativas en pro de la conservación y en bancos de germoplasma de las especies en mención.
En Colombia, no existen publicaciones sobre la flora bacteriana de animales cautivos, ni sobre su sensibilidad antimicrobiana y, mucho menos, sobre su relación o similitud con los gérmenes aislados en humanos. Por ello, es importante realizar investigaciones que contribuyan al conocimiento de las bacterias existentes en las especies silvestres de los zoológicos de Colombia, y de sus tasas de resistencia a los antibióticos de uso común en medicina humana y animal.
El objetivo de este estudio fue aislar bacterias entéricas y respiratorias de animales cautivos, y determinar su sensibilidad antimicrobiana.
Materiales y métodos
Tipo de estudio, localización del área de muestreo y toma de muestras
El estudio fue descriptivo prospectivo, y se realizó en el zoológico de Barranquilla, el cual alberga una población de 400 animales que incluyen aves, mamíferos y reptiles. El zoológico se encuentra ubicado en medio de la ciudad y recibe anualmente 300.000 visitantes, aproximadamente.
La población de estudio fueron aves (n=141) y mamíferos (n=134). No se analizaron los reptiles. De esta población, se tomaron 30 aves (26 Psittaciforme, 3 Falconiforme y un Galliniforme) y 29 mamíferos (22 primates, 3 Artyodactyla, 3 carnívoros y un Perissodactyla). No se analizaron reptiles.
Se tomó una sola muestra para preservar la salud de los animales, sensibles a la excesiva manipulación. Los animales fueron inmovilizados de forma mecánica en las zonas de manejo (áreas donde tenían restricción de los movimientos) y, luego, químicamente, con anestesia, para reducir el estrés del procedimiento y facilitar la toma de muestras. En el caso de los animales cuyos hábitats impidió la inmovilización mecánica, fueron utilizados dardos tranquilizantes. Las muestras se tomaron entre abril del 2005 y enero del 2006.
Muestras del recto de mamíferos
Inicialmente, tanto el ano, como la región perineal y la cola de los animales se lavaron vigorosamente con agua estéril y jabón; luego, se les aplicó solución desinfectante suave de alcohol yodado y se secó el excedente con papel absorbente. Inmediatamente, se les introdujo en el recto un escobillón con carbón activado para la toma de la muestra con movimientos rotatorios y posteriormente, se introdujo en un medio de transporte Amies (Culture Swabplus, Becton Dickinson Microbiology Systems, Cockeysville, USA).
Muestras de la nariz de mamíferos
Al animal inmovilizado se le lavó, inicialmente, con agua estéril y jabón, el área externa de la región nasal. Luego, se le aplicó solución desinfectante suave de alcohol yodado y se eliminó el excedente con papel absorbente. Se introdujo en las fosas nasales un escobillón, igual al descrito antes para el recto, y se tomó la muestra de la glotis sin tocar la orofaringe, para evitar contaminar la muestra con bacterias orales. A cada animal inmovilizado le fueron realizados los dos procedimientos (frotis nasal y frotis rectal) simultáneamente, para evitar el estrés innecesario.
Muestras de la cloaca de aves
En las aves se tomó la muestra de la cloaca mediante un procedimiento similar al que se realizó en los mamíferos.
Después de obtener las muestras, se mantuvieron en una nevera portátil a 6-10ºC, hasta cuando se llevaron para su procesamiento, en un tiempo menor de 24 horas, al Instituto de Investigaciones Biológicas del Trópico de la Universidad de Córdoba.
Aislamiento e identificación de los microorganismos
Las muestras se cultivaron en medios estándar de cultivo en busca de bacterias de interés clínico y, para su identificación, se utilizaron pruebas bioquímicas estándar como: urea, SIM (sulfide-indole-motility medium), TSI (triple sugar iron), LIA (line immunoassay) y citrato. Las cepas encontradas fueron confirmadas con el sistema API 20E (Biomerieux, S.A., Marcy IEtoile, France) y Microscan® Neg combo panel type 32 (Dade behring, CA, USA).
Durante el estudio, las bacterias se mantuvieron en leche descremada a –70oC.
Estudio de sensibilidad antimicrobiana
Se utilizó el método de difusión de disco 2,11 con una concentración de bacterias Gram negativas de 0,5 en la escala de McFarland (1,5 x 108 UFC/ml) y, luego, se colocaron sensidiscos (Oxoid, Cambridge, UK). Los antibióticos usados fueron: ceftadizime (30 µg), cefotaxima (30 µg), gentamicina (10 µg), ciprofloxacina (5 µg), trimetoprim-sulfametoxazol (25 µg), cloramfenicol (30 µg), ampicilina (10 µg), ampicilina-sulbactam (10/10 µg) y oxitetraciclina (30 µg). Para Staphylococci se excluyó la ciprofloxacina (5 µg) y se adicionaron oxacilina (1 µg), eritromicina (15 µg) y lincomicina (2 µg).
Las placas de agar Mueller Hinton (Oxoid, Cambridge, UK) se incubaron por 24 horas a 37ºC; luego se interpretaron los halos y se informaron como ";sensible"; o ";resistente"; (15). Las cepas que resultaron multirresistentes mediante el método de difusión de disco, se confirmaron por Microscan® Neg combo panel type 32 (Dade Behring, CA, USA).
Aspectos éticos
El proyecto garantizó que los animales no sufrieran durante la obtención de las muestras, y no se realizó ningún procedimiento que pusiera en riesgo la salud de los animales. La obtención de las muestras se realizó previa anestesia del paciente, y se administró bajo estricta vigilancia del veterinario del zoológico. No se muestrearon animales que por su tamaño, senectud o estado de salud pusieran su vida en peligro, la obtención de las muestras se llevó a cabo acorde a las condiciones del sitio y manteniendo las normas de bioseguridad establecidas para tal fin.
Se tuvo en cuenta la Resolución No. 008430 de 1993 (4 de octubre de 1993) del Ministerio de Salud de la República de Colombia ";por la cual se establecen las normas académicas, técnicas y administrativas para la investigación en salud, concernientes a la investigación biomédica con animales";, artículo 87, literales c, g y h. La existencia de la reglamentación demuestra la preocupación del ser humano en el manejo y procesamiento de animales de investigación.
Para cumplir con los requisitos de la legislación sobre la investigación científica en diversidad biológica, que involucra alguna o todas las actividades de recolección, captura, caza, pesca, manipulación del recurso biológico y su movilización en el territorio nacional, el Instituto de Investigaciones Biológicas del Trópico solicitó y obtuvo la aprobación de la Fundación Zoológico de Barranquilla. Esto se hizo con el fin de cumplir con las actividades concernientes al desarrollo de esta investigación y de conformidad con el Decreto 309 de 2000 del Ministerio del Medio Ambiente en la República de Colombia ";por el cual se reglamenta la investigación científica sobre la diversidad biológica";, artículo 2º, parágrafo 1º. Los investigadores de este estudio conocían la ";Declaración universal de los derechos de los animales"; proclamada por la Liga Internacional de los Derechos del Animal (UNESCO, 1989, Ginebra, Suiza), la ";Guía para el cuidado y uso de animales de laboratorio"; (NRC, 1996) y los ";Principios éticos de la experimentación animal"; enunciados por el Internacional Council for Laboratory Animal Science (ICLAS) (http://dels.nas.edu/ilar_n/ilarhome/).
Resultados
Dada la gran diversidad de gérmenes que se encontraron, algunos comunes entre las especies estudiadas, se presentan primero los hallazgos en las aves y, luego los encontrados en los mamíferos; posteriormente se presenta un resumen con los resultados de los dos grupos estudiados.
Gérmenes aislados en las aves
Escherichia coli. Se aislaron cinco cepas en glotis de aves (tabla 1): una, en un halcón (Falco columbarius), resistente a trimetoprim-sulfametoxasol, ampicilina y ampicilina sulbactam, y las restantes, en loros reales (Amazona ochrocephala); dos de éstas mostraron resistencia a oxitetraciclina y tres a trimetoprim-sulfametoxasol. Todas fueron resistentes a ampicilina y ampicilina sulbactam.
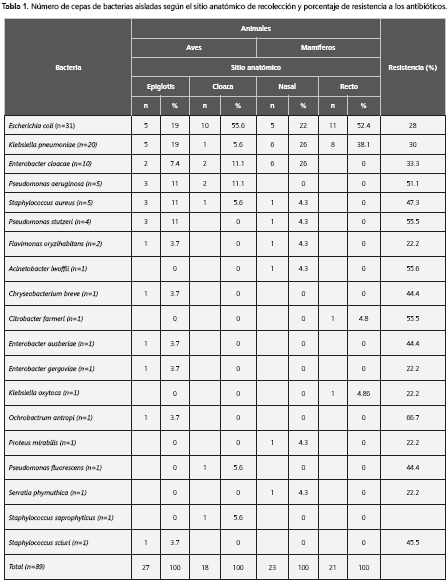
En la cloaca, se aislaron 10 cepas, una de ellas de un cari-cari (Caracara cheriway, antes Polyborus plancus) que fue resistente a ampicilina y ampicilina sulbactam; otra se aisló de un pavo real (Pavo cristatus) y fue resistente a ampicilina y ampicilina sulbactam. Dos cepas aisladas de pericos bronceados (Brotogeris jugularis) fueron resistentes a oxitetraciclina, trimetoprim-sulfametoxasol, ampicilina y ampicilina sulbactam. De seis cepas más, encontradas en loro real, dos mostraron resistencia a oxitetraciclina, una a trimetoprim-sulfametoxasol y todas a ampicilina y ampicilina sulbactam (tabla 2).
Klebsiella pneumoniae. De la glotis se obtuvieron cinco cepas (tabla 1): una se aisló de una cotorra (Aratinga pertinax), otra de un perico bronceado y tres de loros reales. De estas últimas, dos fueron resistentes a oxitetraciclina y una a trimetoprim-sulfametoxasol, y las cinco cepas fueron resistentes a ampicilina y ampicilina sulbactam. Una se aisló de la cloaca de un loro real y fue resistente a cloramfenicol, ampicilina y ampicilina sulbactam (tabla 2).
Enterobacter cloacae. Dos cepas se aislaron de la glotis (tabla 1), una de un loro real y otra de una cotorra. Dos más se aislaron de la cloaca, una en un halcón y otra en un loro real. Esta última fue resistente a trimetoprim-sulfametoxasol, gentamicina y cefotaxima (tabla 2).
Pseudomonas aeruginosa. De la glotis de loros reales se aislaron tres cepas, todas fueron resistentes a oxitetraciclina, trimetoprim-sulfametoxazol, cloramfenicol, ampicilina y ampicilina sulbactam. De la cloaca se obtuvieron dos cepas más, una en una cotorra y otra en un perico bronceado; ambas resultaron resistentes a trimetoprim-sulfametoxazol, cefotaxima, ampicilina y ampicilina sulbactam (tabla 2).
Staphylococcus aureus. En total se aislaron cinco cepas; una de la glotis del ave cari-cari (tabla 1) y una del loro piono cabeza azul (Pionus menstruus); ambas cepas fueron resistentes a oxitetraciclina, cloramfenicol, eritromicina, lincomicina, ampicilina y ampicilina sulbactam. Otra cepa se aisló de la glotis de un loro real que fue resistente a lincomicina, ampicilina y ampicilina sulbactam. La última se aisló de la cloaca de un pavo real y fue resistente a oxitetraciclina, cloramfenicol, eritromicina, lincomicina, ampicilina y ampicilina sulbactam (tabla 3).
Pseudomonas stutzeri. Se aislaron tres cepas de la glotis de loros reales (tabla 1), una de ellas fue resistente a ceftazidima y otra a cloramfenicol; todas fueron resistentes a trimetoprim-sulfametoxazol, cefotaxima, ampicilina y ampicilina sulbactam.
Flavimonasoryzi habitans. Se aisló una cepa de la glotis de un loro real.
Chryseobacterium breve. Se aisló una cepa resistente a múltiples antibióticos en la glotis de un loro real. Resultó resistente a las siguientes familias de antibióticos: tetraciclinas, sulfonamidas y beta-lactámicos.
Enterobacter ausberiae. Se aisló una cepa de la glotis de un loro real que fue resistente a cefotaxima, ceftazidime, ampicilina y ampicilina sulbactam.
Enterobacter gergoviae. Se aisló una cepa de la glotis de un pavo real que fue resistente a ampicilina y ampicilina sulbactam.
Ochrobactrum antropi. De la glotis de un loro real se aisló una cepa resistente a múltiples antibióticos: a las familias de las tetraciclinas, sulfamidas, el cloramfenicol y los beta-lactámicos.
Pseudomonas fluorescens. Se aisló una cepa de la glotis de un loro real que fue resistente a trimetoprim-sulfametoxazol, cefotaxima, ampicilina y ampicilina sulbactam.
Staphylococcus saprophyticus. Se aisló una cepa de la cloaca de una cotorra que no mostró resistencia a las diferentes familias de antibióticos.
Staphylococcus sciuri. Se aisló una cepa de la glotis de una cotorra que mostró resistencia a oxacilina, cefotaxima, ceftazidime, ampicilina y ampicilina sulbactam.
Aislamientos obtenidos en mamíferos
Escherichia coli. Se aislaron cinco cepas de fosa nasal (tabla 1); una de un zaíno (Pecari tajacu), otra de un tigrillo (Leopardus tigrina), otra en una tayra (Eira barbara), una más en un mono cariblanco (Cebus albifrons) y la quinta de un mono copete (Cebus apella). Esta última fue resistente a oxitetraciclina y todas fueron resistentes a ampicilina y ampicilina sulbactam. Se aislaron once cepas del recto: una de un zaíno, otra se aisló en un tigrillo, una en un tayra que fue resistente a oxitetraciclina; cuatro cepas se aislaron de monos copete; dos de monos aulladores (Alouatta seniculus); otra que se aisló de una danta (Tapirus terrestris) fue resistente a ciprofloxacina, cefotaxima y ceftazidime. Otra cepa se aisló de un tití gris (Saguinus leucopus). Las once cepas fueron resistentes a ampicilina y a ampicilina sulbactam (tabla 2).
Klebsiella pneumoniae. Se obtuvieron seis cepas de cavidad nasal (tabla 1): dos se aislaron de zaíno y una de ellas fue resistente a trimetoprim-sulfametoxazol; otra cepa se aisló de un tigrillo. De dos aisladas de monos aulladores, una de ellas fue multirresistente (oxitetraciclina, trimetoprim-sulfametoxazol, ciprofloxacina y cloramfenicol). Una cepa más fue aislada de un tití gris. Todas las cepas aisladas de cavidad nasal fueron resistentes a ampicilina y ampicilina sulbactam.
Del recto de los mamíferos se obtuvieron ocho cepas: una de un zaíno, una de un tigrillo, una de una tayra, una de un mono copete, una de un mapache (Procyon lotor), dos de monos aulladores una de las cuales resultó resistente a oxiteraciclina, trimetoprim-sulfametoxazol, ciprofloxacina, gentamicina y cloramfenicol. Una más se aisló de un tití gris. Las ocho cepas fueron resistentes a ampicilina y ampicilina sulbactam (tabla 2).
Enterobacter cloacae. Se aislaron seis cepas de cavidad nasal (tabla 1): una de un papión de manto (Papio hamadryas), resistente a oxitetraciclina; otra de un zaíno y una más de un tigrillo, resistente a oxitetraciclina; otras dos cepas en monos, una en el mono copete y otra de un mono aullador que resultó resistente a oxitetraciclina, ciprofloxacina y cloramfenicol; otra cepa se aisló de un tití gris, que fue resistente a trimetoprim-sulfametoxazol y cloramfenicol. Todos las cepas de E. cloacae fueron resistentes a ampicilina y ampicilina sulbactam (tabla 2).
Citrobacter farmeri.Del recto de un mono aullador se obtuvo una cepa que fue multirresistente a las tetraciclinas, sulfonamidas y beta-lactámicos.
Klebsiella oxytoca. Del recto de un mono cariblanco se aisló una cepa que fue resistente a ampicilina y ampicilina sulbactam.
Proteus mirabilis. En la fosa nasal de un mono cariblanco se aisló una cepa resistente a ampicilina y ampicilina sulbactam.
Serratia phymuthica. De la fosa nasal de un mono copete se aisló una cepa que fue resistente a ampicilina y ampicilina sulbactam.
Pseudomonas stutzeri. De la cavidad nasal de un mono cariblanco se obtuvo una cepa resistente a múltiples antibióticos, como fueron oxitetraciclina, trimetoprim-sulfametoxazol, cefotaxima, cloramfenicol, ampicilina y ampicilina sulbactam (tabla 1).
Flavimonas oryzihabitans. Se aisló una cepa de la fosa nasal de un zaíno que no mostró resistencia a los antibióticos (tabla 1).
Acinetobacter lwoffii. La cepa aislada de la fosa nasal de un mapache (Procyon cancrivorus) mostró resistencia a las siguientes familias de antibióticos: tetraciclinas, sulfas, fluoroquinolonas y beta-lactámicos, por lo que se consideró resistente a múltiples antibióticos (tabla 1).
Staphylococcus aureus. En la cavidad nasal de un mono aullador se aisló una cepa considerada resistente a múltiples antibióticos, porque fue resistente a oxitetraciclina, cloramfenicol, eritromicina, lincomicina, ampicilina y ampicilina sulbactam (tabla 3).
Resumen general
En total se obtuvieron 89 cepas, 45 de aves y 44 de mamíferos. De ellas, 24 (27%) fueron multirresistentes y, de estas, 16 (36%) se aislaron en aves y 8 (18%) en mamíferos.
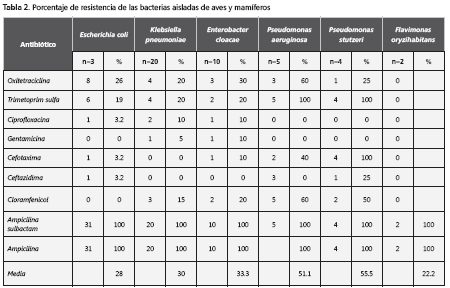
De las cepas de E. coli aisladas, 31 en total, entre aves y mamíferos, el 28% tuvo una resistencia promedio a los antibióticos (tabla 2) y cinco (16%) fueron resistentes a múltiples antibióticos, que incluían tetraciclinas, sulfonamidas y beta-lactámicos.
De K. pneumoniae se hicieron 20 aislamientos de aves y mamíferos con una resistencia promedio a los antibióticos de 30% (tabla 2). Tres, que correspondían al 15%, fueron multirresistentes a tetraciclinas, sulfonamidas, fluoroquinolonas, cloramfenicol, beta-lactámicos y aminoglucósidos.
Se aislaron 10 cepas de E. cloacae, entre aves y mamíferos, con un 33,3% de resistencia promedio a los antibióticos (tabla 2). Tres de éstas (30%) fueron multirresistentes a tetraciclinas, sulfamidas, fluoroquinolonas, cloramfenicol, beta-lactámicos y aminoglucósidos.
Cinco cepas de P. aeruginosa que se aislaron de aves mostraron un 51,1% de resistencia en promedio a los antibióticos (tabla 2). Otras tres cepas (60%) fueron resistentes a múltiples antibióticos pertenecientes a las familias de las tetraciclinas, las sulfonamidas, el cloramfenicol y los beta-lactámicos.
De P. stutzeri se aislaron cuatro cepas de aves y mamíferos, con un 55,5% de resistencia promedio a los antibióticos que fueron expuestas, dos (50 %) fueron multirresistentes a las siguientes familias: tetraciclinas, sulfonamidas, beta-lactámicos y cloramfenicol.
En total, se aislaron dos cepas de F. oryzihabitans y ambas fueron resistentes a ampicilina y ampicilina sulbactam, con un 22,2% de resistencia en promedio.
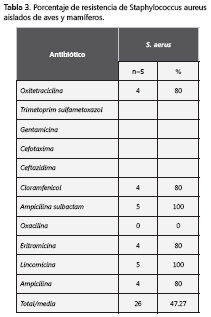
S. aureus se aisló cinco veces, cuatro cepas en aves y una en mamíferos; que mostraron un 47,27% de resistencia promedio a los antibióticos (tabla 3). Cuatro, (80%), fueron resistentes a tetraciclina, cloramfenicol, beta-lactámicos y macrólidos. No hubo resistencia a la oxacilina.
Los antibióticos con mayor porcentaje de resistencia por parte de las bacterias Gram negativas, fueron la ampicilina y la ampicilina-sulbactam, con un 98,8% cada uno; los siguió el trimetroprim-sulfametoxazol, con un 31,7% de resistencia; luego, la oxitetraciclina (28%), la cefotaxima (14,6%) y el cloramfenicol (14,6%). La ciprofloxacina fue resistente en el 6.1% de los casos, ceftazidime mostró resistencia en el 4.9% de los casos y gentamicina mostró un 2.4% de resistencia
Los antibióticos con los que hubo mayor porcentaje de resistencia por parte de Staphylococci, fueron la ampicilina y la ampicilina sulbactam, con 85,7% cada uno; les siguieron lincomicina (71,4%), oxitetraciclina (57,1%), cloranfenicol (57,1%) y eritromicina (57,1%), mientras que cefotaxima, ceftazidime y oxacilina fueron resistentes en 14,3% de los casos. La única especie de estafilococos que fue resistente a la oxacilina fue Staphylococcus sciuri.
Discusión
Los problemas clínicos asociados al incremento y a la diseminación de la resistencia a antibióticos han aumentado en los últimos lustros, especialmente respecto a los antibióticos tipo beta-lactámicos y quinolonas, lo que se ha constituido en un problema de salud pública a nivel global (4,12). Se cree que los animales salvajes cautivos son fuente de 70% de las enfermedades emergentes, incluido el incremento de la resistencia a los antimicrobianos (4).
En ese sentido, un estudio interesante demostró que 25 brotes de enfermedades infecciosas en humanos se asociaron con visitas a sitios de exhibición de animales, como circos y zoológicos (16). Existe preocupación sobre el potencial de transmisión de patógenos bacterianos multirresistentes a los humanos, en el zoológico. No obstante, en Colombia no existen investigaciones sobre la situación de la sensibilidad a los antimicrobianos, en las bacterias aisladas de animales cautivos y silvestres.
En este estudio, la bacteria que se aisló con mayor frecuencia en las aves del zoológico de Barranquilla fue E. coli, dato que coincide con lo obtenido por Steele et al. (1) en frotis de cloacas de aves silvestres. En ambos estudios, la bacteria encontrada en la cloaca con mayor frecuencia fue E. coli; sin embargo, en el estudio de Steele et al. (1) se encontró una mayor prevalencia (89%) con relación a nuestro estudio (55,6%). En su estudio se incluyeron 89 aves, mientras que en nuestro trabajo sólo se incluyeron 30 especímenes aviares. Recientemente, Ahmed4 en Japón, también encontró E. coli como el patógeno más prevalente (53%).
Es interesante observar la relación existente entre los niveles de resistencia encontrados en E. coli aisladas de animales silvestres y los de humanos. En el estudio realizado por Guan et al. (2) en humanos, en animales de granja y en animales silvestres, los mayores porcentajes de resistencia a antibióticos se encontraron en las bacterias aisladas de humanos y de animales silvestres: el 55% de las E. coli aisladas en su estudio fueron resistentes a uno o más antibióticos con 319 aislamientos. Mientras que, en los 30 aislamientos que se realizaron en el zoológico de Barranquilla, todas las cepas de E. coli halladas fueron resistentes a uno o más antibióticos. A su vez, Ahmed4 encontró 21% de resistencia a uno o más antimicrobianos, especialmente a trimetoprim-sulfametoxazol, ampicilina, tetraciclina y cefalosporinas, con fenotipos de resistencia similares a los encontrados por nosotros y otros autores(3). En su estudio, 33% de cepas de E. coli aisladas de aves fueron multirresistentes, mientras que otros autores5 reportaron 55,8% de multirresistencia en las de E. coli aisladas de aves silvestres. En nuestro estudio, no se encontró multirresistencia en E. coli aislada de mamíferos, resultado que difiere del reportado por otros autores (17,19), que encontraron 38% de multirresistencia en E. coli aisladas de mamíferos de varios zoológicos.
Por otro lado, K. pneumoniae tuvo 100% de resistencia a ampicilina en este estudio, lo que coincide con lo reportado por Steele et al. (1) y Ahmed(4). Estos autores también reportaron alta resistencia para ampicilina en E. cloacae, lo que coincide con nuestros resultados.
P. aeruginosa es un microorganismo cuyo tratamiento antimicrobiano es complicado. Su presencia en los animales del zoológico de Barranquilla puede facilitar su transferencia, de manera horizontal, al personal a cargo de los animales o a los equipos de manejo de otros animales. En los trabajos de Steele et al. (1) y Ahmed (4), se reportó aislamiento de cepas con altas tasas de resistencia. En el coológico de Barranquilla, todas las bacterias aisladas del recto de animales fueron resistentes a ampicilina y 20% a ciprofloxacina y gentamicina. Estos resultados fueron similares a los obtenidos por García (18) en muestras de heces de Alouatta palliata, con sensibilidad a ampicilina (77%), a ciprofloxacina (10%) y a gentamicina (23%). La multirresistencia es un problema serio en P. aeruginosa, y la producción de beta-lactamasas de espectro extendido, las mutaciones en la topoisomerasa II y las alteraciones en las porinas de membrana, entre otros, son los factores genéticos que contribuyen a la diseminación de estas cepas resistentes o multirresistentes (4). Los animales del zoológico de Barranquilla no son ajenos a esta problemática, pues 60% de las cepas de P. aeruginosa que se aislaron fueron multirresistentes.
Las tasas de resistencia de las bacterias aisladas en humanos, son más elevadas contra las quinolonas, los beta-lactámicos, las tetraciclinas y los aminoglucósidos (4). En ese contexto, es importante tener en cuenta que los ecosistemas donde se mueven los patógenos humanos la presión selectiva en los hospitales es mayor, ya que los nichos son mas circunscritos, es decir la movilidad de clones es menor que a nivel de zoológicos y en la vida salvaje.
Sin embargo, es importante recordar que la gran mayoría de las bacterias han adquirido su resistencia ";original"; en el medio ambiente que actúa como reservorio natural de donde provienen especialmente Pseudomonas spp. y Acinetobacter spp. (20). Los cambios en la dinámica de las poblaciones bacterianas son directamente proporcionales a los del medio ambiente, debido a que gran cantidad de antimicrobianos son liberados tanto en el suelo, por las prácticas extensivas agropecuarias, como en las aguas residuales que inciden en la selección de la resistencia con consecuencias para la salud humana (20). En Colombia, se ha demostrado que puede existir el riesgo de contraer infecciones bacterianas resistentes a los fármacos debido al consumo de alimentos de origen animal, lo que incrementa la posibilidad de la transferencia genética entre bacterias patógenas (11).
Con respecto a los gérmenes Gram positivos, S. aureus es un patógeno que se aísla frecuentemente en humanos y animales, y que se relaciona con afecciones de la salud en ambos casos. Esta bacteria cuenta con varios factores de virulencia, como son las toxinas, la cápsula y las adhesinas de superficie, entre otras, y cada día es más resistente a los antibióticos de uso común en la terapéutica. Cruz et al. (21)reportaron resistencia a la eritromicina en el 95% de los casos y al cloranfenicol en 35% en hospitales humanos de varias ciudades colombianas. En dicho estudio, realizado en 17 hospitales de 7 ciudades colombianas, se demostró una elevada multirresistencia en 200 aislamientos de S. aureus (96%). El 80% de multirresistencia en el zoológico es también motivo de preocupación, aunque en nuestro estudio no es posible realizar cualquier tipo de comparación, debido al bajo número de aislamientos hechos.
En un estudio reciente (22) en el departamento de Córdoba, se analizaron 90 muestras de animales domésticos, entre equinos, caninos y vacas con mastitis. De las 90 muestras, se encontró S. aureus en 28 y, de éstas, 93% (26/28) fueron sensibles a meticilina. En 7% (2/28) se encontró S. aureus resistente a meticilina y 32% (9/28) fueron productoras de leucocidina Panton Valentine (PVL), de las cuales, 11% (1/9) resultaron ser SAMR-PVL positivas. De los aislamientos de S. aureus, 36% (10/28) fueron productores de β-lactamasas, el 7% (4/28) con resistencia a clindamicina y el 11% (3/28) con resistencia intermedia al mismo, el 4% (1/28) a carbapenems y el 3% a cefalosporinas; todas las cepas fueron sensibles a vancomicina. De las 90 muestras analizadas, en 22 (24%) hubo Staphylococcuscoagulasa negativo. De éstos, once fueron S. sciuri con cuatro de ellos resistentes a meticilina; nueve fueron S. cohnii, uno fue S. warnery y uno fue S. hyicus, estos últimos sensibles a meticilina. Ninguna de las cepas de Staphylococcuscoagulasa negativo produjo PVL (22). Este trabajo demuestra que los Gram positivos aislados de animales también pueden poseer mecanismos de virulencia, como la PVL, así como alta resistencia a los antimicrobianos, mecanismos ya descritos en humanos.
Uno de los principales factores limitantes de nuestro estudio fue el tamaño de la muestra, no obstante, cuando se trabaja con especies silvestres cautivas, se debe limitar el muestreo a los animales que estén en la institución. Además, éste se vio influenciado por el cronograma de capturas, debido a que los animales con los que se trabajó son patrimonio nacional y, por esto, hay que propender por su bienestar y evitar manipulaciones excesivas.
Por el momento, es importante que los resultados obtenidos estimulen la investigación de esta problemática, pues algunos datos coinciden en gran medida con lo encontrado por otros investigadores, tanto en animales como en humanos. Es importante tener en cuenta que algunos de estos animales están en contacto directo con personas y que ésta puede ser una posible vía de contaminación.
En este sentido, algunos investigadores afirman que los animales silvestres de zonas aisladas del hombre no albergan bacterias resistentes, mientras que los que habitan en zonas pobladas por el hombre sí las tienen (23). Esto debería tenerse en cuenta para impulsar la investigación sobre el tema y, en el futuro, realizar estudios comparativos entre los niveles de resistencia a antibióticos encontrados en bacterias aisladas de animales silvestres que no tengan contacto con el hombre, en gérmenes aislados de fauna que viva en áreas aledañas al hombre y en bacterias aisladas de animales cautivos (23)
En este contexto, se ha demostrado que en el dragón de Komodo (Varanus komodoensis), reconocido por la alta virulencia de la flora oral en los ejemplares cautivos, las especies bacterianas de su boca y su número son menores en los ejemplares de vida salvaje (24).
De esta forma, se podría inferir, con propiedad, acerca de la dinámica ambiental de los genes de resistencia a los antibióticos. La importancia de ahondar en el tema de la resistencia bacteriana radica en que muchas de las bacterias citadas, en este y otros estudios a lo largo de los años pasados, han aumentado sus porcentajes de resistencia frente a diversos antibióticos (12-14,21). También, queda claro que la resistencia bacteriana encontrada en las bacterias aisladas de los animales cautivos del zoológico de Barranquilla, son un factor de riesgo para la salud de los mismos, ya que limita las opciones terapéuticas que tiene el médico veterinario para enfrentar las infecciones bacterianas en este centro.
En conclusión, éste es el primer estudio que se ha llevado a cabo en Colombia en animales cautivos en un zoológico y con el que se demostró que los especiemnes del zoológico pueden ser importantes como reservorios de patógenos. Los resultados sirven para intentar, en el futuro, establecer la similitud filogenética existente entre las bacterias aisladas de humanos y de animales, así como, su tendencia a compartir la resistencia con elementos genéticos móviles en ambos grupos, como transposones, integrones y genes de resistencia. La similitud fenotípica de los patrones de resistencia hallados en este estudio, en relación con estudios hechos antes en humanos, presume una movilidad clonal entre éstos y los animales.
Agradecimientos
A la Fundación Botánica y Zoológica de Barranquilla, por brindarnos la posibilidad de realizar este estudio, y a Dave Wehdeking, por su valiosa ayuda en la obtención de muestras.
Correspondencia:
Salim Máttar V. Ph.D. Universidad de Córdoba, Instituto de Investigaciones Biológicas del Trópico, Facultad de Medicina Veterinaria y Zootecnia. Tel.: (475)60710; mattarsalim@hotmail.com. www.unicordoba.edu.co/institutos/iibt/
Referencias
1. Steele C, Brown R, Botzler R. Prevalences of zoonotic bacteria among seabirds in rehabilitation centers along the coast of California and Washington, USA. J Wildlife Dis. 2005;41:735-44. [ Links ]
2. Guan S, Xu R, Chen S, Odumeru J, Gyles C. Development of a procedure for discriminating among Escherichia coli isolates from animals and human sources. Appl Enviroml Microbiol. 2002;68:2690-8. [ Links ]
3. Sawant A, Hegde N, Straley B, Donaldson S. Antimicrobial-resistant enteric bacteria from dairy cattle. Appl Enviroml Microbiol. 2007;73:156-63. [ Links ]
4. Ahmed AM, Motoi Y, Sato M, Maruyama A, Watanabe H, Fukumoto Y, Shimamoto T. Zoo animals as reservoirs of Gram-negative bacteria harboring integrons and antimicrobial resistance genes. Appl Environ Microbiol. 2007;73:6686-90. [ Links ]
5. Middleton J, Ambrose A. Enumeration and antibiotic resistance patterns of fecal indicator organisms isolated from migratory Canada geese (Branta canadensis). J Wild Dis. 2005;41:334-41. [ Links ]
6. Satoshi-Ishii KP, Meyer M, Sadowsky J. Relationship between phylogenetic groups, genotypic clusters, and virulence gene profiles of Escherichia coli strains from diverse human and animal sources. Appl Environ Microbiol. 2007;73:5703-10. [ Links ]
7. Ostebland M, Norrdahi E, Kerpimaki E, Huovinen E. Antibiotic resistance. How wild are wild mammals. Nature. 2001;409:37-8. [ Links ]
8. Girlich D, Poirel L, Carattoli A, Kempf I, Lartigue MF, Bertini A, Nordmann P. Extended-spectrum beta lactamase CTX-M-1 in Escherichia coli isolates from healthy poultry in France. Appl Environ Microbiol. 2007;73:4681-5. [ Links ]
9. Ziebell K, Konczy P, Yong I, Frost S, Mascarenhas M, Kropinski A, et al. Applicability of phylogenetic methods for characterizing the public health significance of verocytotoxin-producing Escherichia coli strains. Appl Environ Microbiol. 2008;74:1671-5. [ Links ]
10. Adaska JM, Silva AJ, Berge AC, Sischo WM. Genetic and phenotypic variability among Salmonella enterica serovar Typhimurium isolates from California dairy cattle and humans. Appl Environ Microbiol. 2006;72:6632-7. [ Links ]
11. Khachatryan A, Besser T, Dale J, Hancock D, Call DR. Use of a nonmedicated dietary supplement correlates with increased prevalence of streptomycin-sulfa-tetracycline-resistant Escherichia coli on a dairy farm. Appl Environ Microbiol. 2006;72:4583-8. [ Links ]
12. Mahony R, Quinn T, Drudy D, Walsh C, White P, Mattar S, et al. Antimicrobial resistance in nontyphoideal Salmonella from food sources in Colombia: evidence for unusual plasmid-localized class 1 integron in serotypes Typhymurium and Anatum. Microbial Drug Resistance. 2006;12:269-77. [ Links ]
13. Máttar S, Martínez P. Emergencia de la resistencia antibiótica debida a las β-lactamasas de espectro extendido (BLEE): detección, impacto clínico y epidemiología. Infectio. 2007; 11: 23-35. [ Links ]
14. Martínez P, Máttar S. Pseudomonas aeruginosa y Acinetobacter baumanii productores de metalo beta-lactamasas en el principal hospital de Córdoba. Infectio. 2005;9:6-14. [ Links ]
15. Martínez P, Espinal P, Máttar S. Epidemiología molecular de Pseudomonas aeruginosa resistente a β-lactámicos de amplio espectro en el Hospital San Jerónimo de Montería. Infectio. 2007; 11: 6-15. [ Links ]
16. Clinical and Laboratory Standard Institute (CLSI). Performance Standards for antimicrobial disk susceptibility test. Information the 8th ed. Supplement M100-s15 document M2-A8. Wayne, PA: Clinical and Laboratory Standards Institute; 2005. [ Links ]
17. Bender JB, Shulman SA. Reports of zoonotic disease outbreaks associated with animal exhibits and availability of recommendations for preventing zoonotic disease transmission from animals to people in such settings. J Am Vet Med Assoc. 2004;224:1105-9. [ Links ]
18. Balde K, Stosik M. Prevalence of antibiotic resistance profile in relation to phylogenetic background among comensal Escherichia coli derived from various mammals. Polish Journal of Microbiology. 2007;56:175-83. [ Links ]
19. García F. Diseminación de mecanismos de resistencia a antibióticos entre bacterias de origen humano, animal y agrícola: impacto en la salud pública y en el medio ambiente. Fecha de consulta: 6 de abril de 2008. Disponible en: http://www.conicit.go.cr/boletin/boletin17/8FernandoGarcia.pdf [ Links ]
20. Ishii S, Meyer M, Sadowsky J. Relationship between phylogenetic groups, genotypic clusters, and virulence gene profiles of Escherichia coli strains from diverse human and animal sources. Appl Environ Microbiol. 2007;73:5703-10. [ Links ]
21. Martínez JL. Antibiotics and antibiotic resistance genes in natural environments. Science. 2008 321:365-7. [ Links ]
22. Cruz C, Moreno J, Renzoni A, Hidalgo M, Reyes J, Schrenzel J, et al. Tracking methicillin-resistant Staphylococcus aureus clones in Colombian hospitals over 7 years (1996-2003): emergence of a new dominant clone. Int J Antimicr Agents. 2005;26:457-62. [ Links ]
23. Lozano D, Máttar S. Primer reporte de Staphylococcus aureus meticilino resistente (SAMR) productores de Panton-Valentine-Leucocidina (PVL) en animales domésticos en Colombia. Infectio. 2008;12(supl.1):111. [ Links ]
24. Goldbertg T, Gillespie T, Rwego I, Estoff E, Chapman C. Forest fragmentation as cause of bacterial transmission among, nonhuman primates, humans and livestock, Uganda. EID. 2008;14:1375-82. [ Links ]
25. Montgomery JM, Gillespie D, Sastrawan P, Fredeking TM, Stewart GL. Aerobic salivary bacteria in wild and captive Komodo dragons. J Wild Dis. 2002;38:545-51. [ Links ]














