Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Infectio
Print version ISSN 0123-9392
Infect. vol.14 no.1 Bogotá Jan./Mar. 2010
1Vitalsalud IPS. Programa Integral Atención del VIH.
2Universidad de Cartagena, Grupo de Investigación en Economía de la Salud.
Recibido: 04/01/2010; Aceptado: 25/01/2010
Resumen
Objetivo: Establecer la frecuencia de la infección por Hepatitis B en los pacientes VIH positivos atendidos en la IPS VitalSalud de Barranquilla, Colombia.
Métodos: Se realizó un perfil serológico para Hepatitis B en los pacientes VIH positivos, consistente en: HBs Ag, Anticore IgG. Estos exámenes se practicaron entre el mes de junio del 2007 hasta julio del 2009.
Resultados: En 24 meses se realizaron exámenes para la detección de Hepatitis B en 103 pacientes VIH positivos. Hubo una prevalencia del 3,1% (tres pacientes) con Hepatitis B crónica. Cuatro pacientes fallecieron durante el período del estudio, ninguno positivo para infección por Hepatitis B. Se detectaron 6 pacientes con Ig G core para VHB positivo aislado, es decir con sospecha de Hepatitis B oculta, la cual se confirmó solo en un paciente con carga viral para ADN de VHB positiva (158 copias/ml). Este paciente no se hallaba usando lamivudina en el momento del examen.
Conclusión: La prevalencia de Hepatitis B en nuestros pacientes corresponde a la reportada en todo el territorio nacional. La búsqueda de infección oculta por Virus de Hepatitis B en los pacientes VIH positivos asistentes a nuestra institución arrojó como resultado un solo paciente con esta patología y con una baja carga viral. La estrategia para el diagnóstico la infección oculta por VHB en los pacientes usando lamivudina debe ser más estudiada.
Palabras Claves: Hepatitis B, SIDA, Hepatitis B oculta
Abstract
Objective: The objective is to establish the frequency of Hepatitis B (VHB) co-infection in HIV outpatients at VitalSalud Health Center in Barranquilla, Colombia.
Methods: Two serological tests to diagnose Hepatitis B in our HIV patients were performed: Hepatitis B surface antigen and Anticore type Ig G (anti HBC Ig G). These tests were run between July, 2007 and July, 2009.
Results: The tests were applied to 103 HIV patients. There was a prevalence of 3.1% (3 patients) for chronic Hepatitis B. Four patients passed away during the study term, none of them was Hepatitis B positive. Six patients with isolated anti HBc Ig G were detected, and only one of them had a positive viral load for VHB DNA (158 copies/ml). This patient was not taking lamivudine at the time of the test.
Conclusions: The prevalence of VHB in our patients is similar to the prevalence reported in our country as a whole. The search for occult hepatitis B was positive, with a low viral load, in one out of 103 of our patients. The strategies for diagnosis of occult hepatitis B in HIV patients under lamivudine treatment require further research.
Key words: Hepatitis B, HIV, AIDS, Occult Hepatitis B
Introducción
La hepatitis B, causada por el virus de la hepatitis B (VHB), constituye un importante problema de salud pública y es el tipo más grave de hepatitis vírica. Puede causar hepatopatía crónica y conlleva un alto riesgo de muerte por cirrosis y cáncer hepático. Se estima que en el mundo hay 2000 millones de personas infectadas por el VHB y más de 350 millones con infección hepática crónica (1). Colombia ha sido clasificado como un país de prevalencia intermedia, con una seroprevalencia del antígeno de superficie de entre 2 y 5%; con variaciones entre regiones geográfica del país con zonas de alta endemia como la Amazonía y baja endemia como el departamento del Atlántico (menos de 2% de portadores) (2).
La coinfección del VHB con el virus de la inmunodeficiencia humana (VIH) es frecuente ya que tienen las mismas rutas de transmisión. En Europa occidental y en los Estados Unidos de América, se ha encontrado que 7 al 10% de los pacientes con VIH, tienen infección crónica por el VHB, siendo los hombres que tienen sexo con otros hombres el grupo de mayor prevalencia (3-5).
Los pacientes coinfectados con el VHB y el VIH tienen un mayor riesgo de cirrosis hepática, enfermedad hepática terminal y muerte por patología hepática, especialmente en pacientes con recuentos bajos de linfocitos CD4 y uso concomitante de alcohol (4). Hay un mayor riesgo de hepatocarcinoma y efectos adversos hepatotóxicos en pacientes usando terapia antirretroviral de alta efectividad (TARAE) coinfectados con Hepatitis B (5).
El 95% de las infecciones por VHB en adultos sanos son autolimitadas> con eliminación del VHB de la sangre e inmunidad duradera contra la reinfección. La infección crónica sucede en menos del 5% de los pacientes mayores de 5 años de edad (3, 6). Los pacientes inmunosuprimidos tales como los pacientes con VIH, los que se encuentran en terapia de sustitución renal y los diabéticos presentan un riesgo mayor de cronicidad de la infección por el VHB (7-9). Aproximadamente 15% de los pacientes con infección crónica mayores de 5 años pueden evolucionar hacia cirrosis y cáncer hepático, permaneciendo asintomáticos hasta la aparición de las manifestaciones clínicas de dichas complicaciones (10). Se estima que el 20% de los pacientes VIH positivos contagiados con el VHB desarrollarán hepatitis crónica por este agente(7).
Los antígenos y anticuerpos asociados con la infección por el virus de hepatitis B son: A) Antígeno de superficie (HBsAg): Se asocia a infección activa. Identifica a los pacientes infectantes y puede detectarse de 3 a 5 semanas tras la infección. Cuando permanece más de seis meses elevado, se relaciona con infección crónica por el VHB (11).
B) Anticuerpo contra antígeno de superficie (Anti HBs): Su presencia indica en la mayoría de las veces, inmunidad para la infección por el VHB, natural o adquirida, siempre y cuando su valor sea igual o superior a 10 UI/ ml ( Unidades Internacionales por mililitro). (12).
C) Anticuerpos contra el core del VHB (anti HBc): El anti HBc total es considerado como marcador de infección previa por VHB. Está compuesto por dos fracciones: Anticore IgM, aparece en el inicio de los síntomas, hasta 30 días después de la aparición del HBs Ag, o durante el período en que las pruebas bioquímicas hepáticas están alteradas en la infección aguda y declina entre tres y doce meses después de la exposición; Anticore IgG, Aparece durante la fase aguda de la enfermedad asociado al HBs Ag y persiste por toda la vida del individuo infectado por el VHB. La presencia del Anticore IgG puede significar: 1) Infección previa con inmunidad, presencia concomitante de anticuerpo contra Antígeno de superficie en suero mayor de 10 UI/ ml. 2) Infección previa con pérdida del Anti HBs, son pacientes en los cuales no hay evidencia ni de replicación viral ni de anticuerpos contra antígeno de superficie, debido a que los niveles de estos anticuerpos han desaparecido con el tiempo, pero reaparecen posterior a la aplicación de una o más dosis de la vacuna contra la Hepatitis B. 3) Infección por VHB oculta, son pacientes con presencia del DNA viral en suero o hígado y ausencia de HBs Ag y Anti HBs. Esta situación no es rara en los pacientes VIH positivos, infección por el virus de la Hepatitis C y en áreas de alta prevalencia de infección por el VHB.
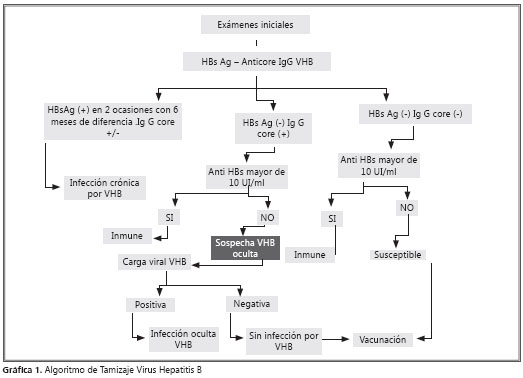
La infección oculta por el VHB puede estar presente en 10 a 45% de los pacientes VIH positivos(13, 14). Por lo anterior se recomienda que a todos los pacientes VIH positivos se les practique los siguientes exámenes para el tamizaje del VHB: HBs Ag, anti HBc totales o anticore Ig G y anti HBs. Si el paciente tiene un anticore IgG positivo aislado, se le debe realizar la carga viral del ADN de VHB. Si en un paciente con anticore Ig G positivo aisladamente la carga viral para VHB resulta negativa, este paciente debería ser vacunado contra la Hepatitis B y podría tener una respuesta anamnésica o primaria (15, 16).
En la Institución de salud, "Vitalsalud IPS" de Barranquilla, se realizó un estudio para determinar la prevalencia de la infección crónica por Hepatitis B, incluyendo a la infección por Hepatitis B oculta, en pacientes seropositivos para VIH.
Metodología
Se realizó un perfil serológico para Hepatitis B en los pacientes VIH positivos asistentes a Vitalsalud IPS consistente en: HBs Ag, Anticore IgG. Estos exámenes se practicaron entre el mes de junio del año 2007, hasta el mes de julio del año 2009. De acuerdo a los resultados de los exámenes se les seguía a los pacientes el algoritmo diagnóstico que se halla en el gráfico 1 y se les clasificaba en: a) Sin infección por VHB, b) Infección crónica por VHB, c) Infección crónica oculta por VHB ó d) Inmune frente a VHB.
Los exámenes de antígeno de superficie fueron hechos con la técnica de quimioluminiscencia amplificada. El anticuerpo contra core Ig G fue realizado con la técnica MEIA usando el instrumento IMX (Laboratorios Abbott®). Las cargas virales para VHB fueron hechas por el método PCR COBAS Amplicor Versión 1.5, (Laboratorios Roche®) con un rango de linealidad de la prueba de 54 a 111,000,000 copias/ml.
Población y muestra. La población la constituyeron todos los pacientes VIH positivos vinculados al programa de atención integral del VIH SIDA de la Institución Prestadora de Salud Vitalsalud, localizada en Barranquilla Colombia, que cumplieron los siguientes criterios de inclusión: a) pacientes de ambos géneros mayores de 18 años; b) pacientes quienes completaron todos los exámenes serológicos para la detección de la infección oculta por el VHB; c) pacientes con exámenes serológicos para hepatitis B no mayores de 2 años de antigüedad. Como criterios de exclusión se tuvieron: a) pacientes con exámenes serológicos incompletos, es decir si HBs Ag y/o Anticore Ig G. b) pacientes que decidieron no participar del estudio.
Recolección y análisis de la información. Se revisaron las historias clínicas de los pacientes para determinar los exámenes serológicos de cada uno. A los pacientes con exámenes incompletos, se les hizo una actualización de los mismos. Se establecieron las siguientes variables: edad, sexo, tendencia sexual, estadio frente a Hepatitis B, recuento de linfocitos CD4 al ingreso a nuestra institución, los resultados de carga viral para ADN de VHB en los pacientes con HBs Ag positivo o con Ig G core positivo aislado, uso o no del fármaco Lamivudina en los pacientes a quienes se les realizó el anterior examen. Las variables catgegoricas se analizaron en sus frecuencias absolutas y relativas; para la operacionalización de las variables numéricas se usaron las respectivas medidas resúmenes. Los datos recolectados fueron ingresados a una base de datos y procesada la estadística descriptiva utilizando la hoja de cálculo de Microsoft Excel®. Para valorar las diferencias entre los resultados de cd4 se utilizó la prueba t de student para dos muestras suponiendo varianzas iguales.
Resultados
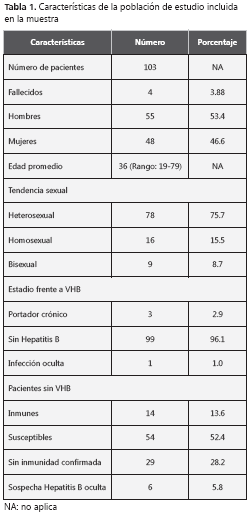
En los 24 meses se realizaron pruebas para la detección de Hepatitis B en 121 pacientes VIH positivos de los cuales a 103 (85,12%) se les logró realizar exámenes completos. Cuatro pacientes fallecieron durante el período del estudio, ninguno positivo para infección por VHB.
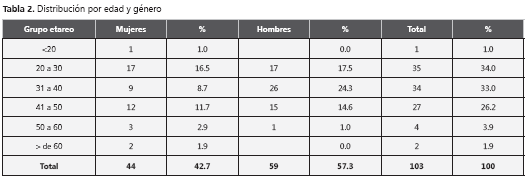
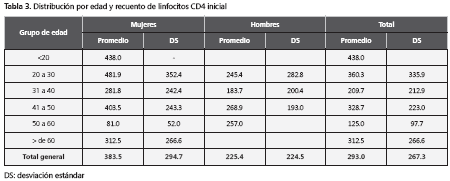
De los 103 pacientes 55 eran hombres (53,4%). El promedio y la mediana de la edad fueron de 36 años (rangos entre 19 y 79 años). En lo referente a la tendencia sexual, 75,7 % de los pacientes se declararon heterosexuales, 15,5% homosexuales y 8,7% bisexuales. La mediana del recuento de linfocitos CD4 de ingreso de los pacientes fue de 248 y el promedio fue de 297,3. Se logró detectar HBs Ag positivo a 3 pacientes (2,9%), todos hombres, dos heterosexuales y un homosexual. Su promedio de linfocitos CD4 inicial fue de 224 células. A estos pacientes se les confirmó el resultado con la repetición del HBs Ag, con más de seis meses de diferencia entre los reportes. Sólo a dos de estos pacientes se les pudo realizar carga viral para VHB, obteniéndose un resultado positivo inicial de 1142 copias/ml, en un paciente que no estaba recibiendo Lamivudina al momento del examen. Este resultado cambió a indetectable posteriormente con el uso de Lamivudina dentro de su régimen antirretroviral. El otro paciente resultó con carga viral negativa y se hallaba usando lamivudina más de 1 año antes de realizarse el examen.
Hubo 14 pacientes con títulos protectores de AntiHBs (13,6%). 83 pacientes tuvieron HBs Ag y anticore Ig G negativos, de los cuales 54 eran susceptibles, o con Anti HBs negativo y a 23 no se les pudo realizar Anti HBs. Se detectaron 6 pacientes con Ig G core para VHB positivo aislado, es decir con sospecha de Hepatitis B oculta, la cual se confirmó solo en un paciente con carga viral para ADN de VHB positiva (158 copias/ml). Este paciente no se hallaba usando Lamivudina en el momento del examen. Cuatro de los cinco pacientes con carga viral para VHB negativa recibían Lamivudina en el momento del examen, todos por un período superior a un año. Los resultados anteriores se resumen en las tabla 1, tabla 2 y tabla 3
Discusión
La prevalencia de pacientes portadores de Hepatitis B en esta investigación (2.9%), es similar a la informada en todo el país, considerado como de prevalencia intermedia (2-10%). La prevalencia de infección por VHB tanto oculta como de los portadores crónicos fue del 3,88%. Todos los pacientes seropositivos para Hepatitis B fueron del sexo masculino. Si bien en la literatura médica se informa una alta resistencia del VHB a la lamivudina (15 a 20% por cada año de tratamiento) (17), nuestros pacientes con coinfección VIH-VHB se mantuvieron con cargas virales para VHB indetectables usando este medicamento dentro de su esquema de TARAE.
La tamización exhaustivo para Hepatitis B oculta dio como resultado a un paciente positivo para la misma, lo que representa una tasa de prevalencia del 0.91% en nuestra población. El 14.2% de los pacientes con Anticore IgG positivo aislado de nuestra muestra resultó positivo para infección oculta por VHB. Las estadísticas que hemos hallado sobre este tema son variables. Un estudio en la ciudad de Medellín, Colombia, halló que el 8, 3% de los pacientes VIH positivos con Anticore Ig G positivo aislado tuvieron carga viral positiva para ADN del VHB (18), mientras que en una investigación realizada en el Líbano, continente asiático, el 83% de los pacientes resultaron con carga viral positiva (19). En ninguno de los estudios mencionados los pacientes investigados estaban recibiendo terapia antirretroviral con lamivudina o Tenofovir, fármacos contra el VIH con acción sobre el VHB. Posiblemente la no detección de un mayor número de pacientes con hepatitis B oculta en pacientes con anticore Ig G positivo aislado fue negativa debido al uso de Lamivudina como parte de la terapia contra el VIH, medicamento que disminuye tanto la replicación del ADN del VHB como del ARN del VIH. Se decidió investigar con carga viral para VHB a los pacientes con HBsAg y/o Anti core Ig G positivos recibiendo Lamivudina por las siguientes razones: a) La necesidad de descartar una replicación del VHB en pacientes con alto riesgo de cirrosis y hepatocarcinoma, tales como los VIH positivos. b) la alta tasa de resistencia que presenta el VHB al uso de Lamivudina como monoterapia para esta enfermedad. En un estudio realizado en Francia en pacientes VIH positivos coinfectados con VHB y en terapia antirretroviral con este fármaco, se encontraron mutaciones de resistencia a este en el 37% de los pacientes en un período de seguimiento de 5 años (20) c) el alto número de pacientes VIH positivos usando Lamivudina como parte de su esquema antirretroviral, de manera crónica, con tamizaje incompleto para VHB, previo al inicio de esta terapia; y d) la no disponibilidad de datos en nuestra región sobre el tema.
Es de importancia resaltar los hallazgos de Pogany y colaboradores (2005), donde se demostró la negativización de carga viral en sus pacientes con Anti HBc (anticuerpos totales contra el core) positivo aislado y carga viral para el VHB positiva, al año de tratamiento con Lamivudina (21). No encontramos estudios sobre la realización de carga viral para VHB en pacientes recibiendo Lamivudina por períodos superiores a un año. Se requiere mayor investigación a este respecto.
El alto porcentaje de pacientes susceptibles a la Hepatitis B o con todos los marcadores serológicos negativos podría estar explicado por: a) La no adecuada respuestas serológica a la inmunización estándar para Hepatitis B en los pacientes VIH positivos: Revisando nuestros datos, hallamos que de 17 pacientes de nuestro estudio con esquema de vacunación completa para VHB entre los años 2005 y 2006, solo 6 tuvieron antiHBs sobre 10 UI/ml, es decir una eficacia del 35%. Esto se podría deber a la alteración de la inmunidad humoral que presentan los pacientes VIH positivos (22). b) Por ser el departamento del Atlántico una zona de baja endemia para Hepatitis B.
Una estrategia para mejorar los porcentajes de inmunidad sería doblar la dosis de la vacuna recombinante contra el VHB en los pacientes VIH positivos. Se requieren más estudios en nuestro medio al respecto.
En general, los resultados del presente estudio muestran que la infección por el VIH en nuestra región compromete más a la población adulta joven, al sexo masculino y a los pacientes con tendencia sexual heterosexual, lo cual nos da una idea del alto impacto socioeconómico de esta enfermedad. Nuestros pacientes en promedio llegaron con linfocitos CD4 menores de 350 y hubo una tasa de mortalidad de 2.08% anual en los pacientes del estudio. El recuento de linfocitos CD4 inicial fue mayor en las mujeres en sin que las diferencias fuesen significativas frente a los hombres. Si bien llama la atención el bajo promedio de linfocitos CD4 en el grupo de mujeres entre 50 a 60 años, el bajo número de pacientes en este grupo de edad (tres), no nos permite establecer una conclusión desde el punto de vista de la estadística.
Conclusiones
La prevalencia de Hepatitis B en los pacientes estudiados corresponde a la reportada a nivel nacional. La búsqueda de infección oculta por Virus de Hepatitis B en los pacientes VIH positivos de nuestra institución arrojó como resultado un solo paciente con esta patología y con una baja carga viral. Todos los pacientes que se hallaban recibiendo Lamivudina por más de 1 año, a los que se les practicó carga viral para ADN del VHB, obtuvieron resultados negativos para la misma. Recomendamos que se debe practicar el tamizaje exhaustivo para Hepatitis B oculta todos los pacientes VIH positivos antes de iniciar terapia antirretroviral, con el fin de poder evitar los falsa negativización de la carga viral para Hepatitis B en los pacientes con sospecha de infección oculta por este agente y para poder escoger la mejor terapia de acuerdo a los resultados de estos exámenes. La estrategia para el diagnóstico la infección oculta por VHB en los pacientes que reciben Lamivudina debe ser más estudiada.
Conflicto de interés.
El autor principal declara no tener conflicto de interés con empresa farmacéutica alguna.
Correspondencia:
Pedro Fernando Polo Acosta, Médico Internista, Programa Integral VIH Vital salud Barranquilla, Atlántico, Colombia. Tel 035-3797904. Correo electrónico: ppoloacosta@hotmail.com
Referencias
1. OMS. Hepatitis B. Organización Mundial de la Salud 2008 [updated 2008; cited Oct 2009]; Available from: http://www.who.int/mediacentre/factsheets/fs204/es/print.html [ Links ]
2. IDROVO CUBIDES Víctor, SUAREZ Q Carmen Yanette, Alvarez Quintero Patricia. Epidemiología e historia natural de la hepatitis B. Rev Col Gastroenterol. 2009;24(suppl.1):4s-12s. [ Links ]
3. Edmunds WJ, Medley GF, Nokes DJ, Hall AJ, Whittle HC. The influence of age on the development of the hepatitis B carrier state. Proc Biol Sci. 1993 Aug 23;253(1337):197-201. [ Links ]
4. Thio CL, Seaberg EC, Skolasky R, Jr., Phair J, Visscher B, Munoz A, et al. HIV-1, hepatitis B virus, and risk of liver-related mortality in the Multicenter Cohort Study (MACS). Lancet. 2002 Dec 14;360(9349):1921-6. [ Links ]
5. Weber R, Sabin CA, Friis-Moller N, Reiss P, El-Sadr WM, Kirk O, et al. Liver-related deaths in persons infected with the human immunodeficiency virus: the D:A:D study. Arch Intern Med. 2006 Aug 14-28;166(15):1632-41. [ Links ]
6. McMahon BJ, Alward WL, Hall DB, Heyward WL, Bender TR, Francis DP, et al. Acute hepatitis B virus infection: relation of age to the clinical expression of disease and subsequent development of the carrier state. J Infect Dis. 1985 Apr;151(4):599-603. [ Links ]
7. Hadler SC, Judson FN, OMalley PM, Altman NL, Penley K, Buchbinder S, et al. Outcome of hepatitis B virus infection in homosexual men and its relation to prior human immunodeficiency virus infection. J Infect Dis. 1991 Mar;163(3):454-9. [ Links ]
8. Hyams KC. Risks of chronicity following acute hepatitis B virus infection: a review. Clin Infect Dis. 1995 Apr;20(4):992-1000. [ Links ]
9. Polish LB, Shapiro CN, Bauer F, Klotz P, Ginier P, Roberto RR, et al. Nosocomial transmission of hepatitis B virus associated with the use of a spring-loaded finger-stick device. N Engl J Med. 1992 Mar 12;326(11):721-5. [ Links ]
10. Goldstein ST, Zhou F, Hadler SC, Bell BP, Mast EE, Margolis HS. A mathematical model to estimate global hepatitis B disease burden and vaccination impact. Int J Epidemiol. 2005 Dec;34(6):1329-39. [ Links ]
11. Hoofnagle JH, Di Bisceglie AM. Serologic diagnosis of acute and chronic viral hepatitis. Semin Liver Dis. 1991 May;11(2):73-83. [ Links ]
12. Alward WL, McMahon BJ, Hall DB, Heyward WL, Francis DP, Bender TR. The long-term serological course of asymptomatic hepatitis B virus carriers and the development of primary hepatocellular carcinoma. J Infect Dis. 1985 Apr;151(4):604-9. [ Links ]
13. Hofer M, Joller-Jemelka HI, Grob PJ, Luthy R, Opravil M. Frequent chronic hepatitis B virus infection in HIV-infected patients positive for antibody to hepatitis B core antigen only. Swiss HIV Cohort Study. Eur J Clin Microbiol Infect Dis. 1998 Jan;17(1):6-13. [ Links ]
14. Piroth L, Binquet C, Vergne M, Minello A, Livry C, Bour JB, et al. The evolution of hepatitis B virus serological patterns and the clinical relevance of isolated antibodies to hepatitis B core antigen in HIV infected patients. J Hepatol. 2002 May;36(5):681-6. [ Links ]
15. Koziel MJ, Peters MG. Viral hepatitis in HIV infection. N Engl J Med. 2007 Apr 5;356(14):1445-54. [ Links ]
16. Santos EA, Yoshida CF, Rolla VC, Mendes JM, Vieira IF, Arabe J, et al. Frequent occult hepatitis B virus infection in patients infected with human immunodeficiency virus type 1. Eur J Clin Microbiol Infect Dis. 2003 Feb;22(2):92-8. [ Links ]
17. Dienstag JL, Schiff ER, Wright TL, Perrillo RP, Hann HW, Goodman Z, et al. Lamivudine as initial treatment for chronic hepatitis B in the United States. N Engl J Med. 1999 Oct 21;341(17):1256-63. [ Links ]
18. Ramirez I, Cataño J. Prevalencia de Hepatitis B oculta en una cohorte prospectiva de pacientes con VIH Iatreia. 2008;21(suplemento 1). [ Links ]
19. Ramia S, Mokhbat J, Ramlawi F, El-Zaatari M. Occult hepatitis B virus infection in HIV-infected Lebanese patients with isolated antibodies to hepatitis B core antigen. Int J STD AIDS. 2008 Mar;19(3):197-9. [ Links ]
20. Miailhes P, Trabaud MA, Pradat P, Lebouche B, Chevallier M, Chevallier P, et al. Impact of highly active antiretroviral therapy (HAART) on the natural history of hepatitis B virus (HBV) and HIV coinfection: relationship between prolonged efficacy of HAART and HBV surface and early antigen seroconversion. Clin Infect Dis. 2007 Sep 1;45(5):624-32. [ Links ]
21. Pogany K, Zaaijer HL, Prins JM, Wit FW, Lange JM, Beld MG. Occult hepatitis B virus infection before and 1 year after start of HAART in HIV type 1-positive patients. AIDS Res Hum Retroviruses. 2005 Nov;21(11):922-6. [ Links ]
22. Bruguera M, Cremades M, Salinas R, Costa J, Grau M, Sans J. Impaired response to recombinant hepatitis B vaccine in HIV-infected persons. J Clin Gastroenterol. 1992 Jan;14(1):27-30. [ Links ]














