Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Infectio
Print version ISSN 0123-9392
Infect. vol.14 no.1 Bogotá Jan./Mar. 2010
1 Médica internista, neumóloga, Hospital Universitario San Ignacio y Pontificia Universidad Javeriana, Bogotá, D.C., Colombia
2 Médico internista, nefrólogo, Hospital Universitario San Ignacio y Pontificia Universidad Javeriana, Bogotá, D.C., Colombia
3 Médico internista, reumátologo, Hospital Universitario San Ignacio y Pontificia Universidad Javeriana, Bogotá, D.C., Colombia
Recibido: 10/08/2009; Aceptado: 25/01/2010
Resumen
La tuberculosis constituye, en nuestro medio, una de las enfermedades infecciosas endémicas. Con el advenimiento de las nuevas terapias para el control de la artritis reumatoide, como los inhibidores del factor de necrosis tumoral, la incidencia de casos de reactivación ha aumentado notoriamente.
Se presenta el caso de una mujer de 42 años de edad, con disnea, dolor torácico, tos, derrame pleural con líquido pleural tipo exudado linfocítico, con deaminasa de adenosina (ADA) de 55 U-L e identificación de granuloma en la biopsia pleural. Se revisa la literatura y se hacen recomendaciones.
Palabras clave: tuberculosis, antagonistas del factor de necrosis tumoral
Abstract
Tuberculosis (TB) represents one of the endemic infectious diseases in our population. The incidence of reactivate TB cases has grown notoriously with the onset of new therapeutic options for controlling rheumatoid arthritis (RA), such as tumor necrosis factor (TNF) inhibitors.
The case of a 42 year old woman is highlighted. Her condition is characterized by shortness of breath, chest pain, cough, pleural effusion, linfocitic exudate pleural fluid, ADA 55 U-L and granuloma in pleural biopsy.
A review of relevant literature and recommendations are presented.
Key words: Tuberculosis, tumor necrosis factor antagonist
Introducción
De los nueve millones de personas que desarrollan anualmente tuberculosis en el mundo, 95% vive en países en desarrollo y los derrames pleurales tuberculosos ocurren hasta en 30% de los pacientes con esta enfermedad (1,2,3).
La tuberculosis es una emergencia sanitaria global, como fue declarada por la Organización Mundial de la Salud (OMS) en 1993, y nuestro país, con altas tasas de infectados y de enfermos, no escapa a esta situación. En Colombia, en el 2008, se notificaron 11.342 casos de tuberculosis pulmonar y extrapulmonar, para una incidencia 25,6 por 100.000 habitantes (3). Esta enfermedad afecta, en especial, a la población en la edad productiva, lo que genera una sobrecarga en los servicios de salud y tiene una indiscutible repercusión sobre la economía, a pesar de la existencia de las herramientas de diagnóstico y tratamiento para detener su incremento en la comunidad (2).
Hasta el momento, se han evaluado ciertos factores de riesgo para la infección por el bacilo tuberculoso; entre ellos se encuentra la coinfección con el virus de la inmunodeficiencia humana y, en los últimos años, gracias a los avances de la terapia biológica, los inhibidores del factor de necrosis tumoral (FNT-α) juegan un rol importante (4).
Estos agentes han probado ser efectivos para controlar los signos, síntomas y mejorar la funcionalidad articular; además, atenúan el daño estructural articular en pacientes con artritis reumatoide.
Presentación del caso
Se trata de una paciente de 42 años de edad, que consultó por un cuadro clínico de un mes de evolución, de disnea progresiva, asociado a dolor torácico tipo pleurítico en el hemitórax izquierdo, escalofríos y tos, inicialmente con expectoración hialina y, posteriormente, seca, que se había incrementado en los últimos cuatro días.
Tenía antecedente de artritis reumatoide diagnosticada 20 años antes, con manejo con 10 mg diarios de prednisona desde hacía 15 años, 50 mg diarios de azatioprina y 7,5 mg de metrotexato desde hacía 3 años; había iniciado manejo con terapia biológica (40 mg de adalimumab, en 8 dosis) tres meses antes de la consulta, previa baciloscopia seriada de esputo que fue negativa, sin prueba de tuberculina por falta de disponibilidad y con radiografía de tórax normal; era hipertensa y no tenía antecedentes de exposición, epidemiológicos ni tóxicos.
En la revisión por sistemas, negó síntomas respiratorios previos al episodio, y refirió pérdida de 3 kg de peso luego de iniciar la terapia biológica y episodios de diaforesis profusa sin un patrón específico de presentación.
En el examen físico de ingreso, se encontró una paciente alerta, febril (38,6oC), con tensión arterial de 130/80 mm Hg, frecuencia cardiaca de 122 por minuto, sin masas ni adenopatías en el cuello, y con ruidos cardíacos rítmicos, taquicárdicos, sin soplos ni frote pericárdico. El examen pulmonar presentaba signos de derrame pleural izquierdo y escasos estertores crepitantes en la base izquierda. El abdomen era blando, sin masas.
Además, presentaba dolor a la palpación de rodillas y tobillos, signos de sinovitis crónica en la primera, la segunda y la tercera articulación metacarpo-falángica en forma bilateral y en las rodillas; limitación para la extensión y flexión de las muñecas, flexión de las articulaciones interfalángicas proximales y distales, deformidad bilateral en cuello de cisne del segundo al quinto dedos y desviación cubital; en los miembros inferiores, presencia de hallux valgus bilateral.
Se hizo una impresión diagnóstica inicial de derrame pleural izquierdo, neumonía adquirida en la comunidad, artritis reumatoide e hipertensión arterial.
En la radiografía de tórax inicial se observó derrame pleural izquierdo (figura 1). El cuadro hemático se encontró anemia microcítica hipocrómica, con hemoglobina de 8,6 g/dl, con recuento de leucocitos dentro de límites normales y trombocitosis de 580.000 plaquetas. Los gases arteriales de ingreso con FiO2 0,21, informaron un pH de 7,39, PaCO2 de 29 mm Hg, HCO3 de 17,7 mEq/L, PaO2 de 37 mm Hg, SaO2 de 71%, con pulsoximetría de 76%. El electrocardiograma evidenciaba taquicardia sinusal.
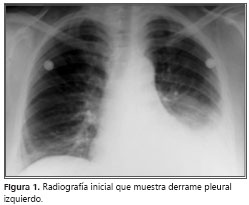
Se inició manejo con oxígeno y ceftriaxona-claritromicina.
Se practicó una toracentesis diagnóstica que mostró líquido indicativo de exudado linfocítico, con glucosa de 71 mg/dl, proteínas de 5,3 g/dl, Lactato deshidrogenasa (LDH) de 2.046 U/L leucocitos 1.584/mm3 con 80% de linfocitos, 20% de neutrófilos; el Gram y el cultivo fueron negativos; se procesó una muestra para determinación de deaminasa de adenosina (ADA). Los hemocultivos fueron negativos.
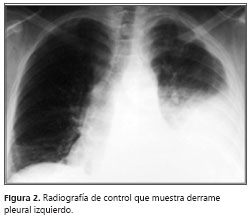
A pesar del manejo instaurado, persistieron los picos febriles, la tos con expectoración hialina y la disnea. Se llevó a cabo un control radiográfico (figura 2) que mostró aumento del derrame pleural; el hemograma no demostró leucocitosis y sí disminución de la trombocitosis; el reporte de ADA fue de 55 U/L unidades por litro. Se decidió practicar una biopsia pleural y se suspendió el manejo con antibióticos. El estudio histopatológico reportó inflamación crónica granulomatosa, con tinciones PAS, Grocott y Ziehl-Neelsen negativas, indicativo de tuberculosis pleural (figura 3> y figura 4).
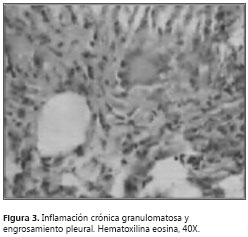
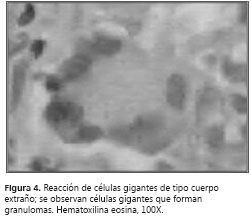
Se tomaron pruebas de función hepática y se hizo la valoración oftalmológica, para así poder iniciarle el tratamiento supervisado con isoniacida-rifampicina-pirazinamida-etambutol.
Después de iniciar el tratamiento antituberculoso con supervisión estricta, la paciente mostró mejoría notoria de su cuadro, sin aparición de nuevos picos febriles, con disminución progresiva de la necesidad de oxígeno suplementario, evolución satisfactoria y desaparición del derrame pleural al finalizar el tratamiento.
Discusión
Teniendo en cuenta la inmunosupresión de la paciente, tanto por la enfermedad de base como por los medicamentos para controlarla, inicialmente se consideró el diagnóstico de un proceso infeccioso neumónico bacteriano. Posteriormente, ante la falta de mejoría con el manejo antibiótico, el aumento del derrame pleural y la presencia de ADA, concomitantemente con el uso crónico de inmunosupresores y el uso reciente de terapia biológica, el diagnóstico se orientó hacia la reactivación de una infección tuberculosa, evidenciada en los cambios histopatológicos con formación granulomatosa crónica en pleura.
El adalimumab es un anticuerpo monoclonal tipo IgG1, específico contra el FNT-α, de forma que no se une a otras citocinas. Se administra por vía subcutánea, disminuye la producción de metaloproteinasas circulantes y marcadores de recambio de cartílago, y frena la activación endotelial y la producción de citocinas proinflamatorias, tanto en la circulación como en la membrana sinovial.
Se ha hecho un seguimiento de más de seis años al medicamento, que ha mostrado un inicio de acción rápido (dos semanas) con resultados sostenidos. Entre los efectos secundarios indeseados de los inhibidores del FNT-α y motivo de mayor estudio, está la predisposición a diversos tipos de infecciones por gérmenes, entre los cuales se han reportado Candida albicans, Listeria monocytogenes, Histoplasma spp., Aspergillus spp., Criptococcus spp. y Mycobacterium tuberculosis (5,6).
Patogénesis
La hipótesis actual para la infección y el exudado pleural tuberculoso plantea la existencia de un foco caseoso subpleural que se rompe al espacio pleural, 6 a 12 semanas después de la infección primaria. Los antígenos de las micobacterias entran al espacio pleural e interactúan con los linfocitos T previamente sensibilizados, lo que resulta en una reacción tardía de hipersensibilidad y acumulación de líquido, y lleva a aumento de la permeabilidad de los capilares pleurales y disminución de la capacidad del sistema linfático para depurar las proteínas del espacio pleural (1,7).
Las primeras células que aparecen como respuesta a las proteínas pleurales son los neutrófilos, pero esta reacción sólo persiste por los primeros tres días y, luego, predominan los linfocitos. Además de actuar como fagocitos y células presentadoras de antígenos, los macrófagos contribuyen en este momento a la formación de los granulomas, por la imposibilidad de eliminar a la micobacteria. Igualmente, contribuyen a la producción de FNT-α e interleucina-1 que, finalmente, se encargan de la activación del linfocito, como otras de sus funciones (1,4).
Se plantea que, en la respuesta inmunitaria a la tuberculosis, el FNT-α puede ser el responsable de la manifestación clínica de la tuberculosis, inclusive de la pérdida de peso, la sudoración nocturna y la destrucción tisular; es decir que juega un papel central en la respuesta del huésped, que incluye la formación de granulomas, la contención de la enfermedad y el proceso inflamatorio, tanto temprano como tardío.
Los anticuerpos contra el FNT-α causan una reactivación de la tuberculosis en modelos animales con infección latente. Los dos receptores (FNTR1 y FNTR2) median señales de apoptosis, diferenciación celular y de activación del factor nuclear-κ, que puede influir en la producción de citocinas (IL-1) y la expresión de moléculas de adhesión, al disminuir la migración de células inmunes, y evitar la apoptosis del macrófago (2,4,8). En ausencia del FNT-α, el granuloma es desorganizado y difuso, e incapaz de contener la bacteria (signo de disrupción de mecanismo protector) y la diseminación de la infección (9)
Ciertos datos de estudios de casos de inhibidores del FNT-α, han sugerido una asociación entre el tratamiento con infliximab y el desarrollo de tuberculosis, aunque con resultados insuficientes como para probar una relación causal. Se ha demostrado un patrón atípico de presentación, en el que predominan el compromiso extrapulmonar y la enfermedad diseminada, el cual se relaciona con estados de importante inmunosupresión. La mayoría de los casos se interpretan como reactivación de la enfermedad (2,5).
Al parecer, por su corto tiempo de utilización, hay menos reportes de casos sobre el adalimumab. En el momento, se plantea una asociación que depende de altas dosis (2) y se está a la espera de seguimientos más prolongados para determinar su papel definitivo.
En un estudio francés, publicado este año, se encontró una tasa de incidencia de tuberculosis ajustada por sexo y edad de 116,7 por 100.000 pacientes-año. Se encontraron mayores tasas con infliximab y adalimumab que con etanercept: las tasas estandarizadas de incidencia fueron 18,6 (IC95% 13,4-25,8) y 29,3 (IC95% 20,3-42,4) versus 1,8 (IC95% 0,7-4,3), respectivamente. Además, se hizo un análisis de casos y controles, y se encontró que la exposición al infliximab o al adalimumab, en comparación con la de etanercept, fue un factor de riesgo independiente para tuberculosis: OR=13,3 (IC95% 2,6-69,0) y OR=17,1 (IC95% 3,6-80,6). En nuestro caso, la paciente recibía adalimumab, el cual probablemente fue un factor potencial de riesgo para el desarrollo de la tuberculosis (10).
Distribución de los casos
Antes de la introducción de los inhibidores del FNT-α, los casos de tuberculosis se observaban ocasionalmente en pacientes con artritis reumatoide y otras condiciones autoinmunes. El papel de otros inmunomoduladores no se ha definido por completo; unos de ellos, los corticoesteroides usados en forma crónica en dosis mayores de 15 mg diarios, han presentado un incremento en la aparición de casos de tuberculosis (4).
Durante los estudios preliminares sobre el adalimumab, de 542 pacientes tratados, 9 (1,7%) desarrollaron tuberculosis; de éstos, 7 casos presentaban anormalidades radiológicas que sugerían que el compromiso era el resultado de la reactivación de una infección latente (11).
Posteriormente, en el reporte de Bieber, entre los 2.500 pacientes con artritis reumatoide tratados con adalimumab, se identificaron 13 casos de tuberculosis, con un tiempo de inicio de 3 a 8 meses y un compromiso extrapulmonar o miliar en 40% de los mismos 4.
Enfoque diagnóstico actual
La mayoría de los pacientes con tuberculosis pleural no tienen síntomas distintivos. La fiebre, el dolor en el tórax y la pérdida de peso constituyen síntomas inespecíficos. Por ello, se ha tratado de llegar a una aproximación más exacta del diagnóstico, generando alternativas a la identificación histológica de los granulomas, a la visualización del bacilo con tinciones para gérmenes ácido-alcohol resistentes y al cultivo.
El estudio del líquido pleural toma cada vez más importancia; la determinación de la deaminasa de adenosina (ADA), enzima que cataliza la conversión de adenosina y deoxiadenosina a iosina y deoxiiosina, respectivamente, es un estudio paraclínico de gran impacto en el momento.
En el caso presentado, no se demostró el bacilo; sin embargo, por las manifestaciones clínicas, los títulos de ADA, la presencia de granuloma en la biopsia, la respuesta clínica y la evolución, se pudo confirmar el diagnóstico, independientemente de dicho hallazgo negativo. No hay que olvidar que el diagnóstico definitivo de tuberculosis pleural se logra con la biopsia pleural.
Otros dos elementos que se deben mencionar son el interferón gamma (INF-γ), igualmente sensible y específico que la biopsia pleural, pero con costos mayores, y la amplificación del ADN de la micobacteria mediante PCR, método comparable con el cultivo. Ambas estrategias son válidas actualmente para el diagnóstico (7,12,13).
Existen grupos con riesgo especialmente alto de desarrollar tuberculosis activa, una vez infectados con M. tuberculosis.
En los grupos con riesgo alto, se incluyen a los individuos con supresión de su sistema inmunitario, generada por la enfermedad que sufren o por los agentes para tratarla; por esta razón, deben ser evaluados y tratados para tuberculosis latente, en el momento en que se diagnostique la condición o antes de iniciar el tratamiento con terapias inmunosupresoras, como corticosteroides por tiempos prolongados y antagonistas del FNT-α (infliximab, etanercept y adalimumab) (14,15).
En Colombia, aún no existe un registro riguroso de estos casos, pero sí hay varias publicaciones de casos colombianos de tuberculosis bajo terapia anti-FNT-α, como una serie de cuatro casos publicados por Rojas et al., en el que se aprecia que el tiempo entre la primera dosis y la aparición de la enfermedad osciló entre 3 y 24 meses, lo que coincide con el presente caso que se presentó a los tres meses. Además, en dicha serie de casos se cuestiona el uso de la prueba de la tuberculina para el diagnóstico de la tuberculosis latente y se recomienda continuar la investigación en búsqueda de una mejor herramienta diagnóstica, teniendo en cuenta las limitaciones que presenta la misma (9).
Recomendaciones
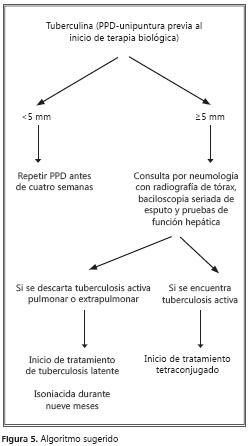
El riesgo de tuberculosis es mayor en pacientes que reciben anti-FNT-α del tipo de anticuerpos monoclonales, que para aquéllos que reciben terapia con receptores solubles del FNT-α (10). Dada la prevalencia de la tuberculosis en nuestro medio, todos los pacientes con artritis reumatoide que sean candidatos a terapia biológica con inhibidores del FNT-α, deben someterse a tamización para infección latente de tuberculosis, con radiografía de tórax y prueba de tuberculina, hasta que dispongamos de una mejor herramienta diagnóstica.
Asimismo, todos los pacientes de alto riesgo, es decir, aquéllos que reciben más de 15 mg de prednisona diarios durante más de un mes, aquéllos con VIH y los contactos cercanos de un paciente con tuberculosis activa, deben evaluarse de igual forma. La reacción a la prueba de la tuberculina se considera positiva si es mayor de 5 mm y los pacientes deben recibir tratamiento para tuberculosis latente antes de iniciarse la terapia biológica (4).
En todos los pacientes se debe interrogar sobre antecedentes de tuberculosis previa (14). Si se demuestra una tuberculosis previa manejada adecuadamente, se considera que el paciente no necesita tratamiento adicional (14).
En pacientes con supresión del sistema inmunitario, los resultados de la prueba de tuberculina pueden ser falsos negativos debido a la terapia medicamentosa o a una condición médica subyacente que cause anergia, es decir, el individuo puede estar infectado con M. tuberculosis. En estos casos, se recomienda hacer la prueba en dos pasos, para incrementar la respuesta a la misma. Las pruebas sanguíneas (INF-γ) no se han estudiado en estos individuos.
Tratamiento
Tuberculosis latente. Se recomienda tratar la tuberculosis latente, una vez se diagnostique y después de descartar la presencia de tuberculosis activa (15). El tratamiento para la tuberculosis latente ha mostrado ser efectivo para prevenir la forma activa.
Un esquema con isoniacida (5 mg/kg diarios) durante nueve meses, acompañada de piridoxina, es la opción preferida para el tratamiento de todos los pacientes con tuberculosis latente,. El uso de un esquema con rifampicina durante cuatro meses es una alternativa aceptable, especialmente en aquéllos con reacciones adversas o resistencia a la isoniacida, pero no a la rifampicina, o cuando el individuo no vaya a estar disponible por más que cuatro a seis meses y sea improbable completar el esquema de nueve meses de isoniacida (15,16,17).
En la literatura no existe uniformidad en la decisión de cuánto deben esperar los pacientes para recibir terapia biológica, después de iniciado el tratamiento para tuberculosis latente. Las guías de la British Thoracic Society recomiendan esperar a terminar la terapia para tuberculosis latente (15), a diferencia de la guía de India, que sugiere que se podría iniciar tratamiento cuando se hayan completado dos meses de iniciado el tratamiento para tuberculosis latente (14,18).
Tuberculosis activa. Los pacientes con tuberculosis activa deben recibir el esquema establecido por el Ministerio de la Protección Social y la Secretaría de Salud, es decir, el tetraconjugado con isoniacida, rifampicina, etambutol y pirazinamida, siguiendo todas las normas recomendadas por dichas entidades.
Debido a las diferentes presentaciones de la tuberculosis, lo complejo de su manejo y los datos no conclusivos de la literatura, para finalizar nuestra discusión y reafirmar que aún no hay consenso definitivo al respecto, queremos mencionar un artículo que se encuentra en prensa y presenta tres casos de tuberculosis con adalimumab, en los cuales se presentó la tuberculosis a pesar de haber seguido las guías españolas, uno de cuales recibió un tratamiento completo de nueve meses para tuberculosis latente. Además, se plantea que la presentación extrapulmonar de la tuberculosis puede retrasar el diagnóstico y se sugiere sutilmente, una mayor probabilidad de hepatotoxicidad en estos pacientes(19).
Conclusión
La comunidad científica debe ser rigurosa en la búsqueda de tuberculosis latente y activa en los pacientes que van a recibir o están recibiendo terapia anti-FNT-α y lo ideal sería que se publicaran los casos para lograr llevar un registro adecuado de los mismos y que se establecieran algoritmos de manejo.
Correspondencia:
Patricia Hidalgo, Unidad de Neumología, Hospital Universitario San Ignacio. Carrera 7 Nº 40-62, Bogotá, D.C., Colombia. Teléfono: (571) 594-6175. hidalgop@javeriana.edu.co
Referencias
1. Ferrer J. Pleural tuberculosis. Eur Respir J. 1997;10:942-7. [ Links ]
2. Bieber J, Kavanaugh A. Consideration of the risk and treatment of tuberculosis in patients who have rheumatoid arthritis and receive biologic treatment. Rheum Dis Clin of North America. 2004;30:257-70. [ Links ]
3. Ministerio de Protección Social. Viceministerio de Salud y Bienestar. Representante OPS/OMS Colombia I.E. Instituto Nacional de Salud. Plan estratégico "Colombia libre de tuberculosis 2010-2015 para la expansión y fortalecimiento de la estrategia alto a la TB". 2009. [ Links ]
4. Keane J, Gershon S, Wise RP, Mirabile-Levens E, Kasznica J, et al. Tuberculosis associated with infliximab, a tumor necrosis factor-α neutralizing agent. N Eng J Med. 2001; 345: 1098-104. [ Links ]
5. Bresnihan B, Cunnane G. Infection complications associated with the use of biologic agents. Rheum Dis Clin North Am. 2003;29:185-202. [ Links ]
6. Dukes C. Infectious complications of treatment with biologic agents. Curr Opin Rheumatol. 2004;16:393-8. [ Links ]
7. Ferrer J. Tuberculous pleural effusion and tuberculous empyema. Sem Resp Crit Care Med. 2001;21:637-43. [ Links ]
8. Ehlers S. Role of tumor necrosis factor (TNF) in host defense against tuberculosis: implications for immunotherapies targeting TNF. Ann Rheum Dis. 2003;62(Suppl.II):ii37-42. [ Links ]
9. Rojas-Villárraga A, Agudelo C, Pineda R, Porras A, Matute G, et al. Tuberculosis en pacientes tratados con antagonistas del factor de necrosis tumoral alfa en un área endémica: ¿vale la pena el riesgo? Biomédica. 2007;27:159-71. [ Links ]
10. Tubach F, Salmon D, Ravaud P, Allanore Y, Goupille P, et al. Risk of tuberculosis is higher with anti-tumor necrosis factor monoclonal antibody therapy than with soluble tumor necrosis factor receptor therapy: the three-year prospective French research axed on tolerance of biotherapies registry. Arthritis Rheum. 2009;60:1884-94. [ Links ]
11. Scheldon K. Adalimumab for use in the treatment of rheumatoid arthritis. Center for Biologics Evaluation and Research Office of Therapeutics Research and Review Division of Clinical Trial Design and Analysis Immunology and Infectious Diseases Branch CLINICAL REVIEW Abbott, Biologic Licensing Application STN 125057?. Fecha de consulta: 2009. Disponible en: www.fda.gov [ Links ]
12. Chapman S, Davies R. Pleural diseases. The management of pleural space infections. Respirology. 2004;9:4-11. [ Links ]
13. Light R. Pleural effusion. N Engl J Med. 2002;346:1971-7. [ Links ]
14. Handa R, Misra R, Chaturvedi VP, Pispati PK, Rao URK. Guidelines for tuberculosis prophylaxis during anti-tumour necrosis factor-treatment: Indian Rheumatology Association. J Rheumatol. 2006;9:181-3. [ Links ]
15. BTS recommendations for assessing risk and for managing M. tuberculosis infection and disease in patients due to start anti-TNF-alfa treatment. Thorax. 2005;60:800-5. [ Links ]
16. Munsiff S, Nilsen D, Dworkin F. Guidelines for testing and treatment of latent tuberculosis infection. New York: Department of Health and Mental Hygiene, Bureau of Tuberculosis Control, 2005. [ Links ]
17. Rom W, Garay S. Tuberculosis. Second edition. Philadelphia: Lippincott Williams & Wilkins; 2004. [ Links ]
18. Montoya JG. TB and transplants. Abstracts, First International Congress on Mycobacteria: A challenge for the 21st century. Palo Alto, CA, Stanford University Medical Center, September 27, 2008. [ Links ]
19. Blanco JJ, Perez A, Pego J, Núñez M, Temes E.Guerra G. Tuberculosis pulmonar en relación con adalimumab: estudio de 3 casos. Arch Bronconeumol. 2009. doi:10.1016. [ Links ]














