Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Infectio
Print version ISSN 0123-9392
Infect. vol.14 no.1 Bogotá Jan./Mar. 2010
1Grupo de inmunología molecular,Universidad del Quindío, Armenia, Colombia.
Recibido: 05/02/2009; Aceptado: 25/01/2010
Resumen
Los péptidos antimicrobianos son las moléculas efectoras del sistema inmune innato, cuyas familias se encuentran en casi todos los organismos, desde bacterias hasta mamíferos. Son una familia de sustancias polifacéticas con complejos mecanismos de acción relacionados con la interacción con el patógeno a través de su membrana, o afectando blancos internos, como la replicación del ADN y la síntesis de proteínas, e interactuando con el huésped con funciones inmunomoduladoras de la regulación del proceso inflamatorio y de la cicatrización.
Aunque la generación de resistencia a los péptidos antimicrobianos es mucho menor si se compara con la generada por los antibióticos convencionales, existen mecanismos de resistencia ya descritos, como la degradación por proteasas, la liberación de proteínas inhibidoras o los cambios en la conformación de la membrana externa del patógeno. El estudio de estas sustancias ha permitido evidenciar sus usos potenciales en el ámbito clínico para contrarrestar los inconvenientes de la resistencia a los antibióticos; sin embargo, a pesar de los grandes avances logrados en este campo, aún quedan puntos controversiales por dilucidar.
Palabras clave: péptidos catiónicos antimicrobianos, péptidos de defensa del huésped, defensinas, antibióticos, cecropinas, catelicidinas.
Abstract
The antimicrobial peptides (AMP) are the effectors molecules of the innate immune system, finding groups of this kind of substances in almost all living organisms from bacteria to mammals. They are a family of versatile substances with complexes action mechanisms in the pathogen they interact with membrane, DNA synthesis and protein synthesis and folding, and also with the host showing immunomodulatory functions in wound healing and inflammation process. Even though the generation of resistance to the AMP is lower compare with conventional antibiotics there are resistance mechanism already describe to this kind of substances like degradation by proteases, releasing of inhibitory substances or conformational changes in the external membrane of the pathogen. Actually the study of this group of substances has make them see as potential tools for clinical use helping to counteract the problem of antibiotic resistance, but even great progress had been made in this field there still exist some controversial issues for future study.
Key words: antimicrobial peptides, cationic antimicrobial peptides, host defense peptides, defensins, antibiotics, cecropins, cathelicidins
Introducción
Los organismos vivos son sistemas abiertos que se encuentran constantemente expuestos al ambiente, lo cual implica afrontar el riesgo constante de adquirir infecciones; para defenderse de este tipo de amenazas han desarrollado mecanismos de defensa que conforman el sistema inmune, clasificados de forma didáctica como los sistemas innato y adaptativo. Los péptidos antimicrobianos hacen parte de los efectores más importantes de la respuesta inmune innata. Generalmente, estos péptidos, o polipéptidos, contienen menos de 200 aminoácidos y son producidos por diferentes tipos de células, se expresan de forma constitutiva o inducible dependiendo del organismo y del tejido en el que estén presentes al momento de la infección, y tienen un amplio espectro antimicrobiano y múltiples mecanismos de acción (1).
La situación actual de resistencia de los microorganismos a los antibióticos convencionales ha llevado a la búsqueda de nuevas alternativas. Los péptidos antimicrobianos han surgido en los últimos 25 años como una familia de sustancias con gran potencial para uso clínico, debido a sus múltiples mecanismos de acción, amplio espectro de actividad y bajo potencial de resistencia (2). Estos péptidos antimicrobianos se han encontrado en casi todos los seres vivos, desde los procariotas, con las bactericinas, a los eucariotas, como mamíferos, anfibios, insectos y plantas con una familia diversa de péptidos (3).
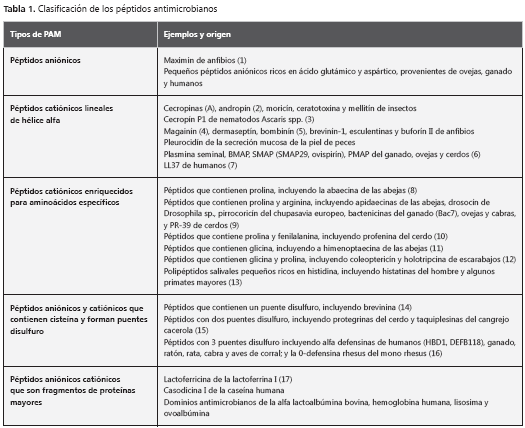
Los péptidos antimicrobianos pueden clasificarse según su estructura secundaria y su composición (4), como lineales, de hélice alfa (tales como cecropinas, magaininas y mellitinas), caracterizados por el enriquecimiento de uno o dos aminoácidos, que contienen puentes disulfuro (defensinas, protegrinas) y fragmentos de otras proteínas más grandes con actividad antibacteriana (tabla 1).
La mayoría de los péptidos antimicrobianos descritos son codificados por genes y se sintetizan en los ribosomas, aunque existen otros que son el resultado de metabolitos secundarios (por ejemplo, la lactoferricina).
El espectro de actividad de los péptidos antimicrobianos es amplio. Se encuentra actividad antiviral, antifúngica, antibacteriana e, incluso, en algunos casos, antitumoral. Sus mecanismos de acción son múltiples e incluyen interacciones con la membrana celular, inhibición de la síntesis proteica y de ácidos nucleicos, con funciones inmunomoduladoras, quimiotácticas y en el proceso de cicatrización (5). Existen en el momento varios productos en estudio clínico de fase II y III, que se utilizan de forma tópica o intravenosa para el tratamiento de infecciones localizadas y sistémicas; por lo tanto, es importante para la futura práctica clínica conocer los aspectos más relevantes de este nuevo grupo de medicamentos, desde sus mecanismos de acción, y algunos puntos esenciales para su uso clínico (8).
Se hizo una búsqueda de información en la base de datos del National Center for Biotechnology Information (NCIB) (http://www.ncbi.nlm.nih.gov/pubmed) con el descriptor principal: péptido catiónico antimicrobiano (cationic antimicrobial peptide), de acuerdo con el MeSH (Medical Subjet Headings) en los últimos cinco años y se obtuvieron 4.746 referencias, de las cuales se hizo una selección de acuerdo con la lectura de los resúmenes. Se escogieron los que mejor cubrían los aspectos de los mecanismos de acción, producción y uso clínico, y se obtuvieron los artículos completos de éstos.
Características físico-químicas y evolutivas de los péptidos antimicrobianos
Desde hace tres décadas, aproximadamente, se ha encontrado que la linfa de los insectos, los gránulos de los neutrófilos humanos y la piel de las ranas contenían péptidos que podían matar bacterias en cultivo. Desde entonces se han observado más de 600 péptidos catiónicos con propiedades antimicrobianas en casi todas las especies, desde bacterias hasta vertebrados. Algunos de estos péptidos, además de destruir directamente microorganismos, parecen capaces de reclutar y promover otros elementos de la inmunidad, particularmente de la inmunidad innata, lo que genera el concepto de péptidos de defensa del huésped y péptidos antimicrobianos, estos últimos descritos como aquéllos cuya función primaria es la destrucción de los microorganismos (9,10).
La mayoría de los péptidos antimicrobianos son catiónicos, lo que significa que tienen una carga positiva a un pH fisiológico, debido al gran contenido de arginina y lisina (residuos cargados positivamente) en relación con el de ácido aspártico y ácido glutámico (residuos cargados negativamente), generalmente, con una carga neta entre +2 y +9 y una proporción substancial (≥30%) de residuos hidrofóbicos. Además, este carácter catiónico puede ser reforzado por una amidación en el extremo C terminal. Frecuentemente, los péptidos antimicrobianos adoptan estructuras anfipáticas con extremos hidrofóbicos que encaran otros hidrofílicos, lo que les confiere propiedades para interaccionar con las membranas, como se describirá en los mecanismos de acción (7).
La gran diversidad de los péptidos antimicrobianos no sólo se debe a que se han encontrados en todos los animales, sino a su variada estructura química y composición. Evolutivamente, estos péptidos se han desarrollado por procesos de duplicación, divergencia y presión selectiva, dada la interacción de cada especie con su ambiente y patógenos específicos (11). Actualmente, existen bases de datos con más de 800 secuencias descritas de péptidos antimicrobianos nativos y sintéticos, disponibles para el estudio de los péptidos antimicrobianos, ya sea contenidas en bases de datos generales, como GenBank, European Molecular Biology Laboratory (EMBL) y Swiss-Prot, o en bases de especializadas en este tipo de moléculas, como Antimicrobial Sequences Database (AMSDb) (http://www.bbcm.univ.trieste.it/~tossi/pag1.htm), peptaibol (http://www.cryst.bbk.ac.uk/peptaibol/home.shtml ), ANTIMIC, SAPD (Synthetic Antibiotic Peptide Database), APD (Antimicrobial Peptide Database) (http://aps.unmc.edu/AP/main.php) (12).
Sin embargo, también existe un amplio número de péptidos con potente actividad antimicrobiana que son sintetizados por fuera de los ribosomas o que contienen substanciales modificaciones posteriores a la traducción, por ejemplo, lipopéptidos (polymixina, dermaseptina) y lantibióticos (3), los cuales contienen aminoácidos no nativos o estructuras principales no peptídicas. Más aún, se ha desarrollado una amplia variedad de péptidos antimicrobianos sintéticos utilizando síntesis por combinaciones o mediante modificaciones de péptidos antimicrobianos existentes en la naturaleza. Éstos incluyen péptidos como el KSL con potente actividad bactericida y fungicida (2), el lipopéptido basado en ornitina MSI-843 (13) y péptidos cíclicos que contienen combinaciones de amino ácidos D y L. Igualmente, se han sintetizado péptidos antimicrobianos por mimetismo molecular utilizando peptoides, que difieren de los péptidos en que la cadena lateral está unida a la estructura amídica nitrogenada en vez del carbono, lo que los hace resistentes a las proteasas (14).
La inducción del proceso de síntesis de los péptidos antimicrobianos es prevalente en insectos, se ha estudiado particularmente en la mosca de la fruta, Drosophila melanogaster, y se ha observado en vertebrados y plantas (15).Las vías de señalización que median la respuesta de los péptidos antimicrobianos son similares para los animales invertebrados y vertebrados, y emplean reguladores de la transcripción similares a la familia de rel/NF-KB (nuclear factor kappa beta).
En los vertebrados, la síntesis de los péptidos antimicrobianos es constitutiva o se puede inducir por respuestas inflamatorias mediadas por citocinas y macromoléculas microbianas. Por ejemplo, la B-defensina de la tráquea bovina (tracheal antimicrobial peptide, TAP) es sintetizada cuando se expone la vía aérea a bacterias o lipopolisacáridos inhalados (16). Esta respuesta, iniciada por los receptores de lipopolisacáridos, se traduce en reguladores de la transcripción que incluyen el complejo de NF-KB y actúan en los motivos de unión NF-KB en el promotor de gen TAP. Además de la regulación por síntesis de la transcripción, un nivel adicional de control y especificidad se da en la acumulación de estos péptidos en células efectoras, como granulocitos, neutrófilos y macrófagos, en mamíferos y hemocitos en insectos. Estas células tienen mecanismos que controlan la liberación de gránulos de este tipo de sustancias, dependiendo de los estímulos específicos (17).
En los invertebrados, los péptidos antimicrobianos se caracterizan por su rápida síntesis y secreción hacia la hemolinfa después de una infección microbiana y se ha encontrado que sus genes se encuentran principalmente activos en el cuerpo graso y los hemocitos (18).
En los mamíferos se ha encontrado que las células de Paneth, ubicadas en el fondo de las criptas del intestino delgado, liberan sus gránulos ricos en defensinas en respuesta a una estimulación colinérgica o un estímulo bacteriano (19).
Mecanismos de acción
Aunque su carácter catiónico, asociado con su tendencia a ser amfipáticos, facilita su interacción e inserción en las paredes celulares aniónicas y membranas de fosfolípidos de los microorganismos, se han propuesto varios mecanismos que explican su modo de acción, como: promover por sí mismo la captación, ejercer una acción detergente sobre la membrana celular y funcionar como poros de la membrana celular.
Los mecanismos de acción de este tipo de sustancias son variados y están relacionados con complejas interacciones moleculares, lo que ha llevado a llamarlas medicamentos sucios, debido a la diversidad de sus mecanismos de acción, su naturaleza anfifílica y su carga catiónica, en comparación con los antibióticos convencionales, como los beta-lactámicos, con un único mecanismo de acción. Esto hace a los péptidos antimicrobianos difíciles de estudiar, pero al mismo tiempo, más interesantes. Aunque por muchos años el dogma ha sido que los péptidos antimicrobianos interaccionan con las membranas bacterianas aumentando la permeabilidad, actualmente se han descubierto blancos adicionales a éstas (figura 1) (20).

Interacciones con la membrana
La interacción inicial de los péptidos antimicrobianos con las bacterias, generalmente, es producida por su carga positiva y su atracción electrostática hacia las superficies polianiónicas de las paredes, ya sea por los ácidos teicoicos y lipoteicoicos en los Gram positivos o los lipopolisacáridos en los Gram negativos. Después de esta interacción, los péptidos antimicrobianos generan áreas de inestabilidad en la membrana externa, permitiendo la translocación de estos mismos a través de la bicapa externa; una vez localizados en la membrana, pueden sufrir modificaciones en su conformación y producir daños en la membrana o internamente.
Interacciones con la membrana
La interacción inicial de los péptidos antimicrobianos con las bacterias, generalmente, es producida por su carga positiva y su atracción electrostática hacia las superficies polianiónicas de las paredes, ya sea por los ácidos teicoicos y lipoteicoicos en los Gram positivos o los lipopolisacáridos en los Gram negativos. Después de esta interacción, los péptidos antimicrobianos generan áreas de inestabilidad en la membrana externa, permitiendo la translocación de estos mismos a través de la bicapa externa; una vez localizados en la membrana, pueden sufrir modificaciones en su conformación y producir daños en la membrana o internamente.
Mecanismo de barril
Luego de interactuar con la membrana y alcanzar un nivel crítico entre péptido y lípido, los péptidos se reorientan de forma perpendicular formando una empalizada con sus cadenas laterales hidrofóbicas que encaran el centro hidrofóbico de la membrana y sus cadenas polares, y enfrentan el centro creando un poro hidrofílico. La formación de este tipo de poros es irregular en tamaño y duración, lo que genera, finalmente, una pérdida del equilibrio osmótico y del potencial de membrana (figura 1).
Mecanismo forma anular
Los péptidos se unen a la membrana al alcanzar una concentración límite que hace que los lípidos se doblen formando un canal delimitado por la cabeza de los grupos lipídicos asociados a los péptidos que, a diferencia del anterior, forma un canal mixto del péptido con los lípidos de la membrana. Este tipo de mecanismo se ha encontrado en péptidos como magainina y mellitina (21).
Mecanismo de alfombra
En este mecanismo, los péptidos no se insertan en la membrana, sino que permanecen asociados con la cara externa y, al alcanzar un punto crítico, forman una especie de alfombra capaz de debilitar la membrana y causar su colapso en una configuración de micelio; eventualmente, se produce la muerte celular por pérdida del citoplasma. Este tipo de mecanismos se ha encontrado en péptidos como latarcín Ltc2a, derivado del veneno de la araña Lachesana tarabaevi (22).
Mecanismo de agregado
En este modelo, similar a la función de los detergentes, el péptido se une a la membrana y, a una concentración suficiente, se reorienta, lo que permite la formación de estructuras parecidas a los micelios que se extienden en la bicapa en un complejo péptido lipídico. Estos agregados aleatorios transmembrana de lípido péptido y agua, forman un canal por el cual se liberan iones, causando la muerte celular por pérdida del contenido citoplasmático, o pueden desintegrarse espontáneamente, lo que lleva a la translocación de los péptidos hacia el citoplasma donde pueden afectar blancos de acción interna.
Funciones relacionadas con los ácidos nucleicos, síntesis, translocación y plegamiento de proteínas
Se ha encontrado que algunos péptidos antimicrobianos, como el buforín II –derivado del sapo Bufo bufo gargarizans– no tienen su función sobre la membrana y son capaces de traspasarla, acumularse internamente y unirse al ADN mediante motivos de unión relacionados con las histonas (23). En otros péptidos, como la indolicina derivada de los neutrófilos bovinos y microcín J25, pueden alterar la permeabilidad de la membrana; también, tienen mecanismos alternativos al unirse al ADN o a algunas enzimas asociadas a éste, como la topoisomerasa I y la ARN polimerasa, encontrándose que estos péptidos pueden inhibir el crecimiento bacteriano mediante la interacción con los ácidos nucleicos (24).
Otros péptidos son capaces de alterar la síntesis proteica, al interrumpir la incorporación de histidinas y alterar las enzimas involucradas en la síntesis proteica. Algunos de los péptidos que han mostrado este tipo de actividad son PR-39 (péptido derivado de los neutrófilos del cerdo), dermaseptín, pleurocidín y péptido-1 (B defensina humana). Otros péptidos, como el pirrocoricín y el drosocín, actúan sobre el plegamiento de las proteínas mediante la inhibición de chaperonas específicas de las bacterias, como DnaK en Escherichia coli (25, 26).
En otros péptidos, como PR39 e indolicín, se han descrito indicios de actividad mediante la alteración de la formación del tabique, lo que lleva a la formación de bacterias filamentosas (27). Se ha encontrado que el péptido nisín de la categoría de las bacteriocinas es capaz de inhibir la síntesis de la membrana y, por lo tanto, la división celular, al unirse al lípido II, un precursor del peptidoglucano.
En péptidos, como el microcín j25, se ha encontrado que, incluso, son capaces de alterar la cadena respiratoria al inhibir el consumo de oxígeno y estimular la producción de especies reactivas de oxígeno (28).
Funciones inmunomoduladoras
Los péptidos de defensa del huésped tienen un amplio rango de funciones inmunomoduladoras, como controlar de alguna forma la expresión de cientos de genes en monocitos y células epiteliales, como quimiotáctico sobre las células del sistema inmune, y en la inducción de citocinas y diferenciación celular, promoviendo la angiogénesis, la curación de las heridas y la resolución de las infecciones (29, 30).
Uno de los péptidos más estudiados es la catelicidina LL37, con capacidad quimiotáctica sobre monocitos, neutrófilos y células CD4, y capaz de unirse a los lipopolisacáridos, inhibiendo la respuesta celular inducida por estos últimos, como la liberación de factor de necrosis tumoral alfa, de óxido nítrico y de otros factores tisulares (31).
Algunos fragmentos de péptidos antimicrobianos que, a pesar de no tener actividad sobre las bacterias, exhiben mecanismos inmunomoduladores sobre el proceso de cicatrización, al inducir la expresión de interleucinas como la IL8, estimular la proliferación de queratinocitos y aumentar la infiltración leucocitaria (32). Otros son capaces de inhibir la actividad de la oxidasa de los neutrófilos e inducir sindecans, proteoglucanos y heparansulfato, moléculas importantes en el proceso de cicatrización (33,34).
Algunas de estas funciones podrían considerarse proinflamatorias, pero de hecho, estos péptidos pueden suprimir las respuestas de la vía de señalización dependiente de receptores TLR (toll-like receptors), la producción de citocinas proinflamatorias como el FNT-α (factor de necrosis tumoral) y el choque séptico en algunos modelos animales (35).
Mecanismos de resistencia
Los péptidos antimicrobianos han sido utilizados por la naturaleza por billones de años y no hay duda de que su uso eventualmente podría generar resistencia, aunque con una mayor dificultad comparado con los antibióticos convencionales. Es importante tener en cuenta que las connotaciones de resistencia en este tipo de sustancia, en cuanto a la generación de resistencia cruzada con los péptidos utilizados por el sistema inmune, pueden ser más graves (36). Algunas cepas resistentes a los péptidos antimicrobianos se han relacionado con la enfermedad; por ejemplo, Staphylococcus aureus resistente a estos péptidos tiende a causar endocarditis bacteriana (37).
La resistencia de las bacterias a los péptidos antimicrobianos está determinada por un número de propiedades en la bacteria que incluyen carga y estructura de los componentes de la membrana externa, como lipopolisacáridos, composición de los lípidos y presencia de un potencial electroquímico en la membrana citoplasmática, y la respuesta de la bacteria a cambios ambientales y bajo estrés, así como mecanismos de transporte, flujo y degradación del péptido (38). Por ejemplo, en Staphylococcus aureus se reduce la carga neta negativa al introducir aminoácidos básicos como d-alanina, desde el citoplasma hacia la superficie del ácido teicoico; también, modifica sus membranas por la vía de MprF con L-lisina, incrementando la carga neta positiva. En otras bacterias, los polisacáridos de la cápsula limitan la interacción de los péptidos antimicrobianos con sus objetivos de membrana, lo que demuestra que los mutantes sin cápsula de Klebsiella pneumoniae son más sensibles a la muerte por los péptidos antimicrobianos(39,40).
En algunas bacterias Gram negativas, por ejemplo, Yersinia enterocolitica, las alteraciones en la producción de proteínas de la membrana externa se relacionan con la resistencia. Asimismo, tienen la capacidad de modificar el lípido A, que es uno de los principales responsables de la interacción con el sistema inmune innato, ya que activa la respuesta de los TLR4 y su fosfato genera una carga negativa que interacciona con los péptidos antimicrobianos; por lo tanto, al modificar su carga es capaz de resistir la acción bactericida de los péptidos antimicrobianos y evitar una respuesta inmune (41). Algunas especies de Salmonella reducen la fluidez de la membrana externa por un incremento de las interacciones hidrofóbicas; se cree que este incremento retarda o suprime la inserción de los péptidos antimicrobianos en la membrana y la formación de poros en ella (4).
En varios organismos se ha descrito la producción de enzimas proteolíticas capaces de degradar los péptidos antimicrobianos; se han encontrado elastasas, gelatinasas, metaloproteinasas, metaloproteasas, proteasas de cisteína y proteasas de superficie, en diferentes organismos como Pseudomonas aeruginosa, Enterococcus faecalis, Proteus mirabilis, Streptococcus spp. y Staphylococcus spp. (42).
Otro mecanismo de resistencia es la neutralización de los péptidos antimicrobianos, ya sea por producción de moléculas unidas a la membrana o secretadas, que se unen directamente a los péptidos antimicrobianos, o por inducción de moléculas del huésped que se unan a los péptidos antimicrobianos; por ejemplo, en Staphylococcus aureus se produce una proteína llamada estafilocinasa, la cual es capaz de unirse directamente a las α-defensinas humanas, logrando una inhibición del efecto bactericida (43).
Al igual que con los antibióticos convencionales, existen algunos transportadores transmembrana capaces de bombear los péptidos antimicrobianos junto con algunos antibióticos convencionales y ser factores de resistencia contra múltiples sustancias (41).
Inquietudes para el uso clínico
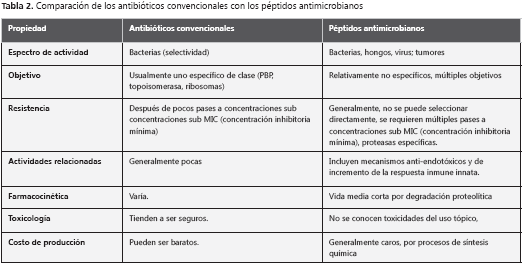
Los péptidos antimicrobianos se plantean como un grupo de sustancias que entrarían al arsenal clínico, ya que tienen ventajas con respecto a los antibióticos convencionales; una de las principales es la poca resistencia producida por los péptidos antimicrobianos, a pesar de pases consecutivos de bacterias a concentraciones inferiores a la inhibitoria (tabla 2) (44,45).
Una de las principales preguntas para llevar este tipo de moléculas a la aplicación clínica, se refiere a su toxicidad. Hasta el momento, la mayoría de los estudios clínicos se enfocan en el uso tópico. Aunque muchos péptidos tienen actividad sobre las membranas eucariotas, esta actividad es mucho menor en comparación con las procariotas; esto puede deberse a la ausencia de lípidos cargados negativamente en la superficie de las membranas eucariotas, el menor potencial de membrana en la mayoría de las células y la presencia de colesterol en las eucariotas.
Junto con esto, es importante destacar los posibles efectos colaterales de este tipo de sustancias; por ejemplo, se ha encontradoactividad embriotóxica y paralizante sobre los espermatozoides, en algunos péptidos, como la nisina y la magainina, y se ha evaluado su posible uso como un anticonceptivo de aplicación vaginal (46,47).
Aunque la interacción con las membranas es uno de los principales mecanismos de acción de los PAM es importante recordar que no es el único. A esto se agrega que puedan tener funciones inmunomoduladoras en la migración de los leucocitos y la activación de las vías de señalización; incluso, algunos péptidos han demostrado proteger contra infecciones y daño tisular in vivo, a pesar de no tener actividad directa contra las bacterias (34).
Otro de los puntos importantes es la degradación de estos péptidos por proteasas, tanto del torrente sanguíneo como del sistema gastrointestinal, así como su unión con otras proteínas, la cual lleva a su inactivación; ésta es una de las principales razones para el uso clínico de forma tópica. Sin embargo, también se han desarrollado análogos sintéticos, como peptoides y otros análogos, que son resistentes a las proteasas, que utilizan aminoácidos modificados que les confieren dicha resistencia (48, 13).
Conclusiones
Los péptidos antimicrobianos constituyen un grupo de sustancias desarrolladas por la naturaleza a través del proceso evolutivo, por la compleja interacción entre el huésped y el patógeno, con un espectro de actividad amplio y mecanismos de acción complejos. El entendimiento de este tipo de sustancias nos enseña una fuente prácticamente inagotable de péptidos antimicrobianos en la naturaleza, para ser evaluados en busca de potenciales medicamentos para tratar de contrarrestar la resistencia microbiana a los antibióticos actuales.
La variedad de propiedades antimicrobianas, sus propiedades físicas y el éxito evolutivo, hacen de los péptidos catiónicos sustancias ideales para el desarrollo de futuras aplicaciones terapéuticas. Sin embargo, a pesar de la gran cantidad de conocimiento adquirido en la descripción de los péptidos, existen muchas áreas que permanecen controversiales.
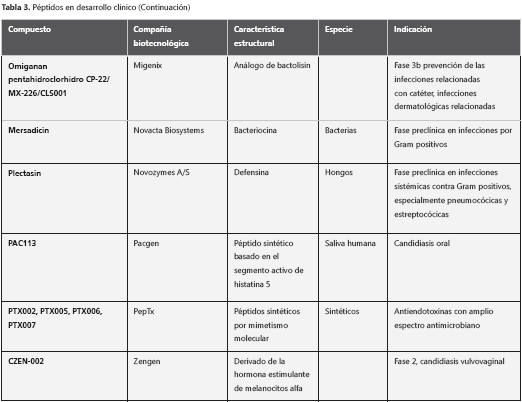

Los péptidos antimicrobianos pueden entrar a la terapéutica por medio de varias estrategias: como monoterapia, para el tratamiento de infecciones, en combinación con los antibióticos convencionales, con el fin de promover un efecto sinérgico o aditivo a estos últimos; como agentes inmunomoduladores que incrementen la inmunidad innata natural, y como agentes neutralizantes de las endotoxinas, con el fin de prevenir complicaciones fatales asociadas con los factores de virulencia que causan el choque séptico (49). Sin embargo, a pesar de la gran cantidad de péptidos descritos en diversos organismos y los esfuerzos adelantados para aprovechar su potencial clínico, no existe actualmente ningún péptido aprobado para uso en humanos por la Food and Drug Administration (FDA) (50).
Agradecimientos:
A COLCIENCIAS Y a la vicerrectoría de Investigaciones de la Universidad del Quindío por la cofinanciación del proyecto código: 111340820432. Dentro del cual se se pudo escribir este artículo.
Correspondencia:
Jhon Carlos Castaño, Grupo de Inmunología Molecular, Universidad del Quindío, Carrera 15 calle 12 norte. Armenia, Quindío, Colombia. jhoncarlos@uniquindio.edu.co.
Referencias
1. Hancock REW, Diamond G. The role of cationic antimicrobial peptides in innate host defences. Trends Microbiol. 2000;8:402-10. [ Links ]
2. Marr AK, Gooderham WJ, Hancock RE. Antibacterial peptides for therapeutic use: obstacles and realistic outlook. Curr Opin Pharmacol. 2006;6:468-72. [ Links ]
3. Bulet P, Stöcklin R, Menin L. Anti-microbial peptides from invertebrates to vertebrates. Immunoll Rev. 2004;198:169-84. [ Links ]
4. Brogden KA. Antimicrobial peptides: pore formers or metabolic inhibitors in bacteria? Nat Rev Microbiol. .2005;3:238-50. [ Links ]
5. Yang D, Biragyn A, Hoover DM, Lubkowski J, Oppenheim JJ. Multiple roles of antimicrobial defensins, cathelicidins, and eosinophil-derived neurotoxin in host defense. Annu Rev Immunol. 2004;22:181-215. [ Links ]
6. Hale JDF, Hancock REW. Alternative mechanisms of action of cationic antimicrobial peptides on bacteria. Exprt Rev Anti Infect Ther. 2007;5:951-9. [ Links ]
7. Hancock RE, Sahl HG. Antimicrobial and host-defense peptides as new anti-infective therapeutic strategies. Nat Biotechnol. 2006;24:1551-7. [ Links ]
8. Hancock REW. Cationic antimicrobial peptides: towards clinical applications. Expert Opin Invest Dis. 2000;9:1723-9. [ Links ]
9. Scott MG, Hancock REW. Cationic antimicrobial peptides and their multifunctional role in the immune system. Crit Rev Immunol. 2000;20:407-31. [ Links ]
10. Hancock RE. Cationic peptides: effectors in innate immunity and novel antimicrobials. Lancet Infect Dis. 2001;1:156-64. [ Links ]
11. Dassanayake RS, Silva Gunawardene YI, Tobe SS. Evolutionary selective trends of insect/mosquito antimicrobial defensin peptides containing cysteine-stabilized alpha/beta motifs. Peptides. 2007;28:62-75. [ Links ]
12. Brahmachary M, Krishnan SPT, Koh JLY, Khan AM, Seah SH, Tan TW, et al. ANTIMIC: a database of antimicrobial sequences. Nucleic acids research. 2004;32:586-9. [ Links ]
13. Thennarasu S, Lee DK, Tan A, Prasad KU, Ramamoorthy A. Antimicrobial activity and membrane selective interactions of a synthetic lipopeptide MSI-843. Biochim Biophys Acta. 2005;1711:49-58. [ Links ]
14. Chongsiriwatana NP, Patch JA, Czyzewski AM, Dohm MT, Ivankin A, Gidalevitz D, et al. Peptoids that mimic the structure, function, and mechanism of helical antimicrobial peptides. Proc Natl Acad Sci USA. 2008;105:2794-9. [ Links ]
15. Meister M, Hetru C, Hoffman JA. The antimicrobial host defenses of Drosophila. In: Du Pasquier L, LitmanGW, editors. Current topics in microbiology and immunity. Origin and evolutions of the vertebrate immune system. Berlin, Heidelberg: Springer-Verlag, 2000:248:17-36. [ Links ]
16. Diamond G, Russell JP, Bevins CL. Inducible expression of an antibiotic peptide gene in lipopolysaccharide challenged tracheal epithelial cells. Proc Natl Acad. Sci. 1996;93:5156-60. [ Links ]
17. Ganz T. the role of antimicrobial peptides in innate immunity. Integr Comp Biol, 2003;43:300-4. [ Links ]
18. Kaneko Y, Furukawa S, Tanaka H, Yamakawa M. Expression of antimicrobial peptide genes encoding enbocin and gloverin isoforms in the silkworm, Bombyx mori. Biosci Biotenchnol Biochem. 2007;71:2233-41. [ Links ]
19. Ouellette AJ, Selsted ME. Paneth cell defensins: Endogenous peptide components of intestinal host defense. FASEB J. 1996;10:1280-9. [ Links ]
20. Jenssen H, Hamill P, Hancock REW. Peptide antimicrobial agents. Clin Microbiol Rev. 2006;19:491-511. [ Links ]
21. Yang L, Harrou TA, Weiss TM, Ding L, Huang Hw. Barrel-stave model or toroidal model? A case study on melittin pores. Biophysical Journal. 2001;81:1475-85. [ Links ]
22. LinksDubovskii PV, Volynsky PE, Polyansky AA, Karpunin DV, Chupin VV, Efremov RG, et al. Three-dimensional structure/hydrophobicity of latarcins specifies their mode of membrane activity. Biochemistry. 2008;47:3525-33. [ Links ]
23. Park CB, Kim HS, Kim SC. Mechanism of action of the antimicrobial peptide Buforin II: Buforin II kills microorganisms by penetrating the cell membrane and inhibiting the cell membrane and inhibiting cellular functions. Biochem Biophys Res Commun. 1998;244:253-7. [ Links ]
24. Marchand C, Krajewski K, Lee HF, Antony S, Johnson AA, Amin R, Roller P, Kvaratskhelia M, Pommier Y. Covalent binding of the natural antimicrobial peptide indolicin to DNA abasic sites. Nucl Acids Res. 2006;34:5157-65. [ Links ]
25. Kragol G, Lovas S, Varadi G, Condie BA, Hoffmann R, Otvos L Jr. The antibacterial peptide pyrrhocoricin inhibits the ATPase actions of DnaK and prevents chaperone-assisted protein folding. Biochemestry. 2001;40:3016-26. [ Links ]
26. Otvos L Jr, O I, Rogers ME, Consolvo PJ, Condie BA, Lovas S, Bulet P, Blaszczyk-Thurin M.. Interaction between heat shock protein and antimicrobial peptides. Biochemestry. 2000;39:14150-9. [ Links ]
27. Friedrich CL, Rozek A, Patrzkat A, Hancock REW. Structure and mechanism of action of an indolicina peptide derivative with improved activity against Gram-positive bacteria. J Biol Cehm. 2001;276:24015-22. [ Links ]
28. Bellomio A, Vincent PA, de Arcuri BF, Farías RN, Morero RD. Microcin J25 has dual and independent mechanisms of action in Escherichia coli: RNA polymerase inhibition and increased superoxide production. J Bacteriol. 2007;189:4180-6. [ Links ]
29. Oppenheim JJ, Yang D. Alarmins: chemotactic activators of immune responses. Curr Opin Immunol 2005;17:359-65. [ Links ]
30. Bowdish DME, Davidson DJ, Hancock REW. A re-evaluation of the role of host defense peptides in mammalian immunity. Curr Protein Pept Sci. 2005;6:35-51. [ Links ]
31. Steinstaesser L, Koehler T, Jacobsen F, Daigeler A, Ole G, Langer S, et al. Host defense peptides in wound healing. Mol Med. 2008;14:528-37. [ Links ]
32. Lee PH, Rudisill JA, Lin KH, Zhang L, Harris SM, Falla TJ, et al. HB-107, a nonbacteriostatic fragment of the antimicrobial peptide cecropin B, accelerates murine wound repair. Wound Repair Regen. 2004;12:351-8. [ Links ]
33. Shi J, Ross CR, Leto TL, Blecha F. PR-39, a proline-rich antibacterial peptide that inhibits phagocyte NADPH oxidase activity by binding to Src homology 3 domains of p47 phox. Proc Natl Acad Sci USA. 1996;93:6014-8. [ Links ]
34. Gallo RL, Ono M, Povsic T, Page C, Eriksson E, Klagsbrun M, et al. Syndecans, cell surface eparan sulfate proteoglycans, are induced by a proline-rich antimicrobial peptide from wounds. Proc Natl Acad Sci USA. 1994;91:11035-9. [ Links ]
35. Bowdish DM, Davidson DJ, Lau YE, Scott MG, Hancock REW. Impact of LL-37 on antiinfective immunity. Journal of Leukocyte Biology. 2005;77:451-9. [ Links ]
36. Perron GG, Zasloff M, Bell G. Experimental evolution of resistance to an antimicrobial peptide. Proc Biol Sci. 2006;273:251-6. [ Links ]
37. Bayer AS, Prasad R, Chandra J, Koul A, Smriti M, Varma A, et al. In vitro resistance Staphylococcus aureus to thrombininduced platelet microbicidal protein is associated with alterations in cytoplasmic membrane fluidity. Infect Immun. 2000;68:3548-53. [ Links ]
38. Devine DA. Antimicrobial peptides in defense of the oral and respiratory tracts. Molecular Immunology. 2003;40:431-43. [ Links ]
39. Campos MA, Vargas MA, Regueiro V, Llompart CM, Albertí S, Bengoechea JA. Capsule polysaccharide mediates bacterial resistance to antimicrobial peptides. Infect Immun. 2004;72:7107-14. [ Links ]
40. Powers JPS, Hancock REW. The relationship between antimicrobial peptide structure and antibacterial activity. Peptides. 2003;24:1681-91. [ Links ]
41. Winfield MD, Latifi T, Groisman EA. Transcriptional regulation of the 4-amino-4-deoxy-L-arabinose biosynthetic genes in Yersinia pestis. J Biol Chem. 2005;280:14765-72. [ Links ]
42. Nizet V. Antimicrobial peptide resistance mechanisms of human bacterial pathogens. Curr Issues Mol Biol. 2006;8:11-26. [ Links ]
43. Jin T, Bokarewa M, Foster T, Mitchell J, Higgins J, Tarkowski A. Staphylococcus aureus resists human defensins by production of staphylokinase, a novel bacterial evasion mechanism. J Immunol. 2004;172:1169-76. [ Links ]
44. Ge Y, MacDonald DL, Holroyd KJ, Thornsberry C, Wexler H, Zasloff M. In vitro antibacterial properties of pexiganan, an analog of magainin. Antimicrob Agents Chemother. 1999;43:782-8. [ Links ]
45. Zhang L, Parente J, Harris SM, Woods DE, Hancock REW, Falla TJ. Antimicrobial peptide therapeutics for cystic fibrosis. Antimicrob Agents Chemother. 2005;49:2921-7. [ Links ]
46. Reddy KVR, Manjramkar DD. Evaluation of the antifertility effect of magainin-A in rabbits: in vitro and in vivo studies. Fertil Steril. 2000;73:353-8. [ Links ]
47. Reddy KV, Yedery RD, Aranha C. Antimicrobial peptides: premises and promises. Int J Antimicrob Agents. 2004;24:536-47. [ Links ]
48. Bradshaw JP. Cationic antimicrobial peptides issues for potential clinical use. Biodrugs. 2003;17:233-40. [ Links ]
49. Gordon YJ, Romanowski EG. A review of antimicrobial peptides and their therapeutic potencial as anti-infective drugs. Curr Eye Res. 2005;30:505-15. [ Links ]
50. Andrès E, Dimarco JL. Cationic antimicrobial peptides: update of clinical development. Journal of Internal Medicine. 2004;255:519-20. [ Links ]
51. Lee WH, Zhang J, Zhang YX, Jin Y, Lai R, Zhang Y. Maximin 9, a novel free thiol containing antimicrobial peptide with antimycoplasma activity from frog Bombina maxima. FEBS Lett. 2005;579:4443-8. [ Links ]
52. Samakovlis C, Kylsten P, Kimbrell DA, Engström A, Hultmark D. The andropin gene and its product, a male-specific antibacterial peptide in Drosophila melanogaster. EMBO J. 1991;10:163-9. [ Links ]
53. Pillai A, Ueno S, Zhang H, Lee JM, Kato Y. Cecropin P1 and novel nematode cecropins: a bacteria-inducible antimicrobial peptide family in the nematode Ascaris suum. Biochem J. 2005;390:207-14. [ Links ]
54. Mehrnejad F, Naderi-Manesh H, Ranjbar B. The structural properties of magainin in water, TFE/water, and aqueous urea solutions: molecular dynamics simulations. Proteins. 2007;67:931-40. [ Links ]
55. Mangoni ML, Grovale N, Giorgi A, Mignogna G, Simmaco M, Barra D. Structure-function relationships in bombinins H, antimicrobial peptides from Bombina skin secretions. Peptides. 2000;21:1673-9. [ Links ]
56. Shin SY, Park EJ, Yang ST, Jung HJ, Eom SH, Song WK, et al. Structure-activity analysis of SMAP-29, a sheep leukocytes-derived antimicrobial peptide. Biochem Biophys Res Commun. 2001;285:1046-51. [ Links ]
57. Barlow PG, Li Y, Wilkinson TS, Bowdish DM, Lau YE, Cosseau C, et al. The human cationic host defense peptide LL-37 mediates contrasting effects on apoptotic pathways in different primary cells of the innate immune system. J Leukoc Biol. 2006;80:509-20. [ Links ]
58. Casteels P, Ampe C, Riviere L, van Damme J, Elicone C, Fleming M, et al. Isolation and characterization of abaecin, a major antibacterial response peptide in the honeybee (Apis mellifera). Eur J Biochem. 1990;187:381-6. [ Links ]
59. Kragol G, Hoffmann R, Chattergoon MA, Lovas S, Cudic M, Bulet P, et al. Identification of crucial residues for the antibacterial activity of the proline-rich peptide, pyrrhocoricin. Eur J Biochem. 2002;269:4226-37. [ Links ]
60. Wang Y, Johansson J, Griffiths WJ. Characterization of variant forms of prophenin: mechanistic aspects of the fragmentation of proline-rich peptides. Rapid Commun Mass Spectrom. 2000;14:2182-202. [ Links ]
61. Casteels P, Ampe C, Jacobs F, Tempst P. Functional and chemical characterization of Hymenoptaecin, an antibacterial polypeptide that is infection-inducible in the honeybee (Apis mellifera). J Biol Chem. 1993;268:7044 -54. [ Links ]
62. Bulet P, Cociancich S, Dimarcq JL, Lambert J, Reichhart JM, Hoffmann D, et al. Insect immunity. Isolation from a coleopteran insect of a novel inducible antibacterial peptide and of new members of the insect defensin family. J Biol Chem. 1991;266:24520-5. [ Links ]
63. Stallmann HP, Faber C, Bronckers AL, de Blieck-Hogervorst JM, Brouwer CP, Amerongen AV, et al. Histatin and lactoferrin derived peptides: antimicrobial properties and effects on mammalian cells. Peptides. 2005;26:2355-9. [ Links ]
64. Conlon JM, Al-Ghaferi N, Abraham B, Jiansheng H, Cosette P, Leprince J, et al. Antimicrobial peptides from diverse families isolated from the skin of the Asian frog, Rana grahami. Peptides. 2006;27:2111-7. [ Links ]
65. Lehrer RI, Ganz T. Endogenous vertebrate antibiotics. Defensins, protegrins, and other cysteine-rich antimicrobial peptides. Ann N Y Acad Sci. 1996;797:228-39. [ Links ]
66. Diamond DL, Kimball JR, Krisanaprakornkit S, Ganz T, Dale BA. Detection of beta-defensins secreted by human oral epithelial cells. J Immunol Methods. 2001;256:65-76. [ Links ]
67. Haug BE, Strøm MB, Svendsen JS. The medicinal chemistry of short lactoferricin-based antibacterial peptides. Curr Med Chem. 2007;14:1-18. [ Links ]














