Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Infectio
Print version ISSN 0123-9392
Infect. vol.14 no.2 Bogotá Apr./June 2010
1 Médico internista, infectólogo, Clínica Las Vegas, Medellín, Colombia
Recibido: 15/10/2009; Aceptado: 12/04/2010
Resumen
Introducción: Las infecciones intrahospitalarias son un serio problema de salud en todos los hospitales del mundo. Se han identificado varios mecanismos responsables de la transmisión de patógenos adquiridos en el hospital, principalmente mediante las manos del personal de salud. Sin embargo, poco se ha explorado otras formas de transmisión, como las cortinas de nuestras entidades de salud.
Objetivo: Identificar la flora que coloniza las cortinas que se usan para proteger la privacidad de los pacientes, en los diferentes servicios de una clínica de tercer nivel de Medellín.
Materiales y métodos: Es un estudio descriptivo y prospectivo, en el cual se tomaron tres tipos de cultivos y se realizaron antibiogramas de todos los gérmenes aislados de las cortinas de cinco zonas críticas de una clínica de tercer nivel de Medellín. Los resultados se expresan en porcentajes según los gérmenes aislados y las áreas físicas de la clínica de donde se aislaron.
Resultados: Se identificaron aislamientos de Staphylococcus haemolyticussensible a la meticilina, Staphylococcus epidermidis sensible a la meticilina, Stenotrophomonas malthophilia y Acinetobacter baumanii, los cuales tenían una distribución diferente según al área critica de donde se hubiera obtenido el cultivo.
Conclusión: Las cortinas de uso hospitalario son una fuente potencial de diseminación de patógenos intrahospitalarios.
Palabras clave: infección, hospitales, cortinas, infecciones intrahospitalarias, cultivos, colonización.
Abstract
Background: Nosocomial infections are a serious healthcare associated problem in many hospitals in the world, and various vectors have been identified as responsible for nosocomial pathogen transmission. Healthcare personnel hands have been signalled as one of the most responsible factors, but very few other vectors such as curtains in our healthcare facilities have been considered.
Objective: Identify the flora that colonizes the curtains used to protect patient privacy in different wards of a third level clinic in Medellin.
Methods: A descriptive and prospective study was carried out, where three different culture types were performed, and all pathogens isolated from the curtains of five critical zones were submitted to susceptibility tests in a third level clinic of Medellin. Results were expressed as percentages according to the physical area of the clinic where the pathogens were isolated.
Results: Isolations of Meticillin susceptible Staphylococcus haemolyticus(SHMS), Meticillin susceptible Staphylococcus epidermidis (SEMS), Stenotrophomonas malthophilia (SM), and Acinetobacter baumanii (AB) were cultured; they were distributed according to the corresponding critical area of the clinic.
Conclusions: Hospital curtains are a potential source of nosocomial pathogen dissemination.
Key words: infection, hospitals, curtains, nosocomial, cultures, colonization.
Introducción
Las infecciones intrahospitalarias son un serio problema de salud en todos los hospitales del mundo, y se ha tratado de encontrar sus causas y los factores de riesgo asociados.Diversos artículos han señalado que la contaminación de diversas superficies juega un papel muy importante en la diseminación cruzada de patógenos intrahospitalarios (1-6).Algunos estudios recientes han reportado aislamientos de Enterococcus faecium resistente a la vancomicina y Staphylococcus aureus resistente a la meticilina, de las manos del personal de salud después de haber estado en contacto con diversas superficies contaminadas de las habitaciones de los pacientes (2). Otros has demostrado que las enfermeras se contaminan con S. aureus resistente a la meticilina después de entrar en contacto con pacientes colonizados por este germen (3). Iguales conclusiones se han informado en estudios realizados en unidades de cuidados intensivos, lo que demuestra que no sólo estos fómites sirven para la diseminación de los patógenos, sino también que la descontaminación ambiental es una medida útil para disminuir su incidencia (4,7,8).
Las cortinas hospitalarias que rodean las camas de los pacientes para brindarles privacidad en habitaciones compartidas, proporcionan una fuente de transmisión para patógenos intrahospitalarios por varias razones: son manipuladas comúnmente por los pacientes y los trabajadores de la salud, se cambian o se limpian sólo cuando están macroscópicamente sucias o dañadas, y los trabajadores de la salud no suelen identificar a las cortinas como una fuente inanimada de infección (2). Aunque los estudios recientes en hospitales de diferentes partes del mundo han demostrado la contaminación de las cortinas hospitalarias con S. aureus resistente a la meticilina, E. faecium resistente a la vancomicina y A. baumannii (9,10,12), en Colombia aún no existe conciencia de este problema y se siguen utilizando cortinas de diversos materiales sin tener en cuenta el potencial riesgo que se corre si no se estandariza se adecuado aseo.
El presente estudio pretendió identificar las bacterias que colonizan las cortinas de una clínica de tercer nivel de Medellín, con el fin de poder demostrar que son un factor de riesgo aún no identificado como fuente de infección hospitalaria en nuestro medio.
Materiales y métodos:
Se llevó a cabo un estudio descriptivo y prospectivo en una clínica de tercer nivel de Medellín, que cuenta con 100 camas de hospitalización, una unidad de cuidados intermedios, una unidad de cuidados intensivos y un área de urgencias y transición con 26 camas.
La planta física de la clínica se dividió en cinco áreas críticas en donde se utilizan cortinas para proteger la privacidad del paciente: urgencias, transición (área de hospitalización temporal mientras el paciente pasa de urgencias a los pisos), segundo piso (único piso donde hay habitaciones compartidas), unidad de cuidados intensivos y unidad de cuidados intermedios.
Posteriormente, se tomaron cultivos de 90 cortinas (todas las de la institución), las cuales están hechas sólo de poliéster y se encuentran distribuidas en las cinco áreas mencionadas. Estas cortinas tienen un lavado programado cada 8 días, o antes, únicamente si se ven macroscópicamente sucias o contaminadas de fluidos corporales; se utiliza un detergente desengrasante. Los cultivos fueron tomados en un día al azar, por lo tanto, podrían haber sido lavadas recientemente o llevar hasta siete días sin ser lavadas, Esto se hizo para recrear lo que puede suceder normalmente a un paciente que acude a urgencias o que es hospitalizado en alguno de los servicios antes mencionados.
Para la toma de los cultivos se demarcaba un área de 25 cm2, medidos de manera equidistante entre la parte superior y la inferior de la cortina, que coincidiera con el borde lateral que es el sitio de donde se sujeta con mayor frecuencia tanto para abrirla como para cerrarla.
Utilizando un guante quirúrgico estéril, se simulaba lo que sería el abrir y el cerrar de la cortina, para que posteriormente se colocaran los dedos y la palma de la mano en cajas de Petri con tres tipos diferentes de cultivos: MacConkey, azida y agar chocolate (Biomérieux), con el objetivo de identificar todos los gérmenes que pudieran estar colonizando las cortinas de cada área. Las cajas de Petri se incubaron a 35,5°C por 72 horas y, posteriormente, se separaron e identificaron todas las bacterias que había, siguiendo las guías del Clinical Laboratories Standards Institute (11) y utilizando un sistema automatizado (Vitek 1 de Biomérieux).
Resultados
Después de aislar todas las colonias que crecieron en las cajas de Petri inoculadas en cada área física de la clínica, se identificaron aislamientos de E. faecium sensible a la meticilina, S. epidermidis sensible a la meticilina, Stenotrophomona malthophilia y A. baumanii, que tenían una distribución diferente según el área critica de donde se hubiera obtenido el cultivo (figura 1).
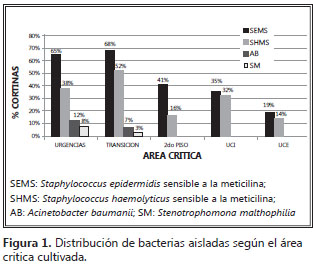
En urgencias se encontraron porcentajes altos de E. faecium y S. epidermidis sensibles a la meticilina (65% y 38%, respectivamente), pero llama la atención la presencia de A. baumanii y S. malthophilia que, aunque con porcentajes bajos (12% y 8%, respectivamente) son muy significativos, puesto que es bien conocido el potencial riesgo que significa el estar colonizado por este tipo de gérmenes.
En el área de transición se encontraron igualmente porcentajes altos de E. faecium y S. epidermidis sensibles a la meticilina (68% y 52%, respectivamente) pero, nuevamente, llama la atención la presencia de porcentajes bajos de A. baumanii y S. malthophilia (7% y 3%, respectivamente). En el segundo piso sólo se aisló E. faecium y S. epidermidis sensibles a la meticilina (41% y 16%, respectivamente), y no se aisló A. baumanii ni S. malthophilia.
En la unidad de cuidados intensivos sólo se aislaron E. faecium y S. epidermidis sensibles a la meticilina (35% y 32%, respectivamente).Finalmente, en la unidad de cuidados intermedios sólo se aisló 19% de S.haemolyticus sensible a la meticilina y 14% de S. epidermidis sensible a la meticilina, sin que se hubiera encontrado A. baumanii o S.malthophilia en ninguna de las unidades de cuidados intensivos o intermedios.
Discusión
Las infecciones intrahospitalarias se han convertido en un serio problema de salud en todo lo concerniente a la atención de pacientes de alta complejidad. Los orígenes y los factores de riesgo para su desarrollo varían mucho de una institución a otra, aunque existen factores comunes a todas, como el contacto con diferentes fómites, que no sólo sirven de reservorio sino que también ayudan a diseminar patógenos hospitalarios por medio de las manos del personal de salud, lo cual facilita la colonización y posterior infección de los pacientes que frecuentan nuestros hospitales y clínicas (2,3,5).
Desde hace ya varios años la literatura médica viene señalando que las cortinas hospitalarias, las corbatas, las batas y hasta los celulares, constituyen nuevos factores de riesgo o factores facilitadores de la diseminación de gérmenes hospitalarios (10,12), pero, hasta ahora, este aspecto no se había corroborado en Colombia.
En el presente estudio se lograron identificar los patógenos que colonizaban las cortinas de los diferentes servicios de una clínica de tercer nivel y se observaron claras diferencias en cuanto al tipo de patógenos encontrados según el área evaluada. En tal sentido, urgencias y el área de transición son zonas de “choque” entre el ambiente hospitalario y la comunidad, en donde se encontraron gérmenes hospitalarios multirresistentes, como A. baumanii y S. malthophilia, los cuales pueden potencialmente colonizar y, luego, infectar pacientes debilitados, que no necesitan estar hospitalizados para adquirir este tipo de patógenos; basta con que consulten al servicio de urgencias y entren en contacto con alguno de estos fómites para que rápidamente sean colonizados y, según su estado de salud, se infecten. Estos patógenos actúan como verdaderos oportunistas que son capaces de deteriorar seriamente la salud de un paciente en un momento dado.
En tal sentido, no se trata sólo de las cortinas, concepto que ha sido bien documentado en diversos estudios que dan cuenta de la importancia del ambiente hospitalario a la hora de contraer infecciones intrahospitalarias (13). Tal vez uno de los sitios más estudiados por su alta incidencia de infecciones, es la unidad de cuidados intensivos, en donde se ha demostrado que no sólo las manos del personal, sino también infinidad de fómites, como los tensiómetros, los estetoscopios, los recipientes y hasta los termómetros, han sido implicados en la diseminación de los patógenos hospitalarios (14).
Éste es el primer estudio en Colombia que explora la posibilidad de que las cortinas de uso hospitalario se hayan convertido en un nuevo factor de riesgo o fómite, que facilita en nuestro medio la diseminación intrahospitalaria y extrahospitalaria de patógenos adquiridos en el hospital. Aunque no se logró demostrar que, en realidad, exista la transmisión de patógenos desde la cortina hacia el paciente, el método utilizado para la recolección de las muestras nos hace suponer esto.
De acuerdo con estos hallazgos, la recomendación es que cada institución corrobore estos datos para determinar si, como sucede en la institución en donde se llevó a cabo este estudio, las cortinas pueden jugar un papel importante como un nuevo factor de riesgo para adquirir patógenos hospitalarios.Mientras se corroboran estos datos, sugiero que se consideren las cortinas como una fuente potencial de patógenos hospitalarios, debiéndose, entonces, estandarizar el lavado de manos después del contacto con ellas, además de protocolizar su aseo frecuente y no sólo cuando se noten macroscópicamente que están sucias.
Agradecimientos
A Ana María Ramírez y Jaime Bermúdez por la invaluable ayuda, sin la cual mi labor diaria y este artículo no hubieran sido posibles.Además, quiero agradecer a Paula Bedoya por su incansable trabajo y paciencia en la elaboración de este articulo.
Declaración de conflictos de interés y financiación
Como único autor, declaro no tener ningún conflicto de interés. No recibí ningún aporte financiero para realizar este trabajo, distinto a mis honorarios como empleado de la institución donde se realizó la investigación.
Correspondencia: Juan Carlos Cataño, Calle 8 sur Nº 43B-112, Medellín, Colombia. Teléfono: (57-4) 448-1001. kataju@hotmail.com
Referencias
1. Boyce JM, Pittet D. Guideline for hand hygiene in healthcare settings: recommendations of the Healthcare Infection Control Practices Advisory Committee and the HICPAC/ SHEA/APIC/IDSA Hand Hygiene Task Force. Infect Control Hosp Epidemiol. 2002;23(Suppl.12):S3-40. [ Links ]
2. Bhalla A, Pultz NJ, Gries DM, Ray AJ, Eckstein EC, Aron DC, et al. Acquisition of nosocomial pathogens on hands after contact with environmental surfaces near hospitalized patients. Infect Control Hosp Epidemiol. 2004;25:164-7. [ Links ]
3. Boyce JM, Potter-Bynoe G, Chenevert C, King T. Environmental contamination due to methicillin-resistant Staphylococcus aureus (MRSA): possible infection control implications. Infect Control Hosp Epidemiol. 1997;18:622-7. [ Links ]
4. Hayden MK, Bonten JM, Blom DW, Lyle EA, van de Vijver D, Weinstein R. Reduction in acquisition of vancomycinresistant Enterococcus after enforcement of routine environmental cleaning measures. Clin Infect Dis. 2006;42: 1552-60. [ Links ]
5. Ray AJ, Hoyen CK, Das SM, Taub TF, Eckstein EC, Donskey CJ. Nosocomial transmission of vancomycin-resistant enterococci from surfaces. JAMA. 2002;287:1400-1. [ Links ]
6. Denton M, Wilcox MH, Parnell P, Green D, Keer V, Hawkey PM, et al. Role of environmental cleaning in controlling an outbreak of Acinetobacter baumannii on a neurosurgical intensive care unit. J Hosp Infect. 2004;56:106-10. [ Links ]
7. Mayfield JL, Leet T, Miller J, Mundy LM. Environmental control to reduce transmission of Clostridium difficile. Clin Infect Dis. 2000;31:995-1000. [ Links ]
8. Wilcox MH, Fawley WN, Wigglesworth W, Parnell P, Verity P, Freeman J. Comparison of the effect of detergent versus hypochlorite cleaning on environmental contamination and incidence of Clostridium difficile infection. J Hosp Infect. 2004;56:78-9. [ Links ]
9. Das I, Lambert P, Hill D, Noy M, Bion J, Elliot T. Carbapenemresistant Acinetobacter and role of curtains in an outbreak in intensive care units. J Hosp Infect. 2002;50:110-4. [ Links ]
10. Klakus J, Vaughan NL, Boswell TC. Methicillin-resistant Staphylococcus aureus contamination of hospital curtains. J Hosp Infect. 2008;68:189-90. [ Links ]
11. NCCLS. Methods for dilution antimicrobial susceptibility tests for bacteria that grow aerobically. Wayne, PA: NCCLS; 1993. p. M7-A3. [ Links ]
12. Trillis F 3rd, Eckstein EC, Budavich R, Pultz MJ, Donskey CJ. Contamination of hospital curtains with healthcareassociated pathogens. Infect Control Hosp Epidemiol. 2008;29:1074-6. [ Links ]
13. Wright SB, Ostrowsky B, Fishman N, Deloney VM, Mermel L, Perl TM. Expanding roles of healthcare epidemiology and infection control in spite of limited resources and compensation. Infect Control Hosp Epidemiol. 2010;31:127-32. [ Links ]
14. Scheckler WE, Brimhall D, Buck AS, Farr BM, Friedman C, Garibaldi RA, et al. Requirements for infrastructure and essential activities of infection control and epidemiology in hospitals: a consensus panel report. Infect Control Hosp Epidemiol. 1998;19:114-24. [ Links ]














