Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Infectio
Print version ISSN 0123-9392
Infect. vol.14 no.2 Bogotá Apr./June 2010
1Departamento de Medicina Interna, Fundación Santafé de Bogotá, Residente en Infectología, Universidad Nacional de Colombia, Bogotá, D.C., Colombia
2Sección de ensayos clínicos, Departamento de VIH y Enfermedades Infecciosas, Hospital Carlos III, Madrid, España
3Sección de Biología Molecular, Departamento de VIH y Enfermedades Infecciosas, Hospital Carlos III, Madrid, España
Recibido: 05/02/2009; Aceptado: 23/02/2010
Resumen
La infección por el virus de la inmunodeficiencia humana ha generado un impacto mundial que ha sobrepasado los cálculos iniciales previstos para esta enfermedad. En la actualidad, se hace necesaria la búsqueda de nuevos medicamentos antirretrovirales dentro de las familias de medicamentos conocidas, pero, aún más importante, es la búsqueda de nuevos blancos terapéuticos sobre los cuales incidan los fármacos a los que no ha estado expuesto el virus y, asimismo, ante los cuales no presentan resistencia natural
Los inhibidores de la integrasa constituyen la familia de medicamentos antirretrovirales más recientemente aprobada para uso clínico. El raltegravir es un medicamento nuevo, con atributos importantes que lo hacen una herramienta que se debe tener en cuenta en esquemas de rescate, terapia de cambio y acorde con la consideración de paciente naive, es decir, sin tratamiento previo con este fármaco
Palabras clave:MK 0518, inhibidores de la integrasa, terapia antirretroviral
Abstract
Immunodeficiency virus infection in humans (HIV) has generated a worldwide impact exceeding initial estimates for this disease. At present, it is necessary to search for new antiretroviral drugs within the families of known medication, but the search for new therapeutic objectives under the effect of medication which has not been exposed to the virus and, therefore without natural resistance to it, is even more important Integrase inhibitors are the family of antiretroviral medication most recently approved for clinical use; raltegravir is a new drug with important attributes that make it a tool to be considered in rescue regimens, change therapies, and naïve patient particular cases
Keywords: MK 0518, HIV intregrase inhibitors, antiretroviral therapy
Introducción
La infección por el virus de la inmunodeficiencia humana (VIH) ha generado un impacto mundial que ha sobrepasado los cálculos iniciales previstos para esta enfermedad. Asimismo, continúa siendo una de las principales causas de muerte relacionada con agentes infecciosos en el mundo (1-4)
La evolución cronológica de la infección por el VIH está marcada por varios periodos; entre ellos, la época anterior a la disponibilidad de la terapia antirretroviral de gran eficacia (Highly Active Antiretroviral Therapy, HAART), en el cual las infecciones oportunistas eran muy frecuentes y la esperanza de vida corta; posteriormente, con el advenimiento de medicamentos antirretrovirales eficaces (inhibidores de proteasa), se pasó a un periodo en el que la supervivencia es cada vez mayor y las infecciones oportunistas tienden a disminuir; asimismo, se comienzan a reconocer problemas que inicialmente no lo eran, como los efectos secundarios y la toxicidad de la medicación, las alteraciones concomitantes propias de los pacientes con enfermedades crónicas y la aparición de resistencia a los medicamentos disponibles que cada vez hace que se cuente con menos opciones terapéuticas para tratar algunos de estos pacientes (5)
En la actualidad, se hace necesaria la búsqueda de nuevos medicamentos antirretrovirales dentro de las familias de medicamentos conocidas, pero, aún más importante, es la búsqueda de nuevos blancos terapéuticos sobre los cuales incidan fármacos a los que no ha sido expuesto el virus y, asimismo, ante los cuales no han desarrollado resistencia
Se hizo una revisión sistemática de la literatura utilizando las bases de datos de Medline, Lilacs y Bireme; como términos MeSH (Medical Subject Headings) se utilizaron “integrase”, “inhibitor”, “raltegravir”, “elvitegravir”, “antirretroviral”, “HIV” y “treatment”. Se buscaron los artículos citados desde el 2000 y se seleccionaron los artículos más relevantes, según el criterio de los autores
Se busca difundir el conocimiento y los avances obtenidos de una nueva familia de medicamentos antirretrovirales, teniendo como objetivo presentar la situación actual del manejo de la infección por VIH con inhibidores de la integrasa
Ciclo viral de replicación
Partiendo del conocimiento de la estructura del virus y de su ciclo de vida, así como de las interacciones que tiene con el huésped, se han generado los medicamentos antirretrovirales disponibles; de esta forma, se desarrollaron inicialmente familias de fármacos, como los inhibidores de la enzima transcriptasa inversa (análogos y no análogos) y los inhibidores de la proteasa. Posteriormente, con los avances en el conocimiento, se han encontrado nuevos blancos terapéuticos, y ahora se cuenta con fármacos en distintos niveles de investigación, que intervienen en etapas del ciclo de vida viral; entre éstos están los inhibidores de fusión de los receptores de la integración y de la maduración (6,7), ver figura 1
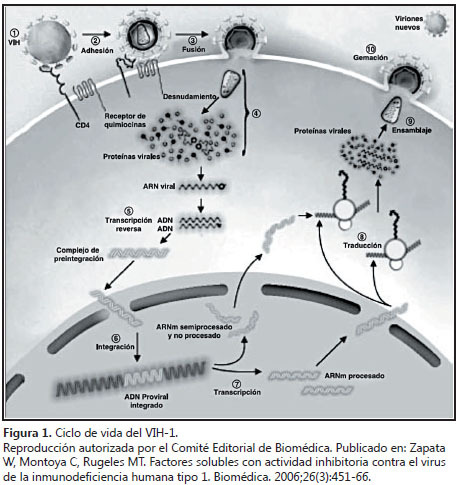
La integración es un paso importante dentro del ciclo de vida del virus, en el cual la doble cadena de ADN que ha sido sintetizada a partir de una cadena de ARN viral, por medio de la enzima transcriptasa inversa, debe unirse al genoma de la célula infectada; este proceso es catalizado por la enzima integrasa y es esencial para la replicación viral, puesto que la transcripción del genoma viral y la producción de proteínas virales sólo se logran cuando la doble cadena de ADN proviral se hace parte del genoma de la célula infectada (8)
La integrasa es una proteína que, al igual que las proteínas transcriptasa inversa y proteasa, es codificada por el gen pol del VIH; está compuesta por 288 aminoácidos y pesa 32 kDa (9), posee tres dominios estructurales que son: amino- terminal, core catalítico y carboxi-terminal
El proceso de integración, a su vez, se divide en tres etapas (8):
1. Formación del complejo núcleo-proteico: consiste en el ensamblaje del complejo proteico antes de la integración sobre la doble cadena de ADN proviral
2. Procesamiento 3’: en esta etapa se realiza la escisión de dos deoxinucleótidos de los extremos 3’ de la cadena de ADN proviral naciente, y
3. Transferencia de la banda: proceso en el cual se traslada el complejo antes de la integración al núcleo y allí se realiza la unión covalente e irreversible del ADN proviral con el ADN de la célula infectada; es tema de discusión si el sitio del genoma en el cual se realiza la unión se escoge de forma aleatoria o si se eligen zonas especiales que poseen alta tasa de transcripción por parte de la ARN pol II (9). Recientemente, se han descrito moléculas del huésped que intervienen en el proceso; éstas son: LEDGF/p75 (factor de crecimiento derivado del epitelio) (10), BAF (barrera para auto integración) y HMG1 (11)
Estudios preclínicos
La búsqueda de inhibidores de la integrasa no es tan reciente como parece; en 1991, los investigadores de los National Institutes of Health de los Estados Unidos publicaron reportes sobre la búsqueda de inhibidores in vitro de la integrasa y resaltaron su importancia como blanco terapéutico en el tratamiento de la infección por VIH, haciendo énfasis en la ausencia de una proteína similar en el humano, lo cual lo hacía más importante (12)
Posteriormente, se adelantaron investigaciones al respecto sin lograrse obtener resultados biológicos significativos y, en 1999, se describió la estructura cristalina de la integrasa junto con la de un inhibidor (13); en el 2000, se publicó en Science el primer reporte de la inhibición exclusiva de uno de los pasos de la integración (transferencia de la banda) utilizando compuestos dicetoácidos (14). En el 2004, el grupo de trabajo de Hazuda identificó el compuesto L-870812 como un inhibidor selectivo y potente de la replicación viral en macaco rhesus (Macaca mulatta), y demostró que había disminución de la carga viral, aumento del conteo de células CD4 e inducción de respuesta inmunitaria celular específica cuando se iniciaba el tratamiento temprano en el curso de la infección (15)
Estudios clínicos
Hasta el momento, se han desarrollado dos compuestos con relevancia clínica que inhiben la integrasa 1, el raltegravir (MK-0518) y el elvitegravir (Gilead-9137); de ellos, tan sólo el primero fue aprobado para uso clínico por la U.S. Food and Drug Administration en octubre de 2007 (16), para el uso en pacientes previamente tratados con otros medicamentos y con resistencia a ellos; por esta razón, en esta revisión se profundiza en este medicamento
Farmacocinética
El raltegravir es un compuesto que pertenece a los derivados hidroxi-naftiridinacarboxamida (8); tiene una rápida absorción por vía oral y logra la concentración máxima plasmática entre 0,5 y 1,3 horas después de su administración; su vida media plasmática es de 7 a 12 horas y alcanza su concentración plasmática de equilibrio a las 48 horas después de su administración (17)
En los estudios en ratas se demostró que se distribuye ampliamente por el sistema digestivo y en los órganos de excreción y, en menor medida, en el cerebro; asimismo, atraviesa la placenta y se encuentra en la leche materna (18). La vía de eliminación es, principalmente, hepática a través de la enzima UDP-glucoronosil-transferasa (UGT1A) y no interfiere con el citocromo P-450, por lo cual las interacciones medicamentosas son menos frecuentes
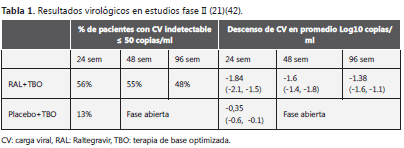
Estudios en pacientes previamente tratados En el 2007 se presentó el protocolo 005 y, recientemente, se publicó la segunda parte de un estudio en fase II, multicéntrico, de asignación al azar, triple ciego, de determinación de dosis, en el que se incluyeron 179 pacientes positivos para VIH con tratamiento previo y con resistencia documentada, por lo menos, a un medicamento de cada una de las tres familias clásicamente descritas; el seguimiento se completó por 96 semanas
Antes de la asignación aleatoria se seleccionó un esquema de base, optimizado teniendo en cuenta la historia clínica del paciente y los perfiles de resistencia genotípica y fenotípica; posteriormente, se dividieron en grupos que recibieron raltegravir a dosis de 200, 400 o 600 mg, dos veces al día y un grupo que solamente recibió el esquema optimizado (21,42)
Al inicio, la mediana de la carga viral fue de 4,7±0,5 log10 copias por mililitro para cada grupo; el tiempo medio de duración del tratamiento antirretroviral fue de 9,9 años; el número medio de medicamentos antirretrovirales que habían usado era de 12. Se hizo un análisis de intención de tratar y para el análisis se subdividieron los grupos que recibieron raltegravir como parte del esquema optimizado; también, se subdividieron según el número de medicamentos antirretrovirales para los cuales era sensible el virus de aquéllos que se utilizaban en el esquema optimizado; asimismo, se llevó a cabo un estudio con el grupo que recibió atazanavir (21)
Los resultados a las 24 y a las 96 semanas se presentan en la tabla 1; además, a las 24 semanas, en promedio, 80% de los pacientes había obtenido un descenso mayor de 1 log10 copias por ml en el grupo de raltegravir contra 18% en aquéllos con placebo. El aumento en el conteo de CD4 fue superior en el grupo que recibió raltegravir y se encontró una diferencia estadísticamente significativa
Al evaluar los subgrupos, se encontró que la probabilidad de lograr una carga viral menor de 50 log10 copias por ml y de tener un descenso mayor en la carga viral era más común en los pacientes que recibían raltegravir en el esquema optimizado; asimismo, la probabilidad de lograr este desenlace está directamente relacionado con la cantidad de medicamentos a los que fuera sensible el virus de aquéllos que están en el esquema antirretroviral
El uso de atazanavir no demostró diferencias estadísticamente significativas, pero sí una tendencia hacia una mayor eficacia; el perfil de seguridad fue adecuado y similar en ambos grupos del estudio (21)
Los estudios de fase III (protocolo 018) y (protocolo 019) son dos estudios idénticos que se realizan en distintas zonas del mundo, conocidos como BENCHMRK 1 y BENCHMRK 2; se trata de estudios multicéntricos, doble ciego, de asignación aleatoria, controlados con placebo. Se realizan con pacientes positivos para VIH con un alto perfil de resistencias a los medicamentos antirretrovirales, y se utiliza una dosis de 400 mg dos veces al día de raltegravir en combinación con un esquema optimizado
En el 2007 se presentaron los resultados preliminares a la semana 16 y 24 (22,23); en la 15th Conference on Retroviruses and Opportunistic Infections (CROI) en el 2008 se presentaron los resultados a la semana 48 (22, 23), recientemente, se han presentado los resultados a la semana 96 y 156 (26, 43,44)
En el estudio BENCHMRK 1, se incluyeron 350 pacientes; el conteo de células CD4 al inicio fue de 140 células por ml en el grupo de raltegravir más esquema optimizado y, de 105 células por ml, en los de esquema optimizado únicamente; la carga viral fue de 4 6 y de 4,5 log10 copias por ml en cada uno de las grupos de estudio. En el estudio BENCHMRK 2 se incluyeron 349 pacientes; el conteo de células CD4 al inicio fue de 102 células por ml en el grupo de raltegravir y esquema optimizado, y de 132 células por ml en los de esquema optimizado únicamente; la carga viral fue de 4,7 log10 copias por ml en ambos grupos
En el análisis conjunto de los resultados se demostró superioridad en la eficacia antirretroviral e inmunológica con raltegravir más el esquema optimizado en comparación con el esquema optimizado, con un mayor beneficio en los pacientes con mayor número de medicamentos activos en el esquema antirretroviral al igual que aquéllos en los que se usaba enfuvirtide o darunavir como parte del esquema optimizado; asimismo, existía una mayor probabilidad de llegar a una carga viral indetectable en aquéllos que tenían menos de 100.000 copias por ml al inicio del tratamiento (24, 25) (tabla 2)

Estudios en pacientes naive
Monoterapia. En la primera parte de un ensayo de fase II, multicéntrico, de asignación aleatoria, doble ciego, controlado con placebo (protocolo 004), se evaluaron la seguridad, farmacocinética y actividad antirretroviral en un grupo de 35 pacientes naive; se completaron 10 días de tratamiento. Los pacientes se dividieron en distintos grupos que recibieron dosis de 100, 200, 400 o 600 mg dos veces al día de raltegravir en monoterapia; se compararon con un grupo que recibía placebo. Al cabo de 10 días, el descenso promedio en la carga viral ARN-VIH fue de -2,0 log10 copias por ml para el grupo raltegravir contra -0,2 log10 copias por ml para el grupo expuesto a placebo; además, el 50% de los pacientes tenía una carga viral menor de 400 copias por ml y todos los grupos tratados mostraron diferencias estadísticamente significativas contra placebo (p<0,001). El fármaco mostró buena tolerancia; los efectos adversos reportados fueron leves a moderados, de los cuales, la cefalea y el mareo fueron los más comunes y en este aspecto no se encontró diferencia entre el grupo placebo y el grupo tratado (19)
Terapia combinada. En la segunda parte del protocolo 004 publicado en 2007, se evaluaron 198 pacientes positivos para VIH sin exposición previa a tratamiento antirretroviral. Se comparó el raltegravir, utilizando dosis de 100, 200, 400 y 600 mg dos veces al día, con el efavirenz, utilizando una dosis de 600 mg diarios. Todos los pacientes del estudio recibieron, además del medicamento en estudio, una combinación de tenofovir y lamivudina (300 mg diarios cada uno). Al inicio del estudio, el promedio de la carga viral VIH-RNA fue de 4,6 y 4,8 log10 copias por ml y el conteo de células CD4 fue de 271 y 338 células por ml, para el grupo con raltegravir y el grupo con efavirenz, respectivamente. Se completó un seguimiento por 48 semanas y se hizo un análisis por intención de tratar (20)
En la semana 4, 60% a 80% de los pacientes en el grupo de raltegravir mostraron una carga viral menor de 50, en comparación con 25% de los pacientes tratados con efavirenz. Sin embargo, a las 24 semanas los dos grupos de tratamiento lograron una proporción similar de pacientes con carga viral menor de 50 copias por ml, sin diferencias estadísticamente significativas. Este comportamiento fue sostenido hasta completar las 48 semanas evaluadas. El incremento en el conteo de células CD4 fue comparable entre los dos grupos a las 24 y 48 semanas. Asimismo, recientemente se han publicado los resultados a la semana 192 (17,45)
En la evaluación de reacciones adversas de cualquier magnitud, se encontró que éstas eran menos frecuentes en el grupo con raltegravir que en el grupo con efavirenz (48% Vs. 71%). La diferencia a favor de raltegravir estuvo especialmente marcada por síntomas neuropsiquiátricos, como pesadillas, sueños anormales e insomnio, los cuales son síntomas ya conocidos que se relacionan con efavirenz. Las reacciones asociadas con raltegravir más comunes fueron náuseas, mareos y cefalea. Los efectos adversos serios fueron similares en ambos grupos (5% a 6%). En la evaluación del perfil lipídico, el raltegravir mostró un mejor comportamiento frente a efavirenz, generando aumento de colesterol total: -2,3 mg/dl Vs +20,7 mg/dl (p<0,001), respectivamente. Además, se encontró un mayor aumento de LDL y triglicéridos con efavirenz (p=0,016 y p=0,07, respectivamente). No hubo diferencias significativas en el impacto sobre HDL
En este estudio se demuestran diferencias en la rapidez y la seguridad del efecto antirretroviral a favor de raltegravir, sin diferencias estadísticamente significativas al final del tratamiento en cuanto a la eficacia medida como descenso en la carga viral y aumento en el conteo de CD4, al utilizarlo en el manejo de los pacientes naive en terapia combinada (20)
Terapia de cambio a raltegravir
Recientemente, se han publicado varios estudios que buscan evaluar la terapia de cambio en el esquema antirretroviral en pacientes con carga viral indetectable por un determinado periodo con el fin de disminuir la toxicidad y mejorar la observancia del tratamiento, manteniendo la eficacia virológica e inmunológica (tabla 3).

El estudio SWITCHMRK 1 y 2 es uno de los más importantes hasta el momento. Consiste en un ensayo clínico controlado de asignación aleatoria, multicéntrico, doble ciego y de fase 3, con 703 pacientes que deberían llevar, por lo menos, tres meses con carga viral indetectable (menor de 50 copias por ml). Los pacientes se dividieron en dos grupos; uno de ellos debía continuar su esquema antirretroviral, en el cual el inhibidor de proteasa consistía en lopinavir/ritonavir; al grupo de estudio se le cambió lopinavir/ ritonavir por raltegravir (400 mg, cutro veces al día). Se evaluaron la eficacia, la seguridad y el cambio en el perfil lipídico (46)
Los resultados resultaron interesantes dado que se encontró que el grupo de estudio con raltegravir presentaba un perfil lipídico favorable, con disminución de 13,6% en el colesterol total, 17,6% en el colesterol no HDL y disminución de 48,6% en triglicéridos, con respecto al grupo con lopinavir/ ritonavir. Por otra parte, no se encontraron diferencias en los efectos adversos relacionados con el medicamento y solamente la diarrea se presentó en más de 1% de los pacientes tratados con lopinavir/ritonavir
Con respecto a la eficacia, se encontró que el grupo con raltegravir no satisfacía los criterios de no inferioridad; a la semana 24, 90,6% de los pacientes del grupo con lopinavir/ritonavir permanecían con carga viral indetectable, mientras que solamente el Infectio. 2010; 14(2): 132-142 139 Inhibidores de la integrasa y raltegravir en el manejo de la infección por virus de la inmunodeficiencia humana en la era de la resistencia a múltiples medicamentos 84,4% de los del grupo con raltegravir continuaba con carga viral menor de 50 copias por ml. Se presentó una diferencia de -6,2% (IC95% -11,2-1,3) entre los dos grupos
Con estos resultados, en este estudio se concluyó que en los pacientes con infección por VIH la terapia de cambio de lopinavir/ritonavir a raltegravir se asociaba con un beneficio importante en el perfil lipídico, sin cambios en los efectos secundarios y con una menor tasa de respuesta virológica, con lo cual el estudio se suspendió a la semana 24 (46)
Posteriormente, se publicó el estudio SPIRAL, un ensayo clínico multicéntrico, de asignación aleatoria, abierto, realizado en 17 centros en España. Incluía 273 pacientes que se dividieron en dos grupos; uno de ellos debía continuar con el esquema antirretroviral que traía, en el cual tenía un inhibidor de proteasa cualquiera; el otro grupo cambió su inhibidor de proteasa por raltegravir. El inhibidor de proteasa más común fue lopinavir/ritonavir (44%). A las 48 semanas se encontró que 89,2% de los pacientes en el grupo con raltegravir y el 86,6% de los pacientes en el grupo con inhibidor de proteasa, no presentaban falla del tratamiento; asimismo, 96,9% permanecía libres de falla virológica y 95,1% de los pacientes en el grupo con raltegravir y el grupo con inhibidor de proteasa (47)
Se comprobó, una vez más, el beneficio en cuanto al perfil lipídico en los pacientes que son llevados a terapia de cambio con raltegravir, evidenciando diferencias estadísticamente significativas en cuanto a colesterol total (-13%), triglicéridos (-26,8%) y relación colesterol total/HDL
En conclusión, se evidenció que los pacientes que recibían terapia de cambio de inhibidor de proteasa a raltegravir, presentaban un beneficio metabólico, con una adecuada eficacia virológica, resultados que son similares a los de un estudio recientemente publicado en nuestro medio (47,48)
Perfil de seguridad
Reacciones secundarias. La mayor parte de la información proviene de los ensayos clínicos. Los efectos reportados han sido leves a moderados y la frecuencia es similar en los grupos placebo y en el grupo con raltegravir
Los efectos secundarios más comunes (más de 10%), de cualquier intensidad y sin importar causalidad, han sido: cefalea, náuseas, fiebre y diarrea. Los efectos con una diferencia mayor de 2% con respecto al placebo, han sido: fatiga, nasofaringitis, herpes zóster y erupción cutánea; éstos han sido leves y no han obligado a la suspensión del tratamiento. Uno de ellos (herpes zóster) está relacionado con el fenómeno de reconstitución inmunitaria y presenta una proporción similar a la reportada para otros antirretrovirales. Los reportes iniciales reportaban mayor incidencia de neoplasias (por ejemplo, sarcoma de Kaposi, linfomas, carcinoma de células escamosas, cáncer anal y hepatocelular) con un riesgo relativo de 1,2 (IC95% 0,4-4,1) pero, al final, la diferencia fue menos evidente y no se ha demostrado causalidad. Sin embargo, existe la recomendación de estar atento a la presencia de dichas anormalidades y su reporte (16,19-21,24,25)
Interacciones medicamentosas. En varios estudios se han analizado las posibles interacciones que pueda tener el raltegravir con otros medicamentos en general y, especialmente, con los antirretrovirales. Los datos indican que el raltegravir es bien tolerado y su comportamiento farmacocinético no se altera significativamente con la administración concomitante de otros medicamentos. A continuación especificaremos las interacciones
Como se ha descrito, inicialmente, en la eliminación del raltegravir no interviene el citocromo P-450; por lo tanto, no se esperan interacciones a este nivel. Esto se demostró en un estudio en el cual se analizó el raltegravir asociado con midazolam (26). Con otros medicamentos se ha demostrado interacción importante y se ha contraindicado su administración conjunta. Éstos son: la rifampicina, para la cual se recomienda aumentar la dosis a 800 mg dos veces al día por la disminución en la concentración sérica, la fenitoína y el fenobarbital
Algunos medicamentos, que se han estudiado sin demostrar interacciones significativas y que se pueden administrar conjuntamente, son 1) antirretrovirales: efavirenz (27), tenofovir (28), nevirapina, etravirina (29), atazanavir, ritonavir (27) y tipranavir (30), y 2) otros medicamentos: midazolam (26), rifabutina e hierba de San Juan
Con respecto al uso de omeprazol, no existe contraindicación, pero el uso conjunto puede aumentar la concentración máxima del raltegravir en 415% y el área bajo la curva en 321%; por lo tanto, se debe tener precaución con su uso (16). Las recomedaciones de las últimas guías United States Department of Health and Human Services publicadas se presentan en la tabla 4

Uso en poblaciones especiales. Hasta el momento, no hay datos para el uso en mujeres embarazadas ni en niños (16). No hay diferencias farmacocinéticas importantes con el uso en pacientes con alteración hepática leve a moderada; sin embargo, no se recomienda el uso de raltegravir cuando hay compromiso importante de la función hepática. No es necesario ajustar la dosis en los casos de insuficiencia renal (16); sin embargo, no hay datos sobre si este compuesto se puede dializar; por esta razón, no está claro cómo se debe administrar ante una sesión de diálisis
Inhibidores de la integrasa y resistencias
La información con respecto a la resistencia a los inhibidores de proteasa proviene de los ensayos clínicos de fase II y fase III que se han desarrollado; entre ellos, los estudios BENCHMRK-1 y BENCHMRK-2 son los que han aportado más información (31,32)
Todas las mutaciones que se han descrito hasta la fecha se encuentran cerca al centro catalítico de la enzima integrasa Se han identificado dos vías principales de mutaciones que generan resistencia al raltegravir; una de ellas es la N155H y la otra es la Q148K/H/R. Posteriormente, en los programas de acceso expandido se han identificado otras mutaciones con menor impacto sobre la reducción de la sensibilidad; éstas son Y143R y E92Q (33)
Ante la aparición de estas mutaciones principales, no existe un patrón de comportamiento definido que se relacione con la aparición de mutaciones secundarias. Sí se sabe que estas mutaciones secundarias aumentan la resistencia al raltegravir en un número de veces que varía según la mutación adquirida. El patrón de mutación más común es Q148H/K/R más G140 S/C, que reduce la sensibilidad, inclusive al elvitegravir en un factor superior a 1.000 veces (34)
La probabilidad de resistencia natural al raltegravir es poco probable. La resistencia natural al raltegravir es poco probable, como lo han demostrado los estudios que evalúan el polimorfismo natural de la integrasa y no se debería tener en cuenta clínicamente
En conclusión, la resistencia al raltegravir está mediada por dos vías principales y otras mutaciones secundarias; existe resistencia cruzada con elvitegravir. El raltegravir debería considerarse un fármaco con baja barrera genética (35)
Correspondencia: Fredy Guevara P., Departamento de Medicina Interna, Fundación Santafé de Bogotá, Calle 119 Nº 7-75, piso 2, Bogotá, D.C., Colombia. Teléfono: 603-0303, extensión 5191 freddyorlando79@gmail.comReferencias
1. UNAIDS. 2005. AIDS epidemic update: December 2005 UNAIDS and WHO. Geneve, Switzerland. Disponible en: http://www.unaids.org/epi/2005/doc/EPIupdate2005_pdf_ en/epi-update2005_en.pdf [ Links ]
2. Pneumocystis pneumonia - Los Angeles. MMWR Morb Mortal Wkly Rep. 1981;30:250-2 [ Links ]
3. Kaposi´s sarcoma and Pneumocystis pneumonia among homosexual men - New York City and California. MMWR Morb Mortal Wkly Rep. 1981;30:305-8 [ Links ]
4. Follow-up on Kaposi´s sarcoma and Pneumocystis pneumonia MMWR Morb Mortal Wkly Rep. 1981;30:409-10 [ Links ]
5. Cohen MS, Hellman N, Levy JA, DeCock K, Lange J. The spread, treatment and prevention of HIV-1: evolution of a global pandemic. J Clin Invest. 2008;118:1244-54 [ Links ]
6. Barre-Sinoussi F, Chermann JC, Rey F, Nugeyre MT, Chamaret S, Gruest J, et al. Isolation of a T-lymphotropic retrovirus from a patient at risk for acquired immune deficiency syndrome (AIDS). Science.1983;220:868-71 [ Links ]
7. Guardiola JM, Soriano V. Tratamiento de la infección por VIH-SIDA fármacos y combinaciones. Décima edición. Madrid: Publicaciones Permanyer; 2007 [ Links ]
8. Pommier Y, Jonson A, Marchand C. Integrase inhibitors to treat HIV/AIDS. Nature Reviews. 2005;4:236-48 [ Links ]
9. Tripathi P, Agrawal S. Immunobiology of human immnunodeficiency virus infection. Indian J Med Microbiol. 2007;25: 311-22 [ Links ]
10. Engelman A, Cherepanov P. The lentiviral integrase binding protein LEDGF/p75 and HIV-1 replication. PLoS Pathog 2008;4:e1000046 [ Links ]
11. Zeinalipour-LE, Nicolaou C, Nicolaides A, Kostrikis LG. HIV- 1 integrase: from biology to chemotherapeutics. Curr HIV Res. 2007;5:365-88 [ Links ]
12. Craigie R, Mizuuchi K, Bushman FD, Engelman A. A rapid in vitro assay for HIV DNA integration. Nucleic Acids Res 1991;19:2729-34 [ Links ]
13. Goldgur Y, Craigie R, Cohen GH, Fujiwara T, Yoshinaga T, Fujishita T, et al. Structure of the HIV-1 integrase catalytic domain coplexed with an inhibitor: a platform or antiviral drug design. Proc Natl Acad Sci USA. 1999;95:4831-6 [ Links ]
14. Hazuda DJ, Felock P, Witmer M, Wolfe A, Stillmock K, grobler JA, et al. Inhibitors of strand transfer that prevent integration and inhibit HIV-1 replication in cells. Science 2000;287:646-50 [ Links ]
15. Hazuda DJ, Young SD, Guare JP, Anthony NJ, Gómez RP, Wai JS, et al. Integrase inhibitors and cellular immunity suppress retroviral replication in rhesus macaques. Science 2004;305:528-32 [ Links ]
16. Evering TH, Markowitz M. Raltegravir: an integrase inhibitor for HIV-1. Expert Opin Investig Drugs. 2008;17:413-22 [ Links ]
17. Markowitz M, Morales-Ramírez JO, Nguyen BY, Kovacs CM, Steigbigel RT, Cooper DA, et al. Antiretroviral activity, pharmacokinetics, and tolerability of MK-0518, a novel inhibitor of HIV-1 integrase, dosed as monotherapy for 10 days in treatment-naive HIV-1-infected individuals. J Acquir Immune Defic Syndr. 2006;43:509-15 [ Links ]
18. Markowitz M, Nguyen BY, Gotuzzo E, Mendo F, Ratanasuwan W, Kovacs C and Protocol 004 Part II Study Team. Rapid and durable antiretroviral effect of the HIV-1 Integrase inhibitor raltegravir as part of combination therapy in treatment-naive patients with HIV-1 infection: results of a 48-week controlled study. J Acquir Immune Defic Syndr. 2007;46:125-33 [ Links ]
19. Grinsztejn B, Nguyen BY, Katlama C, Gatell JM, Lazzarin A, Vittecoq D and the Protocol 005 Team. Safety and efficacy of the HIV-1 integrase inhibitor raltegravir (MK-0518) in treatment-experienced patients with multidrug-resistant virus: a phase II randomized controlled trial. Lancet 2007;369:1261-9 [ Links ]
20. Cooper D, Gatell J, Rockstroh J, Katlama C, Yeni P, Lazzarin A and for the BENCHMRK-1 Study Group. Results of BENCHMRK-1, a phase III study evaluating the efficacy and safety of MK-0518, a novel HIV-1 integrase inhibitor, in patients with triple-class resistant virus. 14th Conference on Retroviruses and Opportunistic Infections. Los Angeles, CA, 2007 [ Links ]
21. Steigbigel R, Kumar P, Eron J, Schechter M, Markowitz M, Loufty M and for the BENCHMRK-2 Study Group. Results of BENCHMRK-2, a phase III study evaluating the efficacy and safety of MK-0518, a novel HIV-1 integrase inhibitor, in patients with triple-class resistant virus. 14th Conference on Retroviruses and Opportunistic Infections. Los Angeles, CA, 2007 [ Links ]
22. Steigbigel R, Kumar P, Eron J, Schechter M, Markowitz M, Loutfy M and for the BENCHMRK-2 Study Group. 48-week results from BENCHMRK-2, a phase III study of Raltegravir in patients failing ART with triple-class resistant HIV-1. 15th Conference on Retroviruses and Opportunistic Infections Boston, MA, 2008 [ Links ]
23. Steigbigel R, Cooper D, Kumar P, Joseph E, Schechter M, Markowitz M, et al. Raltegravir with optimized background therapy for resistant HIV-1 infection. N Engl J Med 2008;359:339-54 [ Links ]
24. Steigbigel R, Cooper D, Teppler D, for the BENCHMRK study teams. Long-term efficacy and safety of raltegravir combined with optimized background therapy in treatment experienced patients with drug resistant HIV infection: Week 96 result of the BENCHMRK 1 and 2 phase III trials. Clin Infect Dis. 2010;50:605-12 [ Links ]
25. Kassahun K, McIntosh I, Cui D, Hreniuk D, Merschman S, Lasseter K, et al. Metabolism and disposition in humans of Raltegravir (MK-0518), an anti AIDS drug targeting the human immunodeficiency virus integrase enzime. Drug Metab Dispos. 2007;35:1657-63 [ Links ]
26. Iwamoto M, Wenning L, Petry A, Laethem T, Desmet P, Kost JT, et al. Minimal effect of ritonavir and efavirenz on the pharmacokinetics of MK-0518. 46th Interscience Conference on Antimicrobial Agents and Chemotherapy. San Francisco, CA, 2006 [ Links ]
27. Wenning L, Friedman E, Kost J, Merschman S, Lasseter K, Azrolan N. Lack of a significant drug interaction between MK-0518 and tenofovir disoproxil fumarate. 46th Interscience Conference on Antimicrobial Agents and Chemotherapy. San Francisco, CA, 2006 [ Links ]
28. Anderson M, Kakuda T, Miller J, Simonts M, Miller D, Hanley H, et al. Pharmacokinetic evaluation of non-nucleoside reverse transcriptase inhibitor (NNRTI) TMC 125 and integrase inhibitor (InSTI) raltegravir (RAL) in healthy subjects. 4th International AIDS Society (IAS) Conference. Sydney, Australia, 2007 [ Links ]
29. Wenning L, Hanley H, Stone J, Moreau J, Kost J, Mangin E, et al. Effect of tipranavir + ritonavir on pharmacokinetics of MK-0518. 46th Interscience Conference on Antimicrobial Agents and Chemotherapy. San Francisco, CA, 2006 [ Links ]
30. Garrido C, De Mendoza C, Soriano V. Resistencias a los inhibidores de la integrasa. Enferm Infecc Microbiol Clin. 2008; 26 Suppl 12:40-6 [ Links ]
31. Arponen S, Benito J, Lozano S, Blanco F, Garrido C, de Mendoza C et al. More pronounced effect of integrase inhibitor raltegravir on proviral DNA reduction that other antiretroviral drugs in patients achieving undetectable viremia. 15th Conference on Retroviruses and Opportunistic Infections. Boston, MA, 2008 [ Links ]
32. Hazuda DJ, Miller MD, Nguyen BY, Zhao J. Resistance to the HIV-integrase inhibitor Raltegravir analysis of protocol 005 A phase II study in patients with triple-class resistant HIV-1 infection. 16th International HIV Drug Resistance Workshop, Barbados, West Indies, June 12-16, 2007 [ Links ]
33. Hazuda D, Miller M, Nguyen B, Zhao J. Resistance to the HIV integrase inhibitor raltegravir. 16th International HIV Drug Resistance Workshop. Barbados, 12-16 June 2007 [ Links ]
34. Garrido C, Geretti AM, De Mendoza C. Polymorphism at the integrase gene in distintc HIV populations may influence the susceptibility to integrase inhibitors. 6th European HIV Drug Resistance Workshop. Budapest, 26-28 March 2008 [ Links ]
35. Hammer SM, Saag MS, Schechter M, Montaner JS, Schooley RT, Jacobsen DM, et al. Treatment for adult HIV infection, 2006 recommendations of the International AIDS Society-USA Panel. JAMA. 2006;296:827-43 [ Links ]
36. Clumeck N, Pozniak A, Raffi F, and EACS Executive Committee Guidelines for the clinical management and treatment of HIV infected adults. HIV Medicine. 2008;9(2):65-71 [ Links ]
37. Panel on antiretroviral guidelines for adults and adolescents Guidelines for the use of antiretroviral agents in HIV- 1-infected adults and adolescents. Department of Health and Human Services. December, 2009. Disponible en: http: //www.aidsinfo.nih.gov/contentFiles/adultandadolescentG L.pdf. Accesed Abril 2009 [ Links ]
38. Gazzard B, Bernard AJ, Boffito M, Churchill D, Edwards S, Fisher N, and the Writing Committee, British HIV Association British HIV Association (BHIVA) guidelines for the treatment of HIV-infected adults with antiretroviral therapy HIV Med. 2006;7(8):487-503 [ Links ]
39. Gazzard B, Bernard AJ, Boffito M, Churchill D, Edwards S, Fisher N, and the Writing Committee, British HIV Association British HIV Association (BHIVA) guidelines for the treatment of HIV-infected adults with antiretroviral therapy HIV Med. 2006;7(8):487-503 [ Links ]
40. Gatell J, Katlama C, Grinsztejn B, Eron JJ, Lazzarin A, Vittecoq D, et al. Long-term efficacy and safety of the HIV integrase inhibitor raltegravir in patients with limited treatment options in a phase ii study. J Acquir Immune Defic Syndr 2010;53:456-63 [ Links ]
41. Steigbigel R, Cooper D, Teppler H, for the BENCHMRK Study Teams. Long-term efficacy and safety of raltegravir combined with optimized background therapy in treatment-experienced patients with drug-resistant HIV infection: Week 96 results of the BENCHMRK 1 and 2 phase III trials. Clinical Infectious Diseases. 2010;50:605-12 [ Links ]
42. Eron J, Cooper D, Steigbigel T, Clotet B, for the BENCHMRK- 1 and 2 Study Groups. Sustained antiretroviral effect of raltegravir at week 156 in the BENCHMRK studies, and exploratory analysis of late outcomes based on early virologic responses. 17th CROI, February 16-19, 2010, San Francisco, CA. Abstract K-128 [ Links ]
43. Gotuzzo E, Nguyen Y, Markowitz M, Mendo F, and the Protocol 004 Part II Study Team. Sustained antiretroviral efficacy of raltegravir after 192 weeks of combination ART in treatment-naive HIV-1 infected patients, 17th CROI, February 16-19, 2010, San Francisco, CA. Abstract #K-127 [ Links ]
44. Eron JJ, Young B, Cooper DA and SWITCHMRK 1 and 2 investigators. Switch to a raltegravir-based regimen versus continuation of a lopinavir-ritonavir-based regimen in stable HIV-infected patients with suppressed viraemia (SWITCHMRK 1 and 2): two multicentre, double-blind, randomized controlled trials. Lancet. 2010;375:396-407 [ Links ]
45. Martínez E, Larrousse M, Libre JM for the SPIRAL Study Group. Substitution of raltegravir for ritonavir-boosted protease inhibitors in HIV-infected patients: the SPIRAL study AIDS. 2010 (en prensa). 2010 Jul;24(11):1697-707 [ Links ]
46. Guevara F, Blanco F, Arredondo M. Terapia de cambio a raltegravir en pacientes VIH positivos con viremia plasmática indetectable y que presentan toxicidad con otros medicamentos antirretrovirales LO-19. Infectio. 2010;14(supl.1):54. [ Links ]














