Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Infectio
Print version ISSN 0123-9392
Infect. vol.14 no.3 Bogotá July/Sept. 2010
Secondary metabolite detection in Ambrosia peruviana Willd and determination of antibacterial and antihelmintic activity
María del Pilar Guauque1, Jhon Carlos Castaño2, Milton Gómez1
1 Departamento de Química, Facultad de Ciencias Básicas y Tecnologías, Universidad del Quindío, Armenia, Colombia
2 Departamento de Medicina, Facultad Ciencias de la Salud, Universidad del Quindío, Armenia, Colombia
Recibido: 16/04/2010; Aceptado: 30/08/2010
Resumen
En el conocimiento etnofarmacológico, Ambrosia peruviana es conocida como una planta antiinfecciosa y antihelmíntica. Dados los altos índices de resistencia bacteriana y parasitaria, se realizó la tamización fitoquímica preliminar siguiendo la metodología de Sanabria, y ensayos biológicos frente a aislamientos clínicos bacterianos, parásitos caninos y Artemia salina.
Los ensayos de citotoxicidad en A. salina se realizaron por exposición de los adultos a concentraciones variables de los extractos. La actividad antibacteriana se realizó por los métodos de difusión en disco y concentración inhibitoria mínima (CIM).
Se determinó el porcentaje de huevos que tenían el embrión del parásito, en el medio de cultivo se mantuvieron en lactato de Ringer con suplemento al 10% de RPMI y 1X ATM. Se determinó el porcentaje de huevos con embrión, o fecundados, liberados en el medio de cultivo con adición de extracto etanólico y acuoso secos de A. peruviana. Los ensayos de la especie vegetal frente a helmintos se realizaron al sumergir los adultos en medio con suplemento de extracto etanólico seco (usando diferentes concentraciones) y con fracciones ricas en alcaloides.
Se identificó la presencia de alcaloides, glucósidos cardiotónicos, quinonas, flavonoides, carbohidratos, taninos y saponinas. La concentración letal media para el extracto etanólico seco fue 64,2 µg/ml, mientras que para el extracto acuoso fue de 840,4 µg/ml. Los extractos no presentaron actividad antibacteriana. Los ejemplares adultos de T. canis presentaron disminución de la motilidad frente a extractos secos, mientras que en la fracción de alcaloides murieron luego de 4 horas de exposición. Los extractos de A. peruviana sobre huevos de T. canis permitieron una disminución en el porcentaje de huevos con embrión que no dependía del extracto observado sino de la concentración empleada.
Palabras clave: Ambrosia peruviana, antibacteriano, antiparasitario, Artemia salina, Toxocara canis.
Abstract
Ambrosia peruviana has been reported as an anti-infective and anti-parasitic plant in the ethno-pharmacological environment. Given the high rates of bacterial and parasitic resistance against commercial drugs recorded, we performed the preliminary phytochemical screening following Sanabria´s method and biological tests against clinical bacterial isolates, dog parasites, and Artemia salina.
Cytotoxicity tests in Artemia salina were carried out by exposing adults to extracts of varied concentrations. The antibacterial activity was performed using the disk diffusion method and CIM. Toxocara canis nematodes were kept in Ringer´s lactate supplemented with 10% RPMI and 1X ATM. The embryo generation percentage of eggs released into the culture medium was evaluated adding ethanol and aqueous extracts of dried A. peruviana. The tests of A. peruviana against helminths were performed by immersing adults in a medium supplemented with dried ethanol extract (at various concentrations) and fractions rich in alkaloids.
Phytochemical screening allowed preliminary identification of alkaloids, cardiotonic glucosides, quinones, flavonoids, carbohydrates, tannins and saponins. The LC50 for dry ethanol extract was 64.2µg/ml, while for the aqueous extract was 840.4µg/ml. The extracts did not show antibacterial activity. T. canis adults showed motility decrease against dried extracts, not so in alkaloid fraction where they died after a 4h exposure. The use of extracts from A. peruviana over Toxocara canis eggs caused a decrease in the percentage of embryo generation, which did not depend on the extract observed but on the concentration used.
Key Words: Ambrosia peruviana, antibacterial agents, antiparasitic, Artemia salina, Toxocara canis.
Introducción
Dado el conocimiento etnofarmacológico de nuestro país y la riqueza botánica de la región, se estudió la especie Ambrosia peruviana Willd (Asteraceae) por su uso en la Amazonia como antihelmíntica. En el ámbito científico, la especie vegetal también es conocida como Ambrosia cumanensis Kunth, Ambrosia eliator y Ambrosia paniculata (1).
De esta forma, el conocimiento etnofarmacológico de la especie ha motivado investigaciones tendientes a corroborar o a refutar las hipótesis generadas a partir del uso popular de A. peruviana con fines terapéuticos. Por ejemplo, Solís y colaboradores reportaron que la infusión (liofilizada) del fruto fresco de A. peruviana no había mostrado actividad antimicrobiana a una concentración de 100 µg/ml contra Escherichia coli ATCC 9637, Staphylococcus aureus ATCC 6538, Klebsiella pneumoniae ATCC 10031, Mycobacterium smegmatis ATCC 607, Pseudomonas aeruginosa ATCC 27853 y Candida albicans ATCC 10231, en una evaluación in vitro sobre placas de agar (2). De igual forma, Meléndez y Capriles reportaron que A. peruviana no poseía actividad contra E. coli y S. aureus (3).
Por otra parte, se ha comprobado la acción citotóxica de los extractos alcohólicos de algunas especies de Ambrosia. La especie mejor estudiada ha sido A. marítima, dada su propiedad moluscocida, demostrándose además que posee actividad antibacteriana. Las propiedades medicinales de la especie han sido investigadas ampliamente y se han propuesto las lactonas sesquiterpénicas como las principales responsables de su acción terapéutica. De acuerdo con los resultados obtenidos, el uso de la planta no presenta contraindicaciones (4).
Teniendo en cuenta que los metabolitos secundarios son los principales responsables de la acción terapéutica de las especies vegetales, es importante el estudio de su composición y distribución en la planta. Se reporta la presencia de alcaloides, taninos, glucósidos cardiotónicos, cumarinas, auronas, esteroides y saponinas en las hojas de A. peruviana (5). En 1966, Joseph-Nathan propuso la peruvinina, una sesquiterpenlactona de tipo seudoguayanólido, como uno de los componentes principales de la especie (6,7). De igual forma, Gwendolyn, en 1987, presentó nuevas estructuras correspondientes a un diol-sesquiterpeno y cuatro seudoguayanólidos presentes en A. peruviana, con la respectiva nomenclatura como sigue: alloaromadendrane-4T, 10U-diol, psilostachyins C y B, ambrosina y damsina (8).
Con estos antecedentes decidimos realizar la tamización fitoquímica preliminar de A. peruviana y evaluar su respuesta frente al crustáceo Artemia salina; a las bacterias Gram positivas S. aureus y S. pyogenes; a las bacterias Gram negativas P. aeruginosa, E. cloacae, P. vulgaris, E. coli y E. coli DH5α, y al nematodo Toxocara canis.
Metodología
Tamización fitoquímica.
Se recolectaron 4,0 kg de hojas de A. peruviana, en el municipio de Armenia, Quindío (1.550 msnm). El material vegetal fue secado a 37ºC en estufa de aire circulante. La identificación taxonómica se llevó a cabo en el Herbario Nacional, Universidad Nacional, sede Bogotá (N°COL 520349).
La tamización fitoquímica se llevó a cabo por desengrase en extractor soxhlet con éter de petróleo, seguido de percolación en etanol al 94,4% y posterior maceración en agua destilada en ebullición. Los extractos etanólico y acuoso se llevaron a sequedad con rotaevaporador a 37ºC y, posteriormente, se sometieron a pruebas de identificación para metabolitos secundarios (9-10). El fraccionamiento preliminar del extracto etanólico seco de la especie (9), permitió obtener fracciones ricas en alcaloides que luego fueron ensayadas sobre nematodos y bacterias.
Dosis letal media. Los crustáceos adultos (20 a 30 por ensayo) se expusieron a concentraciones de 1.000, 750, 500, 250, 100, 50 y 25 µg/ml del extracto etanólico y acuoso secos, con control negativo y control con DMSO al 4% para los extractos insolubles en agua. Se determinó la letalidad del experimento por medida de la cantidad de individuos muertos a las 24 horas con tres repeticiones para cada concentración (11). Los datos se analizaron con el método Probit, usando el paquete estadístico Statgraphics, y se determinó la concentración letal media de los extractos.
Efecto antibacteriano. Con el objetivo de conocer si existía respuesta antibacteriana de A. peruviana sobre distintas cepas, se sometieron a ensayo las bacterias Gram positivas S. aureus y S. pyogenes, y las Gram negativas P. aeruginosa, E. cloacae, P. vulgaris, E. coli y E. coli DH5α, frente a extractos de A. peruviana etanólico y acuoso (1 mg/ml).
Se utilizó el método de concentración inhibitoria mínima (CIM) en caldo nutritivo LB, con tubos control que contenían extracto (etanólico o acuoso), en las concentraciones evaluadas, con caldo nutritivo y tubos control con la cepa creciendo en caldo nutritivo LB. La respuesta esperada era la ausencia de turbidez.
La corroboración de los resultados encontrados por CIM, se llevó a cabo siguiendo los métodos básicos para el estudio de la sensibilidad a los antimicrobianos de la Sociedad Española de Enfermedades Infecciosas y Microbiología Clínica (12); para la concentración de 1 mg/ml, se usó un control positivo de cafalotina para las bacterias Gram positivas y uno de ciprofloxacina para las Gram negativas. La respuesta esperada se manifestó por presencia de un halo de inhibición.
Efecto antihelmíntico. La recolección y la obtención de los huevos y adultos de nematodos de T. canis se hicieron mediante la disección del intestino delgado de perros sacrificados con sobredosis de anestésicos en la Central de Zoonosis de Armenia. Los parásitos adultos así extraídos se lavaron tres veces con lactato de Ringer y PBS, bajo campana de flujo laminar. El mantenimiento de T. canis se hizo en lactato de Ringer con suplemento al 10% de RPMI y 1X ATM (100 unidades de penicilina, 0,1 mg de estreptomicina y 0,25 µg de anfotericina por ml).
Los adultos de T. canis fueron sumergidos en medio con suplemento de extracto etanólico seco a 50, 25, 10, 5 y 1 mg/ml, de extracto acuoso a 10 mg/ml y en fracciones ricas en alcaloides a 900 µg/ml. El uso de fracciones de alcaloides cobra importancia dado que los alcaloides de tipo β-carbolina son usados como nematicidas y poseen baja citotoxicidad (13). La inmovilidad de los parásitos y su nueva suspensión en medio de cultivo (30 minutos) permitieron observar la muerte de los nematodos.
Los productos de excreción y secreción se recolectaron para el almacenamiento de huevos y medición, en placa de cultivo estéril, del porcentaje de huevos fecundados en medio con extractos etanólico y acuoso secos de A. peruviana, después de seis días de incubación a 37ºC y tres repeticiones para 1.000, 500 y 100 µg/ml. Se usó un control negativo de medio de cultivo, un control positivo con albendazol comercial a 1 mg/ml y uno de DMSO al 5%. Los datos se recolectaron por observación del desarrollo larvario con microscopio de luz invertida y se procesaron por ajuste a un modelo estadístico lineal general que relacionaba el porcentaje de huevos no fecundados con dos factores de pronóstico (extracto y concentración) y análisis de varianza, usando el paquete estadístico Statgraphics.
Resultados
Tamización fitoquímica. Mediante la tamización fitoquímica de A. peruviana, se determinó que la especie posee alcaloides, flavonoides, quinonas, taninos, saponinas, cumarinas, lactonas terpénicas, glucósidos cardiotónicos y carbohidratos. No posee cumarinas volátiles, leucoantocianidinas, nafto ni antraquinonas (tabla 1).
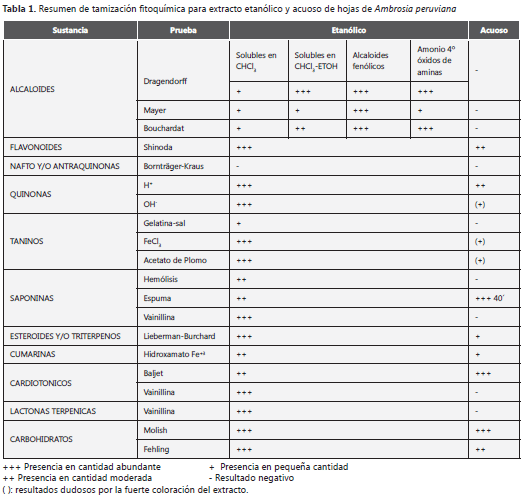
Siguiendo el fraccionamiento preliminar planteado por Sanabria, se logró la separación de las fases de alcaloides y acuosa. Debido a que el procedimiento de extracción de la fase de alcaloides es específico para estos metabolitos, sólo se sometió a las pruebas de identificación de alcaloides, lo cual dio como resultado la presencia abundante (+++) del metabolito en los tres ensayos (Dragendorff, Mayer y Bouchardart) (9).
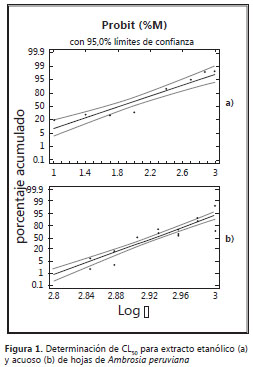
Dosis letal media. El porcentaje de mortalidad se obtuvo con la fórmula de Abbot, que permite hacer la corrección de la mortalidad respecto al blanco con DMSO 4%. Los datos se analizaron con Statgraphics, que muestra los resultados del ajuste de un modelo de regresión tipo Probit para describir la relación entre el porcentaje de mortalidad y la variable independiente concentración. De este análisis se obtuvo un valor de concentración letal media de 64,2 µg/ml para el extracto etanólico y CL50 de 840,46 µg/ml para el extracto acuoso de A. peruviana (figuras 1a y 1b).
Efecto antibacteriano. Los resultados obtenidos en el ensayo de difusión con disco fueron negativos en todos los casos evaluados (tabla 2).
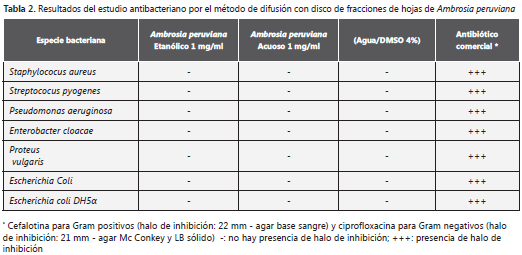
En el caso del ensayo CIM para las mismas concentraciones (1 mg/ml), se evaluó la presencia de turbidez por comparación entre el control negativo, el tubo de ensayo que contenía el extracto junto con el caldo nutritivo y, finalmente, la prueba que contenía el extracto, el caldo nutritivo y la cepa. En todos los casos evaluados, los resultados fueron negativos.
Efecto antihelmíntico. Se observó una disminución de la motilidad de los adultos de T. canis frente al extracto etanólico seco de A. peruviana, en las concentraciones de 25, 10, 5 y 1 mg/ml. Sin embargo, el uso de 50 mg/ml del mismo extracto y de fracciones ricas en alcaloides (900 µg/ml), produjo la inmovilidad completa de los nematodos adultos de T. canis (tabla 3).
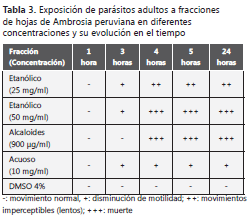
Este resultado se comprobó al suspender nuevamente los nematodos en medio de lactato de Ringer con suplemento al 10% de RPMI y 1X ATM durante 30 minutos, sin recuperación de su actividad motriz.
Para la medición del porcentaje de huevos con embrión, o fecundados, de T. canis frente a los extractos secos etanólico y acuoso de A. peruviana, se hizo un análisis de varianza cuyo valor de p fue de 0,0009. Esto indica que existe una relación estadísticamente significativa entre el porcentaje de huevos sin embrión y las variables estudiadas (extracto, concentración) al 99% de nivel de confianza. Esto se traduce en una relación entre la disminución del porcentaje de huevos sin embrión de T. canis y la exposición a los diferentes extractos de A. peruviana.
Asimismo, se evaluó la contribución de cada una de las variables a la explicación del modelo y su efecto sobre el porcentaje de huevos sin embrión, usando la metodología de suma de cuadrados. Los valores de p para la variable extracto (0,8310) y para la interacción extracto-concentración (0,5262) son superiores al umbral (0,1), lo que indica que no son estadísticamente significativas al 90% de nivel de confianza; por lo tanto, no existe una real diferencia entre los extractos aplicados etanólico y acuoso o el efecto de la interacción, con respecto a la disminución del porcentaje de huevos sin embrión frente al control (figura 2). El valor de p de la concentración demuestra un nivel de significancia alto (<0,05) que indica relevancia del factor sobre el resultado esperado. Se concluye que el factor determinante en la disminución del porcentaje de huevos sin embrión de T. canis es la concentración del extracto, sea etanólico o acuoso, de A. peruviana (figura 3).
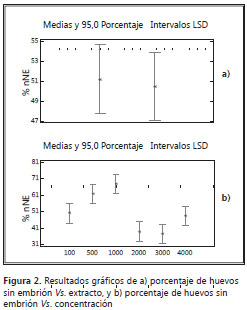
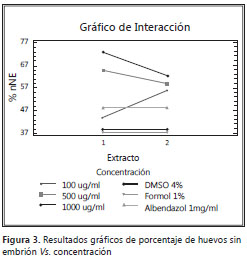
Las convenciones usadas en las figuras son como siguen: 1, para extracto etanólico, y 2, para extracto acuoso de la especie vegetal. Los valores 100, 500 y 1.000 son las concentraciones en µg/ml del extracto etanólico de A. peruviana sobre huevos de T. canis. El valor arbitrario 2.000 se usa para observar los datos de huevos fecundados en DMSO 4%, mientras que 3.000 es el blanco con formol al 1% y 4.000 es el control con albendazol comercial a 1 mg/ml.
Como se puede observar en el gráfico de interacción (figura 3), no hay diferencia estadísticamente significativa entre las variables extracto etanólico y acuoso, mientras que, para la variable concentración (100, 500 y 1.000 µg/ml), sí existe dicha diferencia. Es muy importante observar que el porcentaje de huevos sin embrión en la variable 100 µg/ml se superpone al resultado observado con el antiparasitario comercial (albendazol) y que para las concentraciones más altas el resultado es mejor. Se concluye que la disminución del porcentaje de huevos sin embrión se debe a la concentración empleada en el análisis y no al extracto usado para tal fin.
Discusión
La tamización fitoquímica concuerda con lo reportado previamente, especialmente en lo que se refiere a alcaloides, glucósidos cardiotónicos, taninos y saponinas (5). Sobresale la presencia de lactonas sesquiterpénicas, lo que está de acuerdo con trabajos reportados previamente. Estos compuestos han sido ampliamente identificados y elucidados como componentes importantes de A. peruviana (4,6,8).
En ensayos adicionales se comprobó la presencia de alcaloides mediante la prueba modificada de Draggendorf, con lectura a las 24 horas de asperjada la placa, en algunas de las fracciones obtenidas por elución de una columna cromatográfica con CH2Cl2 (no se presentan los datos), debido a que los resultados arrojados en las pruebas biológicas de este tipo de metabolitos fueron satisfactorias y podría pensarse en su aislamiento, purificación y posterior caracterización espectroscópica. Este resultado pone de manifiesto las características poco polares de los alcaloides presentes en A. peruviana debido, posiblemente, a la presencia de sustituyentes electro-atrayentes (grupo carbonilo) que disminuyen el pH básico del nitrógeno y lo hacen casi neutro o la presencia de cadenas carbonadas de gran tamaño, como en el caso de los alcaloides esteroides (14).
Debido a que se registra una concentración diez veces superior de CL50 en el extracto acuoso, con respecto al mismo parámetro evaluado para el extracto etanólico de A.peruviana sobre Artemia salina, se proponen los metabolitos no comunes a los dos extractos evaluados (alcaloides y saponinas) como principales responsables de la actividad citotóxica de A. peruviana.
Se conoce la actividad moluscicida de saponinas purificadas provenientes de Catunaregam nilotica activas sobre Biomphalaria glabrata, con CL50 de 3 y 26 ppm, dependiendo de la saponina ensayada (15). Asimismo, se conocen múltiples reportes de la actividad citotóxica de los alcaloides; Sarker y colaboradores aislaron alcaloides de tipo indol de Centaurea cyanus(Asteraceae), con gran actividad sobre Artemia salina (CL50 de 21 y 14 µg/ml, según el alcaloide empleado) (16).
Los ensayos de actividad antibacteriana por los dos métodos empleados permitieron confirmar que la especie es inactiva frente a diferentes cepas ensayadas (2,3).
La fracción que contiene alcaloides presenta el mejor comportamiento frente a los parásitos adultos. Es conocido que alcaloides como la Spiganthina de tipo rianodina pueden interaccionar con el canal Ca+2, al unir rianodina en lugar de glutamato para formar una unión irreversible que permite la contracción sostenida de los músculos esqueléticos y la parálisis característica (17,18). De igual manera, los alcaloides de tipo β-carbolina son nematocidas y poseen baja citotoxicidad, lo que los constituye en posibles fármacos (13).
En el caso de los huevos de T. canis, la disminución del porcentaje de huevos sin embrión se debe a la concentración empleada en el análisis y no al extracto usado para tal fin. Por ello se propone, como hipótesis para futuros trabajos, que los metabolitos secundarios comunes a los dos extractos son los responsables de la actividad antiparasitaria. Estos metabolitos secundarios son flavonoides, lactonas y quinonas. Esto podría concordar con lo reportado para el caso de los flavonoides y catequinas que tienen actividad frente a formas amastigotes de T. cruzi (19) y con otros reportes tales, como el publicado por Barrau (2005), en el que se estudian los 3-flavandioles glucosilados presentes en esparceta (Onobrychis viciifolia Scop), que son capaces de inhibir las migración de larvas de Haemonchus contortus (20).
Asimismo, las moléculas del tipo de las quinonas, como la atovacuona, parecen actuar interfiriendo selectivamente el transporte electrónico mitocondrial por inhibición del citocromo C, que hace parte del complejo respiratorio III en protozoos sensibles (21), mientras que se han encontrado quinonas (fumiquinonas) provenientes de Aspergillus fumigatus, con actividad nematocida (22). De igual forma, la actividad nematotóxica de la bacteria Bacillus nematocida sp., descubierta en 2005 por Huang y colaboradores, se explica porque posee cantidades apreciables de menaquinonas (una forma de vitamina K) (23).
De igual forma, las lactonas han sido usadas por años como antiparasitarios comerciales (ivomec y otros). Es el caso de las lactonas macrocíclicas de tipo avermectina. Se sabe que su principal acción se ejerce sobre los canales de flujo de ión Cl- de las células musculares que quedan indefinidamente abiertos y provocan un cambio en la membrana y su correspondiente fallo en la neurotransmisión. Fruto de ello, el nematodo se paraliza y muere o es expulsado del intestino (24). Sin embargo, se debe tener presente que la sobredosificación del fármaco ha permitido la generación de cepas resistentes, lo que ha motivado el creciente interés en moléculas con mecanismos de acción alternativos y, por tanto, la búsqueda de metabolitos secundarios en plantas conocidas dentro del saber etnofarmacológico por su actividad antiparasitaria, como la que se ha presentado en este trabajo.
Agradecimientos
A la Universidad del Quindío, al programa de Química y al Centro de Investigaciones Biomédicas.
Correspondencia: Jhon Carlos Castaño. Grupo Inmunología Molecular, Facultad Ciencias de la Salud, Universidad del Quindío, Carrera 15 Calle 12 Norte, Armenia, Colombia. Teléfono: +(57)67460168. jhoncarlos@uniquindio.edu.co
Referencias
1. Missouri Botanical Garden. Ambrosia peruviana Willd. - Herbarium Specimen. Tropicos.org updates. Fecha de consulta: 14 de noviembre de 2007. Disponible en: http://www.tropicos.org/NameSynonyms.aspx?nameid=2704452. [ Links ]
2. Solis P, Vasquez Y, Ayala H, Gupta M, 2002. Informe de validación de algunas plantas TRAMIL. Informe TRAMIL. Centro de Investigaciones Farmacognósticas de la Flora Panamena CIFLORPAN, Facultad de Farmacai. Universidad de Panamá, Panamá, Panamá. [ Links ]
3. Meléndez PA, Capriles VA. Antibacterial properties of tropical plants from Puerto Rico. Phytomedicine. 2006;13:272-6. [ Links ]
4. Instituto Interamericano de Cooperación para la Agricultura (IICA).Plantas medicinales y otras especies utiles: Diagnostico situacional sobre producción, industrialización y comercialización de plantas medicinales y otras especies útiles. Managua, Octubre del 2005.Fecha de consulta: 27 de abril de 2007. Disponible en: http://www.iica.int.ni/Estudios_PDF/Plant_Medic.pdf [ Links ]
5. Torres H , Mendoza F, Hernandez J. Estudio preliminar en bioactividad y comportamiento agronómico de diez especies silvestres de Plantas medicinales y de uso Biopesticida para su Aplicabilidad en el sector Rural de Daule, Provincia del Guayas. Proyecto Semillas. CICYT - FIMCP. ESPOL. Guayaquil, 2005. [ Links ]
6. Romo J, Joseph-Nathan P, Romo A, Álvarez C. The structure of peruvinin, a pseudoguaianolide isolated from Ambrosia peruviana Willd. Tetrahedron. 1967;23:529-34. [ Links ]
7. Joseph-Nathan P, Romo J. Isolation and structure of peruvin. Tetrahedron. 1966;22:1723-8. [ Links ]
8. Gwendolyn G, Basil A. Sesquiterpene lactones of some Ambrosia species. Phytochemistry. 1969;8:877-81. [ Links ]
9. Sanabri, A. Análisis fitoquímico preliminar. Metodología y su aplicación en la evaluación de 40 plantas de la familia Compositae. Bogota: Facultad de Ciencias. Departamento de Farmacia. Universidad Nacional; 1983. p. 42, 56, 73, 75Domínguez XA. Métodos de investigación fitoquímica. México, D.F: Limusa; 1973. [ Links ]
10. Bilbao MR. Análisis fitoquímico preliminar. Armenia: Universidad del Quindío; 1997. [ Links ]
11. Osorio J. Análisis del procedimiento para la determinación de la DL50 (dosis letal media) a través del método de probit en un bioensayo. Fecha de consulta: 17 de noviembre de 2007. Disponible en: http://www.monografias.com/trabajos14/dosis-letal/dosis-letal.shtml?monosearch; [ Links ]
12 Garcia J, Canton R, Garcia J, Gómez -Lus, Martínez L, Rodríguez-Avial, Vila J. Métodos Básicos para el estudio de la sensibilidad a los antimicrobianos 2000. Fecha de consulta: 23 de octubre de 2007. Disponible en: http://www.seimc.org/documentos/protocolos/microbiologia/cap11.htm [ Links ]
13. Satou T, Horiuchi A, Akao N, Koike K, Fujita K, Nikaido T. Toxocara canis: Search for a potential drug amongst ß-carboline alkaloids -in vitro and mouse studies. Exp Parasitol. 2005; 110: 134-9. [ Links ]
14. Arango GJ. Alcaloides y compuestos nitrogenados. Medellín, Colombia: Universidad de Antioquia; 2002. [ Links ]
15. Lemmich E, Cornett C, Furu P, Jørstian C, Knudsen A, Olsen C, et al. Molluscicidal saponins from Catunaregam nilotica. Phytochemistry. 1995;39:63-8. [ Links ]
16. Sarker S, Laird A, Nahar L, Kumarasamy Y, Jaspars M. Indole alkaloids from the seeds of Centaurea cyanus (Asteraceae). Phytochemistry. 2001;57:1273-6. [ Links ]
17. Assis LM, Bevilaqua CML, Morais SM, Vieira LS, Costa CTC, Souza JAL. Ovicidal and larvicidal activity in vitro of Spigelia anthelmia Linn. extracts on Haemonchus contortus. Vet Parasitol. 2003;117:43-9. [ Links ]
18. Kim YK, Valdivia HH, Maryon EB, Anderson P, Coronado R. High molecular weight proteins in nematode C. elegans bind (3H) ryanodine and form a large conductance channel. Biophys J. 1992;63:1379-84. [ Links ]
19. Paveto C, Guida MC, Esteva MI, Martino V, Coussio J, Flawia MM, et al. Anti-Trypanosoma cruzi activity of green tea (Camellia sinensis) catechins, Antimicrob Agents Chemother. 2004;48:69-74. [ Links ]
20. Barrau E, Fabre N, Fouraste I, Hoste H. Effect of bioactive compounds from Sainfoin (Onobrychis viciifolia Scop.) on the in vitro larval migration of Haemonchus contortus: Role of tannins and flavonol glycosides. Parasitol. 2005;131:1-8. [ Links ]
21. Nwaka S, Riopel L, Ubben D, Craft JC. Medicines for malaria venture, new developments in antimalarials. Travel Med Infect Dis. 2004;2:161-70. [ Links ]
22. Hayashi A, Fujioka S, Nukina M, Kawano T, Shimada A, Kimura Y. Fumiquinones A and B, nematicidal quinones produced by Aspergillus fumigatus. Biosci Biotechnol Biochem. 2007;71:1697-702. [ Links ]
23. Huang XW, Niu QH, Zhou W, Zhang KQ. Bacillus nematocida sp. nov., a novel bacterial strain with nematotoxic activity isolated from soil in Yunnan, China. Syst Appl Microbiol. 2005;28:323-7. [ Links ]
24. Bloomquist J. Insecticidas: Químicas y características.Radcl iffe´s el texto mundial del MIP. Universidad de Minnesota. Fecha de consulta: 20 de diciembre de 2007. Disponible en: http://ipmworld.umn.edu/cancelado/Spchapters/BloomquistSp.htm [ Links ]














