Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Infectio
versão impressa ISSN 0123-9392
Infect. v.14 supl.2 Bogotá dez. 2010
1 Facultad de Ciencias, Pontificia Universidad Javeriana.
2 Grupo de Micología Médica, Instituto Nacional de Cancerología.
3 Facultad de Medicina, Universidad Nacional de Colombia.
4 Grupo de Infectología, Instituto Nacional de Cancerología.
5 Grupo de Investigación Clínica, Instituto Nacional de Cancerología.
Recibido: 11/07/2010; Aceptado: 19/11/2010
Resumen
Introducción: la sensibilidad antifúngica in vitro en hongos filamentosos no ha tenido el mismo desarrollo que en levaduras. Se dispone de limitada información sobre la susceptibilidad en este tipo de aislamientos en Colombia.
Materiales y métodos: se determinó la actividad in vitro de fluconazol, voriconazol, itraconazol, anfotericina B y caspofungina mediante el método de E-Test, de los géneros Aspergillus (36 A. fumigatus, 12 A. flavus, 9 A. niger, 6 A. terreus, 4 A. nidulans y 1 A. versicolor) e hifomicetes hialinos (9 Fusarium sp., 2 Geotrichum sp. y 2 Paecilomyces sp.), provenientes en su mayoría de lavados broncoalveolares (30%) y biopsias pulmonares (36%); 9% provenían de hemocultivos.
Resultados: el perfil de resistencia general fue 28% para itraconazol, 15% para caspofungina, 14% para anfotericina B y 5% para voriconazol. En general, todos los aislamientos presentaron una sensibilidad disminuida para fluconazol e itraconazol. La mejor actividad farmacológica la presentaron voriconazol, caspofungina y anfotericina B. Fusarium sp. presentó una mayor actividad con el voriconazol. Se encontraron diferencias entre el tipo de micelio (Aspergillus vs no Aspergillus) y la susceptibilidad a voriconazol, anfotericina B y caspofungina.
Conclusión: en general, los antimicóticos disponibles para el tratamiento de infecciones por miceliales muestran una sensibilidad disminuida in vitro en relación con el género y la especie identificada.
Palabras claves: pruebas de sensibilidad microbiana, pruebas antimicrobianas de difusión por disco, hongos, aspergillus, fusarium, agentes antifúngicos, resistencia a medicamentos.
Abstract
Introduction: fungal susceptibility against micelial fungi has not been developed at the same pace as susceptibility against yeasts. Scarce information is available about that kind of isolates in Colombia.
Materials and methods: in vitro susceptibility against micelial isolates from patients with cancer was determined. The E-test method was used to find out susceptibility against fluconazole, voriconazole, itraconazole, amphotericin B, and caspofungin. Isolates of the genera Aspergillus (36 A. fumigatus, 12 A. flavus, 9 A. niger, 6 A. terreus, 4 A. nidulans and one A. versicolor isolate), Fusarium (n=9), Geotrichum and Paecilomyces (n=2 each one) obtained from patients with cancer were tested. These isolates were obtained from bronchoalveolar lavage (30%), pulmonary biopsies (36%) and bloodstream infections (9%).
Results: The general pattern of resistance was 28% against intraconazole, 15% against caspofungin, 14% against amphotericin B, and 5% against voriconazole. In general, susceptibility against fluconazole and itraconazole showed a diminishing trend. Voriconazole, caspofungin, and amphotericin B showed the best pharmacologic potency. Fusarium sp. presented a higher activity level against voriconazole. There were differences in the susceptibility against voriconazole, anphotericin B, and caspofungin depending on the type of micelial isolate (Aspergillus vs. Non- Aspergillus).
Conclusion: In general, the available antifungal treatments against mycelial fungi identified in the cancer center show diminished susceptibility.
Key words (MeSH): microbial sensitivity tests, disk diffusion antimicrobial tests, fungus drug sensitivity tests, aspergillus, fusarium, antifungal agents, Amphotericin B, Voriconazole, Itraconazole.
Introducción
Los hongos son reconocidos como una de las principales fuentes de infección en pacientes inmunocomprometidos. En las dos últimas décadas se ha producido un incremento sustancial en la frecuencia de los casos de infecciones asociados a especies miceliales, especialmente de Aspergilosis Invasiva (AI), como consecuencia de una serie de factores de riesgo como: la aparición de la pandemia de sida, el desarrollo de nuevos regímenes de tratamiento quimioterapéutico para tumores sólidos y neoplasias hematológicas, el incremento en muchos países del mundo, especialmente en el nuestro, de los trasplantes de órganos, y la utilización de fármacos inmunosupresores cada vez más potentes, junto con terapias antibióticas de amplio espectro (1-4). Ante el aumento en la incidencia de las infecciones fúngicas, se incrementó el desarrollo de nuevos fármacos antimicóticos, y con estos el interés por el uso de las pruebas de sensibilidad in vitro, especialmente para las especies miceliales, al establecerse una relación directa entre las fallas en el procedimiento y el agente etiológico aislado, y como punto de partida a la hora de elegir un tratamiento oportuno y eficaz para la Enfermedad Fúngica Invasiva (EFI) y constituir un factor que condiciona una terapia dirigida (4-6).
Actualmente se cuenta con métodos de referencia de microdilución en caldo para pruebas de sensibilidad antifúngica que, a pesar de las dificultades que presentan, constituyen un notable avance en el manejo de las enfermedades micóticas al determinar las Concentraciones Mínimas Inhibitorias (CMI) y estableciendo puntos de corte para varios antifúngicos de uso clínico y levaduras frecuentemente asociadas a la EFI. Para el estudio de las infecciones asociadas con hongos miceliales, se dispone del documento M38-A2 del Clinical and Laboratory Standards Immediate (CLSI), que ha permitido estandarizar del método de referencia para la mayoría de los hongos filamentosos, y detectar especies intrínsecamente resistentes a los antifúngicos en estudio, con CIM más elevadas que lo habitual, asociadas a la falla terapéutica, aunque todavía no se hayan establecido puntos de corte para la evaluación clínica de los diferentes antifúngicos disponibles (7-12). De igual manera, se han desarrollado diferentes métodos comerciales, con resultados comparables a los de referencia y que permiten la realización de diferentes estudios clínicos relacionados con el conocimiento de la enfermedad micótica, la determinación de los perfiles de sensibilidad in vitro y la obtención de datos para elaborar los puntos de corte de uso clínico y detectar de la resistencia antifúngica. El uso de los métodos comerciales, como la técnica de E-test® (AB BioDisk, Solna, Sweden), por su facilidad en el montaje, y de la lectura de sus zonas de inhibición,
proporcionan una más amplia gama de CMI y, con resultados reproducibles, permiten establecer una asociación entre los perfiles de sensibilidad de los hongos miceliales y los resultados clínicos, aun cuando hasta el momento no esté clara la identificación de especies con CMI elevadas, la manifestación de la resistencia y el impacto de ella durante el manejo de la enfermedad infecciosa (9-17).
Este trabajo pretende determinar los perfiles de sensibilidad antifúngica y la actividad farmacológica relacionada de los diferentes agentes antimicóticos en estudio, de hongos miceliales obtenidos a partir de aislamientos clínicos en pacientes con cáncer del Instituto Nacional de Cancerología (INC) ESE.
Materiales y métodos
Aislamiento
Se estudiaron un total 81 cepas miceliales obtenidos de aislamientos clínicos de pacientes con cáncer e infección fúngica, atendidos en el INC, entre el periodo comprendido de 1999-2008 que habían sido previamente aisladas y conservadas en el cepario de micología (a - 70°C).
Recuperación e identificación de los géneros y especies
Identificación del género y especie micelial
Las cepas miceliales se recuperaron en Agar Saboreaud-Dextrosa (Merck, KGaA Darmstadt, Germany) (SAB) y Agar Papa-Dextrosa (Oxoid Ltd. Basingstoke, Hampshire, England) (PDA), realizando dos o más pases hasta lograr la estabilización del cultivo del hongo micelial. Se llevó a cabo nuevamente la identificación y confirmación de las cepas aisladas de acuerdo con las claves taxonómicas utilizadas habitualmente para hongos miceliales mediante las preparaciones con azul de lactofenol (E. Merck, Darmstadt) e identificación macroscópica y microscópica.
Los hongos miceliales se cultivaron en agar PDA, durante siete días a 35°C para inducir la esporulación, a excepción de las especies de Fusarium sp., que fue incubado a 35°C de 48-72 horas y luego pasado a 28°C hasta que completó los siete días.
Preparación del inóculo:
Se realizó una suspensión del hongo micelial y se ajustó espectrofotométricamente a las densidades ópticas que van desde 0,09 hasta 0,3 a 530 nm (82 a 60% de transmitancia), y que contenía en su mayor parte estructuras conidiales. La concentración final de la suspensión del inóculo fue de 0,4 X 104 a 5 X 104 UFC/ml; se incubó a 48 h a 28°C, y se verificó de la suspensión mediante un recuento cuantitativo de colonias en agar SAB (8,9).
Pruebas de Sensibilidad Antifúngica: Para la realización de las pruebas se tuvo en cuenta la metodología recomendada por el documento M38-A2 (8) del CLSI, de acuerdo con las recomendaciones del fabricante para la técnica de E-test (AB BIODISK)®. Para el control de calidad se utilizaron las cepas Candida parapsilosis ATCC 22019 y Candida krusei ATCC 6258 (8-10).
Se utilizaron como antifúngicos, tiras de E-test de voriconazol (VCZ), itraconazol (ITZ), anfotericina (AB) y Caspofungina (CAS). El gradiente de concentración de cada antimicótico varió desde 0,002 hasta 32 µg/ml. Las tiras se almacenaron a -70°C hasta el momento de su utilización.
Procedimiento de E-Test: se utilizó el agar RPMI 1640 con Dextrosa (Agar RPMI) (9-11). Cada caja de agar (de 150 mm que contenía 60 ml del medio) se inoculó con la suspensión del inóculo, usando un hisopo estéril, y estriando uniformemente en tres direcciones sobre toda la superficie del agar. ésta se dejó secar durante 15 minutos, y la tira fue colocada sobre el agar inoculado. Se evaluaron conjuntamente con los aislamientos, las cepas control de calidad Candida parapsilosis ATCC 22019 y Candida krusei ATCC 6258.
Las cajas se incubaron a 35 °C, y las CMI se determinaron a las siguientes 24 horas hasta los 4 días de incubación.
Lectura e interpretación de las CM: las CMI obtenidas correspondieron al punto en que la elipse de inhibición interceptó la escala de concentraciones de cada uno de los antifúngicos en estudio. La interpretación de los puntos de corte se basaron en la metodología de referencia, interpretando los puntos de corte de una serie de reportes de la literatura (4-6, 8,9). Para los antifúngicos VCZ, ITZ, AB y CAS se consideraron como Sensibles (S), CMI: <1 µg/ml, Sensibles Dependiente de Dosis (SDD), CMI: 2 µg/ml, y Resistentes (R), CMI: > 4 µg/ml. Dado que no existe consenso en el uso de puntos de corte de interpretación clínica, en general y especialmente en el método de E-test, para la discriminación de los verdaderamente resistentes, se optó por utilizar en su lugar el término de Sensibilidad Disminuida y se incluyeron los aislamientos considerados SDD y R (18).
Análisis de datos
Se llevó a cabo un estudio de tipo descriptivo de corte transversal, en el cual, para la grabación de los datos obtenidos de las CMI se diseñó una base de datos en formato Access, en la que se incorporaron reglas de validación. Para el análisis de los datos se efectuó una exportación de los mismos al programa Stata®. El análisis del componente descriptivo se fundamentó en el uso de proporciones y medias o medianas junto con las correspondientes medidas de dispersión (rangos intercuartílicos o desviaciones estándar). Para las CMI de los aislamientos se hallaron las medias geométricas (MG) de cada especie en los cuatro agentes antifúngicos y se establecieron los rangos de sensibilidad de la misma. Además, se determinaron los percentiles 50 (CMI50) y 90 (CMI90).
Para la frecuencia de resistencia, el numerador correspondió a la cantidad de casos de resistencia y el denominador al total de aislamientos de miceliales, resistente y no resistente dentro del periodo de estudio. Las medidas de frecuencia fueron expresadas junto con sus intervalos de confianza al 95%. Esta estrategia se aplicó tanto al agente antifúngico como a los diferentes tipos de hongos miceliales. En el componente analítico se utilizaron medidas estadísticas X2, y prueba exacta de Fisher dependiendo de las características de las tablas de antifúngicos. Con estas pruebas se observó y se evaluó la asociación entre variables categóricas (resistencia vs. tipo de antimicótico). En todos los casos se utilizaron niveles de significación del 5%.
Resultados
La tabla 1 muestra los géneros y especies de hongos miceliales recuperados y su frecuencia de aparición. Aspergillus fumigatus fue el agente etiológico predominante (44%), y Fusarium solani fue el principal hongo micelial no Aspergillus obtenido (11%). Los hongos miceliales en estudio provenían de diferente aislamientos clínicos: biopsias (n=29, 36%), lavados broncoalveolares (n=24, 30%), líquidos corporales (n=13, 16%), hemocultivos (n=7, 9%) y secreciones (n=8, 9%).
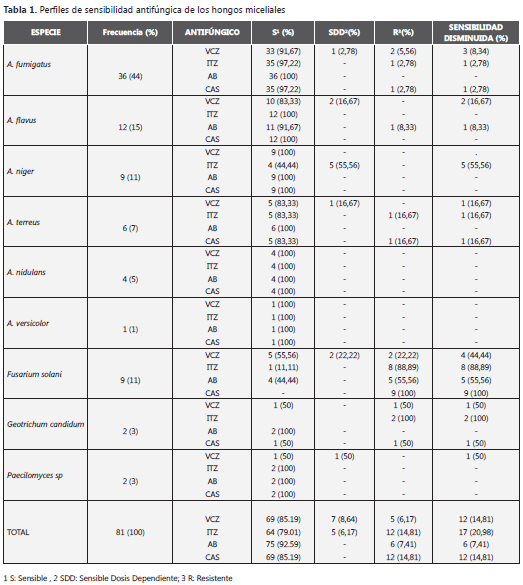
Perfiles de sensibilidad de los hongos miceliales
La tabla 1 muestra los perfiles de sensibilidad y resistencia a los antifúngicos ensayados. En general, tanto las especies miceliales Aspergillus y no Aspergillus presentaron una sensibilidad disminuida al VCZ e ITZ. Los mejores perfiles de sensibilidad los presentaron CAS y AB, a excepción de las especies de F. solani, A. fumigatus y A. terreus, cuyo comportamiento en general fue de sensibilidad disminuida con todos los agentes antimicóticos ensayados. Los patrones de sensibilidad disminuida fueron dependientes de la especie específica.
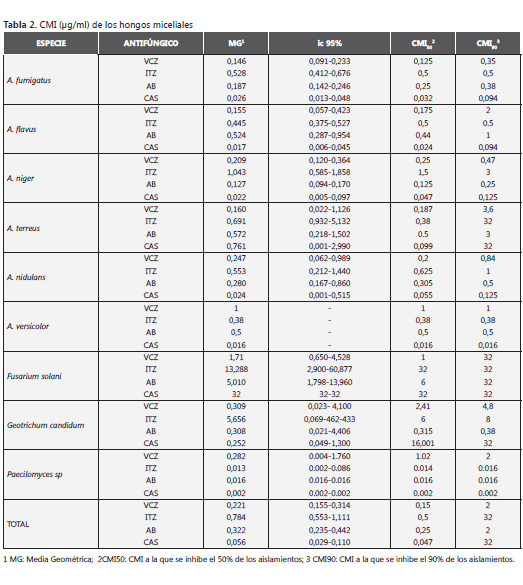
Actividad farmacológica, determinación E CMI 50 y CIM 90 de acuerdo con la especie micelial aislada
Al observar los diferentes agentes etiológicos estudiados, el perfil de sensibilidad y resistencia y la actividad farmacológica, se observó que: Para especies de Aspergillus, los fármacos más activos en su orden fueron CAS, VCZ y AB; la CAS fue el fármaco más activo con las especies de Aspergillus (CMI50 < 1 µg/ml), seguido de VCZ (CMI50 < 1 µg/ml). Para especies no Aspergillus, todos los agentes antifúngicos en estudio presentaron poca actividad frente a los aislamientos de F. solani (CMI90 > 32 µg/ml); la actividad farmacológica frente a Geotricum candidum y Paecilomyces sp. fue similar a la encontrada para las diferentes especies de Aspergillus (tabla 2).
Comparación de los perfiles de sensibilidad a los diferentes antifúngicos entre hongos del género Aspergillus y hongos miceliales no Aspergillus.
Para evaluar la existencia de algún tipo de asociación entre presencia de la resistencia al antifúngico y la especie de micelial aislado, se tomaron en cuenta los perfiles de S, SDD y R descritos en los materiales y métodos, y los aislamientos se dividieron en dos categorías; los miceliales pertenecientes al género Aspergillus (n=68; 84%) y los miceliales no Aspergillus (n=13; 14%) (tabla 3). Al realizar el correspondiente estudio estadístico se encontró asociación entre el tipo de micelial (Aspergillus vs micelial no Aspergillus) y su comportamiento en cuanto al perfil de sensibilidad.
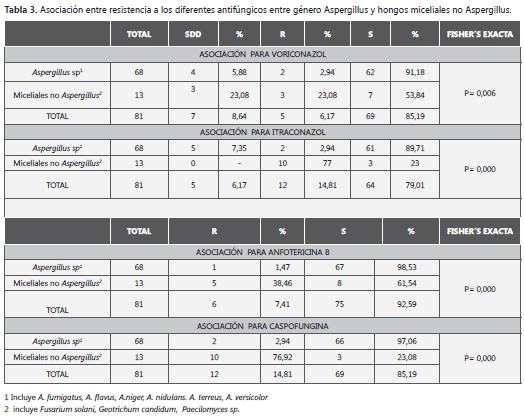
Se encontró una asociación entre el aislamiento de un micelial no Aspergillus y presencia de resistencia en el caso de VCZ (23,08% vs 2,94%) (Prueba exacta de Fisher = 0,006), ITZ (77% vs 2,94%) (Prueba exacta de Fisher = 0,000) y AB (38,46% vs 1,47%) (Prueba exacta de Fisher = 0,000). En el caso de la CAS se encontró una relación entre el aislamiento de una especie de Aspergillus y la presencia de resistencia (76,9 % vs 2,9%) (Prueba exacta de Fisher = 0,000).
Discusión
Desde la década de los ochenta, se ha documentado una mayor incidencia de infecciones invasivas asociadas a especies micóticas, especialmente en pacientes con algún tipo de inmunocompromiso, con un cambio en la epidemiologia microbiana y la aparición de nuevos patógenos, anteriormente considerados contaminantes o colonizantes, que rápidamente incrementan el porcentaje de aparición. Aunque el número de infecciones asociadas a especies miceliales es mucho menor que las causadas por hongos levaduriformes, su incidencia va en aumento, y cada vez se tienen más informes de especies miceliales que manifiestan una resistencia intrínseca o adquirida a los diferentes antimicóticos y su relación con las fallas de tratamiento y el aumento en las tasas de mortalidad de estos pacientes (23).
La utilidad de las pruebas de sensibilidad antifúngica se establece cuando su resultado puede definir la sensibilidad o resistencia de una especie micótica contra un agente antimicótico específico, de acuerdo con los puntos de corte de interpretación clínica. Con este resultado logran clasificar estas especies en tratables o no y ayudan a la predicción del resultado clínico en coordinación con una terapia antimicótica dirigida. Estos puntos de corte, que se establecen con base en los datos de estudios clínicos, los programas de vigilancia global de sensibilidad, el conocimiento de los mecanismos de resistencia y los parámetros farmacodinámicos y farmacocinéticos de los fármacos evaluados (4,5 19-22), ayudarían, dado el impacto de las EFI en la actualidad a predecir la respuesta a un tratamiento contra determinada especie de hongo causante de infección. En general, la determinación de la CIM de hongos miceliales es más complicada que la de hongos levaduriformes. Los factores que pueden influir en la funcionalidad de estas pruebas incluyen los aspectos del hospedero, muchos de los cuales tienen una inmunosupresión significativa, la asociación de la infección con especies poco habituales y escasas veces diagnosticadas por el laboratorio, que hace que existan insuficientes datos disponibles, además de la presencia de resistencia intrínseca a los antimicóticos y una frecuencia alta de falla de tratamiento (1, 2,23). éste uno de los primeros estudios colombianos que evalúa la pruebas de sensibilidad antifúngica de hongos miceliales de infecciones fúngicas en pacientes con cáncer, la relación con la actividad farmacológica de los diferentes agentes antifúngicos ensayados y la manifestación del fenómeno de sensibilidad disminuida.
El método de E-test tiene un valor potencial en las pruebas de sensibilidad para hongos miceliales patógenos. Aunque este método aún no tiene establecidos los puntos de corte de uso clínico, es útil para establecer las especies miceliales potencialmente resistentes, lo cual hace mucho más eficaz que el método de referencia, para el estudio sistemático de los agentes antifúngicos y su actividad frente a los diferentes hongos aislados, la evaluación in vivo-in vitro de la eficacia terapéutica y la predicción de una posible resistencia antifúngica (3,4,7). Convenientemente, este método ha sido adaptado en varios estudios con mohos y evaluado con diferentes agentes antifúngicos, puesto que las CMI obtenidas son fáciles de leer e interpretar. En general, la comparación de este método con los de referencia siempre han demostrado un buen porcentaje de acuerdo para los triazoles (> 90%) y AB (> 80%). Sin embargo, la fiabilidad del método de E-test y la relevancia clínica de las CMI para el estudio de los hongos miceliales de importancia aún debe determinarse porque no han sido aprobadas para el uso clínico, pues está limitado al campo de la investigación.
De acuerdo con los reportes de la literatura (17, 19, 20,23), A. fumigatus es el responsable de la mayoría (85 a 90%) de los diferentes manifestaciones clínicas de infecciones graves asociada a los hongos miceliales. Sin embargo, otras especies de Aspergillus, Fusarium sp. y otros mohos menos comunes, se han convertido en importantes agentes micóticos considerados como patógenos emergentes (23). En nuestro estudio, la especie de hongo micelial más aislado fue A. fumigatus (44%), seguido de A. flavus (15%), A. niger (11%), a partir de muestras de tracto respiratorio superior y biopsias de pulmón, datos que concuerdan con los reportes epidemiológicos internacionales. De igual manera, la especie micelial F. solani (11%) fue la predominante y principalmente asociada como agente causal de fungemia, previamente descrito por la literatura en pacientes con neoplasias hematológicas (23). El impacto de aislamientos de otros miceliales como Geotrichum candidum y Paecilomyces sp. no se estableció por el bajo número de sus aislamientos.
A pesar de la falta de los puntos de corte de interpretación clínica, para los hongos miceliales se han acumulado suficientes datos in vitro a lo largo de los años para permitir la definición del punto de corte epidemiológico en las especies de Aspergillus y los triazoles (21,22), lo que puede ayudar a evaluar los aislamientos clínicos mediante la identificación de cepas con sensibilidad disminuida y servir como mecanismo de alerta temprana de los nuevos cambios sutiles en los patrones de sensibilidad de estos organismos. Este estudio demostró, en general, todos los agentes antimicóticos presentaron perfiles de sensibilidad disminuida, con porcentajes diferentes a estudios similares (15, 21,22), ya sea por la especie micótica en estudio o el agente antifúngico. El porcentaje de sensibilidad disminuida mayor fue para el ITZ (20,98%) seguido de VCZ (14,81%) y CAS (12,81%), la AB (7,41%) presentó el porcentaje de sensibilidad disminuida menor. En relación con la especie aislada, y a diferencia de estudio similares (17, 19- 22), las especies de Aspergillus presentaron sensibilidad disminuida al VCZ (A. fumigatus 8,34%, A. flavus 16,67%, A. terreus 16,67%), al ITZ (A. fumigatus 2,78%, A. niger 55,56%, A. terreus 16,67%), a la CAS (A. fumigatus 2,78%, A. terreus 16,67%) e incluso a la AB (A. flavus 8,33%). Es de anotar que, a diferencia de estos estudios, nuestros aislamientos de A. terreus no presentaron una sensibilidad disminuida a la AB, con patrones de sensibilidad diferentes y que ameritarían otro tipo de análisis. Al revisar las otras especies miceliales, y de acuerdo con los diferentes trabajos relacionados (4,11,15,17), es frecuente la multiresistencia asociada a especies de Fusarium (VCZ 44.44%, ITZ 88,89%, AB 55,56%, CAS 100%); De igual manera, debido a la escasez de datos de estudios similares, y el bajo número de aislamientos, no se estableció una comparación con las otras especies miceliales (G. candidum y Paecilomyces sp.).
En cuanto a la actividad farmacológica in vitro de los diferentes agentes antifúngicos ensayados y el establecimiento del perfil de sensibilidad de cada uno de ellos, se determinó un comportamiento diferente con relación especie-específica. En general, los fármacos que presentaron mejor actividad, en su orden, fueron: CAS (CMI: 0,056 µg/ml), VCZ (CMI: 0,221 µg/ml), AB (CMI: 0,322 µg/ml) e ITZ (CMI: 0,784 µg/ml), resultados similares a los de otros reportes de actividad farmacológica (15). De acuerdo con la especie de Aspergillus y su comportamiento frente a los diferentes fármacos ensayados tenemos que: la CAS fue el más activo para la mayoría de las especies estudiadas (A. fumigatus, CMI: 0,026 µg/ml; A. flavus, CMI: 0,017 µg/ml y A. niger, CMI: 0,022 µg/ml). Aun cuando reportes similares (15,17,19,20) establecen que el fármaco más activo fue el VCZ (A. fumigatus, CMI: 0,146 µg/ml; A. flavus, CMI: 0,155 µg/ml; A. niger, CMI: 0,209 µg/ml, A. terreus, CMI: 0,160 µg/ml). La actividad farmacológica de especies diferentes a Aspergillus fue similar a la reportada en la literatura, como en el caso de F. solani con CMI90 >32 µg/ ml. Para todos los antifúngicos en estudio y los otros miceliales estudiados, la escasez de datos relacionados hace difícil establecer la actividad farmacológica asociada.
De acuerdo con los reportes de la literatura, el VCZ tiene buena actividad in vitro sobre las especies de Aspergillus y es el tratamiento de elección en el manejo de las EFI asociadas a estas especies. Aunque nuestro estudio mostró variaciones entre las CMI de las diferentes especies, la tendencia a CMI50 < 1 µg/ml, aunque con actividad farmacológica variable, que podrían afectar la interpretación de los perfiles de sensibilidad, en general concuerdan con los estudios internacionales realizados con estos hongos miceliales (1, 15, 17). La literatura también reporta que el espectro de actividad de este agente antifúngico, es uno de los más amplios, frente a otros hongos filamentosos, y fue aprobado como tratamiento de rescate en infecciones causadas por Fusarium sp. y en pacientes con aislamientos de cepas resistentes a otros antifúngicos (11,15,23), datos coincidentes con nuestros resultados en los que F. solani (MG: 1,71 µg/ml) fue el más activo de todos los agentes antimicóticos ensayados.
Aunque, según diversos estudios, la resistencia a los triazoles no es común entre especies de Aspergillus, han sido reportados especialmente para el ITZ (5). Deacuerdo con varios trabajos (13,19), el ITZ tiene una aceptable actividad in vitro frente a especies de Aspergillus. Nuestro estudio confirma dicha actividad farmacológica con CMI50 < 0.5 µg/ml ; y actividades farmacológicas aceptables en relación con los otros antifúngicos y especies estudiadas. Frente a los aislamientos de Fusarium sp., este triazol presentó CMI elevadas, y pobre actividad (5, 6,10). Estos estudios también han demostrado que el tipo de resistencia o sensibilidad disminuida que tienden a presentar especies de Fusarium sp. a este antifúngico es intrínseca; mientras que la asociada a especies de Aspergillus se asocia a los antecedentes de tratamiento antimicótico (3,5).
Nuestros resultados sugieren que la técnica de E-test permite la discriminación in vitro de la actividad de AB en miceliales. Se han reportado cepas miceliales resistentes a la AB, con CMI altas (CMI > 2 µg/ml), para un variedad de hongos filamentosos (por ejemplo, Paecilomyces lilacinus, Scedosporium apiospermum, S. prolificans, algunas especies de Aspergillus, especialmente A. terreus y A. ustus, Alternaria spp., Fusarium spp., Penicillium marneffei, Phialophora spp., y Sporothrix schenckii) (5). Se debe ser consciente de que es importante conocer aquellos hongos miceliales que tienen una resistencia intrínseca a la AB, al tiempo que deben establecerse CMI de los aislamientos locales. Hay informes de establecen el desarrollo de resistencia de A. fumigatus, aunque poco frecuente y clínicamente incierta (15) y la resistencia intrínseca de especies Aspergillus (por ejemplo A. terreus), que suelen ser susceptibles a los triazoles más recientes. Nuestro estudio con CMI50 < 0.5 µg/ml determina la buena actividad de este fármaco frente a especies de Aspergillus (3,4) incluso para los aislamientos de A. terreus. Las pruebas realizadas, en general, demostraron una buena actividad farmacológica tanto para los hongos filamentosos Aspergillus sp. como para los no Aspergillus (CMI50 0,09 µg/ ml) con excepción del F. solani (CMI50 32 µg/ml) y G. candidum (CMI50 µg/ml). Sin embargo, aunque los reportes establecen el aumento de su frecuencia en pacientes con malignidades hematológicas, estudios de correlación in vitro-in vivo de los casos de AI tratados con AB siguen siendo limitados, y los datos obtenidos de pacientes con cáncer y AI no han podido demostrar el significado de la sensibilidad in vitro y su eficacia clínica (6).
Recientemente el E-test ha sido evaluado para detectar la sensibilidad disminuida de cepas de A. fumigatus a CAS (6). Se ha demostrado que caspofungina no sólo inhibe el crecimiento in vitro de aislamientos de Candida spp. sino de especies miceliales como Aspergillus sp., Alternaria sp., Curvularia sp., Scedosporium sp., Acremonium sp., Bipolaris sp. y Trichoderma sp. Sin embargo, a diferencia de las CMI, la determinación de la Concentración Mínima Efectiva (MEC) ha probado ser una alternativa más práctica para evaluar la sensibilidad de los miceliales a este agente antifúngico (17,19, 20). Entre las especies miceliales, las equinocandinas son generalmente utilizadas para el tratamiento de las infecciones por Aspergillus sp., y su eficacia ha sido demostrada en estudios de casos de terapia de salvamento. Y aunque se ha reportado la capacidad de la CAS para reducir el crecimiento in vitro de varias de estas especies, aún no existen patrones de sensibilidad estandarizados que puedan ayudar a optimizar la terapia. Las equinocandinas tienden a ser el principal grupo de antifúngicos para ser utilizado en terapia de combinación antifúngica contra hongos miceliales. Aunque no es el tema de esta discusión, hay cada vez más informes de las terapias combinadas con equinocandinas donde que han demostrado una considerable sinergia in vitro, y su utilidad para el manejo de infecciones difíciles por hongos miceliales (4). Nuestro estudio comprobó la buena actividad farmacológica de este agente antifúngico (CMI50 < 0.5 µg/ml), frente a todas las especies de Aspergillus, aun por encima del VCZ, y con los porcentajes de sensibilidad disminuida más bajos. Otros miceliales como F. solani (CMI50 >32 µg/ml) demuestran, por el contrario, la poca actividad, común a todos los agentes antifúngicos frente a estas especies miceliales. El comportamiento de los otros hongos miceliales fue similar al de las especies de Aspergillus.
Finalmente, este estudio trató de establecer si existía algún tipo de asociación entre el aislamiento de una especie micelial (Aspergillus vs no Aspergillus) y presencia de resistencia. En nuestro caso, para el VCZ (23,08% vs 2,94%, Prueba exacta de Fisher = 0,006), el ITZ (77% vs 2,94%, Prueba exacta de Fisher = 0,000) y AB (38,46% vs 1,47%, Prueba exacta de Fisher = 0,000) mostró una relación estadísticamente significativa entre el aislamiento de un micelial no Aspergillus y la manifestación de la resistencia in vitro. En el caso de la se CAS encontró una relación entre el aislamiento de una especie de Aspergillus y la presencia de resistencia (76,9 % vs 2,9%, Prueba exacta de Fisher = 0,000). Aun cuando no se encontraron estudios similares que mostraran este tipo de asociaciones, en los diversos trabajos consultados sí demuestran que las especies miceliales no Aspergillus tienden a la multi-resistencia asociada a los triazoles y la AB (5-7,11,14), aunque no se estableció el impacto clínico y epidemiológico de la presencia de resistencia de especies de Aspergillus a la CAS.
En conclusión, nuestro estudio determinó, que los perfiles de sensibilidad y resistencia, así como los patrones de sensibilidad disminuida, frente a los agentes antifúngicos estudiados, es diferente, con una tendencia epidemiológica y una relación especie-específica en la que la actividad farmacológica suele tener un comportamiento diferente a los reportados en diversos estudios y que puede deberse, entre otras razones, al tipo de paciente en estudio. Estos resultados demuestran la necesidad de individualizar la terapia antimicótica, de acuerdo con el agente etiológico aislado, como base el uso de pruebas de sensibilidad antifúngica, y la elaboración de patrones locales de sensibilidad disminuida y el estudio de los reportes internacionales relacionado, por lo que esta pruebas se constituyen en una herramienta importante a la hora de apoyar la terapia antimicótica dirigida.
Conflicto de intereses No hay conflictos de interés que señalar por parte de los autores.
Financiación El presente trabajo se realizó con el apoyo del Instituto Nacional de Cancerología, ESE.
Correspondencia: Pilar Rivas. Grupo de Micología Médica, Facultad de Medicina, Universidad Nacional de Colombia, Calle 45, carrera 30, Ciudad Universitaria, Bogotá, D.C., Colombia. Tel.: (57) 1 3165000 Ext. 15016-15172. pilyrivasp@yahoo.com
Referencias
1. Ascioglu S, Rex JH, de Pauw B, Bennett JE, Bille J, Crokaert F, et al. Defining opportunistic invasive fungal infections in immunocompromised patients with cancer and hematopoietic stem cell transplants: an international consensus. Clin Infect Dis. 2002 Jan 1;34(1):7-14. [ Links ]
2. De Pauw B, Walsh TJ, Donnelly JP, Stevens DA, Edwards JE, Calandra T, et al. Revised definitions of invasive fungal disease from the European Organization for Research and Treatment of Cancer/Invasive Fungal Infections Cooperative Group and the National Institute of Allergy and Infectious Diseases Mycoses Study Group (EORTC/MSG) Consensus Group. Clin Infect Dis. 2008 Jun 15;46(12):1813-21. [ Links ]
3. Lass-Flörl C, Perkhofer S, Mayr A. In vitro susceptibility testing in fungi: a global perspective on a variety of methods. Mycoses 2010 Jan; 53: 1-11. [ Links ]
4. Forrest G. Role of antifungal susceptibility testing in patient management. Curr Opin Infect Dis 2006; 19: 538-43. [ Links ]
5. Espinel-Ingroff A. Mechanisms of resistance to antifungal agents: Yeasts and filamentous fungi. Rev iberoam Micol. 2008; 25: 101-106. [ Links ]
6. Espinel-Ingroff A, Canton E, Peman J. Updates in Antifungal Susceptibility Testing of Filamentous Fungi. Current Fungal Infection Reports 2009; 3:133-141. [ Links ]
7. Arikan S. Current status of antifungal susceptibility testing methods Med Mycol. 2007 Nov;45(7):569-87. [ Links ]
8. Clinical and Laboratory Standards Institute. Reference method for broth dilution antifungal susceptibility testing of filamentous fungi. Approved Standard, edn 2; Document M38-A2. Wayne, PA: National Committee for Clinical Laboratory Standards; 2008. [ Links ]
9. AB BIODISK. E-Test technical guide 4b: antifungal susceptibility testing of molds. Suiza. ABBIODISK.com; 2007. [ Links ]
10. Pfaller MA, Castanheira M, Diekema DJ, Messer SA, Moet GJ, Jones RN. Comparison of European Committee on Antimicrobial Susceptibility Testing (EUCAST) and E-test methods with the CLSI broth microdilution method for echinocandin susceptibility testing of Candida species. J Clin Microbiol. 2010 May;48(5):1592-9. [ Links ]
11. Espinel-Ingroff A. Comparison of the E-test with the NCCLS M38-P Method for Antifungal Susceptibility Testing of Common and Emerging Pathogenic Filamentous Fungi. J Clin Microbiol. 2001 Apr; 39(4):1360-1367. [ Links ]
12. Espinel-Ingroff A, Rezusta A. E-Test Method for Testing Susceptibilities of Aspergillus spp. To the New Triazoles Voriconazole and Posaconazole and to Established Antifungal Agents: Comparison with NCCLS Broth Microdilution Method. J Clin Microbiol. 2002 June;40(6):2101-07. [ Links ]
13. Pfaller JB, Messer SA, Hollis RJ, Diekema DJ, Pfaller MA. In vitro susceptibility testing of Aspergillus spp.: comparison of Etest and reference microdilution methods for determining voriconazole and itraconazole MICs. J Clin Microbiol 2003, 41:1126-1129. [ Links ]
14. Serrano MC, Ramirez M, Morilla D, et al.: A comparative study of the disc diffusion method with the broth microdilution and Etest methods for voriconazole susceptibility testing of Aspergillus spp. J Antimicrob Chemother 2004, 53:739-742. [ Links ]
15. Sabatelli F, Patel R, Mann PA, Mendrick CA, Norris CC, Hare R, et al. In vitro Activities of Posaconazole, Fluconazole, Itraconazole, Voriconazole, and Amphotericin B against a Large Collectionof Clinically Important Molds and Yeasts. Antimicrob Agents Chemother, 2006 Jun; 50(6):2009-2015. [ Links ]
16. Messer SA, Diekema DJ, Hollis RJ, Boyken LB, Tendolkar S, Kroeger J, et al. Evaluation of disk diffusion and Etest compared to broth microdilution for antifungal susceptibility testing of posaconazole against clinical isolates of filamentous fungi. J Clin Microbiol 2007; 45: 1322-1324. [ Links ]
17. Espinel-Ingroff A, Arthington-Skaggs B, Iqbal N, Ellis D, Pfaller MA, Messer S, et al. Multicenter Evaluation of a New Disk Agar Diffusion Method for Susceptibility Testing of Filamentous Fungi with Voriconazole, Posaconazole, Itraconazole, Amphotericin B, and Caspofungin J Clin Microbiol, 2007 June 2007;45(6): 1811-1820. [ Links ]
18. Durán MT, Velasco D, Canle D, Moure R, Villanueva R. Susceptibilidad antifúngica de aislados de Candida spp. de hemocultivos en un periodo de cinco años (1997-2001). Enferm Infecc Microbiol Clin 2003;21(9):488-92. [ Links ]
19. Diekema DJ, Messer SA, Hollis RJ, Jones RN, Pfaller MA. Activities of caspofungin, itraconazole, posaconazole, ravuconazole, voriconazole, and amphotericin B against 448 recent clinical isolates of filamentous fungi. J Clin Microbiol. 2003 Aug;41(8):3623-6. [ Links ]
20. Pfaller MA, Boyken L, Hollis RJ, Kroeger J, Messer A, Tendolkar S, et al. In vitro Susceptibility of Clinical Isolates of Aspergillus spp. To Anidulafungin, Caspofungin, and Micafungin: a Head-to-Head Comparison Using the CLSI M38-A2 Broth Microdilution Method. J Clin Microbiol. 2009 Oct; 47(10):3323-25. [ Links ]
21. Baddley JW, Marr KA, Andes DR, Walsh TJ, Kauffman CA, Kontoyiannis DP, et al. Patterns of susceptibility of Aspergillus isolates recovered from patients enrolled in the Transplant-Associated Infection Surveillance Network. J Clin Microbiol. 2009 Oct;47(10): 3271-5. [ Links ]
22. Pfaller MA,. Diekema DJ, Ghannoum MA, Rex JH,Alexander BD, Andes D, et al. Wild-Type MIC Distribution and Epidemiological Cutoff Values for Aspergillus fumigatus and Three Triazoles as Determined by the Clinical and Laboratory Standards Institute Broth Microdilution Methods. J Clin Microbiol 2009 Oct;47(10): 3142-3146. [ Links ]
23. Prentice AG, Glasmacher A, Hobson RP, Schey S, Barnes RA, Donnelly JP, et al. Guidelines on the management of invasive fungal infection during therapy for haematological malignancy. British Committee for Standards in Haematology. London: 2007. [ Links ]














