Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Infectio
Print version ISSN 0123-9392
Infect. vol.14 suppl.2 Bogotá Dec. 2010
1 Facultad de Medicina, Universidad Nacional de Colombia, sede Bogotá.
2 Grupo de Infectología, Instituto Nacional de Cancerología, Empresa Social del Estado (ESE).
3 Integrantes del grupo elaborador de la "Guía de práctica clínica para el diagnóstico y tratamiento de la neutropenia febril en pacientes oncológicos mayores de 15 años", del Instituto Nacional de Cancerología, Empresa Social del Estado.
Recibido: 09/07/2010; Aceptado: 19/08/2010
Resumen
El género Aspergillus es ubicuo en la naturaleza y de distribución universal. Por esta razón, el contacto con este hongo incluye hospederos inmunocompetentes e inmunosuprimidos. La vía aérea es la forma más frecuente de adquirir este hongo y sus manifestaciones clínicas y localización topográfica se relacionan con la interacción del hongo y la capacidad inmunológica del hospedero. La principal manifestación clínica de este hongo es a nivel respiratorio, con un impacto muy importante en mortalidad y morbilidad, especialmente en el paciente inmunosuprimido.
Los pacientes con tumores hematológicos, trasplantes de corazón, pulmón y con sida son más susceptibles de presentar invasión tisular y vascular por este hongo, que en tales casos se manifiesta como Aspergilosis Invasora (AI). La AI ofrece dificultades diagnósticas en el hospedero inmunosuprimido por lo que en este grupo de pacientes el uso de métodos de diagnóstico no invasores permite guiar el abordaje terapéutico.
En la actualidad se dispone de medicamentos antifúngicos del grupo de los azoles (voriconazol) y de las equinocandinas (caspofungina) que han mejorado el resultado de la AI. En este artículo se actualiza la literatura en cuanto al diagnóstico y tratamiento de la AI.
Palabras Claves: Aspergilosis Invasora, inmunosupresión, diagnóstico, tratamiento.
Abstract
The genus Aspergillus is ubiquitous in nature and has universal distribution; for this reason contact with this fungus includes immunocompetent and non-immunocompetent hosts. The most common form of acquiring this fungus is through air, and its clinical manifestations and topographic location correspond to the interaction of the fungus and its host's immune capacity. The main clinical manifestation of this fungus is a breathing condition and has a very significant impact on mortality and morbidity, especially in non-immunocompetent patients. Patients with haematological malignancies, heart or lung transplant surgeries, and AIDS are the most susceptible to present tissue and vascular invasion by this fungus in the form of invasive aspergillosis (IA). The IA presents diagnostic difficulties in non-immunocompetent hosts; therefore using non-invasive diagnosis methods for this group of patients offers therapeutic approach guidance.
Antifungal drugs such as azoles (voriconazole) and echinocandins (caspofungin), that have improved the AI group results, are available nowadays. This article updates the literature on AI diagnosis and treatment.
Keyword: Invasive Aspergillosis, non-immunecompetent, diagnosis, treatment
Introducción
Aspergillus spp ha emergido como una de las infecciones que pone en peligro la vida de pacientes inmunosuprimidos, como aquellos con neutropenia prolongada, infección por VIH avanzada, inmunodeficiencia heredada o sometidos a trasplante alogénico de células madre, de pulmón y de corazón. El objetivo de esta revisión es presentar información general y relevante para el médico clínico que le permita prever una infección por Aspergillus en pacientes de alto riesgo, conocer las herramientas diagnósticas disponibles en nuestro medio y acercarse al tratamiento antifúngico más apropiado.
¿Cómo y en dónde se encuentra Aspergillus?
El género Aspergillus fue reconocido inicialmente en 1729 por Micheli en Florencia, Italia. Es un organismo filamentoso anamórfico (asexual) que se reproduce por esporas llamadas conidias, aunque se han descrito formas teleomórficas (sexuales) en A. nidulans, A. fumigatus y A. amstelodam.
Es un organismo de distribución ubicua, se encuentra en el agua, el suelo, el aire, el material en descomposición y otras localizaciones (1,2).
En la naturaleza se han hallado aproximadamente 250 especies pertenecientes a siete subgéneros.
Aspergillus fumigatus se aísla entre el 70 y el 90% de las muestra clínicas, A. flavus en 14% y otras especies como A. terreus y A. niger se reportan hasta en 5% (2,3).
Algunas características particulares pueden ayudar en la identificación de especies. Por ejemplo, A. terreus presenta resistencia intrínseca a varios antimicóticos, especialmente a anfotericina B; A. niger es un colonizante común y puede causar infecciones superficiales tales como otitis externa; y A. flavus se encuentra con relativa frecuencia en casos de sinusitis, infecciones en la piel y en Aspergilosis Invasora (AI) (1,4).
¿Cómo interactúa Aspergillus con el hospedero?
La ruta usual de la infección por Aspergillus es por vía aérea, por la inhalación de las conidias hasta el pulmón. El tiempo de germinación es variable, desde dos días hasta incluso meses de acuerdo con la especie.
La primera línea de defensa del hospedero es el aclaramiento ciliar y la fagocitosis por parte de los macrófagos alveolares que, luego de la ingestión, proceden a la eliminación de las conidias mediante la activación de la enzima NADPH oxidasa que activa la cascada de radicales libres de oxígeno y genera la eliminación dentro del fagosoma. A a este nivel se han encontrado moléculas como los receptores de reconocimiento de patógenos (RRP), que identifican proteínas de la pared celular durante la fase conidial y micelial y activan procesos tales como fagocitosis, liberación de citocinas locales proinflamatorias, reagrupamiento de neutrófilos activados, e inician la subsiguiente inmunidad antígeno específica; se han reportado muchos de estos RRP dentro de los cuales están: receptores parecidos a Toll (TLR-2 y 4), dectina 1, pentraxina 3, proteina del surfactante A y D (SP-A y SP-D), lectina ligadora de manosa (MLB) y factores de diferenciación mieloide (MyD88) (1, 5,6, 7,10).
Posteriormente, la inmunidad específica contribuye a la defensa contra especies de Aspergillus.
Se ha encontrado en modelos animales que los casos en los que predomina la respuesta Th1 con producción de INF-γ se asocian con aumento en la sobrevida, mientras que aquellos en los cuales predomina la respuesta Th2 con producción de IL-4,5 y 13, unos se relacionan con alergia y otros con menor sobrevida. Aún se desconoce cómo se activa cada una de estas respuestas. Se han postulado a las células T reguladoras y a las células dendríticas (1,6,10).
¿Cuáles son las principales manifestaciones clínicas de Aspergillus?
El espectro clínico de la aspergilosis es amplio. Abarca las reacciones alérgicas, la colonización asintomática, la infección superficial y la enfermedad invasora. La presentación clínica depende del estado inmune del hospedero y de los factores de riesgo asociados que presente; en la medida en que progrese la inmunosupresión será más probable presentar enfermedad invasora (1).
Manifestaciones alérgicas
- Aspergilosis broncopulmonar alérgica.
Consiste en una respuesta alérgica crónica a Aspergillus. La incidencia es de 1-2% en pacientes con asma y de 7% en pacientes con fibrosis quística. Se caracteriza por presentar remisiones y exacerbaciones; a largo plazo y sin tratamiento puede progresar a fibrosis pulmonar. Para su diagnóstico se han propuesto siete criterios mayores: 1 Asma, 2 Eosinofilia periférica, 3 Reactividad cutánea inmediata al antígeno de Aspergillus spp., 4 Concentraciones elevadas de la Ig E total sérica, 5 Concentraciones séricas elevadas de anticuerpos IgG, IgE contra Aspergillus, 6 Infiltrados pulmonares temporales o permanentes, y 7 Bronquiectasias centrales.
Entre los criterios menores que pueden reforzar el diagnóstico se encuentran: detección repetida de Aspergillus spp en muestras de esputo, antecedente de expectoración de tapones de moco de color pardo y reactividad cutánea tardía al Aspergillus (1,2,4).
- Otras manifestaciones alérgicas.
La sinusitis alérgica por Aspergillus se presenta en pacientes adultos jóvenes con antecedente de asma o rinitis alérgica, pólipos nasales crónicos y opacificación en los senos paranasales (1,2).
Formas crónicas y saprófitas
- Aspergiloma pulmonar
Una bola de hongos secundaria a Aspergillus (aspergiloma) consiste en un conglomerado sólido de hifas de Aspergillus, fibrina, moco y residuos celulares que crece en una cavidad pulmonar preexistente, predomina en los ápices pulmonares y se asocia con una neumopatía subyacente como: tuberculosis, sarcoidosis, enfisema buloso, histoplasmosis, quistes congénitos o abscesos pulmonares bacterianos. En muchos pacientes permanece como una lesión asintomática; sin embargo, puede ocasionar hemoptisis potencialmente fatal, que es la complicación más grave. El diagnóstico es clínico y radiológico; la imagen es una masa redonda sólida, a veces móvil, de densidad similar al agua, dentro de una cavidad, separada de la pared de ésta por un espacio de aire (signo de la luna creciente) (1,4,7).
- Otras formas crónicas o saprófitas.
La aspergilosis pulmonar crónica cavitaria (APCC) se ha clasificado de diversas formas, sin tener claro el significado académico, terapéutico o pronóstico, y consiste en la presencia de múltiples cavidades que pueden o no contener un aspergiloma asociado con síntomas pulmonares, sistémicos y aumento de marcadores inflamatorios.
La otomicosis es un proceso saprófito que compromete el canal auditivo externo. Los síntomas son prurito, dolor, hipoacusia y otorrea. Se presenta en pacientes con deficiencias inmunes variables como diabetes mellitus, eczema crónico, hipogamaglobulinemia, infección por VIH, tratamiento con corticoides. El germen etiológico más común es A. niger o A. fumigatus (1).
Aspergilosis invasora (AI)
La AI se presenta en pacientes con factores de riesgo dentro de los cuales están: neutropenia prolongada (más de diez días), trasplante alogénico de células madre hematopoyéticas, trasplante de órgano sólido (especialmente pulmón, en el caso de traqueobronquitis), neoplasias hematológicas (leucemia mieloide aguda y síndrome mielodisplásico), y enfermedad injerto contra hospedero (4,7).
- Aspergilosis pulmonar invasora (API)
Se trata de la manifestación más común de la AI. Los síntomas (tos, disnea, dolor pleurítico, fiebre), los hallazgos en el examen físico y los resultados paraclínicos son inespecíficos; el pronóstico y la sobrevida están determinados por la prontitud en el diagnóstico y la rapidez en el inicio de tratamiento eficaz, razón por la cual, se requiere un alto índice de sospecha clínica. La organización europea para la investigación en el tratamiento del cáncer estableció unas categorías diagnósticas para AI que serán referidas posteriormente (8).
La mortalidad asociada a la API está entre el 60-90%, dependiendo de la condición de base del paciente. Un aspecto primordial para la recuperación del paciente es restablecer la función inmune, por lo que se debe disminuir la dosis de esteroides y de inmunosupresores hasta donde sea posible (1).
- Traqueobronquitis
El espectro clínico de la traqueobronquitis se puede dividir en cinco clases: colonización, bronquitis, traqueobronquitis obstructiva, traqueobronquitis pseudomembranosa y traqueobronquitis ulcerativa (7). Es más común en pacientes con sida y en trasplante de pulmón; los síntomas son tos, disnea, fiebre, hemoptisis y dolor torácico; los objetivos del tratamiento, son prevenir la ruptura de la sutura y la pérdida del pulmón trasplantado.
- Aspergilosis cerebral
Es una forma de Al extrapulmonar en la cual el compromiso cerebral es la complicación más temida porque la mortalidad es superior al 90%. El diagnóstico frecuentemente no se sospecha y es difícil de realizar, debido a que se necesita una biopsia para confirmarlo y, dadas las condiciones del paciente, este procedimiento es complicado. Los síntomas son cefalea, convulsiones, déficit focal; los hallazgos por imagen son inespecíficos. Se requiere una intervención diagnóstica y terapéutica intensiva. Es posible limitar el daño neurológico con el reconocimiento y el tratamiento precoces (1,4,5).
- Otras formas de Aspergilosis invasora
Existe compromiso de cualquier órgano en un episodio de AI. Entre los reportados se encuentran: senos paranasales, óseo (osteomielitis y artritis séptica), piel, corazón (endocarditis, miocarditis y pericarditis), riñón, aparato gastrointestinal, ojo (endoftalmitis), peritoneo (1,2,5).
índice de mortalidad de la Aspergilosis invasora
La AI afecta principalmente a los pacientes inmunosuprimidos. A pesar de la disponibilidad de nuevos tratamientos antimicóticos, cerca de la mitad de los pacientes inmunosuprimidos con AI no responde y el 30% muere a las 12 semanas de iniciado el tratamiento. Los pacientes inmunosuprimidos por trasplante alogénico de médula ósea, con sida y críticamente enfermos se encuentran entre los más susceptibles para desarrollar AI (11).
Nivoix y colaboradores, muestran en un estudio retrospectivo de pacientes con cáncer y diagnóstico de AI probada o probable que a las doce semanas de haber iniciado tratamiento antimicótico, los factores de mortalidad atribuible a la AI que tuvieron significación estadística en el análisis multivariado, fueron:
1 Antecedente de trasplante alogénico de células progenitoras o trasplante de órgano sólido;
2 Progresión de la enfermedad de base;
3 Dosis de corticoides ≥0,2 mg/Kg en el día uno del diagnóstico de AI;
4 Depuración de creatinina < 30 ml/min;
5 AI diseminada; 6 Compromiso pulmonar difuso; y,
7 Neutropenia < de 500 (12).
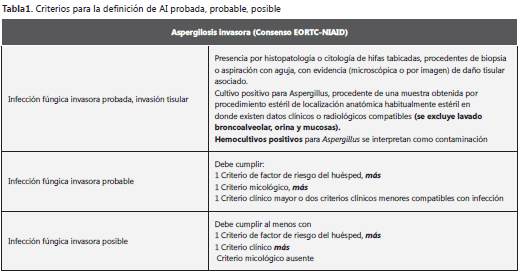
Algunos de los factores predictores de mortalidad identificados en este estudio y otros modificados se consideran en los criterios de definición de la EORTC/MSG para la clasificación de la AI en probada, probable y posible.
Igualmente, la identificación de los factores predictores de muerte ayuda a reconocer pacientes que se pueden beneficiar de estrategias terapéuticas más agresivas. La iniciación del tratamiento en AI clasificada como posible, mejora los resultados de sobrevida y estos factores pueden sustentar el desarrollo de estrategias terapéuticas anticipadas para llenar el vacío entre la terapia empírica y el tratamiento dirigido (12).
¿Cómo se diagnóstica la Aspergilosis invasora?
De las enfermedades causadas por las especies de Aspergillus, la AI es la principal y la más difícil de determinar. La rapidez en el diagnóstico es fundamental, pues permite un porcentaje de supervivencia más alto y la posibilidad del inicio de un tratamiento antifúngico específico. A continuación se presentan las principales herramientas diagnósticas disponibles.
Pruebas microscópicas directas
Se basan en la identificación de estructuras micóticas (para el caso de Aspergillus de micelios) a partir de preparaciones en fresco y coloraciones microbiológicas con KOH, Gram, Giemsa. La principal ventaja de estas pruebas es la relativa rapidez del diagnóstico y la principal desventaja la baja sensibilidad y especificidad, porque en la mayoría de los casos no se puede identificar la especie del hongo, y el diagnóstico diferencial con otros hongos miceliales es amplio, por ejemplo con Penicillium spp. y Scedosporium spp., además de que con estas pruebas no es posible discriminar la capacidad de invasión tisular (13-15).
Cultivo
Aunque Aspergillus spp. puede recuperarse en la mayoría de medios de cultivo de rutina tanto sólidos como líquidos (por ejemplo, agar sangre, agar chocolate, caldo BHI), se debe incluir un medio de cultivo selectivo al momento de la siembra inicial, como el Agar Sabouraud- Dextrosa, ante la sospecha clínica de infección asociada a Aspergillus spp., o de otros mohos (15). La desventaja principal de los cultivos es el tiempo de crecimiento fúngico, que está genéticamente determinado y puede tardar varios días, y presenta diferencias entre las especies y la experticia necesaria para la identificación de ellas. La capacidad de crecer a 37°C diferencia las especies de Aspergillus de los mohos saprófitos ambientales (15,16).
Pruebas de susceptibilidad antifúngica
En la actualidad se ha generado un interés particular en las pruebas de sensibilidad in vitro para los hongos filamentosos, ya que su uso permite establecer tanto la actividad farmacológica adecuada, como las concentraciones mínimas inhibitorias (CMI) de los fármacos de elección para una terapia dirigida.
Se sabe que tanto la actividad farmacológica in vitro de los diferentes antifúngicos como su perfil de sensibilidad y resistencia tienen un comportamiento diferente especie-específica. En estudios realizados se ha establecido que el voriconazol presenta una buena actividad in vitro sobre las especies de Aspergillus spp., aun cuando presentan variaciones entre las CMIs de las diferentes especies, su tendencia es a una CMI 50 < 1 μg/ml. Estudios realizados en Colombia concuerdan con otros estudios similares a escala mundial. La experiencia en pacientes con cáncer muestra que las especies causantes de AI presentan sensibilidad disminuida a varios antifúngicos, por ejemplo, 100% al itraconazol; 16,8% a la Anfotericina B; 16,7% a la Caspofungina y 33,3% al voriconazol. Igualmente, la actividad farmacológica es especie-específica. En relación con la actividad de los fármacos se ha encontrado que en orden de mayor a menor actividad se encuentran: Caspofungina (media geométrica: 0,194 mg/dl), voriconazol (MG: 0,314 mg/dl) y Anfotericina B (MG: 0,601 mg/dl), (17,18).
Pruebas indirectas
Los procedimientos moleculares e inmunológicos permiten hacer un diagnóstico presuntivo y rápido de la interacción del sistema inmune del hospedero con el hongo. Las técnicas serológicas permiten la detección tanto de componentes fúngicos del agente etiológico implicado como de antígenos fúngicos y de la respuesta de anticuerpos que se produce durante el desarrollo de la infección micótica (15,19). Entre las pruebas indirectas se cuenta con la detección de antígeno fúngico circulante (galactomanano y el (1-3) β-D Glucano); y la detección de anticuerpos dirigidos contra Aspergillus spp.
Detección de antígenos circulantes
Galactomanano (GM)
Es un hetero-polisacárido termoestable presente en la pared celular de la mayoría de especies de Aspergillus y Penicillium. La prueba comercial se denomina Platelia Aspergillus® (Bio-Rad, Marnes-La-Coquette, Francia). Es una técnica sencilla, reproducible y rápida. Actualmente se utiliza un ELISA de doble sándwich que emplea un anticuerpo monoclonal de rata EBA-2 dirigido contra las cadenas laterales de 1-5 D-Galactofuranósido del galactomanano de Aspergillus, utilizado como captor y detector del antígeno. La prueba es útil en suero y lavado broncoalveolar, y también puede utilizarse en tejido y fluidos corporales como LCR, líquido peritoneal, orina y líquido pericárdico, aunque son insuficientes los datos obtenidos para demostrar la validez de su medición en este tipo de muestras. Se considera el principal método serológico capaz de mejorar el diagnóstico de la infección tanto en precocidad como en especificidad, y es útil para la selección de los pacientes y la vigilancia de la terapia. Estudios realizados establecen que los títulos de GM son proporcionales a la carga fúngica en tejido, y sus niveles parecen tener importancia pronóstica, con la disminución de dicho niveles por la adecuada terapia antifúngica (20-23). El límite de detección es de 0,5-1 ng/ml y se considera que la prueba es positiva cuando se obtienen al menos dos determinaciones consecutivas positivas. El punto de corte recomendado en suero es > 0,5 ng/ml (21).
La sensibilidad clínica del ELISA-GM es muy variable, con un rango de entre 29-100%. Hay muchas razones para este tipo de resultados. En primer lugar, la variación de acuerdo con el tipo de paciente y la enfermedad subyacente, ya que si están profundamente inmunocomprometidos, se informa de una sensibilidad superior al 90%, mientras que en otros contextos clínicos, por ejemplo en enfermedad granulomatosa crónica y trasplante de órganos sólidos, la sensibilidad suele ser más baja; y en segundo lugar, la evidencia sugiere que la terapia antifúngica concomitante lleva a una disminución de la sensibilidad. Por último, la ausencia de muestras seriadas, disminuye el porcentaje de sensibilidad, ya que es recomendado un muestreo bisemanal, sobre todo en pacientes inmunosuprimidos de alto riesgo.
La especificidad clínica del ELISA- GM en general es mayor del 90%. Esta especificidad suele ser más baja en recién nacidos y niños pequeños, posiblemente debido a la ingesta exógena de GM (en alimentos y agua) o por la traslocación intestinal inmadura o dañada. Los antibióticos representan una fuente adicional de galactomanano y comprometen la especificidad clínica; por lo que se deben tener en cuenta los resultados falsos positivos (reactividad cruzada con otras especies de hongos, algunos exoantígenos bacterianos o antibióticos derivados de hongos) y falsos negativos (angioinvasión escasa, carga fúngica baja, títulos de anticuerpos altos o uso profiláctico o dirigido de antifúngicos.)
(1-3) Β-D Glucano (BG)
Se encuentra presente en la pared celular de la mayoría de los hongos, con excepción de los géneros de Zygomicetes y las especies de Cryptococcus. Su característica es la capacidad del (1,3) β-D Glucano de activar la cascada de coagulación de los amebocitos derivados de la hemolinfa del cangrejo herradura (Limulus polyphemus). Existen dos métodos comerciales: Fungitec-G, Seikagaku Corp., Tokio, Japón; y Fungitellâ¢, Cape Cod Assoc., East Falmouth, MA.
En un estudio prospectivo, esta prueba predice la etiología fúngica en poblaciones de alto riesgo y fiebre, en estudios retrospectivos se ha utilizado en pacientes inmunosuprimidos con AI. Cuando esta prueba es positiva, puede utilizarse como marcador de infección fúngica aunque no permite identificar la especie implicada, por lo tanto, la desventaja de su uso es la incapacidad para distinguir entre diferentes especies: Candida, Aspergillus, Trichosporon, Fusarium, y Saccharomyces.
La sensibilidad analítica del ensayo BG está en el orden de 1 pg/ml, y el punto de corte se encuentra sobre los 60 pg/ml. No existen datos concretos de su sensibilidad clínica específicamente para infecciones por Aspergillus spp. La especificidad clínica puede comprometerse con resultados falsos positivos en pacientes expuestos a otras fuentes de BG tales como filtros y membranas de diálisis, gasa de algodón y esponjas utilizados en cirugía, y algunos medicamentos.
Detección de anticuerpos circulantes
Tradicionalmente, la detección de anticuerpos no es útil para el diagnóstico de AI, aunque se está mejorando el que se basa en la detección de anticuerpos con la utilización de antígenos recombinantes. La detección de anticuerpos puede ser el mejor medio no invasor para la detección de AI subaguda en pacientes no neutropénicos, y a la vez ser útil para establecer de manera retrospectiva la enfermedad invasora en pacientes severamente inmunosuprimidos sometidos a reconstitución inmune, aun cuando se requieran más estudios al respecto.
Metabolitos
Aspergillus spp. produce una serie de enzimas extracelulares (metoloproteasas, fosfolipasas) así como metabolitos primarios (manitol) y secundarios (gliotoxina), todos con el potencial de convertirse en marcadores diagnósticos de AI.
Pruebas de ácidos nucleicos
La detección de ADN fúngico en la muestra clínica es una posibilidad que está siendo estudiada en profundidad para el diagnóstico de AI. No existen todavía pruebas comercializadas para su realización. Esta detección puede efectuarse básicamente por dos técnicas: la amplificación mediante la reacción en cadena de la polimerasa (PCR), de secuencias conservadas en todos los hongos (PCR panfúngica) o de secuencias específicas de una especie concreta (PCR específica) y la utilización de sondas de ADN. En la mayor parte de los estudios hay una tendencia hacia la realización de la PCR panfúngica, que es muy sensible pero presenta una especificidad variable. De la misma manera, la utilización de sondas de ADN permite un diagnóstico muy específico pero relativamente poco sensible (22,23).
La principal ventaja del uso de estos métodos es la detección de mínimas cantidades de material genético micótico, y los diversos estudios de detección de ADN o ARNm fúngico, aunque prometedores, requieren mayor evaluación, y aún no es clara su utilidad como herramienta diagnóstica para AI. Las desventajas de uso de estas técnicas, son la posibilidad de contaminación cruzada, la colonización por Aspergillus de las vías aéreas y los senos paranasales, lo que afectaría su especificidad. Otros problemas técnicos tienen que ver con la rigidez de la pared celular de las especies de Aspergillus (por lo que requiere procedimientos fuertes para la extracción de DNA), el bajo número de hifas durante la infección sistémica, la falta de estandarización en la selección y manipulación de los especímenes clínicos, la extracción del DNA, la detección del amplicon o DNA diana, y la baja reproducibilidad inter-laboratorio, que producen resultados divergentes y representan un obstáculo para el uso generalizado como método diagnóstico (19,23).
Diagnóstico histopatológico
En el diagnóstico de AI, el estudio histopatológico de una muestra tisular es la "prueba de oro" y confirmatoria de invasión del hongo; sin embargo, en pacientes inmunosuprimidos, como aquellos con neutropenia grave postquimioterapia, obtener muestras de tejido es difícil debido a que también pueden presentar trastornos de la coagulación lo cual es un impedimento para realizar procedimientos invasores. En esta situación radica la importancia de disponer de otros métodos diagnósticos no invasores como los estudios inmunológicos (detección de antígenos) y de imagen.
Por otra parte, es importante recordar que el diagnóstico por histología sólo permite describir la estructura del microorganismo definiendo sus características morfológicas más relevantes, las cuales se destacan mediante el empleo de coloraciones que permiten observar el tamaño, la forma, la disposición y la relación del hongo con el sistema circulatorio del órgano, que en este caso es primordial para definir el concepto de invasión. Por las razones expuestas, se deduce que el patólogo podrá acercarse con estas herramientas al diagnóstico de género pero no de la especie, por lo que se requiere el resultado del estudio microbiológico a través del cultivo de la muestra tisular de tal manera que sea posible establecer el género y la especie del hongo.
Igualmente, es importante reconocer la especie y las pruebas de susceptibilidad in vitro con el fin de dirigir de manera racional y más acertada el tratamiento antimicótico.
El estudio histopatólogico de cualquier muestra tisular se basa en la fijación y coloración del tejido a través de la coloración básica de hematoxilina eosina con la cual el patólogo hace un diagnóstico sindromático, es decir, que se puede definir algún tipo de alteración tisular que sugiera una infección fúngica pero, debido a que ningún tipo de inflamación es característica de un hongo en particular y a que la respuesta tisular depende del grado de compromiso inmune del hospedero, el hallazgo "anormal" en hemotoxilina- eosina guía al patólogo para ampliar su mirada y aplicar otras herramientas o coloraciones que en el caso de los hongos le permitan apreciar las características arriba mencionadas.
En cuanto a los hongos, en general se utilizan tinciones especiales que colorean específicamente las estructuras fúngicas; por ejemplo, la tinción derivada de la plata, como la metenamina de plata (tinción de Gomori-Grocott) o la de ácido peryódico de Schiff (tinción de PAS). La ventaja de la coloración de Gomori-Grocott es que tiñe los elementos fúngicos más viejos o no viables (24).
Las características morfológicas de Aspergillus spp son hifas hialinas, septadas, con ramificación dicotómica, en ángulo de 45°, de igual diámetro. En AI se observa inflamación necrosante, purulenta e invasión vascular (Fig. 1) (25). En infecciones por A. niger se pueden encontrar cristales de oxalato de calcio procedentes del ácido oxálico. El patrón característico de la AI se caracteriza por la invasión y oclusión de arterias de pequeño y mediano calibre por hifas del hongo; esta angioinvasión permite la formación de nódulos hemorrágicos y necróticos, descritos como infartos hemorrágicos (26).
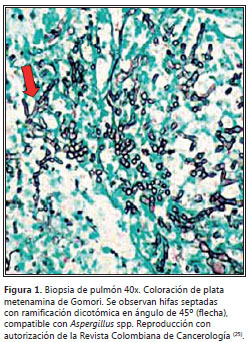
Diagnóstico imaginológico
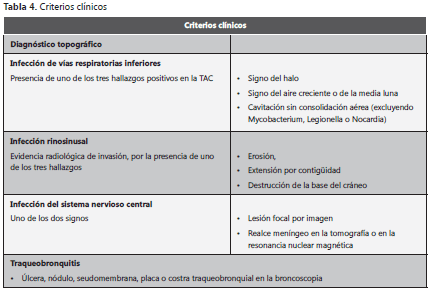
En 1980 Klein y Gamsu publicaron una revisión sobre las manifestaciones radiológicas de la aspergilosis, en el que hacían notar la débil especificidad de los hallazgos y que la fiebre, infiltrados radiológicamente visibles y pobre respuesta a los antibióticos era la presentación más frecuente (27). El advenimiento de las imágenes por tomografía axial computarizada (TAC) permitió apreciar mejor las lesiones asociadas a las aspergilosis pulmonar invasora y su evolución en el tiempo. En dos reportes publicados en 1985 y 1987, el grupo de Kuhlman identificó los patrones tomográficos más frecuentes como son el signo del halo, y el del aire creciente (28,29). Estos hallazgos requieren de adecuada interpretación ajustada a las características del paciente, dado que pueden estar presentes en otras patologías y no hacen el diagnóstico per se (30). El signo del halo se define como una imagen nodular densa en más del 50%, rodeada de atenuación en vidrio esmerilado en más de 180° (31). Caillot y colaboradores describen que en el día cero todos los pacientes presentaban signo del halo, pero sólo 68% lo mantenía al tercer día, 22% al séptimo y 19% al decimocuarto; mientras que el signo del aire creciente se observó en un 8% en el día tercero, 28% en el séptimo y 63% en el decimocuarto (32). Adicionalmente, describieron que en los primeros siete días de tratamiento el volumen de los infiltrados se incrementa hasta cuatro veces y se mantiene estable por la próxima semana; por ello no se propone controlar antes de siete días la evolución tomográfica. En 90% de los pacientes la lesión más apreciada es el macronódulo, seguida del signo del halo. La combinación del signo del halo y la aparición del aire creciente tiene una sensibilidad del 80% para el diagnóstico de aspergilosis invasora en pacientes con riesgo (33,34). Sin embargo, estudios prospectivos muestran que la sensibilidad varía entre el 60 y el 98% (35,36). Dadas estas características, algunos autores postulan la toma semanal de TAC-AR para diagnóstico temprano e instauración de terapia anticipada (37).
¿Cómo se clasifica la Aspergilosis invasora?
En las tabla 1 tabla 2 tabla 3 tabla 4 se describen los hospederos con riesgo para desarrollar AI, los criterios clínicos y micológicos y las definiciones correspondientes a AI probada, probable o posible según el consenso de European Organization for Research and Treatment of Cancer (EORTC), National Institute of Allergy and Infectious Diseases (NIAID) y Infectious Diseases Mycoses Study Group (MSG). Estas definiciones se han modificado con el objeto de clarificarlas y unificarlas para mejorar la calidad de los estudios clínicos y epidemiológicos. Las definiciones que aquí se presentan corresponden a 2008 (38) y son aplicables a pacientes inmunosuprimidos pero no necesariamente enfermos críticos y no se proponen como guía de práctica clínica; sin embargo, pueden ser aplicados en publicaciones con el fin de entender la epidemiología y la evolución de la enfermedad micótica invasora, y facilitar la capacidad de probar la eficacia de las estrategias y medicamentos utilizados.


¿Cuáles son las medidas terapéuticas para el tratamiento de la Aspergilosis invasora?
Desde el punto de vista farmacológico, en la actualidad se pueden plantear cuatro estrategias para el tratamiento de la AI:
1 Profilaxis,
2 Tratamiento empírico,
3 Tratamiento anticipado y
4 Tratamiento dirigido.
1 Profilaxis antifúngica (PAF): definida como el uso de antifúngicos para la prevención primaria de infecciones micóticas invasoras (IMI) por levaduras o mohos. Esta estrategia ha empezado a ser incluida como parte del cuidado estándar del paciente neutropénico con cáncer o con trasplante alogénico de células madre sobre recomendaciones de sociedades científicas como la Infectious Disease Society of America (IDSA), los Centers for Disease Control (CDC) y la American Society for Biochemistry and Molecular Biology (ASBM). Al respecto, más de 80 estudios clínicos de 9000 pacientes no han arrojado conclusiones científicas sólidas sobre la utilidad de la PAF para prevenir IMI. Igualmente, es importante anotar que la elección del antifúngico apropiado para profilaxis debe ser guiada con la eficacia, seguridad, estudio de costos, toxicidad, interacciones y resistencia. Entre los antifúngicos empleados para profilaxis se encuentran el fluconazol y el itraconazol, a los cuales se han sumado otros nuevos como voriconazol, posaconazol y equinocandinas. Varias son las preguntas que debe responder la elección del antifúngico para la prevención de las IMI, a saber: ¿cuál o cuáles son los pacientes que se pueden beneficiar de la profilaxis antifúngica primaria?, ¿la profilaxis antifúngica tiene impacto sobre la incidencia de IMI (levaduras vs mohos), la mortalidad cruda, la mortalidad relacionada con IMI, el uso empírico de tratamiento antifúngico y la toxicidad, y sobre el aumento o la selección de resistencia a los antimicóticos?, ¿cuál es la duración de PAF? Por la posible interacción de las antifúngicos con medicamentos de quimioterapia, surge además la pregunta ¿es necesario monitorear los niveles séricos del antifúngico? Es posible que fluconazol, voriconazol y posaconazol sean los antifúngicos para tener en cuenta para PAF, en grupos específicos de pacientes (39).
2. Tratamiento antifúngico empírico (TAFE):
El concepto de terapia antifúngica empírica como estándar de cuidado para los pacientes con neutropenia febril prolongada de origen desconocido, después de tres a siete días de tratamiento antimicrobiano de amplio espectro, puede ser interpretado como un signo inespecífico de IMI y está basado en el resultado de dos estudios pioneros abiertos, no controlados, aleatorizados, realizados en la década de los ochenta, que no logran demostrar ni reducción en la incidencia, ni de mortalidad por IMI. Sin embargo, teniendo en cuenta el perfil de seguridad de los antifúngicos disponibles actualmente, las equinocandinas y la anfotericina B liposomal podrían considerarse como las que tienen mejor evidencia a la fecha para TAFE. Vale la pena anotar que en nuestro medio el uso de Anfotericina B deoxicolato no tiene documentado a la fecha reacciones adversas severas (nefrotoxicidad que implique diálisis) que contraindiquen su uso, por lo que estudios de costo beneficio en nuestro medio son necesarios. Es importante tener en cuenta que el tiempo de inicio y elección del antifúngico están influenciados por múltiples factores que incluyen el perfil de riesgo del paciente, el uso de PAF, la presentación clínica, la confirmación de infecciones bacterianas y el resultado de pruebas de diagnóstico no invasivas.
3. Tratamiento antifúngico anticipado (TAFA): El TAFA utiliza cambios característicos en la tomografía de tórax o de senos paranasales, marcadores de laboratorio o ambos como blanco de la modificación del tratamiento antifúngico, con el fin de no administrar TAFE a todos los pacientes neutropénicos febriles. Maertens y colaboradores evaluaron la estrategia de PAF con fluconazol en pacientes neutropénicos de alto riesgo seguido por el cambio a Anfotericina B liposomal, considerando los marcadores de laboratorio mencionados arriba, que incluían pruebas séricas y seriadas de galactomanano positivas, lavado broncoalveolar positivo para mohos y signos positivos en la TAC sugestivos de IMI. Se administró TAFA a 7,7% (9/117) pacientes, mucho menos de la tercera parte que debería haber recibido TAFE sobre la base de tener fiebre únicamente. En un estudio aleatorizado de pacientes con énfasis en Aspergilosis invasora con neutropenia febril, TAFA se asoció con un aumento en la incidencia de IMI, sin incremento de la mortalidad y con disminución de costos al comparar con TAFE (41, 42). Por los resultados de este estudio, algunas sociedades aún no recomiendan TAFA como estrategia para uso rutinario (43).
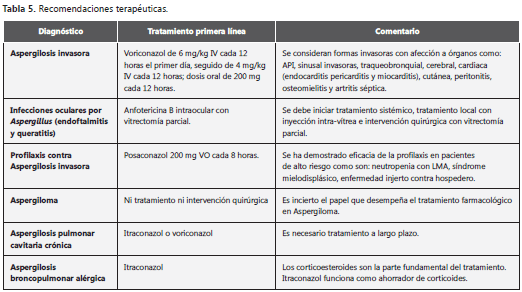
4. Tratamiento antifúngico dirigido (TAFD): Se basa fundamentalmente en la manifestación clínica y la demostración a través de pruebas de laboratorio, de imagen de patología de la presencia y patogenicidad de Aspergillus en uno o más sitios anatómicos de un hospedero susceptible. En la tabla 5 se resumen algunas de las principales manifestaciones clínicas y recomendaciones terapéuticas (4). Entre los tratamientos de segunda línea se encuentran: Anfotericina B formulación lipídica, caspofungina, posaconazol o itraconazol.
Conclusión
La Aspergilosis Invasora es una infección grave y con altas tasas de mortalidad en pacientes inmunosuprimidos, por lo que durante los últimos años ha sido motivo de investigación exhaustiva en dos campos: el diagnóstico y el terapéutico. En el tema del diagnóstico, el esfuerzo se ha realizado en mejorar el rendimiento de las herramientas no invasoras que permitan acercarse a un dictamen más preciso y a la vez construir criterios que combinen los factores de riesgo del hospedero con los hallazgos de laboratorio y de la imagen; y en el campo terapéutico, con el desarrollo de nuevos antifúngicos con mejores perfiles farmacocinéticos y farmacodinámicos que mejoren la sobrevida de los pacientes con AI. A pesar de estos avances, muchas preguntas no se han resuelto. Esperamos que con la construcción y la aplicación de una guía de práctica clínica para nuestros pacientes algunas de estas preguntas se puedan responder y probablemente surjan otras.
Agradecimientos
El grupo de autores agradece a los doctores Mónica Ballesteros, Giancarlo Buitrago y José Daniel Anzola, del Grupo de Epidemiología Clínica del Instituto Nacional de Cancerología ESE, quienes hacen parte del grupo elaborador de la guía de práctica clínica para el diagnóstico y tratamiento de la neutropenia febril en pacientes oncológicos mayores de 15 años por el apoyo metodológico en la búsqueda de la literatura.
Conflictos de interés
El Instituto Nacional de Cancerología ESE brinda el apoyo financiero para la realización de la guía de práctica clínica para el diagnóstico y tratamiento de la neutropenia febril en pacientes oncológicos mayores de 15 años por medio del cual se realizó parte de la búsqueda de la literatura aquí presentada. Los autores del artículo declaran no tener conflictos de interés con la industria farmacéutica.
Correspondencia: Sonia Isabel Cuervo Maldonado, Carrera 30 No. 45-03, Edificio 471, Oficina 511. Tel: 1-3165000 Exts. 15011-15012. Dirección electrónica: sicuervom@bt.unal.edu.co, scuervo@cancer.gov.co.
Aclaración Artículo escrito por encargo de la revista Infectio y desarrollado con absoluta independencia por parte de los autores, cuyas opiniones no reflejan necesariamente el pensamiento de la revista, de sus editores o del patrocinador del suplemento.
Referencias
1. Patterson T. Aspergillus species. In: Mandell GL, Bennett JE, Dolin R, editors. Principles and practice of infectious diseases. 7th ed. Philadelphia: Churchill Livingstone Elsevier; 2010. p. 3241-3256. [ Links ]
2. Maschmeyer G, Haas A, Cornely OA. Invasive aspergilosis. Drugs 2007; 67(11):1567-1701. [ Links ]
3. Verwij PE, Brandt ME. Aspergillus, Fusarium, and other opportunistic monilliaceous fungi. In: Murray PR, Baron EJ, Jorgensen JH, Landry ML, Pfaller MA editors. Manual of clinical microbiology, 9th ed. Washington DC, ASM press; 2007. p. 1802-1838. [ Links ]
4. Walsh TJ, Anaissie EJ, Denning DW, Herbrecht R, Kontoyiannis DP, Marr KA, et al. Treatment of Aspergillosis: Clinical Practice Guidelines of the Infectious Diseases Society of America. CID 2008;46: 327-360. [ Links ]
5. Patterson TF. Aspergillosis. In: Dismukes WE, Pappas PG, Sobel JD editors. Clinical micology. 1st ed. New York: Oxford University Press; 2003. p. 221-240. [ Links ]
6. Sherif R, Segal BH. Pulmonary aspergilosis: clinical presentation, diagnostic test, management and complications. Curr Opin Pulm Med 2010;16:242-250. [ Links ]
7. Barnes PD, Marr KA. Aspergillosis: spectrum of diseases, diagnosis and treatment. Infect Dis Clin N Am 2006;20:545-561. [ Links ]
8. Thompson III GR, Patterson TF. Pulmonary Aspergillosis. Semin Respir Crit Care Med 2008;29:103-110. [ Links ]
9. Richardson MD, Hope W. Aspergillus. In: Anaissie EJ, McGinnis MR, Pfaller MA, editors. Clinical Micology, 2th ed. Philadelphia: Churchill Livingstone Elsevier; 2009. p. 271-296. [ Links ]
10. Segal BH. Aspergillosis. N Engl J Med 2009;360:1870-84. [ Links ]
11. Tumbarello M, Tacconelli E, Pagano L, et al. Comparative analysis of prognostic indicators of aspergillosis in haematological malignancies and HIV infection. J Infect 1997;34:55-60. [ Links ]
12. Nivoix Y, Velten M, Letscher-Bru V, et al. Factors associated with overall and attributable mortality in invasive aspergillosis. CID 2008;47: 1176-84. [ Links ]
13. Hope WW, Wals TJ, Denning DW. Laboratory diagnosis of invasive aspergillosis. Lancet Infect Dis 2005;5: 609-22. [ Links ]
14. Anaissie EJ, McGinnis MR, Pfaller MA, editors. Clinical Mycology.2th ed. Churchill Livingstone; 2009. [ Links ]
15. Pontón J. Diagnostico Microbiológico de las micosis. Rev Iberoam Micol 2002; 19:25-29. [ Links ]
16. Christopher R. Thornton. Detection of Invasive Aspergillosis. In: Advances in Applied Microbiology. Burlingon: Academic Press; 2010; 70:188-216. [ Links ]
17. Cuervo SI, Rivas P, Sánchez R, Cortés JE. Epidemiología, susceptibilidad antimicótica y factores de riesgo de mortalidad de fungemia no Candida en pacientes con cáncer. s.t. En prensa 2010. [ Links ]
18. Rivas P, Cuervo SI, Sanchez R. Tendencia en la frecuencia y susceptibilidad in vitro a agentes antifúngicos de aislamientos de hongos diferentes a Candida spp. a partir de hemocultivos en pacientes con Cáncer (1999-2009). s.t. En prensa. 2010 [ Links ]
19. Maertens J,Theunissen K, Lodewyck T, Lagrou K, Van Eldere J. Advances in the serological diagnosis of invasive Aspergillus infections in patients with haematological disorders. Mycoses 2007;50 (1): 2-17. [ Links ]
20. Mennink-Kersten MA, Donnelly JP, Verweij PE. Detection of circulating galactomannan for the diagnosis and management of invasive aspergillosis. Lancet Infect Dis. 2004; 4: 349-57. [ Links ]
21. Gutierrez GP, Rivas P, Cuervo S, Sánchez R, Parra C. Valor diagnóstico del galactomanano y proteína C reactiva en pacientes con neoplasia hematolinfoide y neutropenia con factor de riesgo de aspergilosis invasiva. s.t. En prensa 2010. [ Links ]
22. Fah Yeo S, Wong B. Current Status of Nonculture Methods for Diagnosis of Invasive Fungal Infections. Clin Microbiol. Rev. 2002; 15(3): 465-84. [ Links ]
23. Millon L, Piarroux R, Deconinck E, Bulabois CE, Grenouillet F,Rohrlich P, Costa JM, Bretagne S. Use of Real-Time PCR To Process the First Galactomannan-Positive Serum Sample in Diagnosing Invasive Aspergillosis. J. Clin. Microbiol. 2005 Oct; 43(10): 5007-5101. [ Links ]
24. España PP. Diagnóstico de Aspergilosis pulmonar invasiva y semiinvasiva. (en línea). (Consultado 23 junio. 2010) Disponible en: www.svnpar.com. [ Links ]
25. Mesa J, Rivas P, Cuervo SI, Mejía M. Diagnóstico histopatológico de micosis invasivas en el paciente inmunocomprometido del Instituto Nacional de Cancerología, en Bogotá. Rev Colomb Cancerol 2006;10(6):207-211. [ Links ]
26. British Committee for Standards in Haematology. Writing group: Prentice AG, Glasmacher A, Hobson RP, Schey S, Barnes RA, Donnelly JP et al. Guidelines on the management of invasive fungal infection during therapy for haematological malignancy. London: 2007. [ Links ]
27. Klein DL, Gamsu G., Thoracic Manifestations of Aspergillosis. AJR 1980; 134: 543-52 [ Links ]
28. Kuhlman JE, Fishman EK, , Siegelman SS, Invasive pulmonary aspergillosis in acute leukemia: characteristic findings on CT, the CT halo sign, and the role of CT in early diagnosis. Radiology 1985; 157(3): 611-14. [ Links ]
29. Kuhlman JE, Fishman EK, Burch PA, Karp JE, Zerhouni EA, Siegelman SS. Invasive pulmonary aspergillosis in acute leukemia. The contribution of CT to early diagnosis and aggressive management. Chest 1987; 92(1): 95-9. [ Links ]
30. Hsu NC, Lee WJ, Kuo SW, Jerng JS., Halos and Crescents. Am J Med 2009; 122(8): 738-40. [ Links ]
31. Hruban RH, Meziane MA, Zerhouni EA, Wheeler PS, Dumler JS, Hutchins GM., Radiologic-pathologic correlations of the CT halo sign in invasive pulmonary aspergillosis. J Comput Assist Tomogr 1987. 11(3): 534-6. [ Links ]
32. Caillot D, Cauaillier JF,, Bernard A, Casasnovas O, Denning DW, Mannone L, et al. Increasing volume and changing characteristics of invasive pulmonary aspergillosis on sequential thoracic computed tomography scans in patients with neutropenia. J Clin Oncol 2001; 19(1): 253-9. [ Links ]
33. Reichenberger F, Habicht JM,, Gratwohl A, Tamm M., Diagnosis and treatment of invasive pulmonary aspergillosis in neutropenic patients. Eur Respir J. 2002; 19(4): 743-55. [ Links ]
34. Greene R. The radiological spectrum of pulmonary aspergillosis. Med Mycol. 2005; 43: S147-54. [ Links ]
35. Won HJ, Lee KS, Cheon JE, Hwang JH, Kim TS, Lee HG, et al., Invasive pulmonary aspergillosis: prediction at thin-section CT in patients with neutropenia--a prospective study. Radiology 1998; 208(3): 777-82. [ Links ]
36. Kami M, Tanaka Y,, Kanda Y, Ogawa S, Masumoto T, Ohtomo K, et al. Computed tomographic scan of the chest, latex agglutination test and plasma (1AE3)-beta-D-glucan assay in early diagnosis of invasive pulmonary aspergillosis: a prospective study of 215 patients. Haematologica 2000; 85(7): 745-52. [ Links ]
37. Yeghen T, Kibbler C, , Prentice HG, Berger LA, Wallesby RK, McWhinney PH, et al. Management of invasive pulmonary aspergillosis in hematology patients: a review of 87 consecutive cases at a single institution. Clin Infect Dis 2000: 31(4): 859-68. [ Links ]
38. De Pauw B, Walsh TJ, Donnelly JP, Stevens DA, Edwards JE, Calandra T. et al. Revised Definitions of Invasive Fungal Disease from the European Organization for Research and Treatment of Cancer/ Invasive Fungal Infections Cooperative Group and the National Institute of Allergy and Infectious Diseases Mycoses Study Group (EORTC/MSG) Consensus Group. CID 2008; jun.;46: 1813-21 [ Links ]
39. Maertens J, Frére P, Lass-Flörl C, Heinz W, Cornely O. Antifungal prophylaxis in leukemia patients 2009 update of the ECIL 1 and 2 guidelines. 3rd European Conference on Infection in Leukemia; 2009 Sep. 25-26; Juan-les-Pins, France. [ Links ]
40. Marchetti O, Cordonier C, Calandra Th. Empirical antifungal therapy in neutropaenic cancer patients with persistent fever. Europ J of Cancer 2007; Suppl 5: 32-42. [ Links ]
41. Maertens J, Theunissen K, Verhoef G. Galactomannan and computed tomography-based preemptive antifungal theraphy in nuetropenic patients at high risk for invasive fungal infection: a prospective feasible study. CID 2005;41:1242-50. [ Links ]
42. Cordonier C, Pautas C, Maury S. Empirical versus preemptive antifungal therapy for high-risk febrile neutropenic patients: a randomized, controlled trial. CID 2009; 48(8):1042-51. [ Links ]
43. National Comprehensive Cancer Network. Prevention and treatment of cancer related Infections. (en línea) 2009. (Consultado 1 de marzo de 2010). Disponible en: www.nccn.org. [ Links ]














