Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Infectio
Print version ISSN 0123-9392
Infect. vol.14 suppl.2 Bogotá Dec. 2010
1 Grupo de Micología Médica y Experimental, Corporación para Investigaciones Biológicas (CIB), Escuela de Microbiología, Universidad de Antioquia, y Escuela de la Salud, Universidad Pontificia Bolivariana (UPB), Medellín, Colombia.
Recibido: 03/08/2010; Aceptado: 17/11/2010
Resumen
La histoplasmosis, micosis sistémica y endémica en una amplia zona de las Américas, es causada por el hongo dimórfico Histoplasma capsulatum. Tradicionalmente, el diagnóstico de esta entidad se realiza por métodos microbiológicos directos y biopsias que emplean una variedad de coloraciones especiales tales como Wright, Giemsa y plata metenamina, entre otras, así como por cultivo; este último representa el estándar de oro. Se emplean, igualmente, métodos indirectos que incluyen la detección de anticuerpos y antígenos. Los valores de sensibilidad y especificidad en ambos métodos son variables, y los resultados dependen, a su vez, de la forma clínica de la enfermedad que presente el paciente y de su estado inmune.
Recientemente, la biología molecular ha permitido introducir nuevas herramientas que han sido utilizadas para la detección e identificación de H.capsulatum, una de ellas es la PCR anidada que se caracteriza por sus altos niveles de sensibilidad y especificidad. De igual forma, estas técnicas moleculares han permitido realizar análisis evolutivos, estudios de diversidad genética y un sinnúmero de estudios de epidemiología molecular, a partir de los cuales se ha logrado recopilar información valiosa sobre la variabilidad genética de este microorganismo.
En esta revisión se describen los métodos de laboratorio convencionales y las técnicas moleculares más empleadas para el diagnóstico de la histoplasmosis; así como también algunas de sus aplicaciones en la epidemiología y biología molecular de este hongo.
Palabras claves: Histoplasma capsulatum, Histoplasmosis, Diagnóstico, Técnicas convencionales, Diagnóstico molecular.
Abstract
Histoplasma capsulatum is the causative agent of histoplasmosis, a systemic and endemic mycosis widely distributed in the Americas. Diagnosis of histoplasmosis is traditionally accomplished by means of direct preparations and biopsies stained by especial methods, as well as by isolation of fungus in culture; the latter is considered the gold standard. Indirect methods, including immunological tests to detect antibodies and/or antigens, are also valuable; both direct and indirect methods present sensitivity and specificity ranges that vary depending on the clinical form of the disease and the immune status of the host. Recently, molecular biology has allowed implementing new tools to detect and identify H. capsulatum, and several molecular tests, such as nested-PCR, are being used for the diagnosis of histoplasmosis, and so provide high sensitivity and specificity values. In addition, these molecular techniques have made it possible to perform evolution analysis, genetic diversity research, and molecular epidemiology, thus compiling valuable information on the genetic variability of this microorganism.
In this review, the conventional and molecular methods employed for the diagnosis of histoplasmosis have been described, as have some of the applications of these molecular techniques to this fungal pathogen’s epidemiology and molecular biology.
Key words: Histoplasma capsulatum, Histoplasmosis, Diagnosis, Conventional techniques, Molecular diagnosis.
Introducción
La histoplasmosis, una micosis sistémica y endémica en una amplia zona de las Américas, es causada por la inhalación de las partículas infectantes del hongo dimórfico térmico Histoplasma capsulatum. En la naturaleza, este hongo crece en forma filamentosa, pero una vez ingresa a los tejidos del hospedero, se convierte en levadura (1-5). El dimorfismo, considerado un factor de virulencia, es de particular interés puesto que es necesario tanto para su adaptación a los tejidos como para el desarrollo de la enfermedad; así mismo, le permite al microorganismo adaptarse a diferentes condiciones ambientales gracias a la expresión de genes específicos, cuyos productos son críticos para su supervivencia y la colonización (5-7). La forma miceliar de H. capsulatum es saprofita-geofílica, y generalmente, se encuentra en recintos o ambientes cerrados (minas, cuevas, pozos, casas o construcciones abandonadas), así como en espacios abiertos contaminados con excretas de murciélago y de aves (ricos en nutrientes necesarios para su crecimiento) (6-10).
La dispersión aérea de la fase miceliar de H. capsulatum es de gran importancia en la diseminación a nuevos ambientes. Se ha establecido que las infecciones ocurren a través de la creación de aerosoles que contienen las partículas infecciosas, que al ser inhaladas por el hospedero la inician y en ciertos casos llevan al establecimiento de la enfermedad (10,11). De igual manera, algunos animales como aves y murciélagos pueden contribuir a la diseminación de las formas infecciosas en la naturaleza (12,13).
Inicialmente, se tenían descritas tres variedades para este hongo: var. capsulatum, patógeno para humanos en América; var. duboisii, patógeno para humanos en áfrica; y var. farciminosum, patógeno para equinos (10). Actualmente, gracias a los estudios de epidemiología molecular, ya no se habla de variedades sino de "clados" y para H.capsulatum se han identificado hasta el momento ocho diferentes que serán descritos más adelante (14).
En relación con los cuadros clínicos de la histoplasmosis, éstos pueden variar dependiendo del estado inmune del hospedero, la edad, el tamaño del inóculo inhalado y la presencia de daños estructurales pulmonares previos que pueda presentar el paciente, como es el caso de la enfermedad pulmonar obstructiva crónica (EPOC) (15).
En un hospedero normal y dependiendo del tamaño del inóculo, la primoinfección puede ser asintomática si es pequeño; por el contrario, si es masivo, puede desarrollarse una infección aguda severa, la que generalmente cursa con un periodo de incubación de una a tres semanas. La infección aguda suele manifestarse con síntomas que simulan una gripe o una neumonitis aguda, y puede acompañarse de adenomegalias y artralgias, entre otros síntomas; sin embargo, muchos pacientes se recuperan espontáneamente en pocos días o semanas y quedan lesiones calcificadas como secuela pulmonar y extrapulmonar (10,15-17).
En el caso de pacientes con deterioro moderado de su estado inmune (edad avanzada, desnutrición, diabetes, alcoholismo, tratamientos con corticosteroides, enfermedades malignas, entre otros) se observan formas diseminadas crónicas que se manifiestan por síntomas generales, lesiones cutáneas ulceradas o úlcero-vegetantes en mucosas, hepato-esplenomegalia, infiltrados pulmonares e insuficiencia suprarrenal (10,15-17).
Las formas diseminadas agudas se presentan generalmente en pacientes con deterioro grave de su inmunidad celular: leucemia, linfoma y, especialmente, síndrome de inmunodeficiencia adquirida (sida). En estos pacientes predominan las manifestaciones generales como fiebre, pérdida de peso, síntomas digestivos, respiratorios, neurológicos, óseos, lesiones cutáneas y mucosas, hepato-espleno y adenomegalias. En algunos casos el progreso de la enfermedad es rápido: va de horas a días (10,15-24).
En pacientes infectados con el virus de la inmunodeficiencia humana (VIH), originarios de regiones endémicas para la micosis, la histoplasmosis presenta tasas que oscilan entre el 2 y el 5%, pero pueden llegar hasta un 25% en el caso de epidemias (25,26). Estos pacientes son propensos a desarrollar formas diseminadas agudas, en las que los hallazgos más frecuentes son fiebre, pérdida de peso y síntomas constitucionales, acompañados en una proporción importante por pancitopenia, compromiso suprarrenal (80% en autopsias) y lesiones en piel y mucosas. El sistema nervioso central está comprometido entre un 10 y un 25% de los pacientes. En ausencia de tratamiento, la enfermedad es rápidamente fatal, en días o semanas, pero la muerte logra disminuirse por debajo del 25% con la instauración de una terapia antimicótica oportuna (18-26).
En Colombia, a pesar de que la histoplasmosis es una de las micosis más frecuentes, su incidencia real e impacto en la salud pública no son muy claros, dado que no es una enfermedad de notificación obligatoria. Los pocos datos que se conocen han sido reportados por Ordoñez y colaboradores 1997 (27), quienes describieron los resultados de un estudio de doce brotes epidémicos de histoplasmosis ocurridos en seis departamentos colombianos del área andina. En este estudio, las pruebas serológicas realizadas en 332 individuos que estuvieron expuestos a los focos de infección determinaron que 11 de ellos constituyeron casos índice de histoplasmosis aguda; estos individuos presentaron síntomas respiratorios, y en algunos casos se logró visualizar y aislar el agente etiológico de muestras clínicas. Adicionalmente, en 140 (42%) de los 321 individuos restantes las pruebas serológicas fueron positivas (27).
En otro trabajo desarrollado por el grupo Colombiano para el estudio de la histoplasmosis, conformado por el grupo de Microbiología del Instituto Nacional de Salud (INS) y la Corporación para Investigaciones Biológicas (CIB), el cual diseñó en 1996 una encuesta nacional de vigilancia con base en las pautas establecidas por el comité Europeo de Micología Médica; hasta el año 2008 se habían analizado 434 encuestas de pacientes diagnosticados con la micosis entre 1992 y 2008, provenientes de 20 departamentos del país. En este estudio se reportó un predominio de adultos (96,1%) de sexo masculino (77%), con una edad promedio de 38,4 años; y en la población de pacientes adultos el 70,5% tenía co-infección con el VIH (28).
Por otra parte, el diagnóstico de esta micosis se realiza tradicionalmente por métodos microbiológicos convencionales como el cultivo, las biopsias y los exámenes directos utilizando una variedad de coloraciones especiales; también se hace el diagnóstico por métodos inmunológicos que detectan la presencia de anticuerpos o antígenos específicos (3,10,16,17,29).
A pesar del aumento significativo en el número de individuos infectados con el VIH, lo que ha incrementado la incidencia de muchas enfermedades infecciosas, entre ellas la histoplasmosis, en nuestro medio se siguen utilizando herramientas convencionales para el diagnóstico de esta micosis. Dichas técnicas, además de hacer arduo y demorado el diagnóstico, presentan valores de sensibilidad y especificidad muy variables, lo que dificulta aún más el dictamen.
Recientemente, la biología molecular ha permitido implementar herramientas moleculares que han sido de gran utilidad para el estudio e identificación de diversos hongos patógenos (13,30-32). En la actualidad, estas técnicas moleculares hacen posible el diagnóstico de muchas enfermedades infecciosas con altos niveles de sensibilidad y de especificidad (33-42). Además, estas metodologías han permitido realizar estudios de diversidad genética, análisis evolutivos y un sinnúmero de estudios epidemiológicos que han arrojado información valiosa sobre la gran variabilidad genética que presenta H.capsulatum (14, 30-33,43).
Con el objetivo de ilustrar a la comunidad médica y a los profesionales del área de la salud sobre los diferentes métodos diagnósticos para confirmar la sospecha clínica de la histoplasmosis, hemos preparado esta revisión de tema que se enfocará en los aspectos más relevantes de las técnicas convencionales e inmunológicas empleadas para el diagnóstico de esta micosis. También se revisan los nuevos acercamientos metodológicos reportados en la literatura que buscan implementar el diagnóstico molecular como prueba regularmente empleada para la determinación de la histoplasmosis, y la utilidad de estas pruebas en algunos estudios de epidemiología.
Detección e identificación de H. capsulatum utilizando técnicas convencionales:
Estas técnicas pueden ser clasificadas en: A) métodos directos o microbiológicos, en los cuales se visualiza o se aísla directamente el microorganismo, y B) métodos indirectos o inmunológicos, en los cuales se detectan anticuerpos producidos por el paciente y/o antígenos o moléculas derivados del microorganismo (3,10,17,29,44,45).
A. Métodos microbiológicos o directos:
A.1. Exámenes en fresco y coloraciones especiales: En el caso de la histoplasmosis, el examen en fresco (observación de la muestra directamente entre lámina y laminilla con o sin KOH) o examen directo a partir de muestras clínicas, no tiene mucho valor debido a que el microorganismo se encuentra en el nivel intracelular y es de un tamaño muy pequeño (2-4 μm), lo que dificulta su observación en el microscopio (15). No obstante, las coloraciones especiales tales como Wright, Giemsa, el ácido peryódico de Schiff (PAS) y la plata metenamina o Grocott, realizadas a partir de muestras respiratorias [lavados broncoalveolares (LBA) y esputos inducidos (EI)], biopsias de tejido, raspados de lesiones en piel y extendidos de médula ósea, se usan con frecuencia para el diagnóstico de esta micosis.
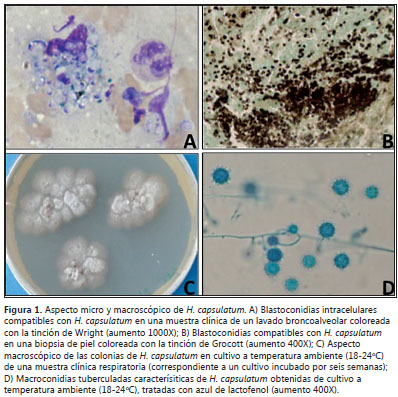
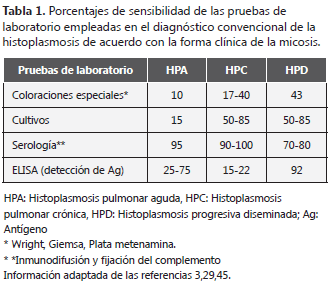
La observación microscópica de estas tinciones permite visualizar las levaduras intracelulares, localizadas en el citoplasma de macrófagos y células fagocíticas del sistema inmune. Con coloraciones hematológicas (Wright o Giemsa) se tiñen de manera parcial y aparecen rodeadas de un halo claro (falsa cápsula) (Figura 1A); con tinciones específicas para hongos como Grocott se observan levaduras pequeñas de color marrón oscuro por la precipitación de los iones de plata (Figura 1B).
Estos métodos basados en tinciones presentan una sensibilidad inferior al 50% y una amplia variabilidad que depende de la forma clínica de la micosis y de la experiencia del observador (tabla 1). Adicionalmente, las levaduras de H. capsulatum son potencialmente confundidas y erróneamente identificadas con otros microorganismos, entre los que se incluyen Candida spp., Penicillium marneffei, Leishmania spp., Pneumocystis jirovecii, Cryptococcus neoformans, Blastomyces dermatitidis y Leishmania spp, además de artefactos (3,10,17,27,44-46).
Por ello, las coloraciones especiales no deben ser utilizadas como única herramienta para el diagnóstico de esta micosis debido a la probabilidad de un diagnóstico erróneo ocasionado por el alto número de falsos positivos o negativos; por esto, generalmente, se recomienda que las coloraciones se acompañen del cultivo (3,10,17,29,44-46).
A.2. Cultivos para el aislamiento de H. capsulatum: para realizar este tipo de pruebas, el laboratorio clínico debe estar equipado con cámaras de bioseguridad nivel II-III y personal de laboratorio capacitado en la manipulación del hongo, debido a que los cultivos de H.capsulatum, en su fase miceliar, permiten la generación de microconidias (partículas naturalmente infectantes).
Los medios de cultivo usualmente utilizados en los laboratorios de micología para aislar este hongo son: el agar de infusión de cerebro y corazón (BHI del inglés "brain heart infusión") con una fuente de sangre (generalmente de carnero) más antibióticos y ciclohexamida, y el Sabouraud dextrosa agar más cicloheximida y cloramfenicol (Mycosel, BBL). En estos medios, la cicloheximida inhibe el crecimiento de hongos saprofíticos contaminantes mientras que los antibióticos frenan el desarrollo de bacterias.
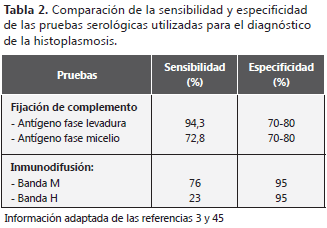
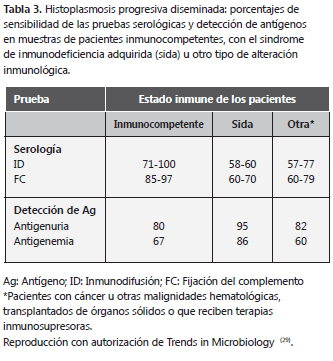
La identificación del hongo se hace con base en las características macro y microscópicas de las colonias. A temperatura ambiente (por debajo de 24oC) H. capsulatum se comporta como un moho de crecimiento lento, de apariencia algodonosa, color blanco o beige. Algunas colonias pueden ser granulares o pulverulentas (Figura 1C); al microscopio se observan hifas septadas, delgadas, hialinas; la esporulación se basa en la producción de microconidias y macroconidias tuberculadas; las primeras miden de dos a cinco micras; las segundas son muy características y son la base de identificación de género y especie (Figura 1D).
Los cultivos presentan también valores de sensibilidad variable que dependen de la forma clínica de la micosis y pueden alcanzar hasta un 85% de sensibilidad en los casos de histoplasmosis pulmonar crónica y diseminada (tabla 1) (3,10,16,17,25,44-46). Estos cultivos tienen varias limitaciones entre las que se cuentan resultados falsos negativos en el 20% de los casos de histoplasmosis diseminada y hasta del 50% en los de histoplasmosis pulmonar crónica (3,29); la sensibilidad es más baja en pacientes con formas agudas y leves de la micosis.
Además, este microorganismo es de crecimiento lento, pues requiriere entre tres y seis semanas para su aislamiento en los medios de cultivo antes descritos (3,10,17,25,44-48).
A.3. Hemocultivo por lisis centrifugación: en los últimos años se ha venido desarrollando un método para el aislamiento e identificación de H. capsulatum a partir de muestras de sangre, denominado método de lisis-centrifugación, en el cual la sangre extraída se pone en contacto con sustancias líticas, como la saponina, que destruyen los eritrocitos y los leucocitos y liberan en el medio las levaduras intracelulares. Actualmente es considerado como el método de elección para el aislamiento de este hongo. Sin embargo, aunque ha mostrado resultados promisorios para el diagnóstico de esta micosis, son aún pocos los laboratorios que lo han implementado como prueba de uso regular debido a que es laboriosa y difícil de estandarizar (3,10,16,29,46,47).
B. Métodos indirectos o técnicas inmunológicas. Muchas de estas técnicas se basan en la detección de anticuerpos (Acs) contra el hongo producidos por el hospedero o de antígenos específicos del microorganismo, y su análisis puede ser cuantitativo o cualitativo. Entre las principales pruebas inmunológicas encontramos: B.1. Fijación de complemento e inmunodifusión en gel-agar: por muchas décadas las pruebas serológicas más ampliamente utilizadas para la detección de anticuerpos contra H. capsulatum han sido la fijación del complemento (FC) y la inmunodifusión en gel-agar (ID). La primera es una prueba inmunológica que busca detectar y medir la presencia de Acs fijadores de complemento específicos contra el hongo, presentes en el suero o en el líquido cefalorraquídeo de los individuos infectados. Para realizar esta prueba se utilizan antígenos obtenidos tanto de la forma de micelio (histoplasmina) como de la levadura (completa). Los títulos de Acs entre 1:8 y 1: 16 son considerados sugestivos de un posible contacto con el hongo; mientras que títulos de Acs mayores a 1:32 se consideran indicativos de una histoplasmosis activa (16,29,44). Por su parte, la prueba de ID en gel-agar permite identificar dos bandas de precipitado, denominadas H y M, que corresponden al reconocimiento de Acs específicos contra tales antígenos presentes en el suero de pacientes con histoplasmosis. Los antígenos H y M son glicoproteínas que sue len ser liberadas en cultivos de ambas formas, miceliar y levaduriforme. El antígeno H tiene homología con una β-glucosidasa y; se detecta hasta en el 10% de los casos y cuando está presente indica una infección activa. El antígeno M tiene homología con una catalasa y se identifica en el suero de aproximadamente 80% de los pacientes; sin embargo, la ID no permite diferenciar una infección reciente de una pasada, dado que los Acs contra este antígeno pueden persistir por meses y, hasta años, después de la primo-infección (10,16,29,44).
La sensibilidad y la especificidad de ambas pruebas en la determinación de Acs contra H. capsulatum dependen de la forma clínica de la micosis (15). Es así como se ha reportado que la FC y la ID son positivas aproximadamente entre el 90-100% de los pacientes con histoplasmosis pulmonar crónica, y entre el 70-80% de los pacientes con histoplasmosis diseminada (tabla 1) (3,10,16,26,44-46).
Aunque la prueba de FC presenta una sensibilidad más alta en comparación con la ID, esta última es mucho más específica independientemente de la forma clínica de la histoplasmosis (tabla 2).
No obstante, ambas técnicas presentan algunas limitaciones, entre las que se mencionan: 1) requerimiento de dos a seis semanas para que un individuo produzca Acs después de haber estado expuesto al hongo; 2) en pacientes inmunosuprimidos, especialmente aquellos con sida, se presentan niveles de sensibilidad muy bajos debido a la disminución en la producción de Acs que caracteriza este síndrome; 3) algunos resul tados positivos pueden deberse a infecciones anteriores y sugerir, incorrectamente, una histoplasmosis activa en pacientes con otra infección (los anticuerpos anti-precipitina M se mantienen hasta por dos años), y 4) pueden ocurrir reacciones cruzadas en el 40% de los pacientes con otras micosis tales como paracoccidioidomicosis, blastomicosis y aspergilosis (3,10,16,17,44-46).
B.2. ELISA directa e indirecta para detección de anticuerpos: los métodos inmuno-enzimáticos para la detección de Acs contra H. capsulatum han sido poco utilizados debido a la dificultad para su estandarización y a su difícil interpretación; además, presentan alta reacción cruzada cuando se utilizan sueros de pacientes con otras enfermedades micóticas tales como paracoccidioidomicosis, blastomicosis, aspergilosis, candidiasis y coccidioidomicosis, lo que afecta su sensibilidad y especificidad (3,16,29,49). Guimaraes y colaboradores (50) desarrollaron un ensayo inmuno-enzimático en el que utilizaron como antígeno la histoplasmina deglicosilada, con el cual se obtuvieron altos valores de sensibilidad (92%), especificidad (96%) y eficiencia (95%).
B.3. Detección de antígenos: el uso de las técnicas de radioinmunoensayo (RIA) y ELISA y el empleo de Acs policlonales han permitido detectar, en pacientes con histoplasmosis, la presencia de antígenos de tipo polisacárido en muestras de fluidos corporales como orina, suero, lavados broncoalveolares y líquido cefalorraquídeo (3,10,16,17,29,49,51-54).
Estas técnicas son una herramienta importante no sólo para el diagnóstico de la histoplasmosis, sino para el seguimiento de los pacientes y la determinación de su respuesta al tratamiento. De igual forma, son fundamentales para el diagnóstico de la micosis en pacientes con algún grado de inmunosupresión, principalmente pacientes con sida, debido a que en ellos la producción de Acs se encuentra disminuida (55).
En los casos de histoplasmosis diseminada, la detección de antígenos permite realizar un diagnóstico temprano, incluso antes de que el microorganismo se aísle en cultivo. Además, esta prueba suele dar positiva mucho antes de la aparición de los Acs, como es el caso de la histoplasmosis pulmonar aguda, lo que la convierte en una herramienta relevante para el diagnóstico de esta micosis (3,10,16,17,29,46,49).
Aunque la sensibilidad de la ELISA en la detección de antígenos presenta valores altos (hasta del 90% en las diferentes formas clínicas de la histoplasmosis), ésta depende en gran parte del tipo de muestra utilizada. Se sabe que muestras como la orina son más sensibles que el suero o el plasma (3,10,17,29,46,49).
La tabla 3 resume algunos valores de sensibilidad en la detección de antígenos de pacientes con histoplasmosis diseminada. Además de presentar reacción cruzada con otras entidades tales como paracoccidioidomicosis, blastomicosis y peniciliosis, la detección de antígeno tanto en orina (antigenuria) como en suero (antigenemia) pueden presentar falsos positivos debido a diversos factores como la presencia de Acs IgG humanos inespecíficos y el factor reumatoide.
También pueden mostrarse resultados falsos negativos debido a una carga fúngica baja al momento de la toma de la muestra o al uso de antifúngicos (3,16,29,56).
Adicionalmente, se han desarrollado otras técnicas
de ELISA que utilizan Acs monoclonales para la detección de antígenos circulantes específicos del hongo, y tienen una alta sensibilidad y especificidad por lo cual permiten, además, el seguimiento de los pacientes antes y durante el tratamiento.
Igualmente, son varios los reportes sobre la estandarización de nuevas pruebas del tipo ELISA que buscan mejorar la sensibilidad y la especificidad; infortunadamente no están aún disponibles en nuestro medio (55,57-63). La prueba basada en RIA para detectar antígeno en suero y orina de individuos infectados, presenta una alta sensibilidad y especificidad (61); sin embargo, requiere de un equipo sofisticado y está disponible solo en los laboratorios de tercer y cuarto nivel de complejidad.
Recientemente se desarrolló una técnica de ELISA de captura que al utilizar Acs policlonales permite la detección de antígenos de H. capsulatum en muestras de orina de pacientes con sida e histoplasmosis diseminada progresiva, con una sensibilidad y especificidad del 81% y del 96%, respectivamente. Lo más importante de esta técnica es que se trata de una prueba de laboratorio sencilla que puede ser fácilmente implementada en laboratorios con recursos limitados (64). Actualmente, nuestro grupo se encuentra en el proceso de validación e implementación de esta técnica.
Técnicas moleculares para el diagnóstico de H. capsulatum: En los últimos años, la biología molecular ha ofrecido potentes herramientas para el diagnóstico de muchas infecciones ocasionadas no sólo por hongos patógenos sino por otras clases de microorganismos, tales como bacterias, virus y parásitos.
Estas técnicas moleculares, basadas en su mayoría, en la PCR o en modificaciones de ésta, incluyen: la amplificación aleatoria de polimorfismos de DNA (RAPD - del inglés "Random Amplification of Polymorphic DNA"), la determinación de polimorfismos en la longitud de fragmentos de restricción (RFLP - del inglés "Restriction Fragment Length Polymorphism"), la reacción en cadena de la polimerasa en tiempo (qRT-PCR - del inglés "Real Time Polymerase Chain Reaction") y la PCR anidada (nested-PCR). Estos métodos ofrecen una importante alternativa para el diagnóstico rápido de las afecciones ocasionadas por diferentes tipos de microorganismos (35,37,41,42,44,65).
Son varios los informes sobre la utilización de herramientas moleculares para el diagnóstico de la histoplasmosis, los cuales están basados en la amplificación de una variedad de genes blanco del microorganismo, cuyos valores de sensibilidad y especificidad son variables (69-100% y 77-100%, respectivamente), y que también dependen de los oligonucleótidos utilizados para la amplificación (tabla 4).
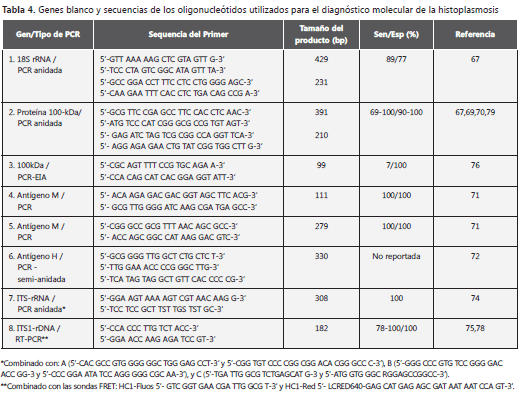
Es así como en el 2001, Bialek y colaboradores (66) reportaron el desarrollo de una nueva prueba de PCR anidada que amplifica la subunidad pequeña del RNA ribosomal (rRNA) aplicada al diagnóstico en un modelo experimental de histoplasmosis.
En este trabajo se demostró que, en comparación con los cultivos, esta prueba era estadísticamente más sensible para detectar el microorganismo, y positiva en presencia de tan solo cinco levaduras en la muestra procesada; adicionalmente, era mucho más rápida que los cultivos (1 vs. 21 días, aproximadamente) (66). Posteriormente, este mismo grupo evaluó dos pruebas de PCR anidada para la detección de DNA de H. capsulatum en muestras de tejido humano utilizando un nuevo gen blanco denominado Hc100 que amplificaba una secuencia del gen que codifica para una proteína de 100-kDa, única y específica de H. capsulatum, descrita y caracterizada previamente (67, 68). Este estudio demostró que ambas pruebas de PCR anidada eran capaces de detectar H. capsulatum en muestras de tejido humano fijado y embebido en parafina con límites de detección similares; sin embargo, la especificidad para la Hc100-PCR fue del 100%, en contraste con la presencia de falsos positivos revelados por la PCR dirigida a amplificar la secuencia 18S del rRNA (77%); además, esta prueba de Hc100-PCR fue útil para el diagnóstico de histoplasmosis diseminada en un paciente con sida (69).
Trabajos recientemente realizados por nuestro grupo han permitido validar e implementar la Hc100-PCR para la identificación de H. capsulatum en diversos muestras clínicas que incluyeron especímenes respiratorios, biopsias y fluidos corporales. Esta prueba molecular presentó una sensibilidad del 100% y una especificidad del 92,4% con respecto a controles negativos y del 95,2% cuando se utilizaron muestras positivas para otras micosis (70).
En otros estudios se han empleado como genes blanco aquellos que codifican para los antígenos H y M, y los espaciadores de transcriptos internos (ITS - del inglés "Internal Transcribed Spacer") de los genes que codifican para el RNA ribosomal (rRNA). Estas pruebas fueron altamente sensibles y específicas para el diagnóstico de la histoplasmosis al compararlas con las técnicas tradicionales. Esto sugiere que el diagnóstico molecular, utilizando como blanco los genes anteriormente mencionados, sería de gran ayuda para detectar la infección por H. capsulatum de manera rápida y eficaz (71-74).
Así mismo, Buitrago y colaboradores (75), realizaron estudios de reproducibilidad, sensibilidad y especificidad de una qRT-PCR que amplificaba una secuencia ITS de los genes del rRNA de H. capsulatum. La técnica se validó con 22 muestras provenientes de 14 pacientes con histoplasmosis, previamente confirmada por cultivo, examen histológico o serología positiva, incluyendo el cuadro clínico y los antecedentes epidemiológicos.
En este trabajo se encontró un coeficiente de variación del 3%, en las concentraciones mayores de DNA empleado (10ng y 200fg), y del 35% en las concentraciones mas bajas (10fg a 1fg). La sensibilidad y la especificidad de la qRT-PCR fueron del 78,3% y del 100%, respectivamente (75).
En los últimos cinco años, se encuentran en la literatura varios reportes que buscan mejorar la sensibilidad, especificidad, eficiencia y eficacia de las pruebas moleculares para el diagnóstico de la histoplasmosis en diferentes muestras clínicas, principalmente especímenes respiratorios (LBA, LB y EI), biopsias y líquidos corporales (líquido cefalorraquídeo, sangre total, orina); y también se han utilizado cultivos del hongo para la obtención del DNA. La mayoría de las pruebas que se vienen desarrollando y estandarizando incluyen las de PCR anidada y PCR en tiempo real, que alcanzan valores de sensibilidad y especificidad que oscilan entre 90% y 100 %, respectivamente (70, 75-80).
Aplicaciones de los métodos moleculares en la epidemiología de la histoplasmosis: Adicionalmente, con el advenimiento de las técnicas moleculares ha surgido la epidemiología molecular, la cual ha permitido avances importantes tanto en la localización de nuevas zonas endémicas como en el conocimiento de la relación paciente-fuente de infección. La aplicación de las técnicas moleculares ha posibilitado la identificación de distintas fuentes de infección y la determinación de una relación genotípica entre aislamientos clínicos de pacientes procedentes de las diferentes regiones, lo que ha contribuido al reconocimiento de áreas endémicas (13,30,32,43,81).
Por estas técnicas se ha demostrado que H. capsulatum posee de 4 a 7 cromosomas, y que el tamaño del genoma varía entre 23 y 32 Mb (44). Por otro lado, análisis por RFLP del DNA mitocondrial y ribosomal, así como del gen que codifica para una proteína específica de la fase levadura (yps-3), había agrupado inicialmente a H. capsulatum en seis clases que se correlacionaban con la distribución geográfica y la virulencia del hongo; interesantemente, aislamientos provenientes de regiones específicas de América del Sur se caracterizaban por producir lesiones en piel (81).
Adicionalmente, se han descrito tres marcadores multialélicos con la característica de ser hiper variables, altamente polimórficos y contener secuencias altamente repetitivas, además de ser conservadas (microsatélites), los que han resultado útiles para tipificar y determinar niveles de variación genética de diferentes aislamientos provenientes de regiones de Estados Unidos y otros países (81).
Como se describió al inicio de esta revisión, hasta hace poco se tenían descritas tres variedades para H. capsulatum (var. capsulatum, var. duboisii, y var. farciminosum) (10); no obstante, a la fecha se han identificado ocho clados diferentes, a saber: (i) Norteamericano clase 1; (ii) Norteamericano clase 2; (iii) Latinoamericano grupo A; (iv) Latinoamericano grupo B; (v) Australiano; (vi) Países Bajos (con la controversia si puede incluir aislamientos de Indonesia); (vii) Euroasiatico, y (viii) Africano (14).
Conclusiones Debido a la alta tasa de morbi-mortalidad que presenta la histoplasmosis y al difícil manejo terapéutico, se hace necesario desarrollar nuevas herramientas que permitan hacer un diagnóstico más rápido y oportuno. Estas nuevas metodologías moleculares para el diagnóstico de la micosis han sido bien descritos y las pruebas son razonablemente sensibles y específicas; y están implementadas en varios laboratorios del mundo.
En Colombia, el Laboratorio de Micología Médica y Experimental de la Corporación para Investigaciones Biológicas (CIB) de Medellín, ha venido implementando estas metodologías en los últimos años (70) y ofrece dentro de su portafolio de servicios pruebas moleculares para el diagnóstico de ésta y otras micosis.
Adicionalmente, y en conjunto con la Red Iberoamericana de Diagnóstico Molecular de las Micosis Endémicas, Oportunistas y Emergentes (Red Micomol), se viene realizando una serie de talleres cuyo objetivo es tratar de hacer la transferencia tecnológica de estas metodologías a otros laboratorios de la ciudad y del país (http://www.micomol-cyted.org). Por lo tanto, creemos que en pocos años estas metodologías podrán ser ofrecidas por otros laboratorios y tener una cobertura más amplia y un diagnóstico de la histoplasmosis más oportuno. No obstante, es importante anotar que el sistema de salud colombiano no incluye este tipo de metodologías diagnósticas en el Plan Obligatorio de Salud (POS), por lo que su cobertura es aún muy baja en nuestro medio.
Por otro lado, al reconocer las limitaciones presentadas por las técnicas convencionales, que incluyen principalmente la variabilidad en los valores de sensibilidad y especificidad, así como el tiempo tan prolongado requerido para el aislamiento del agente etiológio por cultivo (dos a seis semanas), y en el caso de las pruebas serológicas el tiempo que se requiere para que un individuo produzca anticuerpos específicos contra el hongo (dos a cuatro semanas); se sugiere implementar estas nuevas alternativas diagnósticas basadas en métodos moleculares, hecho que quizás permita un más rápido y certero diagnóstico que, a su vez, lleve a instaurar un tratamiento oportuno logrando así disminuir las tasas de morbi-mortalidad que acarrea esta micosis. Es importante anotar que con la implementación de estas nuevas metodologías moleculares no se pretende reemplazar los métodos convencionales. Por el contrario, se trata de complementar y ampliar la batería de pruebas existentes para realizar un diagnóstico más preciso y oportuno.
Adicionalmente, la implementación de estas herramientas moleculares podría ser de utilidad en estudios epidemiológicos y en la caracterización de zonas endémicas. En este sentido, estudios de tipificación molecular de H. capsulatum y su asociación con algunas características epidemiológicas de pacientes con histoplasmosis se están realizando en nuestro laboratorio.
Finalmente, queremos sugerir un algoritmo diagnóstico (Figura 2) que le sería muy útil al cuerpo médico para pacientes con sospecha clí nica de histoplasmosis, porque le puede ayudar a definr las pruebas de laboratorio que le permitan confirmar su impresión diagnóstica: 1) Definir si el paciente es un hospedero normal o con algún tipo de alteración inmunológica.
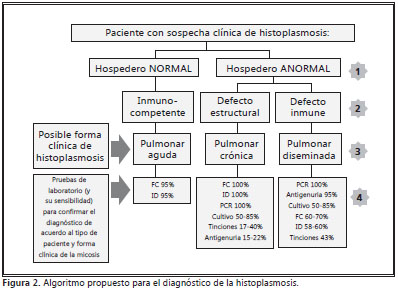
2) Si es un hospedero normal, será por ende inmunocompetente; por el contrario, el hospedero podría presentar defectos en su sistema inmune (por ejemplo sida) o defectos estructurales (por ejemplo cavidades pulmonares, EPOC, etc).
3) Definir con lo anterior la posible forma clínica de la micosis que presente el paciente.
4) Elegir las pruebas de laboratorio adecuadas, teniendo en cuenta la sensibilidad para confirmar el diagnóstico.
De esta manera, el médico podrá decidir cual(es) prueba(s) de laboratorio le ordena al paciente en particular para así poder confirmar la sospecha clinica de histoplasmosis.
Correspondencia: Angel González, Grupo de Micología Médica y Experimental, Corporación para Investigaciones Biológicas (CIB), Carrera 72A # 78 B 141, Medellín, Colombia. Tel.: 057-4-441 08 55 ext 206; Fax: 057-4- 441 55 14. Dirección electrónica: agonzalezm@cib.org.co
Referencias
1. Taylor ML, Pérez-Mejía A, Yamamoto-Furusho JK, Granados J. Immunologic, genetic and social human risk factors associated to histoplasmosis: Studies in the State of Guerrero, Mexico. Mycopathologia. 1997; 138:137-41. [ Links ]
2. Taylor ML, Reyes-Montes MR, Martínez-Rivera MA, Rodríguez- Arellanes G, Duarte-Escalante E. Histoplasmosis en México. Aportaciones inmunológicas y moleculares sobre su epidemiología. Ciencia y Desarrollo. 1997; 23:58-63. [ Links ]
3. Wheat LJ, Kauffman CA. Histoplasmosis. Infect Dis Clin N Am. 2003; 17:1-19. [ Links ]
4. Adderson E. Histoplasmosis. J Pediatr Infect Dis. 2006; 25:73-4. [ Links ]
5. López CE. Dimorfismo y patogenia de Histoplasma capsulatum. Rev Argent Microbiol. 2006; 38:235-42. [ Links ]
6. Retallack DM, Woods JP. Molecular epidemiology, pathogenesis, and genetics of the dimorphic fungus Histoplasma capsulatum. Microbes Infect. 1999; 1:817-25. [ Links ]
7. Eissenberg LG, Goldman WE. The interp lay between Histoplasma capsulatum and its host cells. Bailliere´s Clin Infect Dis. 1994; 1: 265-83. [ Links ]
8. Taylor ML, Granados J, Toriello C. Biological and sociocultural approaches of histoplasmosis in the State of Guerrero, Mexico. Mycoses. 1996; 39:375-9. [ Links ]
9. Taylor ML, Chávez-Tapia CB, Vargas-Yáñez R, Rodríguez-Arellanes G, Peña-Sandoval GR, Toriello C, et al. Environmental conditions favoring bat infection with Histoplasma capsulatum in Mexican shelters. Am J Trop Med Hyg. 1999; 61:914-9. [ Links ]
10. Kauffman CA. Histoplasmosis: a clinical and laboratory update. Clin Microbiol Rev 2007; 20:115-32. [ Links ]
11. Chick EW, Compton SB, Pass HT, Mackey B, Hernandez C, Austin JRE, et al. Hitchcok´s birds, or the increased rate of exposure to Histoplasma from blackbird roost sites. Chest. 1981; 80:434-8. [ Links ]
12. Taylor ML, Chávez-Tapia CB, Reyes-Montes MR. Molecular typing of Histoplasma capsulatum isolated from infected bats, captured in Mexico. Fungal Genet Biol. 2000; 30:207-12. [ Links ]
13. Taylor ML, Chavez-Tapias CB, Rojas- Martinez A, del Rocio Reyes- Montes M, del Valle MB, Zúñiga G. Geographical distribution of genetic polymorphism of the pathogen Histoplasma capsulatum isolated from infected bats, captured in a central zone of Mexico. FEMS Immunol Med Microbiol. 2005; 45:451-8. [ Links ]
14. Kasuga T, White TJ, Koenig G, McEwen J, Restrepo A, Castañeda E, et al. Phylogeography of the fungal pathogen Histoplasma capsulatum. Mol Ecol. 2003;12(12):3383-3401. [ Links ]
15. Restrepo A. Histoplasmosis. En: Restrepo A, Robledo J, Leiderman E, Restrepo M, Botero D, Bedoya VI, editors. Enfermedades Infecciosas. 6a edición. Medellín: Fondo Editorial CIB; 2003. p. 316-26. [ Links ]
16. Kauffman CA. Histoplasmosis. Clin Chest Med. 2009;30:217-225 [ Links ]
17. Wheat JL. Histoplasmosis: a reviews for clinicians from nonendemic areas. Mycoses. 2006; 49:274-82. [ Links ]
18. Tobón AM, Agudelo CA, Rosero DS, Ochoa JE, Bedout C, Zuluaga A, et al. Disseminated histoplasmosis: a comparative study between patients with acquired immunodeficiency syndrome and non-human immunodeficiency virus-infected individuals. Am J Trop Med Hyg. 2005; 73:576-82. [ Links ]
19. Doughan A. Disseminated histoplasmosis: case report and brief review. Travel Med Infect Dis. 2006; 4:332-5. [ Links ]
20. Casotti JA, Motta TQ, Ferreira Júnior CU, Cerutti Junior C. Disseminated histoplasmosis in HIV positive patients in Espitito Santo state, Brazil: a clinical-laboratory study of 12 cases (1999- 2001). Braz J Infect Dis. 2006; 10:327-30. [ Links ]
21. Joshi SA, Kagal AS, Bharadwaj RS, Kulkarni SS, Jadhav MV. Disseminated histoplasmosis. Indian J Med Microbiol. 2006; 24: 297-8. [ Links ]
22. Daher EF, Silva Jr GB, Barros FA, Takeda CF, Mota RM, Ferreira MT, et al. Clinical and laboratory features of disseminated histoplasmosis in HIV patients from Brazil. Trop Med Int Health. 2007; 12:1108-15. [ Links ]
23. Yen AW, Henderson MC. Disseminated histoplasmosis. J Hosp Med. 2007; 2:46. [ Links ]
24. Mora DJ, Barbosa Dos Santos CT, Silva-Vergara ML. Disseminated histoplasmosis in acquired immunodeficiency syndrome patients in Uberaba, MG, Brazil. Mycoses. 2008; 51:136-40. [ Links ]
25. Wheat LJ. Histoplasmosis in the acquired immunodeficiency syndrome. Curr Top Med Mycol. 1996; 7:7-18. [ Links ]
26. Wheat LJ, Sarosi G, McKinsey D, Hamill R, Bradsher R, Johnson P, et al. Practice guidelines for the management of patients with Histoplasmosis. Clin Inect Dis. 2000; 30:688-95. [ Links ]
27. Ordoñez A, Tobón A, Arango M, Tabares A, De Bedout C, Gómez B, et al. Brotes de histoplasmosis registrados en el área andina colombiana. Biomédica 1997; 17:105-111 [ Links ]
28. Arango M, Castañeda E, De Bedout C, Agudelo C, Agudelo CI, Tobón A, et al. Histoplasmosis: resultados de la encuesta nacional 1992-2008. Infectio 2010; 14:1-92 [ Links ]
29. Wheat LJ. Current diagnosis of histoplasmosis. Trends in Microbiol. 2003; 11:488-94. [ Links ]
30. Zancope-Oliveira RM, Silva PM, Medeiros M. Genetic diversity of Histoplasma capsulatum strains in Brazil. FEMS Immunol Med Microbiol. 2005; 45:443-9. [ Links ]
31. Canteros EC, Zuiani MF, Ritacco V, Perrotta DE, Reyes-Montes MR, Granados J, et al. Electrophoresis karyotype and chromosome-length polymorphism of Histoplasma capsulatum clinical isolates from Latin America. FEMS Immunol Med Microbiol. 2005; 45: 423-8. [ Links ]
32. Taylor ML, Ruiz-Palacios GM, Reyes-Montes MR, Rodriguez- Arellanes G, Carreto-Binaghi-Carreto LE, Duarte-Escalante, et al. Identification of the infectious source of an unusual outbreak of histoplasmosis, in a hotel Acapulco, state of Guerrero, Mexico. FEMS Immunol Med Microbiol. 2005; 45:435-41. [ Links ]
33. Ieven M, Goosseens H. Relevance of nucleic acid amplification techniques for diagnosis of respiratory tract infections in the clinical laboratory. Clin Microbiol Rev. 1997; 10:242-56. [ Links ]
34. Lindsley MD, Hurst SF, Iqbal NJ, Morrison CJ. Rapid identification of dimorphic and yeast-like fungal pathogens using specific DNA probes. J Clin Microbiol. 2001; 39:3305-11. [ Links ]
35. Flori P, Bellete B, Durand F, Raberin H, Cazorla C, Hafid J, et al. Comparison between real-time PCR, conventional PCR and different staining techniques for diagnosing Pneumocystis jirovecii pneumonia from bronchoalveolar lavage specimens. J Med Microbiol. 2004; 53:603-7. [ Links ]
36. Murdoch DR. Molecular genetic methods in the diagnosis of lower respiratory tract infections. APMIS. 2004; 112:713-27. [ Links ]
37. Sanchez G, Coronado X, Zulantay I, Apt W, Gajardo M, Solari S, et al. Monitoring the efficacy of specific treatment in chronic Chagas disease by polymerase chain reaction and flow cytometry analysis. Parasite. 2005; 12:353-7. [ Links ]
38. Bretagne S, Costa JM. Towards a molecular diagnosis of invasive aspergillosis and disseminated candidosis. FEMS Immunol Med Microbiol. 2005; 45:361-8. [ Links ]
39. Durand-Joly I, Chabé M, Soula F, Delhaes L, Camus D, Dei-Cas E. Molecular diagnosis of Pneumocystis pneumonia. FEMS Immunol Med Microbiol. 2005; 45:405-40. [ Links ]
40. Bialek R, González GM, Begerow D, Zelck UE. Coccidioidomycosis and blastomycosis: Advances in molecular diagnosis. FEMS Immunol Med Microbiol. 2005; 45:355-60. [ Links ]
41. Allice T, Enrietto M, Pittaluga F, Barreto S, Franchello A, Marchiaro G, et al. Quantitation of cytomegalovirus DNA by real-time polymerase chain reaction in peripheral blood specimens of patients with solid organ transplants: Comparison with end-point PCR and pp65 antigen test. J Med Virol. 2006; 78:915-22. [ Links ]
42. Rebollo MJ, Garrido SJ, Folgueira D, Palenque E, Diaz-Pedroche C, Lumbreras C, et al. Blood and urine samples as useful sources for the direct detection of tuberculosis by polymerase chain reaction. Diagn Microbiol Infect Dis. 2006; 56:141-6. [ Links ]
43. Muniz MM, Pizzini CV, Peralta JM, Reiss E, Zancopé-Oliveira RM. Genetic diversity of Histoplasma capsulatum strains isolated from soil, animals, and clinical specimens in Rio de Janeiro State, Brazil, by a PCR-based random amplified polymorphic DNA assay. J Clin Microbiol. 2001; 39:4487-94. [ Links ]
44. Guimaraes AJ, Nosanchuk JD, Zancope-Oliveira MR. Diagnosis of histoplasmosis. Brazilian J Microbiol. 2006;37:1-13 45. Wheat LJ. Improvements in diagnosis of histoplasmosis. Expert Opin Biol Ther 2006; 6:1207-21. [ Links ] [ Links ]
46. Couppie P, Aznar C, Carme B, Nacher M. American histoplasmosis in developing countries with a special focus on patients with HIV: diagnosis, treatment, and prognosis. Curr Opin Infect Dis. 2006; 19:443-9. [ Links ]
47. Axel RS, Hernández B, Rodríguez M, Romero H. Comparación del método de hemocultivo convencional con el de lisis/centrifugación modificado para el diagnóstico de fungemias. Rev Iberoam Micol. 2004; 21:198-201. [ Links ]
48. Weydert JA, Van Natta TL, DeYoung BR. Comparison of fungal culture versus surgical pathology examination in the detection of Histoplasma in surgically excised pulmonary granulomas. Arch Pathol Lab Med. 2007; 131:780-3. [ Links ]
49. Wheat LJ. Antigen detection, serology, and molecular diagnosis of invasive mycoses in the immunocompromised host. Transpl Infect Dis. 2006; 8:128-39. [ Links ]
50. Guimaraes AJ, Pizzini CV, Matos-Guedes HL, Albuquerque PC, Peralta JM, Hamilton AJ, et al. ELISA for early diagnosis of histoplasmosis. J Med Microbiol. 2004; 54:509-14. [ Links ]
51. Durkin MM, Connolly PA, Wheat LJ. Comparison of radioimmunoassay and enzyme-linked immunoassay methods for detection of Histoplasma capsulatum var. capsulatum antigen. J Clin Microbiol. 1997; 35:2252-5. [ Links ]
52. Pickering JW, Sant HW, Bowles CA, Roberts WL, Woods GL. Evaluation of a (1-3)-D-Glucan assay for diagnosis of invasive fungal infections. J Clin Microbiol. 2005; 43:5957-62. [ Links ]
53. Hage CA, Davis TE, Egan L, Parker M, Fuller D, LeMonte AM, et al. Diagnosis of pulmonary histoplasmosis and blastomycosis by detection of antigen in bronchoalveolar lavage fluid using an improved second-generation enzyme-linked immunoassay. Respir Med. 2007; 101:43-7. [ Links ]
54. Lindsley MD, Holland HL, Bragg SL, Hurst SF, Wannemuehler KA, Morrison CJ. Production and evaluation of reagents for detection of Histoplasma capsulatum antigenuria by enzyme immunoassay. Clin Vaccine Immunol. 2007; 14:700-9. [ Links ]
55. Gómez BL, Figueroa JI, Hamilton AJ, Diez S, Rojas M, Tobón A, et al. Detection of the 70-kilodalton Histoplasma capsulatum antigen in serum of histoplasmosis patients: correlation between antigenemia and therapy during follow-up. J Clin Microbiol. 1999; 37:675-80. [ Links ]
56. Kricka LJ. Human anti-animal antibody interferences in immunological assays. Clin Chem. 1999; 45:942-56. [ Links ]
57. Gómez BL, Figueroa JI, Hamilton AJ, Ortiz BL, Robledo MA, Restrepo A, et al. Development of a novel antigen detection test for histoplasmosis. J Clin Microbiol. 1997; 35:2618-22. [ Links ]
58. Wheat LJ, Connolly P, Durkin M, Book BK, Pescovitz MD. Elimination of false-positive Histoplasma antigenemia caused by human antirabbit antibodies in the second-generation Histoplasma antigen assay. Transpl Infect Dis. 2006; 8:219-21. [ Links ]
59. Wheat LJ, Hackett E, Durkin M, Connolly P, Petraitiene R, WalshTJ, et al. Histoplasmosis-associated cross-reactivity in the BioRad platelia Aspergillus enzyme immunoassay. Clin vaccine immunol. 2007; 14:638-40. [ Links ]
60. Ranque S, Pelletier R, Michel-Nguyen A, Dromer F. Platelia Aspergillus assay for diagnosis of disseminated histoplasmosis. Eur J Clin Microbiol Infect Dis. 2007; 26:941-3. [ Links ]
61. Cloud JL, Bauman SK, Neary BP, Ludwig KG, Ashwood ER. Performance characteristics of a polyclonal enzyme immunoassay for the quantitation of Histoplasma antigen in human urine samples. Am J Clin Pathol. 2007; 128:18-22. [ Links ]
62. LeMonte A, Egan L, Connolly P, Durkin M, Wheat LJ. Evaluation of the IMMY ALPHA Histoplasma antigen enzyme immunoassay for diagnosis of histoplasmosis marked by antigenuria. Clin Vaccine Immunol. 2007; 14:802-3. [ Links ]
63. Wheat LJ. Nonculture diagnostic methods for invasive fungal infections. Curr Infect Dis Rep. 2007; 9:465-71. [ Links ]
64. Scheel CM, Samayoa B, Herrera A, Lindsley MD, Benjamin L, Reed Y, et al. Development and evaluation of an enzyme-linked immunosorbent assay to detect Histoplasma capsulatum antigenuria in immunocompromised patients. Clin Vacc Immunol. 2009; 16: 852-858. [ Links ]
65. Eiler A, Bertilsson S. Detection and quantification of Vibrio populations using denaturant gradient gel electrophoresis. J Microbiol Methods. 2006; 67:339-48. [ Links ]
66. Bialek R, Fischer J, Feucht A, Najvar L, Dietz K, Knobloch J, et al. Diagnosis and Monitoring of murine histoplasmosis by a Nested PCR assay. J Clin Microbiol. 2001; 39:1506-9. [ Links ]
67. Bialek R, Feucht A, Aepinus C, Just-Nübling G, Robertson VJ, Knobloch J, et al. Evaluation of two nested PCR assays for detection of Histoplasma capsulatum DNA in Human tissue. J Clin Microbiol. 2002; 40:1644-7. [ Links ]
68. Porta A, Colonna-Romano S, Callebaut I, Franco A, Marzullo L, Kobayashi GS, et al. An homologue of the human 100-Kda protein (p100) is differentially expressed by Histoplasma capsulatum during Infection of murine macrophages. Biochem Biophys Res Commun. 1999; 254:605-13. [ Links ]
69. Rickerts V, Bialek R, Tintelnot K, Jacobi V, Just-Nuling G. Rapid PCRBased Diagnosis of disseminated Histoplasmosis in an AIDS patient. Eur J Clin Microbiol Infect Dis. 2002; 21: 821-3. [ Links ]
70. Muñoz C, Gómez BL, Tobón A, Arango K, Restrepo A, Correa MM, et al. Validation and clinical application of a molecular methods for identification of Histoplasma capsulatum in human specimens in Colombia, South America. Clin Vacc Immunol. 2010;17:62-67. [ Links ]
71. Matos-Guedes HL, Guimaraes AJ, Muniz MM, Pizzini CV, Hamilton AJ, Peralta JM, et al. PCR assay for identification of Histoplasma capsulatum based on the nucleotide sequence of the M antigen. J Clin Microbiol. 2003; 41:535-9. [ Links ]
72. Bracca A, Tosello ME, Girardini JE, Amigot SL, Gomez C, Serra E. Molecular detection of Histoplasma capsulatum var. capsulatum in human clinical samples. J Clin Microbiol. 2003; 41:1753-5. [ Links ]
73. Spencer WH, Chao CC, Shen DF, Rao NA. Detection of Histoplasma capsulatum DNA in lesions of chronic ocular histoplasmosis syndrome. Arch Ophthalmol. 2003; 121:1551-5. [ Links ]
74. Ueda Y, Sano A, Tamura M, Inomata T, Kamei K, Yakoyama K, et al. Diagnosis of histoplasmosis by detection of the internal transcribed spacer region of fungal rRNA gene from a paraffin- embedded skin sample from a dog in Japan. Vet Micribiol 2003;94:219-224. [ Links ]
75. Buitrago MJ, Gómez-López A, Monzón A, Rodríguez-Tudela JL, Cuenca-Estrella M. Evaluación de una técnica de PCR cuantitativa para el diagnóstico clínico de la histoplasmosis importada. Enferm Infecc Microbiol Clin. 2007; 25:16-22. [ Links ]
76. Tang YW, Li H, Durkin MM, Sefers SE, Meng S, Connolly P, et al. Urine polymerase chain reaction is not as urine antigen for the diagnosis of disseminated histoplasmosis. Diagn Microbiol Infect Dis. 2006; 54:283-7. [ Links ]
77. Pounder JI, Hansen D, Woods GL. Identification of Histoplasma capsulatum, Blastomyces dermatitidis, and Coccidioides species by repetitive-sequence-based PCR. J Clin Microbiol. 2006; 44:2977-82. [ Links ]
78. Buitrago MJ, Berenguer J, MelladoE, Rodríguez-Tudela JL, Cuesta- Estrella M. Detection of imported histoplasmosis in serum of HIV-infected patients using a real-time PCR-based assay. Eur J Clin Microbiol Infect Dis. 2006; 25:665-8. [ Links ]
79. Maubon D, Simon S, Aznar C. Histoplasmosis diagnosis using a polymerase chain reaction method. Application on human samples in French Guiana, South America. Diagn Microbiol Infect Dis. 2007; 58:441-4. [ Links ]
80. Simon S, Veron V, Boukhari R, Blanchet D, Aznar C. Detection of Histoplasma capsulatum DNA in human samples by real-time polymerase chain reaction. Diagn Microbiol Infect Dis. 2010;66: 268-273. [ Links ]
81. Carter DA, Taylor JW, Dechairo B, Burt A, Koenig GL, White TJ. Amplified single-nucleotide polymorphisms an (GA)n microsatellite marker reveal genetic differentiation between populations of Histoplasma capsulatum from the Americas. Fungal Genet Biol. 2001; 34:37-48. [ Links ]














