Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Infectio
Print version ISSN 0123-9392
Infect. vol.14 suppl.2 Bogotá Dec. 2010
Recibido: 07/10/2010; Aceptado: 08/11/2010
Resumen
La candidiasis invasora representa el 75% de las infecciones por hongos en pacientes hospitalizados, con una mortalidad que alcanza cifras hasta del 78%. La frecuencia de estas infecciones varía de acuerdo con el servicio de hospitalización y los factores de riesgo de los pacientes. Paralelamente, se han venido observando cambios en la epidemiología de las especies de Candida, variaciones en su prevalencia y en la resistencia a los antimicóticos según su localización geográfica. Por todo lo anterior, es imperativo establecer un diagnóstico temprano que lleve a la identificación correcta de la especie implicada de manera que se instaure un pronto y adecuado tratamiento antimicótico. El diagnóstico de la candidiasis invasora continúa siendo un reto, en el cual combinar los diferentes métodos diagnósticos, los microbiológicos, los inmunológicos y los nuevos moleculares, aún en desarrollo y validación, es la mejor estrategia para lograr un dictamen oportuno. En esta revisión se describen los métodos disponibles, sus limitaciones y las perspectivas de los que están en etapa de desarrollo y validación. En la última década se cuenta con métodos de referencia para la medición de susceptibilidad in vitro a los antimicóticos, lo cual ha permitido conocer los perfiles de sensibilidad de las diferentes especies de Candida a escala mundial y local.
Palabras claves: Candida, candidiasis, diagnóstico convencional, diagnóstico molecular, susceptibilidad antimicóticos.
Abstract
Invasive candidiasis represents 75% of fungal infections in hospitalized patients, with reported mortalities up to 78%. The frequency of these infections varies according to the hospital services and the risk factors of the patients. In parallel, changes in the epidemiology of the Candida species have been observed, in particular variations in their prevalence and in their resistance to antifungals according to geographic location. For these reasons it is crucial to establish an early diagnosis that identifies the pathogen to the species level in order to allow an appropriate therapeutic decision. The diagnosis of invasive candidiasis continues to be a challenge, where combining the different available methods (microbiologic, immunologic and new molecular approaches) is the best strategy to achieve a prompt and accurate diagnosis. We review the currently available assays for conventional and molecular diagnosis, their limitations, and the perspectives for assays that are now in development and validation. In the last decade, well established reference methods have become available for testing antifungal susceptibility and this has allowed worldwide and regional sensitivity profiles to be established for the different Candida species.
Key words: Candida, candidiasis, conventional diagnosis, molecular diagnosis, antifungal susceptibility.
Introducción
En décadas recientes se ha comprobado un marcado incremento de las micosis invasoras, debido al aumento paralelo de pacientes de alto riesgo, como los trasplantados, los que tienen neoplasias, los inmunosuprimidos (HIV-sida y otras), los recién nacidos de bajo peso, los pacientes de edad avanzada, a los que se les han practicado cirugías extensas y los hospitalizados en las unidades de cuidado intensivo (UCI). En estos grupos, estas infecciones predominan debido a que la mayoría de los pacientes reciben múltiples tratamientos como antibióticos de amplio espectro, esteroides, citotóxicos, y requieren uso de catéteres intravasculares y procedimientos diagnósticos invasores (1,2,3). Se estima que el 5% de los pacientes hospitalizados en las UCI van a desarrollar una enfermedad por hongos, especialmente candidiasis invasora (3%-6%) que acarrea morbilidad y mortalidad altas (4).
La candidiasis invasora representa el 75% de las infecciones invasoras por hongos en pacientes hospitalizados en Estados Unidos; su frecuencia varía de acuerdo con el servicio de hospitalización y los factores de riesgo del paciente (5, 6). Paralelamente, se han venido observando cambios en la epidemiología de las especies de Candida y existen, además, variaciones en su prevalencia y en la resistencia de algunas especies a los antimicóticos según su localización geográfica (7, 8). Por todo lo anterior, es imperativo establecer un diagnóstico temprano que lleve a la identificación correcta de la especie implicada de manera que se instaure un pronto y adecuado tratamiento antimicótico.
El diagnóstico de la candidiasis invasora continúa siendo un reto, ya que incluye la demostración de la invasión tisular por el hongo y su cultivo en muestras habitualmente estériles, el que, además, suele ser tardío. Lo anterior repercute en forma directa en la supervivencia del paciente por lo cual la rapidez en la instauración del tratamiento es el factor más importante. Es así como se pasa de una tasa de mortalidad del 78%, si el tratamiento es tardío, a una del 40% si se instaura precozmente (1,10,11). La combinación de los diferentes métodos diagnósticos, los microbiológicos, los inmunológicos (búsqueda de anticuerpos o antígenos circulantes y otros metabolitos) y los nuevos métodos moleculares aún en desarrollo y validación, continúan siendo la mejor alternativa para lograr un diagnóstico más oportuno.
A partir de 1997 se cuenta con métodos de referencia para la medición de susceptibilidad in vitro a los antimicóticos, que permiten conocer los perfiles de sensibilidad de las diferentes especies y alternativas terapéuticas para cada una de ellas, y ayudan a la selección de un tratamiento adecuado, lo cual influye en una terapia más exitosa.
Epidemiología y patogénesis
El género Candida contiene aproximadamente 200 especies, cifra que sigue en aumento gracias a los avances tecnológicos que afectan la taxonomía existente y ayudan al descubrimiento de nuevas especies. No obstante, menos de 20 especies han sido implicadas en infecciones clínicas, algunas con más frecuencia que otras (C. albicans, C. glabrata, C. tropicalis, C. parapsilosis, C. krusei) (tabla 1) (12, 13, 14). Varias especies de Candida forman parte de la flora endógena y son comensales de las mucosas, del tracto digestivo y genitourinario del hombre, de la piel y las uñas. La colonización en piel y uñas es transitoria con predominio de las especies C. parapsilosis y C. guilliermondii. En mucosa oral, la prevalencia de especies de Candida varía entre el 2% y el 37% en población sana y entre el 13% y el 76% en pacientes hospitalizados. La transmisión mano a mano o aun, a través de objetos inanimados, ha sido confirmada (15).
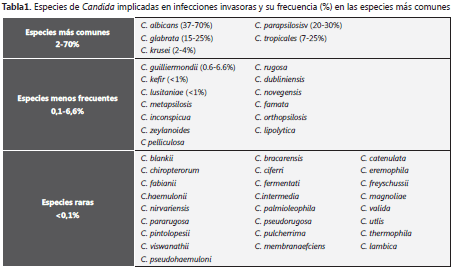
De las especies de Candida, C. albicans predomina en candidiasis genital, oral y cutánea (>90%). En candidemias y enfermedad invasora continúa siendo la causa más frecuente, pero se ha observado una disminución del 7%-10% (1997-2005) en su prevalencia. También se ha anotado disminución de acuerdo con el incremento en la edad, después de la exposición a los azoles y en las UCI (16, 17).
C. glabrataha incrementado desde 1993, su frecuencia como causa de candidemia en Norte América, con lo cual se ubica como la segunda especie más frecuente, lo que la cataloga como un importante oportunista emergente con gran potencial para desarrollar resistencia a los antimicóticos, especialmente fluconazol. Se la asocia a pacientes mayores de 60 años, trasplantados de órganos sólidos o con cáncer. La profilaxis con fluconazol es un factor predisponente. En Latinoamerica esta especie tiene una baja incidencia (4-6%) (16, 17).
El complejo C. parapsilosis está conformado por tres especies: C. parapsilosis, C. orthopsilosis y C. metapsilosis; tal discriminación en tres especies está soportada en su diversidad revelada por técnicas moleculares (18). El complejo es considerado patógeno exógeno y se encuentra como colonizador transitorio de piel-uñas y, ocasionalmente, de mucosas. Se asocia a infecciones adquiridas a través de las manos y de los ambientes hospitalarios e, igualmente, también con nutrición parenteral, cirugías recientes que requieran catéteres intravenosos y uso de caspofungina en pacientes con trasplante de células madre. En Latinoamérica esta especie está distribuida en todos los rangos de edad, incluyendo neonatos, grupo que es el más frecuentemente afectado por esta especie en Norteamérica y otras regiones del mundo (16, 17).
C. tropicalis es considerada una causa importante de candidiasis invasora en pacientes con cáncer, especialmente con leucemia, neutropenia y en trasplante de células madre. Se ha observado disminución de candidemias por esta especie con el uso profiláctico de fluconazol en pacientes con cáncer. Esta especie disminuyó como agente de las candidemias en Norteamérica del 10%-12% en los años noventa a 7%-8% en el año 2000. En América Latina y Asia, su incidencia en candidemia es mayor del 15% (16, 17).
C. krusei es una especie considerada emergente debido al uso profiláctico con fluconazol; igualmente C. tropicalis está asociada a pacientes con neutropenia. La colonización por esta especie es un predictor de candidemia. Se trata de un microorganismo multidrogo-resistente debido a que tiene una resistencia intrínseca al fluconazol, una susceptibilidad disminuida a la anfotericina y la flucitocina que está además, asociada a alta mortalidad (80%-40%) (16, 17).
El término Candidiasis comprende un espectro clínico extremadamente variado desde una infección superficial hasta una diseminada, y puede afectar cualquier órgano o sistema. La principal fuente de infección del humano es endógena; en el caso de C. albicans, en circunstancias relacionadas con la pérdida del balance de la flora normal o con el compromiso de las defensas inmunes, cuando aumenta la población de levaduras, ocurre sobrecolonización e invasión, por ejemplo, en el paso del tracto digestivo al torrente sanguíneo por medio de la traslocación. Las fuentes de infección exógenas son las manos del personal médico o paramédico, al nacer o con material contaminado como soluciones parenterales, soluciones oftálmicasdespués de una cirugía, dispositivos médicos como catéteres, válvulas cardíacas y respiradores, entre otros (15,19).
El estado inmune del hospedero es el factor más importante para que Candida spp se transforme en germen patógeno. Por ello es considerada como el oportunista por excelencia. Los factores de virulencia que determinan su relación con el hospedero (patogenia) son numerosos; entre ellos cuenta con la capacidad de adherirse a los tejidos o a superficies de catéteres o prótesis, lo cual le permite colonizar estas superficies. Además, tiene la capacidad de formar biopelículas que las hacen menos vulnerables a la acción de los antimicóticos, debido a que la matriz extracelular excluye o limita el acceso de éstos. En estas formaciones también hay disminución del metabolismo y crecimiento del hongo, lo cual disminuye los sitios de acción de la mayoría de los antimicóticos. Igualmente se relaciona con aumento de genes de resistencia presentes en las levaduras en dichas biopelículas. Otros factores que la ayudan a invadir y diseminarse por los tejidos son la capacidad de producir enzimas (proteasas, fosfolipasas y lipasas) y el cambio morfológico de blastoconidia o seudohifa e hifa (15, 19,20).
Prevalencia de las diferentes especies de Candida
En aproximadamente 95-97% de las infecciones invasoras están implicadas cinco especies (C. albicans, C. glabrata, C. tropicalis, C. parapsilosis, C. krusei), de las cuales son verdaderamente nuevas y emergentes sólo C. glabrata y C. krusei, que tienen una resistencia intrínseca o adquirida a los azoles, así como a los antimicóticos utilizados comúnmente (7, 8). Las infecciones restantes (3-5%) son causadas por 15-18 diferentes especies que incluyen a C. lusitaniae, C. guillermondii y C. rugosa. Estas especies son consideradas como causa inusual de candidiasis y están asociadas a brotes, o bien exhiben resistencia adquirida o innata a los antimicóticos de uso común (7, 21, 22).
Existen variaciones en la prevalencia de las especies de Candida, aisladas de procesos invasores según localización geográfica, edad y factor de riesgo del paciente. La especie predominante sigue siendo C. albicanspero en los últimos años se ha producido un importante cambio epidemiológico en la etiología de la candidiasis invasora: la presencia de las otras especies diferentes a C. albicans, que representan el 35% y el 55% de los aislamientos clínicos (7,8). En Latinoamérica C. albicansse presenta en una frecuencia del 34,3%, seguida de C. parapsilosis (21%) y C. tropicalis (17%); a diferencia a lo observado en Norte América y Europa, para esta región C. glabrata tiene una frecuencia menor al 6%, además con el incremento de especies poco frecuentes a nivel mundial como son C. guilliermondii (3%) y C. rugosa (5%), se han considerado estas dos especies como patógenos emergentes en Latinoamérica (7, 16,17, 21).
Datos de estudios locales provenientes de aislamientos de especies de Candida de procesos invasores en pacientes de las unidades de UCI de algunos hospitales de la ciudad de Medellín, (2001 -2007), dan un acercamiento de lo que sucede en Colombia, C. albicanses la especie más frecuentemente aislada (43,6%), seguida de C. tropicalis (23.4%), C. parapsilosis (13.9%), C. glabrata (9.5%) C. guilliermondii (3.6 %), C. krusei (3.3%) y otras especies diferentes como C. famata, C. lusitaniae, C. lipolytica y C. pelliculosa (2.7%) (23).
Diagnóstico por el laboratorio
El diagnóstico de candidiasis invasora se basa en métodos microbiológicos como son la demostración del hongo en el tejido por medio de el examen directo, del cultivo y de la histopatología, en cultivar la candida de cualquier sitio esteril y en la detección de un número de biomarcadores como anticuerpos, antígenos y DNA de Candida. A pesar de los muchos avances en los metodos diagnósticos la mejor estrategia para llegar a un diagnóstico y tratamientos tempranos continúa siendo el emplear un bateria de pruebas diagnósticas asociadas a los aspectos clínicos del paciente (24).
Para un diagnóstico correcto es necesario seleccionar, obtener y enviar la muestra adecuada. Existen condiciones importantes para tener en cuenta, como sigue: las muestras deben ser recolectadas asépticamente en frasco estéril con tapa rosca y se deben enviar al laboratorio a la menor brevedad posible. Su recolección y transporte varían de acuerdo con el espécimen y sitio de la infección (tabla 2). Además, cada espécimen debe estar bien rotulado, debe ir acompañado de los datos del paciente (nombre completo, sexo, edad) y datos clínicos (factores de riesgo, tratamiento con antibióticos o antimicóticos, sospecha clínica), examen solicitado y nombre, dirección y otra información de contacto del médico que lo solicita (15, 25, 26).
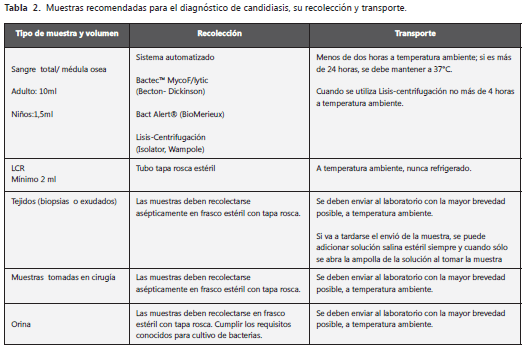
Los aislamientos de Candida spp. provenientes de sitios corporales no estériles (orina, secreciones respiratorias) presentan dificultades en su valoración pues no permiten establecer un diagnóstico de candidiasis invasora y aun los cultivos cuantitativos no logran diferenciar entre colonización e infección; no obstante, tienen importancia como factor de riesgo.
Pruebas microbiológicas
Para aumentar la probabilidad de observación y aislamiento de hongos, se utiliza el pretratamiento de las muestras con procedimientos como la centrifugación, que permite concentrar los hongos; la lisis centrifugación, que favorece la liberación de los microorganismos intracelulares en los hemocultivos; y la maceración en el caso de biopsias. Las pruebas de rutina son las siguientes: a. Examen directo: suele dar un resultado rápido que confirma la presencia del hongo en el nivel de género. Es el cultivo necesario para identificar la especie y adoptar una terapia más adecuada; además, cuando existen pocos elementos fúngicos los directos pueden ser negativos y se muestra más sensible el cultivo.
Examen en fresco, con KOH o empleando tinciones (Gram, Wright, Giemsa o blanco de calcoflour): en el microscopio se observan blastoconidias redondas, ovaladas o alargadas de 4-8mm, unigemantes o multigemantes, de pared delgada con seudohifas o hifas a excepción de C. glabrataque sólo produce blastoconidias.
Histopatología: el estudio de biopsias con el empleo de tinciones adecuadas {hematoxilina- eosina, plata metenamina de Gomori (Grocott-Gomori methenamine-silver stain, GMS), ácido periódico -Schiff (PAS)} permite diferenciar entre colonización e invasión, por lo que las biopsias son prueba definitiva de invasión tisular; no obstante, no es posible identificar la especie a menos que se utilice metodología de avanzada como el uso de anticuerpos y sondas de ADN o se proceda al aislamiento en cultivo de la especie de Candida para su posterior identificación.
b. Cultivo: las levaduras del género Candida son poco exigentes, crecen en los medios de cultivo de rutina empleados en laboratorios de micología, como el Sabouraud, y en medios utilizados para bacterias (agar sangre, agar chocolate y caldos como el BHI); el Mycosel no es útil por contener actidiona, compuesto que inhibe el crecimiento de algunas especies de Candida. También están disponibles comercialmente medios cromógenos diferenciales como el CHROMagar Candida® (Francia, distribuido por Becton Dickinson), Fungiscreen 4HTM (BioRad) los cuales permiten detectar infecciones causadas por varias
especies de Candida e incluso identificar la categoría, y son útiles en el momento de proceder a una terapia antimicótica rápida. Están disponibles también otros medios cromógenos que sólo identifican rápidamente C.albicans, CandiSelect® (Sanofi Diagnostic Pasteur, Francia), Fluoroplate® (Merck, Alemania), Murex CA 50® Diagnostic (USA) y Albicans ID® (BioMerieux, Francia).
Las especies de Candida spp. crecen entre 48 y 72 horas, pero los cultivos se deben observar hasta por dos semanas. Las colonias son cremosas de color blanco o crema, brillantes o ligeramente opacas, de lisas a rugosas. Pueden observarse los filamentos que penetran en el agar.
Los hemocultivos para detectar candidemia han mejorado recientemente y se cuenta ahora con nuevos métodos que permiten monitorización continua y botellas con medios de cultivos especiales para hongos como el BactT/Alert® (BioMerieux, Francia), BactecTM Myco/F lytic (Becton- Dickinson) y Lisis- Centrifugación (Isolator, Wampole), pero aun así la sensibilidad de los cultivos está entre 60-70%. El tiempo de crecimiento de las diferentes especies es diferente: C. albicans, C. parapsilopsis y C. tropicalis se detectan entre tres y cuatro días; C. krusei y C. glabratatoman más tiempo para crecer (hasta diez días). Por ello, los hemocultivos en los que se sospechen especies de Candida deben ser evaluados por dos semanas. Un hemocultivo negativo no descarta la infección pero uno solo positivo confirma el diagnóstico de candidemia (27, 28, 29, 30).
En orina, los cultivos positivos con >1X104 ufc/ ml suelen sugerir infección, especialmente en neonatos de bajo peso ya que en la mayoría de los casos la candiduria puede significar candidiasis invasora (31).
Los cultivos de vigilancia en pacientes críticos tienen valor para identificar el riesgo de candidiasis invasora (CI). El índice de Colonización (IC) se define como el número total de lugares anatómicos colonizados, dividido por el número total de muestras. El IC >0,5 ayudaría a la predicción de CI, o en el caso de aislamientos de C. tropicalis en pacientes inmunocomprometidos, éste se asocia al desarrollo de CI; también en aquellos casos en los que se obtengan aislamientos de C. krusei o C. glabrata, cuando se debe considerar el uso de antimicótico diferente al fluconazol (32, 33).
Identificación de las especies de Candida
En el laboratorio, la clasificación de las levaduras es una aproximación polifacética, en la que se debe contar tanto con las características morfológicas como con la producción de tubo germinal después de incubar a 36°C durante dos horas en suero humano, y la formación de seudomicelios y clamidoconidias obtenidas en diferentes medios (agar harina de maíz, agar Bilis de buey, entre otros), elementos característicos y de utilidad para la identificación de C. albicansy C. dubliniesis. Sin embargo, no hace una discriminación entre estas dos especies. Las características fenotípicas (perfiles de asimilación, fermentación, identificación de metabolitos y crecimiento sobre medios diferenciales) tarda entre 15-72 horas (identifica múltiples especies, grupo 3) o <24 horas (identifican una o varias especies, grupo 1 y 2) según la prueba comercial utilizada (tabla 3). Las pruebas de identificación rápida hacen una identificación presuntiva (grupo 1-2) que hace necesaria la confirmación de la misma (grupo 3). Generalmente los sistemas diseñados para identificar múltiples especies son menos certeros en la clasificación de especies inusuales o para discriminar aquellas con perfiles bioquímicos similares (especies crípticas), las cuales sólo logran ser identificadas por métodos moleculares (12,13,25). Hay varios ensayos de investigación reportados en la literatura (25) y a la fecha sólo un kit comercial está aprobado por la FDA (Food and Drug Administration, USA), el cual detecta ácidos nucleicos fluorescentes mediante hibridización in situ {peptic nucleic acid fluorescent in situ hybridization (PNA-FISH)} directamente de muestras clínicas: C. albicansPNA FISH® y C. albicans/C. glabrata PNA FISH® (AdvanDx, Woburn, Mass, distribuido por bioMerieux, Inc. en los Estados Unidos). Esta prueba detecta secuencias específicas de C. albicansy C. glabratadel rRNA. La prueba no reemplaza el subcultivo, pues muchos hemocultivos pudieran contener infecciones mixtas. La prueba detecta rápidamente (90 minutos) si C. albicanso C. glabrataestán presentes en el hemocultivo positivo. Muchos estudios han demostrado que la prueba es altamente sensible (99%) y 100% específica (34).
Pruebas Inmunológicas
El término diagnóstico serológico corresponde a una época en la cual el diagnóstico de muchas infecciones estaba basado sólo en la detección de anticuerpos o antígenos en suero. Actualmente pueden detectarse en cualquier líquido corporal, por lo cual es más adecuado referirse a métodos inmunológicos que detecten anticuerpos contra antígenos de Candida o antígenos o metabolitos específicos de Candida en los distintos liquidos corporales dependiendo de las técnicas. A pesar de que se ha trabajado muchísimo en métodos no microbiológicos para el diagnóstico de la candidiasis hematógena, los resultados siguen siendo poco satisfactorios (35). Es importante tener en cuenta que las especies de Candida son comensales normales del intestino que causan infección diseminada principalmente en pacientes con defectos inmunes severos. Entre las razones más importantes que limitan el valor de estas pruebas tenemos: i) muchos pacientes tiene anticuerpos contra su flora comensal y es difícil distinguir entre comensalismo y enfermedad ii) encontrar moléculas de Candida en suero no indica que se puede distinguir comensalismo de enfermedad iii) muchos pacientes que presentan infección diseminada no desarrrollan respuesta inmune y iV) los antígenos circulantes y otros metabolitos a veces son rápidamente retirados de la circulación (24, 25).
Por muchas décadas, la investigación se ha dirigido a descubrir moléculas de Candida spp que pudieran distinguir entre enfermedad y comensalismo. Los componentes que forman parte de la estructura básica del hongo, se encuentran básicamente en dos localizaciones: la pared celular y el citoplasma. Los extractos citoplasmáticos contienen un gran número de antígenos y dentro de ellos dos de los más importantes para el diagnóstico de la candidiasis invasora son la enolasa y un antígeno de 47 kDa, que es un fragmento de una proteína de choque térmico de 90 kDa (HSP90) ampliamente estudiada (36,37,38,39). La pared celular también contiene numerosos antígenos capaces de estimular potentes respuestas inmunológicas. El manano es el componente principal y es un abundante polisacárido en las levaduras y micelios de Candida albicans. Es un antígeno de alto peso molecular (>260 kDa). Más recientemente y en un esfuerzo que continúa tratando de encontrar marcadores de la candidiasis sistémica, el grupo de Pittarch y colaboradores (40,41) ha utilizado una aproximación inmunoproteómica con la ayuda de la bioinformática. Se usa la espectrometría de masas por desorción/ionización láser asistida por matriz (MALDI-TOF-MS), y se ha encontrado que anticuerpos anti Bgl2p (1,3-beta-glucosidase) y anticuerpos anti Pgk1 (phosphoglycerate kinase) entre otros, son una nueva herramienta que puede utilizarse como biomarcadores de la candidiasis sistémica (40, 41, 42).
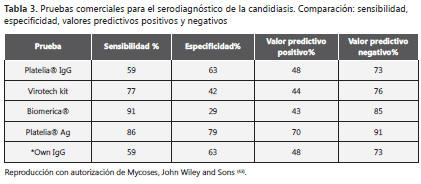
En la actualidad se dispone de muchas pruebas comerciales para la detección de antígenos o anticuerpos (tabla 3) (43). La sensibilidad reportada entre estos distintos métodos es de 59-91% y para la especificidad de 29-79%. Las pruebas basadas en aglutinación con partículas de látex son las menos sensibles. La interpertación de estas pruebas es a veces confusa pues los reportes varían de acuerdo con los diferentes estudios conducidos por los investigadores (44,25). También existen varias pruebas en desarrollo para la detección de β-1:3-glucan, componente de la pared celular. Entre las pruebas comerciales más usadas figuran el Fungitec-G, (Seikagaku Kogyo, Tokyo, Japan) y el Glucatell (Associates of Cape Cod, E. Falmouth, USA). Es importante tener en cuenta que este compuesto también está presente en la mayoría de los hongos patógenos, es decir que no es una prueba específica para Candida.
Pruebas moleculares
El diagnÏstico molecular se ha convertido en una parte muy importante de todo laboratorio clínico y juega un papel destacado en la práctica clínica. La biología molecular ha revolucionado la investigación en el área biológica y biomédica y pone a disposición variedad de métodos y técnicas para identificar las enfermedades y entender la predisposición a ellas analizando el DNA o el RNA de un organismo. Técnicas basadas en la amplificación de ácidos nucleicos como la PCR, la PCR anidada (Nested PCR), la PCR en tiempo real (Real time PCR) la hibridización in situ (in situ Hybridization), la hibridización in situ con fluorescencia (Fluorescence in situ Hybridization (FISH)) y la secuenciación de los productos del DNA amplificados se cuentan entre las técnicas disponibles que ofrecen grandes ventajas como alta sensibilidad y especificidad, rapidez y la posibilidad de establecer en forma cuantitativa la presencia o ausencia de agentes infecciosos en el hospedero afectado. Para el diagnÏstico molecular de infecciones por hongos, sin embargo, los avances han sido más lentos y, a pesar de las múltiples publicaciones disponibles en las últimas décadas, aún no hay suficiente estandarizaciÏn y consenso entre los diferentes grupos de investigadores, por lo que las pruebas siguen siendo “caseras” (in house tests) (25, 45). El gran objetivo de los investigadores y grupos de consenso es incluir estas pruebas en los parámetros de diagnóstico utilizados y recomendados por la “European Organization for Research and Treatment of Cancer y el Mycoses Study Group” (EORTC/MSG) (46).
Dentro de las varias publicaciones disponibles en la literatura se destaca el uso de la PCR en tiempo real, ya que tiene la ventaja de reducir las posibilidades de contaminación durante el montaje de la técnica y dar resultados más rápidos que la PCR convencional. Guiver y colaboradores (47) han descrito una PCR en tiempo real que es capaz de identificar C. albicans, C. glabrata, C. kefyr, C. krusei, y C. parasilopsis utilizando la plataforma TaqMan system (Perkin Elmer, Applied Biosystems, USA). Los autores reportaron una especificidad del 100% para las distintas especies (47). Otras plataformas de PCR en tiempo real también han sido usadas como el Light Cycler (Roche Molecular System, USA) utilizando como blanco secuencias de las regiones del rDNA 18S y 28S que son capaces de identificar por cebadores (primers) específicos, C. albicans, C. glabrata, C. krusei, C. parasilopsis, C. guillermondi y C. tropicales (48). El grupo de consenso de estandarización de PCR del Reino Unido, en un estudio multicéntrico, evaluó dos PCR en tiempo real para el diagnóstico molecular de candidiasis invasora con resultados promisorios (45), pero carecen aún de validación clínica.
Otros grupos que recientemente han hecho contribuciones importantes han publicado la comparación de diferentes métodos para optimizar la extracción del DNA de las muestras clínicas. También evaluaron si había diferencias importantes entre usar suero o sangre total y determinaron que con el suero se logró una mejor sensibilidad en la PCR y la extracción era más rápida (49,50). Autores de este mismo grupo publicaron luego un estudio prospectivo realizado con pacientes críticamente enfermos con candidemia comprobada, en el que utilizaron tres ensayos de PCR en tiempo real (Plataforma TaqMan) que diferencian las especies de Candida más frecuentes en las infecciones C. albicans, C. parasilopsis, C. tropicalis, C.dubliniensis, C. glabrata y C. krusei con una sensibilidad de 90,9% y una epecificidad de 100% (51). Este estudio ha sido bien acogido, aunque una nota editorial publicada en la misma revista por un experto clínico dice que se necesita más validación clínica, ya que el grupo de pacientes con candidemia comprobada fue pequeño (n=23) (52).
A la fecha el único kit comercial que utiliza un sistema basado en la secuenciación es el MicroSEQ ® D2 LSU rDNA Fungal Identification Kit (Applied Biosystems, USA). Este sistema identifica y compara las secuencias obtenidas con una base de datos que contiene cerca de 1,000 especies entre levaduras y hongos filamentosos. Se han reportado resultados que concuerdan hasta un 98% con la identificación de las especies de Candida usando el API 20C AUX. Sin embargo, algunos grupos que lo han usado informan que no disntingue la C. dubliniensis y que ésta es reportada como C. albicans(53). Otro avance reciente e importante ha sido la estandarización de métodos que permitan extraer el DNA fúngico y su identificación mediante secuenciación de muestras de tejidos embebidos en formalina y parafina. Muchas veces ésta es la única muestra disponible para el diagnóstico y la identificación molecular definitiva del agente casual de la infección. La histopatología en muchísimos casos sólo reporta presencia de levaduras o hifas que por sus características morfológicas son muy difíciles de identificar (54). Algunas limitaciones que se encuentran todavía con los sistemas de secuenciación son la exigencia de personal muy especializado y los elevados costos para los laboratorios de rutina.
Medición de susceptibilidad in vitro a los antimicóticos
El Instituto de Estándares Clínicos (Clinical Laboratory Standards Institute, CLSI), antes conocido como el Comité Nacional de Estándares Clínicos (National Committee for Clinical Laboratory Standards, NCCLS), convocó a un subcomité para desarrollar el método de susceptibilidad utilizando macro y micro dilución en caldo (documento M27-A3) (55) y el de difusión en disco (documento M44-A) (56) para levaduras. En los correspondientes procedimientos (documento M27-S3) (57) están descritos los puntos de corte para siete antimicóticos sistémicos (fluconazol, itraconazol, voriconazol, flucitocina, anidulofungina, caspofungina y micafungina). Estos puntos de corte están dados con base en la correlación de las pruebas in vitro (concentración inhibitoria mínima-CIM), con la respuesta clínica del paciente, con parámetros de farmacocinética y con la farmacodinamia del medicamento. Estos métodos son reproducibles y proporcionan datos importantes al clínico para el oportuno suministro de un tratamiento adecuado. Paralelamente, se han desarrollado otros métodos como el EUCAST (Comité Europeo para las pruebas de susceptibilidad a los antimicóticos) y comerciales como Yeast One Colorimetric®, VITEK 2 Yeast susceptibility test® y Etest®, que tienen una buena reproducibilidad y correlacion con los métodos de referencia (documento M27- A3) (55).
A pesar de que hay datos epidemiológicos a escala mundial y se podría con base en esto predecir el comportamiento de las especies de Candida, en algunas ocasiones ciertos aislamientos se escapan a dichas predicciones y por ello es importante resaltar que existen diferencias de comportamiento de la susceptibilidad a los antimicóticos según la región geográfica, lo que hace necesario conocer los patrones característicos para cada institución, ciudad o país (7,58,59).
Datos del estudio de susceptibilidad in vitro al fluconazol (FCZ) y al voriconazol (VCZ) por el método de difusión en disco (documento M- 44A) (56) en aislamientos de especies de Candida provenientes de pacientes hospitalizados en las UCI de algunos hospitales de la ciudad de Medellín, permitieron un acercamiento a la situación local. Con respecto a la susceptibilidad a estos dos antimicóticos, 78,3% y 94,0% de los aislamientos fueron susceptibles al FCZ y al VCZ, respectivamente. En los aislamientos estudiados se observó que 12,2% fueron susceptibles dosis dependientes (SDD) al FCZ y 2,4% SDD al VCZ. En cuanto a la resistencia (R), ésta fue del 9,5% para el FCZ y 3,6% para el VCZ. Cuando lo anterior se analizó en el nivel de especies, se encontró que para el FCZ C. albicansfue susceptible en el 95,2% de los casos, seguida por, C. tropicalis en el 86% de los casos, C. parapsilosis en el 59,6%; las otras especies tuvieron un porcentaje mayor de aislamiento SDD o necesitaron dosis más altas del antimicótico para responder al tratamiento y R como era de esperar. Con respecto al voriconazol, todas las especies presentaron una susceptibilidad mayor al 94%, con excepción de C. krusei que mostró SDD en 36,4% y R en 18,2% de los casos (23). Los datos de C. parapsilosis con fluconazol y los de C. krusei con voriconazol confirmaron la existencia de diferencias de comportamiento a los antifúngicos según la región geográfica reiterando la importancia de estos estudios en el nivel local.
Correspondencia: Catalina de Bedout. Corporación para Investigaciones Biológicas (CIB). Carrera 72 A. N° 78B - 141, Barrio Robledo. Medellín - Colombia. Teléfono: (94) 4410855. Exts: 221 - 218; Fax: (94) 4415514. Dirección electrónica: cbedout@cib.org.co
Aclaración: Artículo escrito por encargo de la revista Infectio y desarrollado con absoluta independencia por parte de los autores, cuyas opiniones no reflejan necesariamente el pensamiento de la revista, de sus editores o del patrocinador del suplemento.
Referencias
1. Pappas PG. Invasive candidiasis. Infect Dis Clin North Am. 2006; 20(3):485-506. [ Links ]
2. Pelroth J, Choi B, Spellberg B. Nosocomial fungal infections: epidemiology, diagnosis and treatment. Med Mycol. 2007; 45:321-246. [ Links ]
3. Kollef MH, Napolitano LM, Salomkin JS, Wunderink RG, Bae IG, Fowler VG, et al. Health care-associated infection (HAI): a critical appraisal of the emerging treat-proceeding of the HAI summit. Clin Infect Dis. 2008; 47(2): 55-99. [ Links ]
4. Quindós G. Nosocomial candidemias and invasive candidiasis. Med Clin. 2010; 134(1):17-9. [ Links ]
5. Horn DL, Meofystos D, Anaissie EJ, Fishman JA, Steinbach WJ, Olyaei AJ, et al. Clinical characteristics of 2,019 patients with candidemia: data from the PATH Alliance Registry. Clin Infect Dis. 2009; 48:1695- 1703. [ Links ]
6. Neofytos D, Horn D, Anaisse E, Steinback W, Olyaei A, Fishman J, et al. Epidemiology and outcome of invasive fungal infection in adult hematopoietic stem cell transplant recipient: analysis of PATH Alliance Registry. Clin Infect Dis. 2009; 48:265-273. [ Links ]
7. Pfaller MA, Diekema DJ, Gibbs DL, Newell VA, Meis JF, Gould IM, et al. 1997-2005: An 8.5-year analysis of susceptibilities of Candida and Other Yeast Species to Fluconazole and Voriconazole by CLSI Standardized Disk Diffusion Testing. J Clin Microbiol. 2007; 45(6):1735-1745. [ Links ]
8. Leroy O, Gangneux JP, Montravers P, Mira JP, Gouin F, Sollet JP et al. Epidemiology, management, and risk factors for death of invasive Candida infections in critical care: a multicenter, prospective, observational study in France (2005-2006). Crit Care Med. 2009; 37:1612- 1618. [ Links ]
9. Pappas PG, Rex JH, Lee J, Hamill RJ, Larsen RA, Powderly W, et al. A prospective observational study of candidemia: epidemiology, therapy, and influences on mortality in hospitalized adult and pediatric patient. Clin Infect Dis. 2003; 37(5):634-643. [ Links ]
10. Zaoutis TE, Aragon J, Chu J, Berlin JA, Walsh TJ, Feudtner C. The epidemiology and attributable outcomes of candidemia in adults and children hospitalized in united state; a propensity analysis. Clin Infect Dis. 2005; 41(9):1232-1239. [ Links ]
11. Almirante B, Rodríguez D, Park BJ, Cuenca-Estrella M, Planes A, Almela M, et al. Epidemiology and predictors of mortality in case of Candida bloodstream infection: results from population-based surveillance, Barcelona, Spain, from 2002 to 2003. J Clin Microbiol. 2005; 43:1829-1835. [ Links ]
12. Hazen KC, Howell SA. Candida, Cryptococcus and other yeast of medical importance In: Murray PR, Baron EJ, Jorgensen JH, Landry Ml, Pfaller MA, editors. Manual of clinical Microbiology, 9th ed. Washington, DC: ASM press; 2007. p. 1762-1788. [ Links ]
13. Johnson EM. Rare and emerging Candida species. Current Fungal Infection Reports. 2009; 3:152-159. [ Links ]
14. Lockhart SR, Diekema DJ, Pfaller MA. The Epidemiology of Fungal Infections, In: Anaissie EJ, Phaller MA, editors. Clinical Mycology. 2nd ed. Oxford, UK: Elsevier; 2009. p. 1-14. [ Links ]
15. Dignani MC, Solomkin JS and Anaissie EJ. Candida. In: Anaissie EJ, Pfaller MA, editors. Clinical Mycology, 2nd ed. Oxford, UK: Elsevier; 2009. p. 197-229. [ Links ]
16. Pfaller MA, Diekema DJ. Epidemiology of invasive mycoses in North America. Crit Rev Microbiol. 2010; 36(1):1-53. [ Links ]
17. Nucci M, Queiroz-Telles F, Tobón AM, Restrepo A, Colombo AL. Epidemiology of opportunistic fungal infections in Latin America. Clin Infect Dis. 2010; 51(5):561-70. [ Links ]
18. Tavanti A, Davidson AD, Gow NA, Maiden MC, Odds FC. Candida orthopsilosis and Candida metapsilosis spp. nov. to replace Candida parapsilosis groups II and III. J Clin Microbiol. 2005; 43(1):284-92. [ Links ]
19. Sobel JD. Candidiasis. In: Hospenthal DR, Rinaldi MG editors. Diagnosis and treatment of human mycoses. New Jersey: Humana PressTotowa; 2008. p. 137-161. [ Links ]
20. Ramage G, Saville SP, Derek PT and Lopez-Ribot JL. Candida Biofilm: an Update. Eucaryotic Cell. 2005; 4:633-638. [ Links ]
21. Colombo A, Nucci M, Park BJ, Nouer SA, Arthington-Skaggs B, Damatta DA, et al. Epidemiology of candidemia in Brazil: a nationwide sentinel surveillance of candidemia in eleven medical centers. J Clin Microbiol. 2006; 44:2816-2823. [ Links ]
22. Arkinson BJ, Lewis RE Kontioyiannis DP. Candida lusitaniae fungemia in cancer patients; risk factors for amphotericine B failure and outcome. Med Mycol. 2008; 46:541-546. [ Links ]
23. Zuluaga A, de Bedout C, Agudelo CA, Hurtado H, Arango M, Restrepo A, Gonzalez A. Sensibilidad a fluconazol y voriconazol de especies de Candida aisladas de pacientes provenientes de unidades de cuidados intensivos en Medellín, Colombia (2001-2007). Rev Iberoam Micol, en prensa. [ Links ]
24. Pontón J. Utilidad de los marcadores biológicos en el diagnóstico de la candidiasis invasora. Rev Iberoam Micol. 2009; 26 (1):8-14. [ Links ]
25. Ellepola AN and Morrison CJ. Laboratory diagnosis of invasive candidiasis. J Microbiol. 2005; 43(5):65-84. [ Links ]
26. Montagna MT, Caggiano G, Borghi E and Morace G. The role of the laboratory in the diagnosis of invasive candidiasis. Drugs, 2009; 69(1):59-63. [ Links ]
27. Horvath LL, George BJ, Murray CK, Harrison LS, Hospenthal DR. Direct comparison of the BACTEC 9240 and BacT/ALERT 3D automated blood culture systems for candida growth detection. Clin Microbiol. 2004; 42:115-118. [ Links ]
28. McDonald LC, Weinstein MP, Fune J, Mirrett S, Reimer LG, Reller LB. Controlled comparison of BacT/ALERT FAN aerobic medium and BATEC fungal blood culture medium for detection of fungemia. J Clin Microbiol. 2001; 39(2):622-624. [ Links ]
29. Mirrett S, Reller LB, Petti CA, Woods CW, Vazirani B, Sivadas R, et al. Controlled clinical comparison of BacT/ALERT standard aerobic medium with BACTEC standard aerobic medium for culturing blood. J Clin Microbiol 2003; 41(6):2391-2394. [ Links ]
30. Yera H, Sendid B, Francois N, Camus D. Contribution of serological test and blood culture to early diagnosis of systemic candidiasis. Eur J Clin Microbiol Infect Dis. 2001; 2001:864-870. [ Links ]
31. Achkar JM and Fries B. Candida infections of genitouriunary tract. Clin Microbiol Rev. 2010; 25(2):253-273. [ Links ]
32. Charles PE. Multifocal Candida species colonization as a trigger for early antifungal therapy in critically ill patients: what about other risk factors for fungal infection? Crit Care Med. 2006; 34:913-914. [ Links ]
33. Agvald-Ohman C, Klingspor L, Hjelmqvist H, Edlund C. Invasive candidiasis in long-term patients at a multidisciplinary intensive care unit: candida colonization index, risk factors, treatment and outcome. Scand J Infect Dis. 2008; 40:145-153. [ Links ]
34. Wilson DA, Joyce MJ, Hall LS, Reller LB, Roberts GD, Hall GS, et al. Multicenter evaluation of Candida albicans peptide nucleic acid fluorescent in situ hybridization probe for characterization of yeast isolates from blood cultures. J Clin Microbio. 2005; 43: 2909-2912. [ Links ]
35. Pontón J. El diagnóstico microbiológico independiente del cultivo en la candidiasis invasora. Importancia de los marcadores fúngicos. Rev Iberoam Micol. 2006; 23: 20-25. [ Links ]
36. Matthews RC, Burnie JP, Tabaqchali S. Isolation of immunodominant antigens from sera of patients with systemic candidiasis and characterization of serological response to Candida albicans. J Clin Microbiol. 1987; 25(2):230-7. [ Links ]
37. Matthews R, Burnie J. Cloning of a DNA sequence encoding a major fragment of the 47 kilodalton stress protein homologue of Candida albicans. FEMS Microbiol Lett. 1989; 1;51(1):25-30. [ Links ]
38. Burnie J, Matthews R. The role of antibodies against hsp90 in the treatment of fungal infections. Drug News Perspect. 2003;16(4):205-10. [ Links ]
39. Mason AB, Brandt ME, Buckley HR. Enolase activity associated with a C. albicanscytoplasmic antigen. Yeast. 1989; 5 Spec:S231-9. [ Links ]
40. Pitarch A, Abian J, Carrascal M, Sánchez M, Nombela C, Gil C. Proteomics-based identification of novel Candida albicans antigens for diagnosis of systemic candidiasis in patients with underlying hematological malignancies. Proteomics. 2004; 4(10):3084-106. [ Links ]
41. Pitarch A, Jiménez A, Nombela C, Gil C. Decoding serological response to Candida cell wall immunome into novel diagnostic, prognostic, and therapeutic candidates for systemic candidiasis by proteomic and bioinformatic analyses. Mol Cell Proteomics. 2006; 5(1):79-96. [ Links ]
42. Clancy CJ, Clancy MJ, Nguyen M, Cheng S, Huang H, Fan G et al. Immunoglobulin G responses to a Panel of Candida albicans antigens as accurate and early markers for the presence of systemic candidiasis. J Clin Microbiol. 2008; 46(5): 1647-1654. [ Links ]
43. Persat FR, Topenot MA, Piens A, Thiebaut A, Dannaoui E, Picot S. Evaluation of different commercial ELISA methods for the serodiagnosis of systemic candidosis. Mycoses. 2002; 45:455-46. [ Links ]
44. White PL, Archer AE, Barnes RA. Comparison of non-culture methods for detection of systemic fungal infections, with emphasis on invasive Candida infections. J. Clin Microbiol. 2005; 43(5): 2181-2187. [ Links ]
45. White PL, Barton R, Guiver M, Linton CJ, Wilson S, Smith M, et al. A consensus on fungal polymerase chain reaction diagnosis?: a United kingdom-ireland evaluation of polymerase chain reaction methods for detection of systemic fungal infections. J Mol Diagn. 2006; July 8(3):376-84. [ Links ]
46. De Pauw B, Walsh TJ, Donnelly JP, Stevens DA, Edwards JE, Calandra T, et al. Revised definitions of invasive fungal disease from the European Organization in Research and Treatment of Cancer/Invasive Fungal Infections Cooperative Group and the National Institute of Allergy and Infectious Diseases Mycosis Study Group (EORTC/MSG) Consensus Group. Clin Infec Dis 2008; 46(12):1813-21. [ Links ]
47. Guiver M, LeviL, Oppenheim BA. Rapid identification of Candida species by TaqMan PCR. J Clin Pathol. 2001; 54:362-366. [ Links ]
48. Hsu MC, Chen KW, Lo HJ, Chen YC, Liao MH, Lin YH et al. Species identification of medically important fungi by use of realtime Light Cycler PCR. J Med Microbiol. 2003; 52:1071-1076. [ Links ]
49. Metwally L, Fairley DJ, Coyle PV, Hay RJ, Hedderwick S, McCloskey B, et al. Improving molecular detection of Candida DNA in whole blood: comparison of seven fungal DNA extraction protocols using real-time PCR. J Med Microbiol. 2008; 57(3):296-303. [ Links ]
50. Metwally L, Fairley DJ, Coyle PV, Hay RJ, Hedderwick S, McCloskey B, et al. Comparison of serum and whole blood specimens for the detection of Candida DNA in critically ill, non-neutropenic patients. J Med Microbiol. 2008; 57(Pt10):1269-72. [ Links ]
51. McMullan R, Metwally L, Coyle PV, Hedderwick S, McCloskey B, O'Neill HJ, et al. A prospective clinical trial of a real-time polymerase chain reaction assay for the diagnosis of candidemia in nonneutropenic, critically ill adults. Clin Infect Dis. 2008; Mar 15;46(6):890-6. [ Links ]
52. Bennett J. Is real-time polymerase chain reaction ready for real use in detecting candidemia? Clin Infect Dis. 2008; 46(6):897-8. [ Links ]
53. Hall LS, Wohlfield S, Roberts GD. Experience with the MicroSeq D2 large-subunit ribosomal DNA sequencing kit for identification of commonly encountered, clinically important yeast species. J Clin Microbiol. 2003; 41: 5099-5102. [ Links ]
54. Muñoz-Cadavid, C, Rudd S, Zaki S, Patel M, Moser M, Brandt ME, et al. Improving molecular detection of fungal DNA in FFPE tissues: comparison of five tissue DNA extraction methods using panfungal PCR. J Clin Microbiol 2010; 48(6): 2147-53. [ Links ]
55. Clinical Laboratory Standards Institute (CLSI). Reference method for broth dilution antifungal susceptibility testing of yeast. Approved standard M27-A3. Wayne, Pa: National Committee for Clinical Laboratory Standards; 2008. [ Links ]
56. Clinical Laboratory Standards Institute (CLSI). Method for antifungal disk diffusion susceptibility testing of yeast. Approved guideline M44-A. Wayne, Pa: National Committee for Clinical Laboratory Standards, 2004. [ Links ]
57. Clinical Laboratory Standards Institute (CLSI). Reference method for broth dilution antifungal susceptibility testing of yeast. Third informational supplement. M27-S3. Wayne, Pa: National Committee for Clinical Laboratory Standards; 2008. [ Links ]
58. Pfaller MA, Diekema DJ, Gibbs DL, Newell VA, Nagy E, Dobiasova S, et al. Candida krusei, a multidrug-resistant opportunistic fungal pathogen: Geographic and temporal trends from the ARTEMIS DISK antifungal surveillance program. J Clin Microbiol. 2008; 46: 515-521. [ Links ]
59. Pfaller MA, Diekema DJ, Gibbs DL, Newell VA, Ng KP, Colombo A, et al. Geographic and Temporal Trends in Isolation and Antifungal Susceptibility of Candida parapsilosis: a Global Assessment from the ARTEMIS DISK Antifungal Surveillance Program, 2001 to 2005. J Clin Microbiol. 2008; 43: 842-849. [ Links ]














