Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Infectio
Print version ISSN 0123-9392
Infect. vol.14 suppl.2 Bogotá Dec. 2010
1 Unidad de Infectología, Hospital Universitario San Ignacio. Bogotá, D.C., Colombia
Recibido: 08/07/2010; Aceptado: 30/08/2010
Resumen
Las infecciones por levaduras del género Candida sp. son cada vez más prevalentes en pacientes hospitalizados, especialmente en grupos de mayor riesgo como pueden ser pacientes con neoplasia hematológica bajo tratamiento de quimioterapia y en cuidados intensivos. La resistencia de Candida sp. representa un reto terapéutico que deja un menor número de posibilidades para el tratamiento de estas infecciones que se caracterizan, a su vez, por una alta morbimortalidad. Esta revisión describe los mecanismos de resistencia de Candida sp. a fluconazol y los factores de riesgo para la adquisición de éstos.
Palabras claves: fluconazol, Candida, Candida albicans, Resistencia a medicamentos, Farmacorresistencia microbiana, Resistencia a múltiples medicamentos, Farmacorresistencia micótica.
Abstract
Yeast infections of the genus Candida sp are becoming more prevalent in hospitalized patients, especially in high risk groups such as patients with hematologic malignancy undergoing chemotherapy and in intensive care units. Candida sp's resistance represents a therapeutic challenge that leaves fewer opportunities for the treatment of these infections which are characterized by high morbidity and mortality. This review describes Candida sp's resistance mechanisms to fluconazole and the risk factors for their acquisition.
Key words: Fluconazole, Candida, Candida albicans, therapeutic use, Drug Resistance, Microbial Drug Resistance, Multiple Drug Resistance, Fungal Drug Resistance.
Introducción
Después de la introducción de las primeras medicaciones antimicóticas en los años cincuenta con la aparición de los polienos, el surgimiento de nuevos medicamentos para infecciones micóticas sistémicas ha sido muy modesto si lo comparamos con el desarrollo de los agentes antibacterianos. El posterior surgimiento de los azoles en la década de los setenta y los triazoles, con su representante más importante, el fluconazol (FCZ), a partir de los años ochenta, ha permitido su uso más generalizado, entre otras razones porque coincidió con la pandemia de sida y las indicaciones terapéuticas derivadas de ésta. Además de las ventajas farmacocinéticas del FCZ en relación con su posología, también la disponibilidad en el mercado facilitó su uso; sin embargo, como consecuencia de su uso tan generalizado, se ha desarrollado en levaduras como Candida sp. el riesgo potencial de resistencia. Este fenómeno que se encuentra ampliamente documentando en la literatura desde 1988.
En la actualidad, la resistencia informada al FCZ en especies de Candida albicans es cercana al 3%, con variaciones regionales y locales muy notorias (1,2,3). Hasta el 10% de los pacientes con sida y candidiasis mucocutánea presentaba resistencia a FCZ antes del surgimiento de la terapia antiretroviral altamente efectiva (TARAE), la cual se relacionó con las dosis administradas o la duración del tratamiento, por lo que se interpretó como un tipo de resistencia adquirida. En los últimos años, con el uso de TARAE, los episodios de candidiasis mucocutánea recurrente son cada vez menos frecuentes y, por esta condición, la resistencia a los azoles actualmente no es de gran impacto en los países industrializados. Esto, sin embargo, no es extrapolable a países en condiciones de extrema pobreza, como los del continente africano, donde se siguen reportando porcentajes significativos de Candida sp. resistente a azoles aisladas en orofaringe de pacientes con VIH, con informes de Candida albicans resistente a fluconazol hasta en el 9,5% (4). En Colombia, Gutiérrez y colaboradores, en muestras de orofaringe de 56 pacientes con candidiasis oral pseudomembranosa con infección por VIH/sida, encontraron resistencia al fluconazol del 20,8% para Candida sp. y 6,3% con patrón Sensible Dosis Dependiente (SDD)(5). No menos importante es la frecuencia de Candida sp. como causante de otras infecciones comunes como vulvovaginitis, que se reportan con resistencia a azoles (6,7,8) y complicaciones infecciosas en huéspedes inmunosuprimidos que reciben terapias inmunosupresoras o terapia biológica que son motivo de preocupación por el cambio en la epidemiología de este tipo de infecciones (9).
Mecanismos de resistencia (10)
Los derivados triazólicos como el FCZ inhiben de forma selectiva la enzima 14 α esterol demetilasa en la síntesis del ergosterol, que es dependiente del citocromo p450. La depleción del ergosterol, en conjunto con la acumulación de compuestos intermedios en la síntesis del mismo, conlleva a una pérdida de la funcionalidad de la membrana plasmática (10, 11).
Se describen tres posibles mecanismos en la génesis de la resistencia: el primero es la modificación de la enzima blanco; el segundo, la incapacidad de alcanzar concentraciones adecuadas del antibiótico en el sitio de acción por la presencia de barreras de permeabilidad o sistemas de bombeo activo; y por último, la inactivación del antibiótico por modificación del mismo. De todos éstos, en el caso de los azoles sólo se conocen los dos primeros como potenciales causas de resistencia.
En las especies de Candida y en muchos otros hongos, el gen ERG11 se encarga de la síntesis de la Erg11p o la enzima 14 α demetilasa indispensable para la síntesis del ergosterol. La resistencia a los azoles se ha descrito en aislamientos clínicos en los que se demuestra una disminución de la expresión de dicha enzima o la presencia de mutaciones específicas que la afectan en su estructura o función; y puede ser inducida por regulación negativa de su síntesis tras la exposición prolongada al fluconazol (12). Otras enzimas involucradas en la síntesis del ergosterol como la Î 5 - 6 desaturasa pueden también ser responsables de este fenómeno (13).
En relación con el sistema de transporte activo a través de bombas y con base en modelos experimentales con otras levaduras no patógenas como Sacharomyces cerevisiae, se ha logrado
determinar la presencia de un conjunto de genes denominados factores de resistencia múltiple o pleiotrópica a fármacos (PDR: Pleiotropic Drug Resistance) dado que confieren resistencia a múltiples medicamentos sin ninguna semejanza estructural definida.
El primero de ellos definido en Candida spp. fue MDR1, el cual codifica una proteína MDR1p que pertenece a una superfamilia de proteínas transportadoras transmembranales con 6 dominios, (MFS: Major Facilitators Superfamily). Se ha demostrado en ratones que la sobreproducción de esta proteína confiere resistencia al FCZ (14).
Otros de los genes caracterizados se denominan CDR1 y CDR2 que codifican una proteína transportadora del tipo ABC (ATP Binding Cassette), también de tipo multifuncional para una variedad de compuestos. En relación con estos rasgos de resistencia adquiridos, se sabe, por ejemplo, que algunos de estos además se relacionan no sólo con resistencia a los azoles sino con mayor virulencia de la levadura, como ocurre en el caso de C glabrata con sobreexpresión de la mutación CgPDR1 (15).
La evidencia a favor de estos mecanismos de resistencia se apoya en la presencia de aislamientos clínicos de pacientes con sida sometidos a terapia con FCZ por largos periodos de tiempo con niveles hasta diez veces mayores de los habitualmente presentados para productos como la proteína sintetizada de CDR1, y la mayor susceptibilidad de las cepas al FCZ y otros azoles cuando se produce deleción de estos genes (12).
Poblaciones de riesgo de infección o colonización por Candida sp. resistente a azoles
Con el aumento de la disponibilidad de recursos tecnológicos para el cuidado de pacientes con patologías neoplásicas, reumatológicas o críticamente enfermos, el riesgo de infecciones micóticas sistémicas (16) reemerge como un problema potencial que se ve agravado por la resistencia a los azoles y en particular al FCZ.
Este aspecto debe llamar la atención de todas aquellas personas que participen en el tratamiento de este tipo de pacientes, debido a que la candidiasis sistémica tiene una mortalidad atribuible cercana al 40% en las diferentes series, con tasas de mortalidad anual de 1,2 por 100.000 en pacientes oncológicos (16, 17, 18), que pueden ser aun mayores si la especie de Candida causante de la infección además es resistente a FCZ.
A partir de la introducción del fluconazol en 1990, se generó una presión selectiva a través del uso de este agente para tratamiento o profilaxis, que pudo generar selección de microorganismos resistentes. Se determinaron cambios en la ecología de la flora intrahospitalaria en varios estudios que demostraron que tras el uso de fluconazol se incrementaba la colonización por Candida no albicans. Esto fue claramente visible en especial con la estrategia de profilaxis en pacientes con neoplasias hematológicas bajo protocolos de quimioterapia.
En estudios de casos y controles se documentó igualmente que en pacientes con sida en tratamiento para candidiasis mucocutánea, el antecedente de consumo previo de azoles y los estados avanzados de inmunosupresion con bajos conteos de CD4 se asociaban con emergencia de resistencia al fluconazol (19). En un estudio posterior multivariado no se encontró relación con el conteo de CD4 pero, en cambio, la historia de uso de medicamentos antituberculosos o quinolonas se asoció con la pérdida de susceptibilidad a fluconazol por la supresión de la flora bacteriana endógena (20,21).
La determinación de factores de riesgo para resistencia al fluconazol y candidemia en pacientes no HIV se ha estudiado, aunque no tan extensamente. En algunas series de casos pequeñas en pacientes neutropénicos se ha documentado la presencia de infecciones por C. krusei que se ha asociado con la exposición previa a fluconazol, la neutropenia severa y el antecedente de leucemia aguda. En el caso de C. glabrata, el uso previo de anfotericina B, antibióticos de amplio espectro, uso de catéteres intravenosos centrales, hemodiálisis y tumores sólidos se han asociado como facilitadores de la colonización e infección por este microorganismo (21). Algunos estudios también han asociado el uso profiláctico del fluconazol (22). Se presenta habitualmente un patrón de múltiples mecanismos de resistencia (mutaciones puntuales en sitio blanco de acción enzimático y bombas de expulsión del antimicótico, especialmente). (21,23). De forma indirecta se ha demostrado cómo los pacientes con candidemias resistentes al fluconazol tenían antecedente de haberlo recibido por lo menos dos semanas antes (50% vs. 19,2% (p< 0,017) (24). En la serie de Chen y colaboradores (17), la mortalidad por candidemia se asoció a la presencia en el análisis univariado de choque, trombocitopenia, PCR > 100 mg /dl, BUN mayor a 20 mg / dl, y puntuación de Apache II mayor de 10 puntos. En el análisis multivariado, estos mismos autores demostraron que la presencia de trombocitopenia fue el único factor asociado al desenlace primario (mortalidad). Al realizar el análisis final de los casos, cuando se redujo de forma arbitraria el CIM a menos de 2μg /ml para considerar resistencia al fluconazol en un análisis post hoc, se obtuvo significancia estadística para el desenlace primario (17).
Takakura y colaboradores realizaron un programa de vigilancia y evaluaron sobrevida en aquellos pacientes con infecciones por Candida en torrente sanguíneo y factores de riesgo relacionados con resistencia al fluconazol. Encontraron que el 4,6 % de 326 aislamientos eran resistentes al FCZ; en el análisis univariado se documentó que la edad avanzada, la presencia de neoplasia hematológica y la neutropenia se correlacionaban con la resistencia al fluconazol.
Sin embargo, en el análisis multivariado sólo fue estadísticamente significativa la presencia de neoplasia hematológica de base como factor de riesgo (OR 6,6 con IC 95% de 1,6 a 26,9 con p < 0,009). La sobrevida calculada a 30 días fue de 68,4%. En el caso de candidiasis sistémica en el análisis multivariado se encontró estadísticamente significativo como factor protector la remoción del catéter central (OR 6 IC 95% 2,2 a 16,1 p< 0,001) y el uso de terapia antifúngica apropiada; definida como: elección adecuada de agente antimicótico según susceptibilidad antifúngica, dosis diaria apropiada y duración óptima del tratamiento con un tiempo mínimo de diez días. (OR 2,1 IC 95% 1.1 a 4,1 p< 0.03) (25) Lin y colaboradores encontraron en un estudio de casos y controles que el uso previo de antibioticoterapia de amplio espectro podría convertirse en un factor predictor de colonización o infección por Candida sp. resistente a azoles (C glabrata y C Krusei) y en particular con el uso de piperacilina-tazobactam (OR 4,15 95% IC 1,04 - 16,50) y vancomicina (OR 6,48 95% IC 2,20 - 19,13)(26) tabla 1
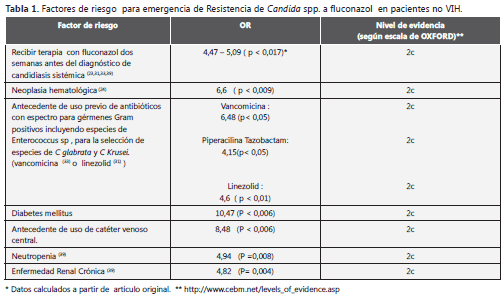
Lee y colaboradores (27) evaluaron los factores de riesgo de candidemia por C glabrata resistente a azoles en un estudio con metodología de casos y controles realizado en el periodo comprendido entre 2003 y 2007 en tres instituciones de alta complejidad, documentando como predictores: uso previo de fluconazol (OR 2.3 IC 95% 1.3-4.2), así como el uso previo de linezolid (OR 4.6 IC 95% 2.2-9.3). Este último hallazgo fue explicado por los autores: dado el espectro del linezolid para gérmenes gram positivos, incluido Enterococcus sp., al parecer generar cambios en la flora gastrointestinal podría favorecer la posibilidad de colonización por especies de Candida sp. Sin embargo, la plausibilidad de este hallazgo queda en entredicho al no encontrar una explicación de cómo éste favorece la colonización por una especie de candida resistente a azoles sobre la emergencia de una especie prevalente como Candida albicans, habitualmente susceptible.
Por otra parte, Tumbarello y colaboradores (28) en un estudio de casos y controles documentaron como factores predictores de resistencia a azoles nuevamente la exposición previa a azoles, (OR) 12,24, IC 95% 1,77-84,39 P < 0.01, antecedente de Diabetes mellitus(OR 10.47, 95% CI 1,96-55,96, P < 0,006) y uso de acceso venoso central previamente (OR 8,48, 95% CI 1,82-39,36, P < 0,006).
A pesar de considerar que en Latinoamérica la situación puede ser muy similar a la descrita en otros lugares del planeta, un estudio multicéntrico de vigilancia de resistencia en aislamientos de candida en sangre realizado en varios países de Sudamérica no encontró ninguna cepa resistente al fluconazol en cinco instituciones hospitalarias de tercer nivel; la frecuencia de aislamientos de candida spp fue: Candida albicans 42%, C. tropicalis 24%, C. parasilopsis 21%, C. glabrata 7% (29).
En Colombia, Rivas y colaboradores (30), en una serie de casos de candidiasis sistémica de pacientes oncológicos del Instituto Nacional de Cancerología, documentaron resistencia al fluconazol en 19,6% de los aislamientos, que correspondían en su mayoría (51,6%) a Candida albicans, seguida por C tropicalis (34,2%) de un total de 181 muestras. Sin embargo, en este caso debe tenerse en cuenta el sesgo de selección por cuanto esta institución corresponde a un centro de remisión de pacientes con cáncer. Sánchez y colaboradores también del Instituto Nacional de Cancerología, en una cohorte retrospectiva correspondiente a los años comprendidos entre 1999 y 2009, en 164 aislamientos de Candida sp.en hemocultivos no documentaron resistencia pero sí sensibilidad disminuida dosis dependiente para C tropicalis y C albicans en un 17 y 11%, respectivamente. Además de esto, al realizar un análisis de los factores predictores de mortalidad ajustado por especie de Candida sp. encontraron como variables predictoras: tumor hematológico, sensibilidad disminuida a azoles, cambio de antifúngico, uso de esteroides, presencia de síndrome de respuesta inflamatoria sistémica (SIRS) y diseminación fúngica (31). En otro estudio de nivel local, Torres D y colaboradores encontraron en el Hospital Universitario San Ignacio de Bogotá, en un trabajo que evaluaba tres técnicas comparativas para el estudio de resistencia antifúngica en levaduras del género Candida sp. (respectivamente M27 -A2 de CLSI, difusión en disco y ETest) de 90 aislamientos de Candidiasis invasiva, que la resistencia al fluconazol fue de 0%, con concentración inhibitoria mínima (CIM) en rango de sensibles dosis dependientes (SDD) en 2,2% y susceptibles el 97,8% de los aislamientos estudiados. Sin embargo, la mortalidad atribuible a este tipo de infecciones fue del 38% similar a lo previamente descrito (30). Lo anterior pone en evidencia que la realidad de la resistencia de las especies de Candida sp. a azoles es heterogénea y que depende posiblemente de múltiples factores globales, regionales y locales, lo que explica por qué en una misma ciudad, instituciones hospitalarias similares en complejidad de atención pero con calidades diferentes del tipo de pacientes que atienden, poseen epidemiología tan diversa en este tipo de aislamientos.
Sistemas de vigilancia de resistencia antimicótica (33)
A partir de 1995, la Sociedad Americana de Microbiología (ASM en inglés) ha orientado la creación de sistemas de vigilancia para la aparición de resistencia a antimicrobianos. De allí se deriva la necesidad de hacer un uso prudente de los antimicóticos y en particular de los azoles, para determinar la frecuencia de la resistencia y así guiar los programas de control del uso de antimicóticos y delimitación de la progresión de la resistencia. De todas las infecciones micóticas sistémicas, es la candidiasis la que cobra mayor importancia por su frecuencia y hacia la cual se dirigen grandes esfuerzos en los programas de vigilancia.
Estos programas son más sencillos que los estudios de sobrevida poblacionales. Sólo se interpretan a la luz de una población específica en un tiempo determinado y no intentan encontrar asociaciones para determinar factores de riesgo. Sin embargo, para que estos programas de vigilancia cumplan con su función, se debe empezar por estandarizar los procesos de la toma y transporte de las muestras clínicas, su aislamiento, identificación y determinación de susceptibilidad por parte de un laboratorio central de referencia que genere información y retroalimentación a los múltiples centros participantes. En Colombia, Cortés J y colaboradores reportaron en 27 hospitales de la red GREBO (Grupo para el estudio de la resistencia bacteriana de Bogotá), correspondientes a cinco ciudades colombianas, la presencia de fungemia en 4,1% de los hemocultivos positivos de aislamientos en la Unidad de Cuidado Intensivo (UCI) y en servicios hospitalarios (no UCI), de los cuales el 99% correspondió a levaduras del género Candida sp., en orden de frecuencia C. albicans, C tropicalis, C parasilopsis seguido por otras especies de Candida no tipificables (32).
Las poblaciones en estudio pueden ser estratificadas por condiciones clínicas predisponentes, grupos etarios y especies aisladas, dado que en los últimos años se han encontrado variaciones en las frecuencias de las levaduras aisladas con tendencia creciente a aislamientos de Candida no albicans. Esto último es relevante en tanto que especies de Candida son intrínsecamente resistentes al FCZ como es el caso de C. krusei, C.glabrata y permitiría un enfoque terapéutico diferente en estos casos (33,34). Algunos autores han logrado demostrar que al utilizar un enfoque de tratamiento frente a Candida sp. resistente a azoles, según susceptibilidad in vitro, podría modificar el desenlace en términos de disminución de mortalidad atribuible por candidemia secundaria a C glabrata (p:0,02). El concepto, sin embargo, podría ser extrapolable a las otras especies de Candida resistentes a azoles (35).
El uso cada vez más difundido de las pruebas de susceptibilidad para hongos, y en particular para levaduras, a través del protocolo M27A del Clinical Laboratories Standard Institute (CLSI) ha permitido especificar los puntos de corte para el FCZ considerando susceptibles los aislamientos de Candida albicans con CIM menores de 8 μg/ml, sensibilidad dosis dependiente con CIM entre 16 y 32 μg/ml y resistente con CIM mayores a 64 μg/ml. Sin embargo, estos datos no son extrapolables a todas las condiciones clínicas pues los aislamientos utilizados para validar estos puntos de corte fueron
tomados de aislamientos clínicos de pacientes con sida y candidiasis mucocutánea, a pesar de lo cual se han venido utilizando de forma generalizada para todas las infecciones por Candida incluyendo Candida no albicans. A pesar de este sesgo, algunos estudios de candidemia han mostrado una buena correlación entre la falla terapéutica y la resistencia in vitro para el FCZ (37). Esto es importante por la emergencia de nuevas cepas de Candida resistentes al fluconazol y causantes de enfermedad en huéspedes susceptibles, a las que antes sólo se les confería importancia apenas como colonizantes o contaminantes.
Por otro lado, debe recordarse que no se puede interpretar la resistencia in vitro de forma aislada por cuanto las fallas terapéuticas no dependen sólo de este aspecto sino también de la penetración del medicamento y sus propiedades farmacocinéticas, además de los propios factores inmunes del huésped favorecedores de la infección (36).
Toda esta información de un perfil de sensibilidad conocido en un espacio y tiempo, permite un uso más racional del recurso antimicótico y evita la resistencia. Además la detección de cepas resistentes permitiría evaluar también los mecanismos, por ejemplo la determinación de la presencia de MDR y CDR denominado fenotipo RR con resistencia al fluconazol e itraconazol, en tanto que la expresión solamente de MDR y no de CDR conlleva una resistencia al fluconazol y sensibilidad al itraconazol denominado fenotipo RS. Este último ha mostrado en estudios de tipo experimental una potencial susceptibilidad a los nuevos azoles en desarrollo como el posaconazol, recientemente introducido para la práctica clínica y el ravuconazol (34).
Además de lo mencionado, en los programas de vigilancia de resistencia deben implementarse otras medidas complementarias que eviten la aparición de resistencia a antimicóticos, empezando por un adecuado abordaje diagnóstico de estas entidades, uso temprano y apropiado de los antimicrobianos (20); aplicación de medidas orientadas a disminuir la colonización fúngica, manejo quirúrgico agresivo cuando sea recomendado para drenar el foco infeccioso, e implementación de protocolos de tratamiento para cada institución que se acomoden a las políticas locales (37).
Factores de riesgo para la emergencia de resistencia al fluconazol
La resistencia de Candida spp. al FCZ es un riesgo potencial si se tiene en cuenta el número cada vez mayor de pacientes que son sometidos a inmunosupresion posquimioterapia para tratamiento de las neoplasias hematológicas o tumores sólidos, y a la cantidad también creciente de individuos en las UCI con requerimiento de monitorización invasiva. Los estudios que abordan este problema tienen debilidades de carácter metodológico, motivo por el cual en la mayoría de los casos se cuenta con niveles de evidencia moderados. Dentro de los estudios más importantes se destaca como grupo blanco a los pacientes con neoplasias hematológicas que presentan susceptibilidad disminuida como consecuencia del uso profiláctico del fluconazol, que genera resistencia, de la presión de selección que favorece la aparición de numerosas infecciones por Candida no albicans.
Durante los primeros estudios publicados se encontraron asociaciones con el uso de FCZ profiláctico de forma discriminada y la selección de levaduras con mecanismos de resistencia a este último y, en particular, en el grupo de pacientes con infección por el pasar del tiempo y el progreso en los esquemas antirretrovirales, la utilidad del uso generalizado de esta opción terapéutica fue reemplazada y el número de pacientes con esta condición resultó más infrecuente. Una reciente revisión sistemática publicada por Brion y colaboradores (38), quienes seleccionaron doce estudios clínicos controlados, encontraron que el uso de terapia profiláctica a fluconazol puede asociarse con la colonización de levaduras del género Candida sp con sensibilidad reducida o resistencia al fluconazol (RR 1,44, 95% CI 1,05- 1,96) con un NNT de 26; pero no fue posible concluir si existe un mayor riesgo de infección invasiva por estas últimas y el tamaño de muestra no permitió extrapolar estos datos a las Candidas no albicans. Garnacho - Montero y colaboradores en una publicación del presente año sobre un estudio de cohorte prospectivo, llama la atención sobre la heterogeneidad en la presentación de resistencia en las diferentes especies de Candida no albicans. Durante este estudio, que reunió 226 episodios de candidemias en una institucion hospitalarias de alta complejidad en España, se encontró que el 53% de los episodios correspondió a especies de Candida no albicans pero sólo el 18,2% de estos presentó resistencia al fluconazol. Los factores independientes de resistencia al fluconazol en el análisis multivariado fueron: neutropenia (OR 4,94 IC 95% 1,5 - 16,20 p=0,008), Enfermedad Renal Cronica (OR 4,82 IC 95% 1,47 - 15,88 p=0,01), y exposición previa al fluconazol (OR 5,09 IC 95% 1,66 - 15,6 p=0,004). Este último posee limitaciones por ser un estudio que involucra población de un solo centro asistencial, donde no se realizó un registro de los antimicrobianos utilizados previamente en estos pacientes que en estudios anteriores han mostrado ser relevantes, especialmente para especies de C krusei y C glabrata. Sin embargo, su aporte es poner de manifiesto la dificultad de caracterización epidemiológica en este escenario, lo cual podría dar resultados en muchos casos contradictorios (40). Posiblemente los mayores aportes de este estudio son la confirmación de que el grupo de pacientes con neoplasia hematológica es el de mayor relevancia y la asociación estadísticamente significativa con la variable Neutropenia (40), esta última determinada por primera vez en un trabajo clínico.
En los últimos años se han entendido de forma más completa los mecanismos de resistencia de las levaduras tipo Candida al FCZ y, en particular, el grupo de Candida no albicans ha surgido como un problema en los pacientes con neoplasias hematológicas, que son los que han recibido una mayor atención por cuanto es una población claramente identificada en riesgo.
Teniendo en cuenta que el fenómeno de la presión de selección por el uso de FCZ no ha sido reproducido en los seguimientos de pacientes bajo estas condiciones, su real implicación en este fenómeno de resistencia se ha cuestionado seriamente y algunos autores abogan más por el perfil diferencial de susceptibilidad a los azoles, dependiendo de las características propias de cada especie de levadura.
Conclusiones
Aunque el fenómeno de resistencia de Candida al FCZ no es prevalente, según la literatura mundial, existe un grupo de pacientes con patologías y condiciones predisponentes que deben ser de especial atención como aquellos con patologías neoplásicas de tipo hematológico. En nuestro medio se desconoce la incidencia real de este fenómeno y por las razones hasta aquí expuestas es necesario plantear estudios con mayor fortaleza metodológica para encontrar asociaciones que permitan inferir factores de riesgo de esta seria infección micótica. Es claro, además, que se debe contar con estudios que involucren poblaciones con diferentes condiciones médicas y fortalecer los programas de vigilancia antimicótica en nuestras instituciones para permitirnos llegar a conclusiones más cercanas a la realidad.
Conflicto de intereses
No se declaran conflictos de intereses.
Correspondencia: Carlos Gómez. Unidad de infectología, Hospital Universitario San Ignacio. Bogotá D.C., Colombia. Cra 7 No. 40-62, 2do piso. Teléfono 01-57-3232667, PBX 01-575946161. Dirección electrónica: chgomez@husi.org.co.
- Aclaración: Artículo escrito por encargo de la revista Infectio y desarrollado con absoluta independencia por parte de los autores, cuyas opiniones no reflejan necesariamente el pensamiento de la revista, de sus editores o del patrocinador del suplemento.
Referencias
1. Lorian V. Antibiotics in laboratory medicine. In: Lippincott Williams & Wilkins, editors. Antifungal Drugs: Mechanism of Action, Drug resistance, Susceptibility Testing and Assays of activity in biological fluids. 5th ed. Barcelona: Wolters Kluwer Health. 2005. P. 226-265. [ Links ]
2. Nightingale CH, Murakawa T, Ambrose PG, editors. Antimicrobial pharmacodynamics in theory and clinical practice. New York: Marcel Dekker; 2002. p. 285-302. [ Links ]
3. Wang JL, Chang SC, Hsueh PR, Chen YC. Species distribution and fluconazole susceptibility of Candida clinical isolates in a medical center in 2002. J Microbiol immunol infect. 2004: 236-241. [ Links ]
4. Enwuru CA, Ogunledun A, Idika N, Enwuru NV, Ogbonna F, Aniedobe M, et al. Fluconazole resistant opportunistic oro-pharyngeal candida and non-candida yeast-like isolates from HIV infected patients attending ARV clinics in Lagos, Nigeria. African Health Sciences 2008; 8(3): 142-148. [ Links ]
5. Gutiérrez C, Bedout C, Tobon AM, Cano LE, Arango M, Tabares AM, et al. Sensibilidad a fluconazol y voriconazolde aislamientos de Candida spp., obtenidos de mucosa oral de pacientes con sida. Infectio 2007; 11(4): 183-189. [ Links ]
6. Donders GG,Babula O,Bellen G,Linhares IM,Witkin SS. Mannosebinding lectin gene polymorphism and resistance to therapy in women with recurrent vulvovaginal candidiasis. BJOG 2008;115 (10):1225-31. [ Links ]
7. Alburquerque OC; Hermosilla DG y Tapia PC. Distribución y susceptibilidad a fluconazol de levaduras del género Candida aisladas en pacientes hospitalizados y ambulatorios. Rev. chil. infectol. 2009; 26(5):435-439. [ Links ]
8. Panizzo M; PérezC y Maniscalchi, MT. Susceptibilidad in vitro a los antifúngicos de Candida sp.. y serotipos de Candida albicans aisladas de pacientes con vaginitis primaria y recurrente. Rev. Soc. Ven. Microbiol. 2000; 20(1). [ Links ]
9. Silva V. Diaz J, Febre N y Red de diagnostico en micologia medica. Vigilancia de la resistencia de levaduras a antifúngicos. Rev. chil. infectol. 2002;19 (2):149-156. [ Links ]
10. Hernaez ML, Pla Jesús, Nombela C. Aspectos moleculares y genéticos de la resistencia a azoles en Candida albicans. Rev. Iberoam Micol. 1997; 14:150-154. [ Links ]
11. White T, Marr K, Bowden R. Clinical, cellular, and Molecular factors that contribute to antifungal Drug resistance. Clinical Microbiology Review. 1998 Apr; 11(2):382-402. [ Links ]
12. Martínez M, López-Ribot JL, Kirkpatrick WR, Bachmann SP, Perea S, Ruesga MT, et al. Heterogeneous mechanisms of azole resistance in Candida albicans clinical isolates from an HIV-infected patient on continuous fluconazole therapy for oropharyngeal candidosis. J Antimicrob Chemother. 2002 Mar;49(3):515-24. [ Links ]
13. Casalinuovo IA, Di Francesco P, Garaci E. Fluconazole resistance in Candida albicans: a review of mechanisms. Eur Rev Med Pharmacol Sci. 2004; 8:69-77. [ Links ]
14. Albertson GD, Niimi M, Cannon RD, Jenkinson HF. Multiple efflux mechanisms are involved in Candida albicans fluconazole resistance. Antimicrob Agents Chemother 1996; 40(12):2835-41. [ Links ]
15. Ferrari S, Ischer F,Calabrese D, Posteraro D, Sanguinetti M, Fadda G et al. Gain of Function Mutations in CgPDR1 of Candida glabrata Not Only Mediate Antifungal Resistance but Also Enhance Virulence. PLoS Pathogens 2009 Jan; 5(1):1-17.,Vol 5, Issue 1. e1000268.Pg: 1-17. [ Links ]
16. Bille J, Marchetti O, Calandra T. Changing face of health care associated fungal infections. Current Opinion in infectious diseases. 2005;18: 314-319. [ Links ]
17. Chen TC, Chen YH, Tsai JJ, Peng CF, Lu PL, Chang K, et al. Epidemiologic analysis and antifungal susceptibility of Candida blood isolates in southern Taiwan. Microbiol Inmmunol Infect.2005; 38:200-210. [ Links ]
18. Carnuto MM, Gutiérrez Rodero F. Antifungal drug resistance to azoles and polyenes. The Lancet infectious diseases, 2002 Sept; 2:550-563. [ Links ]
19. Maenza JR, Keruly JC, Moore RD, Chaisson RE, Merz WG, Gallant JE. Risk factors for fluconazole resistant candidiasis in human immunodeficiency virus infected patients. J infect Dis. 1996; 173:219-25. [ Links ]
20. Clancy C.J., Kauffman CA, Morris A. Correlation of fluconazole MIC and response to therapy for patients with candidemia due to C albicans and non C albicans spp: results of a multicenter prospective study of candidemia.Clin Infect Disease 1998;27: 938. [ Links ]
21. Redding SW, Kirkpatrick WR, Saville S, Coco BJ, White W, Fothergill A, et al. Multiple patterns of resistance to fluconazole in Candida glabrata isolates from a patient with oropharyngeal candidiasis receiving head and neck radiation. J Clin Microbiol. 2003 Feb;41(2):619-22. [ Links ]
22. Kunova A, Trupl J, Demitrovicova A, Jesenska Z, Grausova S, Grey EMicrob, et al. Eight-year surveillance of non-albicans Candida spp. in an oncology department prior to and after fluconazole had been introduced into antifungal prophylaxis. Drug Resist. 1997 Fall;3(3): 283-7. [ Links ]
23. Sanglard D, Ischer F, Calabrese D, Majcherczyk PA, Bille J. The ATP binding cassette transporter gene CgCDR1 from Candida glabrata is involved in the resistance of clinical isolates to azole antifungal agents. Antimicrob Agents Chemother. 1999 Nov;43(11):2753-65. [ Links ]
24. Baddley JW, Patel M, Jones M, Cloud G, Smith AC, Moser SA. Utility of real-time antifungal susceptibility testing for fluconazole in the treatment of candidemia. Diagn Microbiol Infect Dis. 2004 Oct;50(2):119-24. [ Links ]
25. Takakura S, Fujihara N, Saito T, Kudo T, Iinuma Y, Ichiyama S, et al. Clinical factors associated with fluconazole resistance and shortterm survival in patients with Candida bloodstream infection. Eur J Clin Microbiol Infect Dis. 2004 May;23(5):380-8. [ Links ]
26. Lin M, Carmeli Y, Zumsteg J, Flores E, Tolentino J, Sreeramoju P, et al. Prior Antimicrobial Therapy And Risk For Hospital-Acquired Candida Glabrata And Candida Krusei Fungemia: A Case-Case-Control Study. Antimicrobial Agents And Chemotherapy, 2005 Nov; 49(11):4555-4560. [ Links ]
27. Lee I, Fishman N, Zaoutis T, Morales K, Weiner M, Synnestvedt M et al. Risk Factors for Fluconazole-Resistant Candida glabrata Bloodstream Infections. Arch Intern Med. 2009;169(4):379-383. [ Links ]
28. Klevay MJ, Ernst EJ, Hollanbaugh JL, Miller JG, Pfaller MA, Diekema DJ. Therapy and outcome of Candida glabrata versus Candida albicans bloodstream infection. Diagn Microbiol Infect Dis. 2008 Mar;60(3):273-7. [ Links ]
29. Godoy P, Tiraboschi I.N, Severo L:C, Et. al. Species Distirbution and Antifungal Susceptibility Profile of Candida spp. Bloodstream isolates from Latin american Hospitals. Mem Inst Oswaldo Cruz, 2003 April; 98(3):401-405. [ Links ]
30. Torres D, Alvarez C, Rondon M. Fluconazole susceptibility of invasive Candida sp isolates as determined by three methods. Bogota - Colombia. Rev Chil Infect 2009; 26(2):135-143. [ Links ]
31. Pfaller MA, Diekema D.J. Minireview: Role of Sentinel surveillance of Candidemia: Trends in species distribution and antifungal susceptibility, Journal of Clinical microbiology 2002 Oct;40(10):3551-3557. [ Links ]
32. Sanchez R, Rivas P, Cuervo SI, Cortes J. Frecuencia y factores predictores de mortalidad asociados a candidemia em pacientes com cáncer (1999-2009) Infectio 2010 14 (S1) Pág.:39 [ Links ]
33. Almirante B, Rodríguez D, Park BJ, Cuenca-Estrella M, Planes AM, Almela M, et al. Epidemiology and predictors of Mortality in cases of Candida Bloodstream infection: Results for population Based Surveillance, Barcelona, Spain, from 2002 to 2003. J Clin Microbiol. 2005. Vol. 43. No. 4. p:1829-1835. [ Links ]
34. Pfaller MA, Diekema DJ, Messer SA, Boyken L, Hollis RJ. Activities of fluconazole and voriconazole against 1,586 recent clinical isolates of Candida species determined by Broth microdilution, disk diffusion, and Etest methods: report from the ARTEMIS Global Antifungal Susceptibility Program, 2001. J Clin Microbiol. 2003 Apr;41(4):1440-6. [ Links ]
35. Klevay MJ, Ernst EJ, Hollanbaugh JL, Miller JG, Pfaller MA, Diekema DJ. Therapy and outcome of Candida glabrata versus Candida albicans bloodstream infection. Diagn Microbiol Infect Dis 2008; 60: 273-277. [ Links ]
36. Kantarjian HM, O'Brien S, Smith TL, Cortes J, Giles FJ, Beran M, et al. Results of treatment with hyper-CVAD, a dose-intensive regimen, in adult acute lymphocytic leukemia. J Clin Oncol. 2000; Feb;18(3): 547-61. [ Links ]
37. Michalopoulos AS, Geroulanos S, Mentzelopoulos S. Determinants of candidemia and Candidemia relathed Dead in cardiothoracic ICU patients. CHEST 2003; 124:2244 -2255. [ Links ]
38. Brion LP, Uko SE, Goldman DL. Risk of resistance associated with fluconazole prophylaxis: Systematic review. Journal of Infection 2007; 54:521- 529. [ Links ]
39. Garnacho-Montero J, Díaz-Martín A, García-Cabrera E, Ruiz Pérez de Pipaón M, Hernández-Caballero C, Aznar-Martín J, et al. Risk factors for fluconazole-resistant candidemia. Antimicrob Agents Chemother. 2010 Aug;54(8):3149-54. [ Links ]














