Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Infectio
Print version ISSN 0123-9392
Infect. vol.15 no.3 Bogotá July/Sept. 2011
1Estudiante del programa de Medicina. Universidad del Quindío
2Grupo Inmunología Molecular. Facultad Ciencias de la Salud.
Universidad del Quindío. Armenia, Quindío.
Recibido: 08/01/2011; Aceptado: 03/08/2011
Resumen
Introducción. Toxocara canis es el segundo nematelminto más prevalente en perros a nivel regional y entre los tres más frecuentes en algunos países de la región. Debido a que la fuente de contaminación es el perro, éste se convierte en un nematodo con gran potencial zoonótico. Por esta razón, consideramos importante disponer de una línea celular de este helminto para el estudio de los aspectos básicos, así como para el desarrollo de técnicas diagnósticas.
Objetivo. Obtener una línea celular primaria a partir de huevos con embrión de T. canis.
Métodos. Los parásitos se extrajeron del intestino delgado de perros menores de un año. Las células embrionarias se obtuvieron mediante la embriogénesis de los huevos de los nematodos adultos, en cuatro diferentes medios; dos ricos en sustancias nutritivas, el tercero con formol al 1 % y el cuarto con agua destilada. Las células se obtuvieron mediante disociación mecánica de los huevos con embrión mediante la utilización de jeringas 30G.
Resultados. El tiempo estimado de obtención de la línea celular fue de 15 días, en los que siete eran utilizados en la embriogénesis de los huevos.
Las células respondieron positivamente a los métodos de crioconservación luego de dos días, e inclusive dos meses después, permitiendo fases de replicación de cuatro pases.
Conclusiones. Se logró obtener una línea celular de T. canis a partir de huevos con embrión de este helminto. Esta línea celular ayudará al entendimiento de las relaciones patógenas, posibles blancos terapéuticos y para el desarrollo de métodos diagnósticos.
Palabras clave: Toxocara canis, células embrionarias, línea celular, medios de cultivo, agua destilada.
Abstract
Introduction: Toxocara canis is the second most prevalent nemathelminthes in dogs at regional level and among the three most frequent in some countries in the region. Due to the fact that the dog is the contamination source, it becomes a nematode with a high zoonotic potential, so we consider it important to be able to use the cell line of this helminth to study the basic aspects, as well as the development of diagnostic techniques.
Objective: To obtain a primary cell line from embryonated eggs of T.canis.
Methods: The parasites were extracted from the small intestines of dogs under one year old. Embryonic cells were obtained by embryogenesis of the eggs secreted by adult worms in four different media; two were rich in nutrients, one was 1% formaldehyde, and the other was distilled water. The cells were obtained by mechanical dissociation of embryonated eggs using 30G needles.
Results: The estimated time for obtaining the cell line was fifteen days, from which seven were used for egg embryogenesis. The cells responded positively to the cryopreservation methods after two days or even two months, allowing a replication phase with four passes.
Conclusions: We managed to obtain a cell line from T. canis embryonated eggs. This cell line will help the understanding of pathogenic relationships, potential therapeutic targets and for developing diagnostic methods.
Key words: Toxocara canis, embryonic cells, cell line, culture media, distilled water.
Introducción
Toxocara canis se encuentra entre los primeros tres nematodos más prevalentes en los estudios llevados a cabo en perros de zonas urbanas de países como Perú (1, 2), Argentina (3, 4) y México (5), mientras que, a nivel nacional en municipios como Popayán (6), se encuentra en el tercer lugar. En los estudios hechos en Bogotá, presenta una prevalencia de 66,7 % en infección de cachorros (6). En Popayán, Vásquez, et al., reportaron la presencia de T. canis en 4,3 % de una población canina estudiada en el 2004 (7). A nivel regional presenta la segunda mayor prevalencia después de Ancylostoma caninum (8), lo que trae consigo un gran potencial zoonótico (9,10).
Los cultivos celulares han sido una de las herramientas más importantes para el entendimiento de las relaciones que se dan entre los sistemas vivos y su ambiente. Además, los modelos celulares son de crucial importancia para el estu dio de sistemas vivos, de aspectos metabólicos, genéticos, estructurales y fisiológicos, así como para dilucidar procesos de diferenciación e interacción celular, estudios de toxicidad y de mecanismos de acción de medicamentos; también, en la comprensión de los sistemas inmunológicos y patógenos que, por ende, permiten hallar blancos terapéuticos. Otras aplicaciones son el estudio de las vías de invasión y diseminación de bacterias, hongos y virus (11).
Debe también recordarse que las líneas celulares pueden ser muy específicas y sólo permitir el crecimiento de determinados elementos, como en el caso de las células de Aedes albopictus (C6/C36) y Aedes pseudoscutellaris (AP-61), que permiten, exclusivamente, el cultivo del virus del dengue (12); de igual forma, pueden ser muy versátiles y permitir el crecimiento de múltiples organismos, como en el caso de las células Vero.
Se han establecido pocas líneas celulares derivadas de nematodos, como las del fitopatógeno del tomate, Meloidogyne incognita (13), Caenorhabditis elegans, nematodo de vida libre no patógeno (14), y de platelmintos como Echinococcus granulosus (15) y Echinococcus multilocularis (16). El establecimiento de las líneas celulares de estos nematodos se utilizó para el entendimiento de las relaciones entre organismo patógeno y huésped, así como para determinar posibles blancos terapéuticos (17).
La finalidad de este estudio fue establecer una línea celular primaria de células de T. canis, lo que permitirá establecer en el futuro un modelo de estudio sobre este nematodo y entender los mecanismos moleculares de acción patógena y determinar las vías de interacción inmunológica y, posteriormente, posibles blancos terapéuticos.
Materiales y métodos
Obtención de los parásitos adultos. La obtención de los parásitos se efectuó a partir de los intestinos de perros sacrificados en el Centro de Zoonosis de la Secretaría de Salud de Armenia, como parte de la estrategia de control de animales callejeros.
Los perros se sacrificaron por sobredosis de anestésicos, después de lo cual se procedió a disecar la cavidad abdominal y extirpar el intestino delgado, el cual fue llevado al laboratorio del Centro de Investigaciones Biomédicas de la Universidad del Quindío, manteniendo la cadena de frío. Una vez en las instalaciones del Centro de Investigaciones Biomédicas, se procedió a la extracción de los adultos de T. canis, los cuales se lavaron con solución salina al 0,1 %, hasta que se hubiera observado la solución transparente. De los adultos obtenidos, se identificaron las hembras de las cuales se obtuvieron los huevos.
Obtención de los huevos. Después de los lavados antes descritos, los adultos se mantuvieron en cajas de Petri, con medio de cultivo compuesto por lactato de Ringer USP (Harman), RPMI 1640 (Sigma, USA) al 10 % (v/v) y antibióticos antifúngicos (ATM: 10.000 unidades/ml de penicilina, 10 mg/ml de estreptomicina, 25 µg/ ml de anfotericina B. Sigma, USA) (18) y se incubaron a 37 °C. El volumen del medio se mantuvo constante, lo que permitió la viabilidad de los adultos durante dos semanas.
Durante este tiempo, el medio de cultivo en el que las hembras adultas eliminaban los huevos se recuperó cada dos días y se almacenó en tubos cónicos con tapa rosca de 50 ml y se conservó a 4 °C. Se utilizó esta técnica en lugar de la disección de las hembras, para evitar contaminaciones potenciales con células de diferentes tejidos de los adultos. A partir del sedimento, se recuperaron los huevos, que se conservaron en agua destilada estéril hasta el momento de su utilización (19).
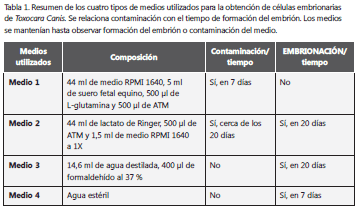
Embriogénesis de huevos. Se utilizaron cuatro métodos tratando de establecer las mejores condiciones para el desarrollo de la embriogénesis del huevo en el menor tiempo. Todos los medios de embriogénesis se tamizaron previamente, utilizando filtros de 13 mm con poros de 0,2 µm (tabla 1).
Obtención y siembra de las células. Después de que los huevos fértiles tenían larvas en su interior, se pusieron en una caja de Petri con tampón de fosfato salino de pH 7,0, se maceraron con una laminilla de vidrio y, posteriormente, se pasó la solución obtenida diez veces por agujas 30G (0,40 mm). La ruptura de los huevos se confirmó microscópicamente. Cuando esto se logró, se pasó toda la suspensión de la caja de Petri a tubos cónicos de 15 ml y se centrifugó a 107g en una centrífuga Heraeus Megafuge 11R®, por tres minutos; luego se eliminó el sobrenadante y el precipitado se suspendió nuevamente en medio de cultivo RPMI 1640 Sigma con suplemento de suero fetal equino (SFE) y ATM (10.000 unidades/ ml de penicilina, 10 mg/ml de estreptomicina, 25 µg/ml de anfotericina B (Sigma, USA). Las células obtenidas se sembraron en placa de 96 pozos Cultivo Celular Falcon™; las placas se incubaron a 37 oC y se hicieron observaciones diarias en el microscopio invertido para determinar el estado de la células obtenidas.
Pruebas de esterilidad microbiológica. Para determinar la presencia de bacterias contaminantes, los medios y las células obtenidas se sometieron a cultivo en agar MacConkey y Sabouraud.
Coloración de Wright y esterilidad de cultivos.
Las células obtenidas en cultivo, se tiñeron con la coloración de Wright, que permite observar estructuras diferenciales de células eucariontes, como el núcleo, y diferenciar dichas estructuras de otros microorganismos que puedan crecer en el medio.
Criopreservación y descongelación. Las células obtenidas mediante cultivo se sometieron a crioconservación, siguiendo los procedimientos clásicos descritos para esta técnica; las células se ajustaron a una concentración de 1 x 106 /ml y se preparó la solución de congelación [DMSO al 10% (v/v), SBF al 50% (v/v), diluidos en RPMI 1640, ATM 1X (10.000 unidades/ml de penicilina, 10 mg/ml de estreptomicina, 25 µg/ml de anfotericina B (Sigma, USA))].
Las células se congelaron por dos días, después de lo cual se determinó su resistencia a este procedimiento. Para ello, se tomó uno de los viales congelados, el que se resuspendió en medio de crecimiento celular (previamente descongelado a temperatura ambiente); posteriormente se centrifugó por tres minutos para sedimentar las células y eliminar la solución de congelación. Se tomaron las células y se completó el volumen con 1,5 ml de medio de cultivo celular y se colocaron 200 µl de la suspensión de células por pozo en una caja de cultivo de 96 pozos (20).
Curva de crecimiento. El número de células obtenidas en los cultivos se determinó mediante conteo en cámara de Neubauer Boeco (Prof. 0,100 mm); igualmente, se determinó el porcentaje de viabilidad con azul de tripano.
Se contaron las células durante el tiempo que permanecieron vivas. De esta manera, se contaron las células cada cuatro horas por cuatro días, cada ocho horas durante los siguientes 12 días, y cada 24 horas durante los 15 días siguientes, dando un total de 31 días. En total, se hicieron cuatro fases de replicación.
Determinación de la curva de cinética de crecimiento. Para determinar el crecimiento de las células obtenidas, se tomaron muestras de los cultivos con pipetas y descargas para el desprendimiento de las células, procedimiento realizado, en promedio, cada 18 horas durante los 28 días que las células permanecieron vivas. Se contaron las células por ml y se calculó el porcentaje de viabilidad en cada una de las muestras. Con los datos obtenidos se elaboró una gráfica: en el eje X se registraron las horas del cultivo al momento de la toma de la muestra, y en el eje Y se registró el número total de células vivas.
Resultados
Embriogénesis de los huevos. Con el medio 1 de embriogénesis, el día séptimo se presentó contaminación de los pozos y se formaron precipitados blancos. Debido a los resultados obtenidos con el medio 1, se procedió a retirar los huevos de los pozos y poner los que no se habían desarrollado en el medio 2, con lo cual se buscó reducir los posibles contaminantes y favorecer un desarrollo rápido de los huevos (tabla 1).
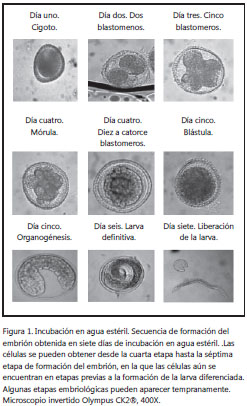
Los huevos se mantuvieron en el medio 2 y su embriogénesis se revisó diariamente. Transcurridos siete días (tiempo de contaminación del medio 1) después del cambio de medio, los huevos no presentaron desarrollo embriológico; no obstante, se dejaron los huevos en este medio hasta permitir su desarrollo. Sin embargo, el medio 2 también presentó problemas de contaminación cerca del día 20, después de los cuales se observó que las larvas de T. canis habían desarrollado embrión. Durante este tiempo, se produjeron nuevamente los precipitados blancos que contaminaron reiteradamente los pozos. Después de esto, se decidió no continuar con este medio de embriogénesis, ya que no se reducían las probabilidades de contaminación. La embriogénesis con medio 3 permitió el desarrollo de los embriones cerca del día 22, tal cual lo referencia la literatura. La embriogénesis con el medio 4 permitió el desarrollo de los embriones hasta etapas previas a la formación de la larva definitiva en seis días, sin observarse contaminación de los contenidos. En la tabla 1 se resumen los medios utilizados y su efectividad, y en la figura 1, el desarrollo embriológico de la larva de T. canis en este estudio.
Obtención de las células para cultivo y esterilidad. La obtención de las células mediante la ruptura de los huevos se siguió microscópicamente. De las células obtenidas, un gran número presentaban conformación y diámetro similares. No obstante, se apreciaron células grandes, lo que conformaba un tipo celular mixto.
Con la coloración de Wright se observaron estructuras específicas de las células eucariotas, como el núcleo (figura 2D), con lo que se esclarece la constitución del cultivo de células y no de otros organismos.
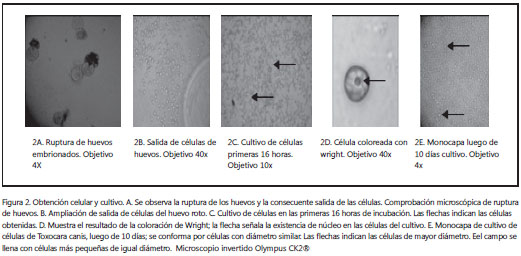
Las pruebas realizadas en agar MacConkey y agar Sabouraud demostraron esterilidad completa, ya que no se registró crecimiento de ningún microorganismo.
Pasados 10 días, se observó una monocapa del cultivo en todo el pozo, conformada por células de un diámetro similar y raramente células grandes (figura 2E), de la que se tomaron células para practicar la crioconservación.
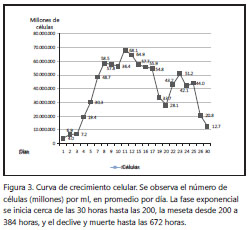
Curva de crecimiento. Se contaron las células durante el tiempo que permanecieron vivas (28 días/672 horas). De esta manera, se contaron las células en un promedio de 18 horas en 37 conteos, luego de los cuales se obtuvo una gráfica en la que se esquematizó el número de células durante las horas (figura 3).
Criopreservación y fase de replicación. Se contaron las células para determinar la cantidad de células vivas luego de la descongelación dos días después y, también, dos meses después, y se encontró una tasa alta de viabilidad (6â150.000/6â345.000=97 %).
La fase exponencial de crecimiento se inició cerca de las 30 horas, con una tasa de reproducción o de doblaje de células en un promedio de 32 horas, la cual culminó cerca de las 200 horas, luego de las cuales existía una pequeña entre 55 y 60 millones de células por ml. Esta fase duró entre las 200 y 384 horas; posteriormente, se presentó el declive hasta la fase total de muerte, cerca de las 672 horas (figura 3).
Se tomaron cerca de tres millones de células resuspendidas y se colocaron en cinco pozos, para determinar simultáneamente la capacidad de replicación. El primer pase logró la monocapa en cerca de 11 días, con un valor aproximado de 39 millones de células, momento en el cual se hizo el siguiente pase, tomando del primer pozo un valor aproximado de 11 millones de células, los cuales necesitaron siete días para alcanzar la monocapa. De esta manera, se completaron dos pases más, para un total de cuatro pases. No obstante, el cuarto pase no logró la monocapa en el tiempo estimado según la curva de crecimiento, incluso al dejarlas incubadas mucho más tiempo (figura 3).
Discusión
En el presente estudio se logró obtener un cultivo celular primario de células del helminto T. canis. Se pudo establecer el cultivo en tiempo estimado de 15 a 17 días, incluidos los siete días de embriogénesis. Los medios utilizados para el desarrollo del embrión se utilizaron paulatinamente. Los medios 1 y 2 los formamos nosotros mismos, pensando que ofrecerían las mejores condiciones para el desarrollo. No obstante, estos presentaron fallas, ya que fueron fácilmente aprovechados por otros microorganismos oportunistas, tales como hongos y bacterias, debido a la gran concentración de sustancias nutritivas.
El medio 3 es el método estandarizado para la obtención de las larvas, tal y como lo referencian algunos autores (17), y en algunos casos, ácido sulfúrico 1N (18), ambos con la intención de reducir las variables de contaminación (17). Sin embargo, la utilización de formol como medio de embriogénesis de los parásitos, trae consigo una demora en el desarrollo del embrión (en comparación con el agua estéril). No obstante, no se reduce en su totalidad, ya que en este estudio se obtuvo la embriogénesis en 23 días. Además, estudios hechos en Brasil sobre la acción de algunas sustancias en la embriogénesis de este tipo de parásitos, así lo demuestran (19).
La utilización de agua destilada como medio de embriogénesis se decidió al analizar el estudio de Lara, et al. (21), en el que utilizaron diferentes medios para la embriogénesis de los huevos de Ascaris lumbricoides. De ellos, los de mejor comportamiento para tal fin fueron: alquil-dimetilbencil cloruro de amonio, hipoclorito de sodio, hidróxido de sodio, cloruro de sodio, y solución de aldehído fórmico al 40 %. Todas estas soluciones son utilizadas como desinfectantes, germicidas y bactericidas. Con esto se interpreta que estas sustancias no ofrecen ningún tipo de alimentación ni soporte fisiológico a los huevos y que los huevos poseen los nutrientes necesarios para su desarrollo. Asimismo, al igual que estas sustancias, el agua no contribuye en procesos fisiológicos ni evita la utilización de protocolos para la limpieza de los huevos para la posterior obtención de células embrionarias, como sí ocurre cuando se utiliza formol como medio de cultivo; en éste, después de desarrollarse el embrión, los huevos deben lavarse, ya que los restos son tóxicos para las células y las larvas.
En cuanto a los tiempos de embriogénesis, estos variaron radicalmente, ya que los protocolos que utilizan formol como medio de cultivo, sugieren que los huevos deben estar entre 20 y 30 días en incubación. Esto produce demora en las pruebas. La obtención de los embriones en sólo siete días con la utilización de agua destilada, facilita la labor en este campo. En cuanto a la obtención de las células, se sugiere esperar entre el día 6 y 7, ya que durante este tiempo el huevo se ha preparado para salida de la larva. Esto facilita la ruptura de los huevos y la obtención de las células.
Sobre el medio de cultivo celular utilizado en este estudio, cabe decir que se debió utilizar antibiótico antifúngico, al igual que para Echinococcus multilocularis, ya que al suprimir dicho elemento se exponía a un grado de contaminación que, posiblemente, reduciría la proliferación celular. No obstante, sí difiere en que el cultivo de E. multilocularis necesitó atmosfera de CO2 y otros suplementos para desa rrollar el cultivo. El utilizado en este estudio necesitó menos suplementos, haciéndolo un medio de cultivo más económico y sencillo de mantener (22).
La obtención de las células fue más rápida en comparación con otros tipos de cultivos celulares, ya que la maceración de los huevos con embrión evitó la utilización de enzimas para obtener las células cuando se parte de un organismo completo o de un tejido. De esta manera, se ahorra un paso en los protocolos convencionales en la obtención de células para la creación de este tipo de cultivo celular. En las figuras 2A y figura 2B se muestra la liberación de las células luego de la ruptura de los huevos.
La curva de crecimiento presentó tres fases de desarrollo, de las cuales, la primera (exponencial) fue la más clara. La meseta tuvo desde su inicio algunos altibajos que se pueden atribuir a los cambios de medio de cultivo que se hacían cada 200 horas (figura 3). Las células respondieron exitosamente luego de la crioconservación, ya que los lotes de dos días de conservación proliferaron y continuaron su proceso de división permitiendo llevar a cabo la fase de replicación, la que produjo hasta cuatro pases, después de los cuales las células perdieron su capacidad de reproducción. Esto mismo se observó, inclusive, con lotes de congelación puestos a prueba dos meses después. Estos datos presentan diferencias con respecto a los cultivos celulares de E. multilocularis, en los que las células han permitido hasta 90 pases (6). Estos resultados hicieron que el trabajo con este tipo de cultivo se utilizara para tiempos cortos.
El presente trabajo abre las posibilidades de contar con una nueva metodología in vitro que facilita el estudio en el área de pruebas diagnósticas (18), así como el de los antihelmínticos.
Agradecimientos
Al grupo de Inmunológica Molecular, a todo el personal del Centro de Investigaciones Biomédicas de la Universidad del Quindío, al Grupo de Patología Molecular y al Grupo de Investigaciones Biomédicas, y al Centro de Zoonosis de Armenia.
Correspondencia: Carrera 15 calle 12 Norte, Armenia, Colombia. Teléfono (576) 746-0129. Dirección electrónica: jhoncarlos@uniquindio.edu.co
Referencias
1. Trillo-Altamirano M, Carrasco A, Cabrera R. Prevalencia de helmintos enteroparásitos zoonóticos y factores asociados en Canis familiaris en una zona urbana de la ciudad de Ica, Perú. Parasitol Latinoam. 2003;58:136-41. [ Links ]
2. Milagros S, Verastegui M, Cabrera R. Prevalencia de enteroparasitosis en una comunidad altoandina de la Provincia de Víctor Fajardo, Ayacucho, Perú. Rev Gastroenterol Perú. 2005;25:150-5. [ Links ]
3. Betti A, Cardillo N, Diez M, Cornero F, Braida M, Agostini A. Prevalencia de parasitosis entéricas en caninos de un área del gran Buenos Aires, 2003-2004. In Vet. 2007;9:2-6. [ Links ]
4. De los Ángeles M, Martín G, Chamorro M, Alonso J. Toxocariosis en niños de una región subtropical. Medicina (Buenos Aires). 2005;65:226-30. [ Links ]
5. Fernández CF, Canto AG. Frecuencia de helmintos intestinales de perros sin dueño sacrificados en la ciudad de Querétaro México. Vet Méx. 2002;33:247-53. [ Links ]
6. Guzmán A, Pachón R. Estudio epidemiológico retrospectivo de enfermedades zoonóticas de 1997 a 2003 en Colombia (tesis). Bogotá, D.C.: Universidad de La Salle; 2005. p. 167. [ Links ]
7. Vásquez LR, Campo VH, Vergara D, Rivera O. Prevalencia de Toxocara canis y otros parásitos intestinales en caninos en la ciudad de Popayán, 2004. Revista Facultad de Ciencias de la Salud de la Universidad del Cauca. 2005;7. Fecha de consulta: 11 de julio de 2011. Disponible en: en: http://www.facultadsalud.unicauca.edu.co/fcs/2005/diciembre/Toxocara.pdf. [ Links ]
8. Giraldo MI, García Nl, Castaño JC. Prevalencía de helmintos intestinales en caninos del departamento del Quindío. Biomédica. 2005;25:346-52. [ Links ]
9. Santillán G. Caracterización de proteínas específicas para el diagnóstico de Toxocara canis. Revista Electrónica Escuela de Posgrado de UNSAM. 2000. Fecha de consulta: 21 de agosto de 2008. Disponible en: www.unsam.edu.ar/escuelas/posgrado/revista/r0202_santillan.pdf. [ Links ]
10. De la Fé P, Dumenico B, Elio A, Aguiar J. Toxocara canis y síndrome de Larva migrans visceralis. Revista Electrónica de Veterinaria REDVET. 2006;7(4). Fecha de consulta: 21 de agosto de 2008. Disponible en: www.veterinaria.org/revistas/redvet/n040406/040612.pdf. [ Links ]
11. Reina M. Introducción al cultivo celular. Barcelona: Universidad de Barcelona; 2003. Fecha de consulta: 21 de agosto de 2008. Disponible en: http://www.ub.es/biocel/wbc/tecnicas/cap1.htm#1. Introducción histórica. [ Links ]
12. Castañeda N, Castellanos J, Zapata A, Bello F. Línea celular de Aedes aegypti (Diptera: Culicidae) aegy-28 refractaria a la infección con los virus dengue 2 y fiebre amarilla. Acta Biol Colomb. 2007;12:47-58. [ Links ]
13. Thanasis M, David J. Establishment of two cell lines from the nematode Meloidogyne incognita (Tylenchida: Meloidogynidae). In Vitro Cell Dev Biol. 1990;26:1105-14. [ Links ]
14. Bianchi L, Drisco M. Culture of embryonic C. elegans cells for electrophysiological and pharmacological analyses. En: Worm Book, ed. The C. elegans Research Community, Worm Book; 2006. Fecha de consulta: 21 de agosto de 2008. Disponible en: http://www.wormbook.org. [ Links ]
15. Fiori Pl, Monaco G, Scappaticci S, Pugliese A, Canu N, Cappuccinelli P. Establishment of cell cultures from hydatid cysts of Echinococcus granulosus. Int J Parasitol. 1988;18:297-305. [ Links ]
16. Furuya K. An established cell line of larval Echinococcus multilocularis. Int J Parasitol. 1991;21:233-40. [ Links ]
17. Yoneva A, Mizinska-Boevska Y. In vitro cultivation of helminthes and establishment of cell cultures. Experimental Pathology and Parasitology. 2001;4:3-8. [ Links ]
18. Bojanich M, Alonso J, Chamorro M. Evaluación de antígenos de E/S de Toxocara canis para tests inmunoenzimáticos. Instituto de Medicina Regional, Universidad Nacional del Nordeste. Fecha de consulta: 21 de agosto de 2008. Disponible en: www.unne.edu.ar/Web/cyt/cyt/medicina/m-030.pdf. [ Links ]
19. Quesada LF, Castaño JC, Bilbao M. Efecto antiparasitario de los extractos etanólicos y etéreos de Ficus obtusifolia Kunth (Moraceae), frente a parásitos de clase nematodos (Toxocara catis y Toxocara canis). Infectio. 2009;13:259-67. [ Links ]
20. Odintsova N, Kiselev K, Sanina N, Kostetsky E. Cryopreservation of primary cell cultures of marine invertebrates.CryoLetters. 2001;22:299-310. [ Links ]
21. Lara C, Salgado R, Dias L Guerra H, dos Santos O. Atividade de detergentes e desinfetantes sobre a evolução dos ovos de Ascaris lumbricoides. Cad Saúde Pública, Rio de Janeiro. 2003;19:335-40. [ Links ]
22. Rakha N, Dixon J, Carter S, Craig P, Jenkins P, Folkard S. Echinococcus multilocularis antigens modify accessory cell function of macrophages. Immunology. 1991;74:652-6. [ Links ]














