Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Infectio
versão impressa ISSN 0123-9392
Infect. v.15 n.4 Bogotá out./dez. 2011
1Centro de Investigaciones en Microbiología y Parasitología Tropical, Departamento de Ciencias Biológicas, Facultad de Ciencias, Universidad de los Andes, Bogotá, D.C., Colombia
Recibido: 16/05/2011; Aceptado: 09/11/2011
Resumen
Introducción. La enfermedad de Chagas, cuyo agente causal es Trypanosoma cruzi, constituye una antropozoonosis ampliamente distribuida en América Latina. Los estudios moleculares y los perfiles genéticos han demostrado que el parásito presenta una gran variabilidad y han permitido la clasificación de T. cruzi en seis unidades discretas de tipificación (I-VI), de las cuales, TcII a TcVI han sido ampliamente caracterizadas por distintos marcadores moleculares.
Objetivo. Evaluar la variabilidad genética de TcI, mediante el uso de marcadores de microsatélites.
Materiales y métodos. Se evaluaron siete microsatélites en quince aislamientos colombianos obtenidos mediante PCR a partir de reservorios, vectores y humanos, y se analizaron en un gel para desnaturalizar de poliacrilamida de un secuenciador láser fluorescente automático (ALF). Los datos se analizaron en un software para análisis de genética de poblaciones (Arlequin® 3.1 y Microsat®).
Resultados. Los resultados demostraron variabilidad dentro de TcI al obtener 24 alelos, de los cuales, 12 se reportan por primera vez. Aunque se encontraron genotipos asociados a la infección humana y al ciclo selvático de transmisión, ningún locus permitió comprobar la presencia de los genotipos previamente reportados. Los parámetros de heterocigocidad observada y esperada, permitieron determinar la presencia de dos poblaciones (aislamientos domésticos y selváticos); asimismo, el desequilibrio de ligamento facilitó la creación de dos mapas físicos para los loci analizados.
Conclusiones. Se corrobora la gran variabilidad genética presente en TcI, lo que sugiere un patrón de variación intraespecífica en Colombia.
Palabras clave: microsatélites, genotipos, Trypanosoma cruzi, unidades discretas de tipificación.
Abstract
Introduction: Chagas disease which is caused by the protozoan Trypanosoma cruzi, is a major public health problem in Latin American countries with a different distribution of the parasite across the continent in which nearly 15 million people are infected and 28 million are at risk. Genetic profiling of T. cruzi has shown great diversity and variability of the parasite allowing its classification into six discrete typing units (DTUs I-VI) in which TcII to TcVI are well characterized by different molecular markers. However, the presence of four subgroups according to the transmission cycle has only been reported in DTU T. cruzi I.
Objective: To evaluate the genetic variability evidenced within TCI by the use of microsatellite markers.
Materials and methods: Seven microsatellite loci were tested in fifteen Colombian isolates from vectors, reservoirs, and humans by means of PCR and automatic laser fluorescent sequencer (ALF). Data were analyzed using a population genetic data analysis software (Arlequin® 3.1 and Microsat®).
Results: Variability among the isolates was demonstrated with 24 alleles, from which twelve had never been reported before. However, none of the microsatellite loci were able to support the idea of genotypes within TcI strains. The parameters of expected and observed heterozygocity allowed us to determine presence of two populations (domestic and sylvatic isolates); likewise, the linkage disequilibrium helped with the construction of two physical maps for the loci analyzed.
Conclusions: We corroborated the high genetic variability displayed by TcI populations suggesting a pattern of intraspecific variation in Colombia.
Keywords: Discrete typing units, microsatellites, genotypes, Trypanosoma cruzi.
Introducción
La enfermedad de Chagas, cuyo agente causal es Trypanosoma cruzi, constituye una antropozoonosis ampliamente distribuida en el continente americano. Así mismo existen reportes en países no endémicos, como Estados Unidos y España (1,2). Su transmisión se encuentra asociada a heces infecciosas de insectos triatominos, transfusiones sanguíneas, infecciones orales o congénitas, y accidentes de laboratorio (3).
Para el año 2007 se reportó que, en Colombia, alre dedor de 1’300.000 habitantes presentaban la enfermedad y unos 3’500.000 se encontraban en riesgo de contraer la infección (4); siendo la población infantil la más propensa.
Numerosos estudios con marcadores moleculares, como la región intergénica del gen miniexón, el dominio D7 de la subunidad del gen 24Sα del ADN ribosómico, el PCR-RFLP (Polymerase Chain Reaction - Restriction Fragment Length Polymorphism), el RAPD (Random Amplified Polymorphic DNA), el LSSP-PCR (Low Stringency Single Primer- PCR), se han llevado a cabo en T. cruzi (5-11), lo que permitió clasificar al parásito en seis unidades discretas de tipificación, TcI-TcVI (12).
Con respecto a la distribución geográfica de las unidades discretas de tipificación de T. cruzi, TcI se ha encontrado desde Argentina hasta los Estados Unidos, mientras que TcII-VI se encuentra distribuida desde la cuenca amazónica hasta el sur de Argentina. Sin embargo, es posible encontrar regiones donde todas las unidades discretas de tipificación están presentes, como es el caso de Colombia, en donde TcI se ha reportado de forma predominante y, en una baja proporción, a TcII, TcIII, TcIV y TcVI (13-19).
Actualmente, se conoce la gran variabilidad genética presente en TcII-TcVI (20-22), pero muy poco se conoce sobre la variabilidad de TcI y su división en genotipos, ya sea en relación con el ciclo de transmisión del parásito (6,8,17,23) o con la agrupación de ciertos aislamientos de acuerdo con su origen geográfico (16,24). Sin embargo, estas divisiones deben continuar siendo esclarecidas mediante varios marcadores moleculares para corroborar su existencia y, de esta forma, ampliar el conocimiento sobre uno de los grupos ancestrales de T. cruzi y sus procesos evolutivos. Por esta razón, este estudio pretendió evaluar el uso de marcadores microsatélites que, por su carácter hipervariable y utilidad en la detección de polimorfismos genéticos, resultan ser una herramienta adecuada para la detección de variabilidad en el ADN nuclear (25,26).
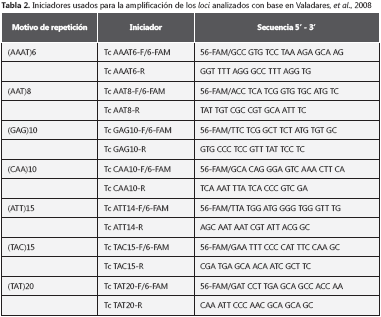
Los marcadores microsatélites han sido ampliamente utilizados para dilucidar la estructura genética de T. cruzi (23,26,27). En el 2008, Valadares, et al., reportaron el uso de siete loci con el fin de determinar perfiles genéticos en aislamientos TcII-TcVI y un solo aislamiento TcI y, por lo tanto, prometen ser de gran utilidad en la evaluación de la variabilidad genética.
El objetivo de nuestro estudio fue implementar el uso de estos siete loci en aislamientos colombianos de T. cruzi I de diferentes huéspedes y regiones geográficas, con el fin de aportar nuevos conocimientos sobre la presencia de genotipos en TcI y conocer más a fondo las relaciones genéticas intraespecíficas. Este trabajo constituye, entonces, el primer reporte sobre el uso de microsatélites en Colombia para la evaluación de la variabilidad genética en aislamientos de T. cruzi I.
Materiales y métodos
Se utilizaron 15 cepas colombianas de T. cruzi, obtenidas de vectores, reservorios y humanos (tabla 1). Trece de las 15 muestras pertenecen a TcI previamente caracterizadas mediante amplificación del gen miniexón, análisis del dominio D7 del ADN ribosómico y secuenciación directa del gen citocromo b (6,8,17). La obtención del ADN se llevó a cabo mediante el protocolo de extracción fenolcloroformo- alcohol isoamílico (28,29) a partir de parásitos en medio de cultivo bifásico a 25 °C.
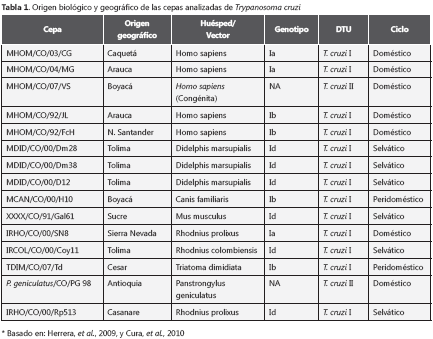
PCR y detección de microsatélites: siete marcadores microsatélites dentro del genoma de T. cruzi se analizaron median- te reacción en cadena de la polimerasa (PCR), haciendo uso de pares de iniciadores para cada locus reportado por Valadares, et al., en el 2008 (tabla 2) (27). Cada reacción de PCR se llevó a cabo en un volumen total de 21 μl que contenía tampón PCR (Tris HCl100 mM pH 8,5, KCl 500mM), 25 mM de MgCl2, 100 mM de solución de deoxinuxleótidos, 50 pM de cada iniciador, 5U/μl TucanTaq DNA polimerasa (Corpogen, Bogotá, Colombia) y 30 ng/μl de ADN.
El perfil térmico implementado consiste en una desnaturalización inicial de cinco minutos por 95 °C, seguida por 40 ciclos de 30 segundos a 95 °C, 20 segundos a 57 °C y 30 segundos a 72 °C, con un paso de extensión final de cinco minutos por 72 °C. Para determinar el tamaño alélico, los productos de amplificación se analizaron en un gel para desnaturalizar de poliacrilamida de un secuenciador láser fluorescente automático.
Parámetros estadísticos
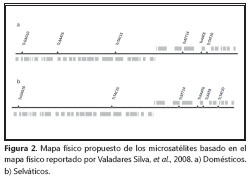
El software Arlequin® 3.1 se utilizó para calcular la heterocigocidad esperada y la observada para cada locus y el desequilibrio entre ellos del ligamento (30). Los análisis se llevaron a cabo en dos poblaciones resultantes, a partir de la distribución de los resultados obtenidos de acuerdo con el ciclo doméstico y peridoméstico (genotipos Ia-Ib) o selvático (genotipo Id) (9). Los datos calculados para el desequilibrio de ligamento se utilizaron para crear un mapa hipotético de la ubicación de los loci analizados, modificando el mapa construido por Valadares, et al. Este mapa está basado solamente en los valores de asociación entre loci calculados en Arlequin® 3.1. Para la construcción de este mapa, se compararon los valores de los aislamientos de origen doméstico y selvático.
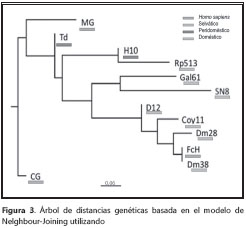
Por último, se calcularon las distancias genéticas entre los aislamientos estudiados de TcI mediante el programa Microsat®, asumiendo un modelo de evolución de microsatélites basado en alelos infinitos y utilizando el algoritmo DAS (Distance Allele Shared) (31). A partir de los datos obtenidos del algoritmo DAS, se construyó un árbol de distancias utilizando el método de vecinos cercanos (neighbour-joining) (32), el cual se visualizó en Fig- Tree® 3.0 para observar los patrones de distancia entre todos los aislamientos estudiados.
Resultados
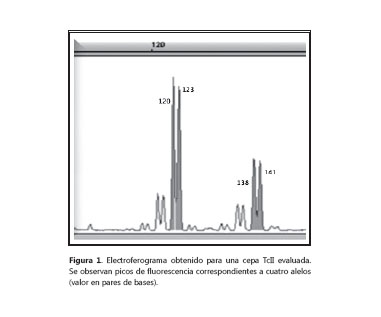
Mediante el análisis de los productos de amplificación, se determinó que la cepa MHOM/CO/92/ JL debía ser retirada del estudio por ausencia de amplificación en cuatro de los siete loci caracterizados. De igual forma, la obtención de más de dos picos de fluorescencia en un mismo locus para una de las cepas TcII (figura 1), como resultado de la multiclonalidad de las mismas (23,26,27), obligó a que los resultados correspondientes a P. geniculatus/CO/PG98 y MHOM/CO/07/VS no se tuvieran en cuenta para los análisis de heterocigocidad y equilibrio de ligamento.
Identificación y caracterización de los microsatélites
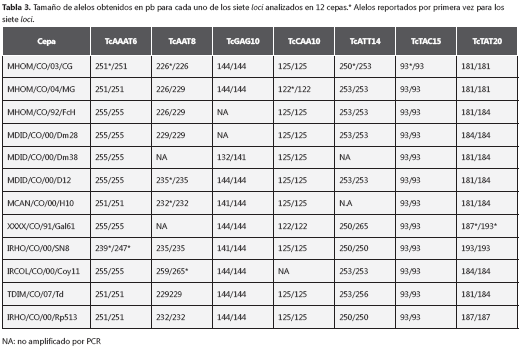
De los siete loci evaluados, TcAAT8 presentó el mayor número de alelos (6), seguido por TcAAAT6, TcATT14 y TcTAT20 (4), TcGAG10 y TcCAA10 (3 y 2 alelos respectivamente). El séptimo locus, TcTAC15, sólo presentó un alelo y, por consiguiente, se consideró monomorfo para la población de estudio (27). De los alelos encontrados, 12 se reportaron por primera vez en este estudio (tabla 3), mientras que los alelos restantes corresponden a alelos ya obtenidos en trabajos anteriores (27,33), y TcGAG10 fue el único locus que no presentó nuevos alelos. De igual forma, se debe destacar que el alelo único de 93 pb en el locus TcTAC15, fue uno de los nuevos reportados.
Los parámetros calculados mostraron que, para la población de aislamientos domésticos, la heterocigocidad observada fue de 0,2286 y la esperada de 0,477, y para la población de aislamientos selváticos, la heterocigocidad observada fue de 0,1643 y la esperada de 0,463. Los parámetros estadísticos calculados evidencian que únicamente el locus TcAAT8 presenta dife rencias significativas entre la heterocigocidad observada y la esperada para ambas poblaciones. De igual forma, se estableció un alto grado de desequilibrio de ligamento entre los loci evaluados; cinco de ellos se encontraron asociados en la población de genotipos Ia-Ib y, cuatro, en la población conformada por las cepas pertenecientes al genotipo Id. Estos resultados fueron significativos con p menor de 0,05.
Con base en el mapa físico de los loci reportado por Valadares, et al., (27) y los resultados del desequilibrio de ligamento, se pueden observar cambios físicos hipotéticos en el genoma de las cepas TcI colombianas (figura 2). Asimismo, en el filograma por el método de vecinos cercanos (figura 3), es posible observar que los aislamientos humanos son genéticamente distintos a los selváticos y aquellos que pertenecen a aislamientos peridomésticos, lo que demuestra la presencia de posibles genotipos relacionados con la infección humana y otros con el ambiente selvático.
Discusión
La obtención de múltiples picos en la amplificación de los dos aislamientos TcII analizados (figura 1), demuestra la constitución multiclonal de las cepas y permite establecer que hay poblaciones de T. cruzi con estructura multiclonal circulando tanto en vectores como en humanos. Este patrón de "multiclonalidad" ha sido corroborado en reservorios mamíferos, demostrando que este mecanismo de infecciones está relacionado con un proceso de selección de diversificación en T. cruzi (34).
Se encontró que los aislamientos TcII evaluados provienen de Panstrongylus geniculatus y Homo sapiens de una infección por vía congénita, pues concuerdan con reportes en la literatura científica en la que se habla sobre la frecuencia de "multiclonalidad" en insectos, animales silvestres y pacientes agudos (26), al igual que en tejidos placentarios (27), más aun, si se sabe que P. geniculatus es un vec animales de los cuales es posible aislar diferentes unidades discretas de tipificación, como TcII, TcIII y TcIV (22,35,36). En estos casos, la aneuploudía queda parcialmente descartada puesto que se está trabajando con aislamientos puros que no son clonales; además, por tratarse de cepas caracterizadas como TcII por diferentes marcadores moleculares, se considera que las mismas pertenecen a un grupo ancestral del parásito (10), con pocas posibilidades de presentar hibridación.
Por otro lado, se encontraron 24 alelos y, de éstos, 12 son reportados por primera vez; este resultado era de esperarse, por ser ésta la primera ocasión en que un número de cepas TcI se enfrentan a un análisis por microsatélites en Colombia. Estos resultados demuestran el carácter hipervariable de los microsatélites como resultado de los polimorfismos que presentaron seis de los sietes loci; TcAAT8 coincide con reportes en la literatura científica, al ser el locus con mayor número de alelos amplificados a partir de ADN del parásito cultivado in vitro (27).
Se demostró que los alelos se hallan ampliamente distribuidos entre los siete loci y en ningún caso presentaron agrupaciones que permitieran corroborar los genotipos de TcI previamente reportados, basados en la región intergénica del gen miniexón y citocromo b (8, 17). Sin embargo, los valores de heterocigocidad observada muestran una diferencia en el grado de heterocigocidad entre los aislamientos domésticos y los silvestres, lo cual podría sugerir que existen genotipos emergentes asociados a la adaptación de ciertas poblaciones de T. cruzi a diferentes ciclos de transmisión(37).
Es importante mencionar que el árbol de distancias construido señala que las cepas aisladas de humanos son bastante lejanas de aquellas aisladas de los ciclos peridoméstico y selvático. En especial, la cepa MHOM/CO/CG presenta un patrón completamente lejano al de otras cepas, con características intrínsecas de esta cepa, la cual fue aislada de un paciente con VIH y coinfección con Toxoplasma gondii, y que presentó chagoma cerebral.
Por consiguiente, se puede inferir que, posiblemente, las características genéticas del parásito estén relacionadas con las diversas formas clínicas de la enfermedad de Chagas (29,38). Esto se ha corroborado en pacientes colombianos con enfermedad de Chagas: aquellos que presentan mayores alteraciones cardiacas están infectados con TcI, lo que demuestra la importancia de los linajes genéticos del parásito en la progresión de la enfermedad (39).
Sin embargo, el análisis más detallado por cepa muestra que el aislamiento IRHO/CO/00/SN8 presenta de forma única diferencias significativas respecto a los otros aislamientos; este aislamiento, considerado doméstico por obtenerse de un Rhodnius prolixus domiciliado en la Sierra Nevada de Santa Marta, en el departamento del Magdalena, no presenta asociación alguna con los domésticos, los peridomésticos, ni con los selváticos. Además, su clasificación como aislamiento doméstico debería reconsiderarse o corroborarse, especialmente, porque se sabe que las poblaciones silvestres y domésticas de R. prolixus son poco diferenciables, (23) y es difícil establecer relaciones entre los distintos grupos del parásito y las especies silvestres de Rhodnius spp. debido a la selección de genotipos que se favorecen al cultivar el parásito a partir de infecciones mixtas, específicamente de TcI y TcIV de R. robustus R. brethesi y R. pictipes (35).
Es importante aclarar que el no obtener un locus que permite diferenciar entre las poblaciones domésticas y silvestres de T. cruzi no significa que las mismas no sean significativamente diferentes, sino que es posible que los microsatélites evaluados sean más informativos a nivel de unidades discretas de tipificación que de las poblaciones pertenecientes a una misma unidad.
Finalmente, la mayoría de los loci correspondientes a los microsatélites evaluados, presentaron un alto grado de polimorfismo y desequilibrio de ligamento. Sin embargo, la presencia de loci no asociados se da únicamente en el locus TcAAT8, lo que implica la existencia de rearreglos cromosómicos en el parásito y fundamentan la existencia de la variabilidad encontrada en las cepas (40). Estos posibles rearreglos cromosómicos ayudan a sustentar los mapas físicos hipotéticos (figura 2) creados para la población doméstica, peridoméstica y para la población selvática.
Los alelos obtenidos mediante la evaluación de siete microsatélites y, especialmente, los reportados por primera vez en este estudio, son una clara muestra de la heterogeneidad presente en TcI y muestran la necesidad de encontrar un marcador molecular que sea verdaderamente capaz de establecer genotipos dentro del mismo, ya que los microsatélites del estudio no arrojaron resultados concretos. No obstante, los microsatélites demostraron ser una herramienta útil para el estudio de poblaciones, para determinar la estructura de las mismas y para aportar información genética del parásito.
Asimismo, los patrones de heterocigocidad observada y esperada permitieron demostrar un grado de subdivisión de población entre los aislamientos domésticos y los selváticos, pero esta premisa debe corroborarse con un mayor número de aislamientos.
En el futuro, sería ideal repetir el estudio con un mayor número de cepas cuyas poblaciones sean clonales, para determinar los verdaderos alcances de los microsatélites, para establecer y corroborar si verdaderamente TcI puede dividirse en genotipos y, finalmente, para determinar si existen cambios genéticos en T. cruzi explicados por las interacciones huésped-parásito o vectorparásito y observar si realmente la variabilidad genética del parásito tiene implicaciones relevantes en las manifestaciones clínicas de la enfermedad de Chagas en Colombia.
Agradecimientos
Proyecto Chagas EpiNet, The European Union Seventh Framework Programme, Contrato 223034; Facultad de Ciencias, Universidad de los Andes; Grupo de Parasitología, Instituto Nacional de Salud.
Correspondencia: Felipe Guhl, apartado aéreo 4978, Carrera 1 N° 8-A-10, Bogotá, D.C., Colombia Teléfono: (571) 332-4540; fax: (571) 332-4540 fguhl@uniandes.edu.co
Referencias
1. Rassi Jr A, A Rassi, Marin-Neto JA. Chagas disease. Lancet. 2010;375:1388-1402. [ Links ]
2. Schmunis GA, Yadon ZE. Chagas disease: A Latin American health problem becoming a world health problem. Acta Tropica. 2010;115:14-21. [ Links ]
3. OMS. Reporte sobre la enfermedad de Chagas. Buenos Aires, Argentina: 2007. [ Links ]
4. Guhl F. Chagas disease in Andean countries. Mem Inst Oswaldo Cruz. 2007;102:29-38. [ Links ]
5. Brisse S, Barnabé C, Tibayrenc M. Identification of six Trypanosoma cruzi phylogenetic lineages by random amplified polymorphic DNA and multilocus enzyme electrophoresis. Int J Parasitol. 2000;30:35- 44. [ Links ]
6. Falla, A., Herrera, C., Fajardo, A., Montilla, M., Vallejo, G.A., Guhl, F. Haplotype identification within Trypanosoma cruzi I in Colombian isolates from several reservoirs, vectors and humans. Acta Tropica. 2009;110:15-21. [ Links ]
7. Gomes, M.L., Macedo, A., Pena, S., Chiari, E. Genetic relationships between Trypanosoma cruzi strains isolated from chronic chagasic patients in southern Brazil as revealed by RAPD and SSR-PCR analysis. Acta Tropica. 1998;69:99-109. [ Links ]
8. Herrera, C., Bargues, M.D., Fajardo, A., Montilla, M., Triana, O., et al. Identifying four Trypanosoma cruzi I isolate haplotypes from different geographic regions in Colombia. Infection, Genetics and Evolution. 2007;7:535-9. [ Links ]
9. Rozas, M., De Doncker, S., Coronado, X., Barnabé, C., Tibayrenc, M., et al. Evolutionary history of Trypanosoma cruzi according to antigen genes. Parasitology. 2008;135:1157-64. [ Links ]
10. Souto, R.P., Fernandes, O., Macedo, A., Campbell, D., Zingales, B. DNA markers define two major phylogenetic lineages of Trypanosoma cruzi. Mol Biochem Parasitol. 1996;83:141-52. [ Links ]
11. Zingales, B., Souto, R.P., Mangla, R.H., Lisboa, C.V., Campbell, D.A., et al. Molecular epidemiology of American trypanosomiasis in Brazil based on dimorphisms of rRNA and mini-exon gene sequences. Int J Parasitol. 1998;28:105-12. [ Links ]
12. Zingales, B., Andrade, S.G., Briones, M., Campbell D.A., Chiari, E., et al. A new consensus for Trypanosoma cruzi intraspecific nomenclature: Second revision meeting recommends TcI to TcVI. Mem Inst Oswaldo Cruz. 2009;104:1051-4. [ Links ]
13. Burgos, J.M., Diez, M., Vigilano, C., Bisio, M., Risso, M., et al. Molecular identification of Trypanosoma cruzi discrete typing units in end-stage chronic Chagas heart disease and reactivation after heart transplantation. Clin Infect Dis. 2010;51:485-95. [ Links ]
14. Cura, C.I., Mejía-Jaramillo, A.M., Duffy, T., Burgos, J.M., Rodriguero, M., et al. Trypanosoma cruzi I genotypes in different geographical regions and transmission cycles based on a microsatellite motif of the intergenic spacer of spliced-leader genes. Int J Parasitol. 2010;40:1599-1607. [ Links ]
15. Guhl F, Ramírez JD. Trypanosoma cruzi I diversity: Towards the need of genetic subdivision? Acta Tropica. 2011;119:1-4. [ Links ]
16. Mejía-Jaramillo AM, Peña VH, Triana-Chávez O. Trypanosoma cruzi: Biological characterization of lineages I and II supports the predominance of lineage I in Colombia. Exper Parasitol. 2009;121:83- 91. [ Links ]
17. Ramírez JD, Duque MC, Guhl F. Phylogenetic reconstruction based on cytochrome b (Cytb) gene sequences reveals distinct genotypes within Colombian Trypanosoma cruzi I populations. Acta Tropica. 2011;119:61-5. [ Links ]
18. Zafra G, Mantilla JC, Jácome J, Macedo AM, González CI. Direct analysis of genetic variability in Trypanosoma cruzi populations from tissues of Colombian chagasic patients. Human Pathol. 2011;42:1159-68. [ Links ]
19. Zafra, G., Mantilla, J.C., Jácome C., Macedo, A., González, C.I. Evidence of Trypanosoma cruzi II infection in Colombian chagasic patients. Parasitol Res. 2008;103:731-4. [ Links ]
20. Freitas, J.M., Lages-Silva, E., Crema, E., Pena, S., Macedo, A. Real time PCR strategy for the identification of major lineages of Trypanosoma cruzi directly in chronically infected human tissues. Int J Parasitol. 2005;35:411-7. [ Links ]
21. Sturm, N.R., Vargas, N., Westenberger, S., Campbell, D.A., Zingales, B. Evidence for multiple hybrid groups in Trypanosoma cruzi. Int J Parasitol. 2003;33:269-79. [ Links ]
22. Yeo, M., Acosta, N., Llewellyn, M., Sánchez, H., Adamson, S., et al. Origins of Chagas disease: Didelphis species are natural hosts of Trypanosoma cruzi I and armadillos hosts of Trypanosoma cruzi II, including hybrids. Int J Parasitol. 2005;35:225-33. [ Links ]
23. Llewellyn, M.S., Miles, M.A., Carrasco, H., Lewis, M., Yeo, M., et al. Genome-scale multilocus microsatellite typing of Trypanosoma cruzi discrete typing unit i reveals phylogeographic structure and specific genotypes linked to human infection. PLoS Pathog. 2009;5:e1000410. [ Links ]
24. Salazar A, Schijman AG, Triana-Chávez O. High variability of Colombian Trypanosoma cruzi lineage I stocks as revealed by lowstringency single primer-PCR minicircle signatures. Acta Tropica. 2006;100:110-8. [ Links ]
25. Macedo, A.M., Machado, C.R., Oliveira, C.P, Pena SP. Trypanosoma cruzi: Genetic structure of populations and relevance of genetic variability to the pathogenesis of Chagas disease. Mem Inst Oswaldo Cruz. 2004;99:1-12. [ Links ]
26. Oliveira, R.P., Broude, N., Macedo, A., Cantor, C.R., Smith, C., et al. Probing the genetic population structure of Trypanosoma cruzi with polymorphic microsatellites. Proc Nat Acad Sci USA. 1998;95:3776- 80. [ Links ]
27. Valadares, H.M.S., Ramos Pimenta, J., de Freitas, J.M., Duffy, T., Bartholomeu, D., et al. Genetic profiling of Trypanosoma cruzi directly in infected tissues using nested PCR of polymorphic microsatellites. Int J Parasitol . 2008;38:839-50. [ Links ]
28. Britto, C., Cardoso, M.A., Wincker, D., Morel C.M. A simple protocol for the physical cleavage of Trypanosoma cruzi kinetoplast DNA present in blood samples and its use in polymerase chain reaction (PCR)-based diagnosis of chronic Chagas disease. Mem Inst Oswaldo Cruz. 1993;88:171-2. [ Links ]
29. Ramirez, J.D., Guhl, F., Rosas, F., Morillo, C., Marin-Neto, F., Restrepo, S. Evaluation of adult chronic Chagas´ heart disease diagnosis by molecular and serological methods. J Clin Microbiol. 2009;47:3945- 51. [ Links ]
30. Excoffier LGL, Schneider S. Arlequin ver. 3.0: An integrated software package for population genetics data analysis. Evolutionary Bioinformatics Online. 2005;1:47-50. [ Links ]
31. Minch E, Ruiz-Linares A, Goldstein D, Feldman M, Cavalli-Sforza L L. Microsat, version 1.4d. A computer program for calculating various statistics on microsatellite allele data. 1995. Stanford University Medical Center, Stanford. [ Links ]
32. Tamura, K., Peterson, D., Peterson, N., Stecher, G., Nei, M., et al. Molecular biology and evolution. MEGA4: Molecular Evolutionary Genetics Analysis (MEGA) Software Version 4.0. 2007;24;1596-1599. [ Links ]
33. D´Avila, D.A., Macedo, A., Valadares, H.M., Dias, E., de Castro, A.M., et al. Probing population dynamics of Trypanosoma cruzi during progression of the chronic phase in chagasic patients. J Clin Microbiol. 2009;47:1718-25. [ Links ]
34. Llewellyn, M.S., Rivett-Carnac, J., Fitzpatrick, S., Lewis, M., Yeo, M., et al. Extraordinary Trypanosoma cruzi diversity within single mammalian reservoir hosts implies a mechanism of diversifying selection. Int J Parasitol. 2011;41:609-14. [ Links ]
35. Marcili, A., Lima, L., Valente, V., Valente, S., Batista, J., et al. Trypanosoma cruzi in Brazilian Amazonia: Lineages TCI and TCIIa in wild primates, Rhodnius spp. and in humans with Chagas disease associated with oral transmission. Int J Parasitol. 2009.;39:615-23. [ Links ]
36. Yeo, M., Lewis, M., Carrasco, M., Acosta, N., Llewellyn, M.S., et al. Resolution of multiclonal infections of Trypanosoma cruzi from naturally infected triatomine bugs and from experimentally infected mice by direct plating on a sensitive solid medium. Intl J Parasitol. 2007;37:111-20. [ Links ]
37. Barnabé, C., De Meeus, T., Francois, N., Bosseno, M.F., Monje, E.M., et al. Trypanosoma cruzi discrete typing units (DTUs): Microsatellite loci and population genetics of DTUs TcV and TcI in Bolivia and Peru. Infection, Genetics and Evolution. In Press, Corrected Proof. [ Links ]
38. Burgos, J.M., Althech J., Petrucelli, N., Bisio, M., Levin, M., et al. Molecular diagnosis and treatment monitoring of congenital transmission of Trypanosoma cruzi to twins of a triplet delivery. Diagn Microbiol Infect Dis. 2009;65:58-61. [ Links ]
39. Ramírez, J.D., Guhl, F., Rendón, L.M., Rosas, F., Morillo, C., et al. Chagas cardiomyopathy manifestations and Trypanosoma cruzi genotypes circulating in chronic chagasic patients. PLoS Negl Trop Dis. 2010;4:e899. [ Links ]
40. El-Sayed, N.M., Myler, P., Bartholomeu, D., Nilsson, D., Aggarwal, G., et al. The genome sequence of Trypanosoma cruzi, etiologic agent of Chagas disease. Science. 2005;309:409-15. [ Links ]














