Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Infectio
Print version ISSN 0123-9392
Infect. vol.15 no.4 Bogotá Oct./Dec. 2011
1Centro de Investigaciones Biomédicas, Universidad del Quindío, Armenia, Colombia; actualmente en la Universidad de Cartagena, Cartagena, Colombia
2Centro de Investigaciones Biomédicas, Universidad del Quindío, Armenia, Colombia
3Programa de Medicina, Facultad de Ciencias de la Salud, Universidad del Quindío, Armenia, Colombia
4Facultad de Medicina de la Universidad Autónoma de Madrid, Madrid España
La investigación fue financiada por la Universidad del Quindío a través de un proyecto aprobado en convocatoria interna.
Recibido: 25/04/2011; Aceptado: 09/11/2011
Resumen
Objetivo. Evaluar el efecto micobactericida del ácido hipocloroso siguiendo las normas internacionales de desarrollo de nuevos desinfectantes.
Materiales y métodos. Se evaluó la efectividad del ácido hipocloroso en Mycobacterium chelonae, M. fortuitum, M. intracellulare y M. tuberculosis en diferentes concentraciones en cuatro intervalos de tiempo, a 225 ppm, 450 ppm, 750 ppm y 1.500 ppm, durante 5, 10, 15 y 20 minutos. Las pruebas desarrolladas fueron: exposición directa al desinfectante en condiciones limpias, exposición con interferencia (condiciones sucias), exposición en superficies en condiciones limpias y prueba de corrosión del desinfectante.
Resultados. Todas las concentraciones evaluadas del ácido hipocloroso en condiciones limpias, es decir, en exposición directa y en superficies, resultaron ser efectivas durante todos los intervalos de tiempo, mientras que para la prueba con interferencia, fue necesario aumentar el tiempo, la concentración o ambos para tener, al menos, un 99,9 % de efectividad del desinfectante sobre la concentración bacteriana usada; estos resultados probablemente dependieron de la reducción de la concentración del ácido hipocloroso, causada por la interferencia con albúmina y de la resistencia intrínseca de cada especie micobacteriana.
Conclusiones. El ácido hipocloroso es 100 % efectivo en todos los intervalos de tiempo y a todas las concentraciones evaluadas en condiciones limpias, y demostró ser efectivo después de lavados que arrastren con la mayoría de materia orgánica en una superficie, debido a que, en condiciones sucias, sólo es efectivo con las concentraciones más altas (900 y 1.500 ppm) y en tiempos mayores de 15 minutos.
Palabras clave: ácido hipocloroso, micobacterias, desinfectante de alto nivel, germicida.
Abstract
Objective: to evaluate the mycobactericidal effect of hypochlorous acid according to the international standards for the development of new disinfectants.
Materials and methods: the effectiveness of hypochlorous acid in M. chelonae, M. fortuitum, M. intracellulare and M. tuberculosis was evaluated at different disinfectant concentrations in 4 time intervals, at 225 ppm, 450 ppm, 750 ppm and 1500 ppm for 5, 10, 15 and 20 minutes. The main tests
Results: all concentrations of hypochlorous acid tested in clean conditions, i.e. in direct exposure and in surfaces, were found to be effective at all the time intervals, while for the test with interference it was necessary to increase the time and/or concentration of the disinfectant for it to be at least 99.9% effective in the bacterial concentration used; these results were likely due to the reduction of acid concentration caused by the albumin used as interference and the intrinsic resistance of each mycobacterial species.
Conclusions: hypochlorous acid is 100% effective in clean conditions at all the time intervals and in all the concentrations tested, proving to be effective after performing washes that drag away most organic matter on a surface, as in contaminated conditions its effectiveness is reduced to just higher disinfectant concentrations (900 and 1500 ppm) and times longer than 15 minutes.
Keywords: hypochlorous acid, mycobacteria, high-level disinfectant, germicide
Introducción
El género Mycobacterium está constituido por bacilos ácido-alcohol-resistentes, Gram positivos, aerobios y no esporulados (1). Las micobacterias incluyen varias especies causantes de enfermedades importantes en humanos y animales (2). Se clasifican en pigmentadas y no pigmentadas de lento crecimiento, y pigmentadas de rápido crecimiento (1,3). En el grupo compuesto por las de lento crecimiento, se encuentran Mycobacterium tuberculosis, patógeno obligado, y Mycobacteriumavium-intracellulare, cepa ambiental y patógeno oportunista de humanos. Entre las de rápido crecimiento, llamadas generalmente micobacterias "atípicas" o no "tuberculosas", "oportunistas" o "ambientales" (4) principalmente saprofitos, que en algunos casos se vuelven patógenas, se encuentran Mycobacterium chelonae, Mycobacterium abscessus y Mycobacterium fortuitum (1,5-8).
Las micobacterias no tuberculosas de rápido crecimiento, se encuentran en muchos sitios, como suelos, alimentos, polvo de casa y vegetación (9). Están ampliamente distribuidas en la naturaleza y se les puede aislar del agua dulce (ríos, lagos, pantanos, piscinas, acuarios, grifos y desagües), agua salobre, agua de consumo e, incluso, se han encontrado en máquinas que producen hielo (1,7,10,11).
Una característica de persistencia del género Mycobacterium en el ambiente es la resistencia de la superficie de la pared celular, rica en lípidos pesados que la hacen hidrofóbica, con baja permeabilidad y con resistencia innata a una amplia gama de agentes antimicrobianos, incluyendo antibióticos y desinfectantes (1,11-13).
La resistencia, sumada a la ubicuidad de las micobacterias no tuberculosas, aumenta la diseminación en todo tipo de superficies e instrumentos de uso clínico, de laboratorio, odontológicos y quirúrgicos reutilizables pero que no se esterilizan y al ser reusados pueden desencadenar infecciones en individuos tanto inmunocomprometidos como inmunocompetentes, cuando no son correctamente desinfectados (6,14-17).
Las micobacterias no tuberculosas pueden causar una gama muy variada de cuadros clínicos pulmonares y extrapulmonares (18), además de infecciones de partes blandas y tejido celular subcutáneo; las más frecuentes son las asociadas a un antecedente traumático de piel: inyecciones, laceraciones, pinchazos, procedimientos cosméticos como la mesoterapia o liposucción, herida quirúrgica, entre otros; estos casos han sido asociados particularmente a M. chelonae, M. abscessus, M. fortuitum, M. peregrinum y M. simiae (6,14-17). No se sabe si las infecciones por micobacterias no tuberculosas se desarrollan inmediatamente o, como en el caso de la tuberculosis, lo hacen después de un periodo de infección latente.
Existen pocos bactericidas capaces de eliminar a las micobacterias de los materiales de uso clínico; comercialmente se dispone, como única alternativa comprobada, de los desinfectantes de alto nivel, como el ortoftalaldehído o los compuestos de ácido peracético (19,20). No obstante, pueden ser muy costosos o agresivos para el material y para las personas que los utilizan, por lo que su uso es restringido.
Existen biocidas alternativos eficaces, y menos costosos, que hasta el momento no se han usado en la eliminación de micobacterias de los materiales clínicos, como por ejemplo, el ácido hipocloroso (HClO) (21), el cual es fundamental para potenciar la acción bactericida, principalmente en desinfectantes como el hipoclorito de sodio; no obstante, estando sola, esta sustancia ha actuado de manera mucho más efectiva en otros experimentos, ya que se encarga de penetrar fácilmente en la célula bacteriana a través de la membrana citoplásmica, actúa sobre proteínas y ácidos nucleicos de los microorganismos, oxida grupos sulfhídrilos (-SH), y ataca grupos aminos, indoles y al hidroxifenol de la tirosina. Este desinfectante puede ejercer una rápida y selectiva inhibición del crecimiento bacteriano y la división celular, comprobada en otras especies bacterianas como Staphylococcus aureus, Escherichia coli, Klebsiella pneumoniae, Salmonella enteritidis y Pseudomonas aeruginosa (21).
Sin embargo, a pesar de que se sabe que el ácido hipocloroso es un bactericida muy potente, se han realizado muy pocos estudios relacionados con su actividad y con la de otros micobactericidas que intervienen en la inhibición de crecimiento y daño celular producido en las bacterias principalmente patógenas (22).
El propósito de este trabajo fue evaluar el efecto bactericida del ácido hipocloroso, sobre diferentes especies patógenas ambientales del género Mycobacterium, determinar la concentración mínima micobactericida y comparar la efectividad del ácido hipocloroso con el ortoftalaldehído, siguiendo las normas internacionales y nacionales de desarrollo y utilización de nuevos desinfectantes (23-25).
Materiales y métodos
Muestra y tipo de estudioSe diseñó un experimento en una muestra por conveniencia, con tres especies de micobacterias no tuberculosas potencialmente patógenas (M. chelonae, M. intracellulare y M. fortuitum) y M. tuberculosis, para conocer su comportamiento ante la exposición a diferentes concentraciones del ácido hipocloroso (biocida). Se tomaron en cuenta las normas para desarrollo, comercialización y pruebas de desinfectantes (23-25).
Cepas y medio de cultivo usados
Mycobacterium intracellulare, M. fortuitum y M. tuberculosis corresponden a cepas de referencia ATCC (American Type Culture Collection of Microbiologics Lyfo-Disk), mientras que M. chelonae es una cepa CIP (The Collection of Pasteur Institute), proporcionada por el Instituto de Medicina Tropical de Bélgica.
La viabilidad de las bacterias se comprobó contando las unidades formadoras de colonias (UFC) resultantes del cultivo en el medio Middlebrock 7H10 con suplemento de ácido oleico, albúmina-dextrosa (OADC®, Becton Dickinson).
Cada micobacteria se suspendió en agua destilada estéril, hasta obtener una turbidez igual a la del tubo 3 de la escala de McFarland (Biomeriux), equivalente a un inóculo aproximado de 75’000.000 unidades formadoras de colonias por mililitro (UFC/ml).
Prueba de exposición directa
Se utilizó una solución madre de ácido hipocloroso de un producto comercialmente disponible (a 1.500 o 4.500 ppm), se diluyó en agua destilada estéril para obtener las cinco concentraciones (225 ppm, 450 ppm, 750 ppm, 900 ppm y 1.500 ppm) y se almacenó a temperatura ambiente, siguiendo las instrucciones del proveedor.
La efectividad se evaluó en cuatro intervalos de tiempo (5, 10, 15, y 20 minutos) con las cinco concentraciones del ácido hipocloroso; cada prueba se hizo por duplicado.
Usando una microplaca de polietileno, plana, de 96 pozos, con tapa nueva estéril (Falcon Becton Dickinson), se colocaron 25 µl de la suspensión bacteriana y 125 µl del desinfectante a las diferentes concentraciones en cada pozo; se dejó actuar en cada uno de los intervalos de tiempo establecidos, los cuales se delimitaron adicionando 150 µl de la solución neutralizadora de tiosulfato de sodio (el cual no tiene actividad sobre las micobacterias) al 0,6 %, esterilizada por filtración en membrana millipore de 0,22 µm.
Actividad del ácido hipocloroso con interferencia
La actividad del biocida se evaluó mezclando las suspensiones bacterianas con una solución de albúmina sérica bovina al 5 % filtrada en membrana millipore de 0,22 µm, imitando la efectividad del desinfectante en presencia de proteínas.
En una placa de polietileno de 24 pozos con tapa (Falcon Becton-Dickinson), se agregaron 170 µl del inóculo bacteriano, aproximadamente 75’000.000 UFC, 100 µl de albúmina al 5 %, 730 µl del desinfectante ácido hipocloroso (HCIO) y 1.000 µl del neutralizador de tiosulfato de sodio al 0,6 % al pasar cada intervalo de tiempo.
Prueba en portaobjetos (condiciones sucias).
Para la prueba de superficie se usó un soporte metálico (limas de endodoncia de 25 mm), contaminado por inmersión en una suspensión de micobacterias igual a la del tubo 3 en la escala nefelométrica de McFarland (75’000.000 UFC) durante una hora; luego, se dejó secar durante 15 minutos sobre una superficie estéril. Cada lima se introdujo en un recipiente con 3 ml con la respectiva concentración de ácido hipocloroso (750 ppm, 900 ppm y 1.500 ppm) con perlas de vidrio de 1 mm de diámetro, durante 5, 10, 15 y 20 minutos, y se adicionaron 3 ml del inhibidor tiosulfato de sodio al 0,6 %. Pasados 10 minutos, se agitó en vórtex por sesenta segundos, y, finalmente, se tomaron 0,05 ml del sobrenadante para practicar la prueba de viabilidad. Después de cada tratamiento, se realizó la siembra inoculando 50 µl de la suspensión final en medio sólido Middlebrook 7H11 y se incubó a 37 °C hasta observar crecimiento (dependiendo de la velocidad de crecimiento de cada micobacteria), y se contaron las colonias sobrevivientes frente al control positivo.
Prueba de corrosión
Las limas de endodoncia se impregnaron de sangre humana para simular condiciones sucias. Éstas se sumergieron en desinfectante a 225 ppm, 450 ppm, 750 ppm, 900 ppm y 1.500 ppm, por 5, 10, 15, 20 minutos, 24 horas y posteriormente durante una semana, determinándose la corrosión por observación directa como se recomienda (26).
Controles
Para el control de efectividad, se expusieron las cuatro especies al ortoftalaldehído, como recomienda su fabricante. Para el control de crecimiento positivo, en cada tratamiento la cantidad de desinfectante se reemplazó por agua para obtener en la siembra el número de colonias de referencia de cada especie expuesta.
Para el control de crecimiento negativo, en cada ensayo el inóculo fue reemplazado por agua para comprobar la pureza de los cultivos al momento de hacer los experimentos. Antes y después de exponer las micobacterias a cada prueba con el desinfectante, se realizó tinción de Ziehl-Nielsen para verificar la pureza de los cultivos.
Para el control del reactivo neutralizador, se usó la mezcla de 125 µl de ortoftalaldehído o ácido hipocloroso con 125 µl de tiosulfato de sodio, se dejó reposar durante 10 minutos y se adicionaron 2,5 µl de suspensión bacteriana, se sembró en medio sólido y se observó el crecimiento, indicando la interacción del neutralizador con ambos desinfectantes.
Procesamiento y análisis de la información
Se llevaron a cabo con el paquete SPSS®, versión 14.0. Las variables de análisis fueron: las unidades formadoras de colonias, el tiempo en minutos con los siguientes cortes: 5,10, 15 y 20; y las concentraciones de ácido hipocloroso y de ortoftalaldehído 225, 450, 750, 900 y 1.500 ppm. Para determinar la efectividad del desinfectante, se contaron las colonias del control de crecimiento positivo, lo que correspondió al 100 % de crecimiento bacteriano. Posteriormente, se contaron las colonias sobrevivientes en los diferentes tiempos, para cada una de las concentraciones probadas. Así, el porcentaje de efectividad se calculó restando al 100 % de efectividad, el porcentaje de UFC capaces de resistir la acción bactericida del ácido hipocloroso, a una concentración y tiempo determinados. Además, se calculó el tiempo mínimo de acción del desinfectante capaz de eliminar, al menos, el 99,9 % del crecimiento bacteriano.
Aspectos bioéticos
La investigación fue aprobada por el Comité de Bioética institucional. Se cumplieron los requisitos de la Resolución 8430 de 1993 del Ministerio de Salud, que define las normas técnicas, científicas y administrativas para la investigación en salud, en particular, lo contemplado en el capítulo lll de investigación de otros nuevos recursos.
Flujo de biológicos.
Las muestras fueron procesadas por profesionales capacitados en las normas de bioseguridad. El Centro de Investigaciones Biomédicas cumple con todas las normas y requisitos para el manejo de muestras de origen biológico, tal como consta en el certificado de la Secretaría de Salud de Armenia.
Resultados
Control de viabilidad de las micobacterias
Todos los inóculos bacterianos fueron viables antes de la exposición al desinfectante y en los controles de cada prueba; se observaron UFC en los controles positivos para cada especie y cada prueba, la tinción de Zielh-Nielsen fue positiva y los controles negativos mostraron la pureza de los cultivos durante los experimentos.
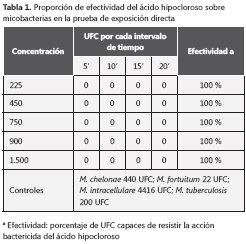
Exposición directa al ácido hipocloroso En la tabla 1 se puede observar el inóculo real para cada prueba, los diferentes valores obtenidos en cada control positivo, y el tiempo límite en el que se observó crecimiento, teniendo en cuenta que M. chelonae es una micobacteria de crecimiento rápido (menos de 7 días) M. fortuitum es una micobacteria de crecimiento intermedio (≤7 días), M. intracellulare y M. tuberculosis son micobacterias de crecimiento lento (más de 7 días). En las pruebas de exposición directa, la efectividad del desinfectante en condiciones limpias fue de 100 %, ya que no se observó crecimiento en ningún tiempo ni concentración.
Actividad del ácido hipocloroso con interferencia
En la tabla 2 se puede observar la efectividad del ácido hipocloroso en cada especie, con interferencia de sangre y de albúmina. La efectividad del ortoftalaldehído con interferencia por presencia de albúmina al 5 %, fue de 100 %. En concentraciones de 1.500 ppm y a partir de 10 minutos de exposición, la efectividad fue de 100 % para todas las especies, menos para M. intracellulare, en la cual la efectividad estuvo por debajo de 50 % en casi todas las concentraciones y tiempos; sólo se observó inhibición del crecimiento por encima de 90 %, a los 20 minutos con una concentración de 900 ppm y a los 15 minutos con una de 1.500 ppm.
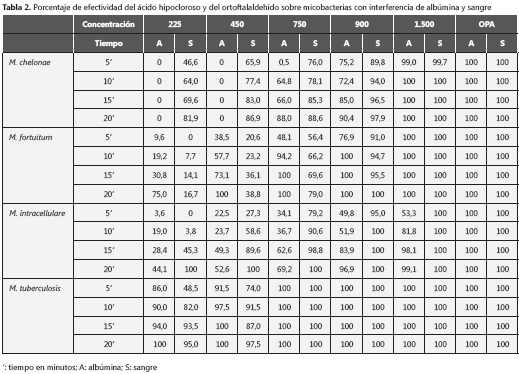
Mycobacterium tuberculosis fue la especie en que la efectividad fue mejor: 100 % con concentraciones a partir de 750 ppm desde los 5 minutos de exposición; también, tuvo efectividad con 450 ppm desde los 15 minutos y con 225 ppm a los 20 minutos. La efectividad mínima se observó a los 5 minutos con una concentración de 225 ppm y fue de un 86 %.
Para M. fortuitum, la efectividad fue muy baja con concentraciones de 225 ppm y 450 ppm; únicamente fue de100 % a partir de los 15 minutos con una concentración de 750 y después de 10 minutos con una concentración de 900 ppm.
En M. chelonae no se encontró ninguna efectividad con concentraciones de 225 y 450 ppm, ni siquiera en el tiempo máximo de exposición de 20 minutos. Se comenzó a observar efectividad cuando se utilizó el desinfectante a una concentración de 750 ppm, pero a los 5 minutos fue únicamente de 0,5 %; con las demás concentraciones, la efectividad estuvo por encima de 66 %. Con 900 ppm, la efectividad varió entre 75 y 90 %, en el tiempo máximo de exposición.
Actividad del ácido hipocloroso con interferencia de sangre
Cuando en lugar de albúmina las pruebas se hicieron con interferencia de sangre, se observó nuevamente un 100 % de efectividad con ortoftalaldehído, desde la exposición mínima de 5 minutos y para todas las especies. La efectividad fue también de 100 % con concentraciones de 1.500 ppm y desde la mínima exposición, a excepción de M. chelonae, con la cual se obtuvo donde esta cifra se observó a partir de los 10 minutos de exposición.
En M. tuberculosis, se observó un 100 % de efectividad a partir de la mínima exposición y con una concentración desde 750 ppm, y por encima de 95 % a partir de los 20 minutos, con las concentraciones de 225 y 450 ppm.
En M. intracellulare se observó un 100 % de efectividad con todas las concentraciones cuando la exposición fue de 20 minutos y, con 900 ppm, a partir de los 10 minutos; con 225 ppm, la efectividad fue menor de 4 %.
En M. fortuitum, se encontró una efectividad por debajo de 40 % con concentraciones de 225 y 450 ppm, y, entre 56 y 79 %, con 750 ppm. Con 900 ppm, la efectividad estuvo por encima de un 90 %.
Mejor que en la especie anterior fue el comportamiento en M. chelonae que, con una concentración de 225 ppm, tuvo una efectividad entre 46,6 y 81,9 %, con 450 y 750 ppm, una entre 65,9 y 88,6 %, y fue mayor de 94 % a partir de los 10 minutos de exposición con una concentración de 900 ppm (tabla 2).
Prueba en portaobjetos (condiciones sucias)
La concentración del inóculo real de esta prueba no es posible calcularla, ya que el volumen inicial depende de las limas de endodoncia empleadas para llevar a cabo esta prueba. En la prueba de superficie, se obtuvieron resultados similares a los de la prueba de exposición directa para cada una de las especies evaluadas, es decir, en esta prueba también se observó un 100 % de efectividad del desinfectante en todas las concentraciones e intervalos de tiempo, con respecto a las unidades formadoras de colonia en los controles positivos. Además, en la prueba de corrosión se encontró que el ácido hipocloroso en concentraciones que fluctúan entre 225 y 1.500 ppm, pasados los 20 minutos o los 5 días, no generó ningún daño sobre las limas de endodoncia de 25 mm.
Discusión
El avance de las técnicas genéticas ha permitido, desde 1990, la identificación taxonómica de 42 nuevas especies del género Mycobacterium. Muchas de ellas son potencialmente patógenas y están implicadas en enfermedades oportunistas, en pacientes con sida y en infecciones en heridas postraumáticas y posquirúrgicas.
Para la elección de un desinfectante, es necesario tener en cuenta la toxicidad, el olor, la compatibilidad con otros compuestos, el posible efecto residual y las características de los microorganismos que pueden modificar la eficacia (9).
El ácido hipocloroso es un agente oxidante cuya acción biocida consiste en interferir con la síntesis de las proteínas en las células, lo que resulta en la muerte de los microorganismos; para que la acción biocida se mantenga efectiva, se debe aplicar en condiciones limpias. Aunque hay estudios de la efectividad del ácido hipocloroso en la eliminación de otras bacterias y sobre M. tuberculosis, no se ha descrito ampliamente su efecto sobre las micobacterias ambientales (27), lo cual fue el objeto del presente estudio.
En este trabajo, en condiciones limpias (libres de materia orgánica o interferente), el ácido hipocloroso fue 100 % efectivo durante todos los intervalos de tiempo y a todas las concentraciones evaluadas, actuando a una concentración mínima de 225 ppm durante 5 minutos (prueba de exposición directa al ácido hipocloroso y portaobjetos). Sin embargo, se requiere de un desinfectante capaz de eliminar los microorganismos que puedan estar acompañados de componentes biológicos, tales como proteínas, lípidos o células, entre otros, siendo de vital importancia probar el ácido hipocloroso en presencia de un agente orgánico como la albúmina (interferencia) o la sangre.
La prueba con interferencia para M. chelonae y M. fortuitum evidenció que, al aumentar el tiempo, en las concentraciones más altas (750, 900 y 1.500 ppm), aumentó también la efectividad del desinfectante hasta llegar a 100 %, reduciéndose el número de UFC sobrevivientes, mientras que, para M. intracellulare, el número de UFC sobrevivientes, aunque se redujo, se mantuvo más alto con respecto a las otras dos especies aquí evaluadas. Las mayores tasas de efectividad se obtuvieron con M. tuberculosis, pero es necesario tener en cuenta la gran cantidad de micobacterias ambientales que son potencialmente patógenas y que se encuentran ampliamente distribuidas en la naturaleza y que, de acuerdo con los resultados obtenidos en estas pruebas, son más resistentes que M. tuberculosis al desinfectante utilizado.
A pesar de que el ácido hipocloroso es un oxidante no selectivo que reacciona hábilmente con todas las biomoléculas, puede oxidar nucleótidos, activar enzimas latentes, inactivar enzimas, romper membranas basales o membranas celulares y fragmentar proteínas (27), se encontró gran diferencia en la efectividad en condiciones limpias y "sucias", lo cual sugiere que puede requerirse mayor concentración o tiempo de exposición para obtener un adecuado efecto. Por otro lado, es importante resaltar que es probable que la cantidad de bacterias utilizadas en el inóculo real de este trabajo, influyó en los resultados esperados para esta prueba, ya que es superior a lo que se llegaría a encontrar en una muestra clínica.
Este desinfectante funcionó muy bien en condiciones libres de materia orgánica, al menos por 5 minutos a una concentración de 225 ppm, aunque estas condiciones no son las que se presentan en la realidad. Por lo tanto, para uso comercial sería adecuado basarse en los resultados obtenidos en la prueba con interferencia, la cual permite inferir que el desinfectante es efectivo a 1.500 ppm durante 10 o 15 minutos. Es importante tener en cuenta todas estas observaciones para recomendar el uso de este producto o cualquier otro, ya que es posible que las personas no sigan estrictamente las instrucciones de uso del mismo (28). Vale la pena resaltar su efectividad total en la desinfección de superficies contaminadas con micobacterias.
Con los resultados obtenidos, el ácido hipocloroso aún no puede recomendarse como desinfectante de alto nivel, pero no se descarta que pueda serlo, ya que, además de disminuir significativamente el número de especies de micobacterias (como M. chelonae, M. fortuitum y M. intracellulare), tiene la capacidad de eliminar otros microorganismos, como las cepas ATCC de S. aureus, E. coli, P. aeruginosa, S. enteritidis y K. pneumonia,e evaluadas en 2003 por Henao, et al. No obstante, de acuerdo con los resultados mencionados, se sugiere que este producto debe ser evaluado con cepas de aislamientos clínicos y comparar la efectividad obtenida con cepas ATCC, ya que éstas son adaptadas al laboratorio y pueden no ser buenas para predecir la sensibilidad de cepas que producen infección.
En este trabajo se descartó la variable de temperatura de almacenamiento, dado que en otros trabajos se ha encontrado que no influye en la efectividad del ácido hipocloroso. El número de unidades formadoras de colonias varía entre las pruebas de condiciones limpias y sucias, con respecto a la prueba de superficie y entre especies. La variación de las UFC entre las pruebas puede deberse a la diferencia en el volumen inicial del inóculo; es probable que la cantidad de bacterias adheridas a las limas de endodoncia sea mucho menor que la cantidad adicionada en las otras pruebas (exposición directa y con interferencia), las cuales constaron de 25 y 170 µl, respectivamente.
En la decisión de utilización del ácido hipocloroso como desinfectante a nivel comercial, es necesario tener en cuenta que, aunque el cloro es utilizado en todo el mundo como un desinfectante químico por sus atributos biocidas, se ha demostrado toxicidad de subproductos de los desinfectantes clorados cuando se utilizan para desinfección del agua (29).
Asimismo, se requieren más estudios sobre la estabilidad del ácido hipocloroso para establecer las mejores condiciones de su manejo durante la desinfección; por estudios sobre la desinfección del agua con hipoclorito de sodio, se ha determinado que este último es más estable que el ácido hipocloroso y, sin embargo, las soluciones se descomponen hasta perder su concentración. Los factores que determinan la estabilidad son la concentración, la temperatura, la alcalinidad, la concentración de impurezas y la exposición a la luz.
El lograr la utilización de un desinfectante tuberculocida económico y de fácil manipulación, es una de las estrategias más valiosas para el control y la prevención de las infecciones asociadas con la atención en salud; tiene gran relevancia en el control ambiental de micobacterias no tuberculosas y de M. tuberculosis, sobre todo ahora cuando la reemergencia de la tuberculosis causada por microorganismos resistentes y asociados a la infección por HIV se ha convertido en un gran desafío para la salud pública, y es necesario implementar todas las estrategias posibles para evitar la diseminación (30,31).
Sin embargo, se deben recordar dos aspectos. El primero es que el control de la transmisión de la tuberculosis está primordialmente dirigido a la prevención de la diseminación a través del aire y el ambiente tiene poca importancia en los mecanismos de transmisión, pero, las características de crecimiento y las publicaciones que implican las micobacterias no tuberculosas en enfermedad en humanos, le imprimen al control de ambiente y superficies una importancia vital. El segundo es que las pruebas que se realizan con un desinfectante para evaluar su capacidad tuberculocida no se limitan al control de las micobacterias, sino que, dado que los microorganismos esporulados son los más difíciles de eliminar mediante los procesos de esterilización y desinfección, la efectividad demostrada de un desinfectante para estos gérmenes lo hace de elección para la desinfección en áreas de atención a pacientes y en los laboratorios.
El ortoftalaldehído es un desinfectante de alto nivel, el cual muestra un efecto bactericida a una concentración de 0,55 % y no necesita de un agente de activación, permaneciendo estable por, al menos, 14 días. El ortoftalaldehído puede reducir a las micobacterias en un factor de 105 en 5 minutos; entre sus ventajas están que no necesita ser activado, no es irritante, el olor es casi indetectable y es estable sobre un amplio rango de pH (3 a 9). En este estudio, el ortoftalaldehído tuvo una efectividad del 100 % en todas las especies en condiciones limpias y con interferencia.
Se concluye con el presente estudio que el ácido hipocloroso es 100 % efectivo en todos los intervalos de tiempo y a todas las concentraciones evaluadas en condiciones limpias, mientras que, en condiciones sucias, se ve reducida su efectividad sólo a las más altas concentraciones (900 y 1.500 ppm). En la prueba de superficie, el ácido hipocloroso inhibió el crecimiento de las micobacterias a la mínima concentración (225 ppm durante 5 minutos), obteniendo el mismo porcentaje de efectividad que en condiciones limpias (100 %).
Se demostró que el ácido hipocloroso, al menos en las concentraciones evaluadas en este trabajo, no llega a ser tan efectivo como lo es el ortoftalaldehído, el cual fue 100 % efectivo en todas las condiciones evaluadas. El ácido hipocloroso es más económico y muestra ser efectivo en ausencia de materia orgánica, y en las pruebas de corrosión demostró ser seguro para los materiales.
Para recomendar la utilización del ácido hipocloroso en la desinfección de alto nivel para instrumentos médicos, es necesario hacer pruebas con aislamientos clínicos y pruebas de subproductos del desinfectante para determinar la probable toxicidad en su uso rutinario, recordando que, en todos los casos, la limpieza manual es un primer paso en el proceso para eliminar los residuos de las superficies o instrumentos y que la desinfección de superficies (elementos no críticos) no requiere que los desinfectantes utilizados tengan actividad tuberculocida.
Correspondencia: Ángela Liliana Londoño, Programa de Medicina, Facultad de Ciencias de la Salud, Universidad del Quindío, Calle 12 norte con carrera 15, Armenia, Colombia. Teléfonos: (576) 746-0129 y 746-0185: fax: (576) 746-0129. Dirección electrónica: angelalilianal@uniquindio.edu.co
Referencias
1. Murray PR, Rosenthal KS, Pfaller MA. Microbiología médica. Madrid: Elsevier España; 2007. p. 297-310. [ Links ]
2. Casal MM, Casal M. Las micobacterias atípicas como patógenos emergentes. Enf Emerg. 2000;2:220-30. [ Links ]
3. Primm TP, Lucero CA, Falkinham III JO. Health impacts of environmental Mycobacteria. Clin Microbiol Rev. 2004;17:98-106. [ Links ]
4. García JM, Palacios JJ, Sánchez AA. Infecciones respiratorias por micobacterias ambientales. Arch Bronconeumol. 2005; 41:206-19. [ Links ]
5. Howard S, Byrd T. The rapidly growing mycobacteria: Saprophytes and parasites. Microbes Infec. 2000;2:1845-53. [ Links ]
6. Zaballos P, Ara M, Seral C, Rodero J, Grasa MP, Agurruza JM, et al. Foliculitis pos depilación por M. chelonae. Actas Dermosifilogr. 2002;93:259-62. [ Links ]
7. Le Dantec C, Duguet JP, Montiel A, Dumoutier N, Dubrou S, Vincent V. Chlorine disinfection of atypical Mycobacteria isolated from a water distribution system. App Environ Microbiol. 2002; 68(3):1025-32. [ Links ]
8. Falkinham JO. Environmental sources of M. avium linked to routes of exposure. En: Pedley S, Bartram J, Rees G, Dufour A, Cotruvo JA, editors. Pathogenic Mycobacteria in water: A guide to public health consequences, monitoring and management. Geneva: WHO; 2004. [ Links ]
9. Rutala WA, Weber DJ; the Healthcare Infection Control Practices Advisory Committee (HICPAC). Guideline for disinfection and sterilization in healthcare facilities. Atlanta: CDC; 2008. [ Links ]
10. Falkinham JO, Nichols G, Bartram J, Dufour A, Portaels F. Natural ecology and survival in water of Mycobacteria of potencial public health significance. En: Pedley S, Bartram J, Rees G, Dufour A, Cotruvo JA, editors. Pathogenic Mycobacteria in water: A guide to public health consequences, monitoring and management. Geneva: WHO; 2004; p: 18-21. [ Links ]
11. Caminero JA. Micobacterias atípicas. BSCP Can Ped. 2001;25(2):237- 48. [ Links ]
12. Leão SC, Martín A, Mejía GI, Palomino JC, Robledo J, Da Silva MA, et al. Practical handbook for the phenotypic and genotypic identification of Mycobacteria. Fecha de consulta: 1 de diciembre de 2010. Disponible en: http://www.esmycobacteriology.eu/PDF%20files/foreword.pdf [ Links ]
13. Tortoli E. Impact of genotypic studies on Mycobacterial taxonomy: The new Mycobacteria of the 1990s. Clin Microbiol Rev. 2003;16:319-54. [ Links ]
14. Rivera IA, Guevara A, Escalona A, Oliver M, Pérez R, Piquero J, et al. Infecciones en tejidos blandos por micobacterias no tuberculosas secundarias a mesoterapia. ¿Cuánto vale la belleza? Enferm Infecc Microbiol Clin. 2006; 24:302-6. [ Links ]
15. García I, Fernández P, Fernández J, García A. Infección cutánea por M. chelonae. Revisión de seis casos. Actas Dermosifilogr. 2002; 93:584-7. [ Links ]
16. Gómez R, Hidalgo F, Crespo AM, Fernández J. Infección cutánea por M. chelonae en relación con la acupuntura. Med Clin (Barcelona). 2004;122:636-9. [ Links ]
17. Del Solar M, Salomón M, Bravo F, Seas C, Gotuzzo E, Culqui D, et al. Infección cutánea por micobacterias atípicas de crecimiento rápido (MACR) debido a mesoterapia cosmética: reporte de casos y revisión de la literatura. Folia Dermatol Perú. 2005;16:127-35. [ Links ]
18. Henry MT, Inamdar L, Riordain DO, Schweiger M, Watson JP. Nontuberculous Mycobacteria in non-HIV patients: Epidemiology, treatment and response. Eur Respir J. 2004;23:741-6. [ Links ]
19. Bello T, Rivera IA, De Waard JH. Inactivación de micobacterias con desinfectantes registrados como tuberculocidas. Enferm Infecc Microbiol Clin. 2006;24:319-21. [ Links ]
20. Herruzo R, Vizcaíno MJ, Rodríguez J. Comparison of the microbicidal efficacy on germ carriers of several tertiary amine compounds with ortho-phthalaldehyde and perasafe. J Hosp Infec. 2006;63:73-8. [ Links ]
21. Henao S, Sierra C, Gaitán J. Actividad bactericida del ácido hipocloroso. Rev Fac Med Univ Nac Colomb. 2003;51:136-42. [ Links ]
22. Oriani DS, Sagardoy MA. Susceptibilidad de Mycobacterium fortuitum, Mycobacteriun phlei y Mycobacteriun kansasii frente a tres soluciones germicidas. InVet. 2005;7:55-62. [ Links ]
23. Asociación Española de Normalización y Certificación. Norma UNEEN 14885: 2007. Aplicación de normas europeas para los antisépticos y desinfectantes químicos. Madrid, España AENOR; 2007. [ Links ]
24. Instituto Colombiano de normas técnicas y certificación. Norma Técnica Colombiana 4672: Requisitos mínimos para la comercialización de desinfectantes de uso hospitalario de acuerdo a su indicación de uso. Bogotá: ICONTEC; 2006. [ Links ]
25. Instituto Colombiano de normas técnicas y certificación. Norma Técnica Colombiana 4964: Ensayo para determinar el efecto corrosivo de un descontaminante, agente limpiador o desinfectante sobre los instrumentos medico quirúrgicos reutilizables. Bogotá: ICONTEC; 2001. [ Links ]
26. Herruzo R, Vizcaíno MJ, Fernández MJ. The influence of laboratory adaptation on test strains, such as Pseudomonas aeruginosa, in the evaluation of the antimicrobial efficacy of ortho-phthalaldehyde. J Hosp Infec. 2004;57:217-22. [ Links ]
27. Rojas R. Estabilidad de la solución de hipoclorito generado por electrólisis. Lima, 2000. En: ABES - Associação Brasileira de Engenharia Sanitária e Ambiental XXVII Congresso Interamericano de Engenharia Sanitária e Ambiental. Porto Alegre. Fecha de consulta: 1 de diciembre de 2009. Disponible en: http://www.cepis.org.pe/tecapro/documentos/agua/iEstabilidad.pdf. [ Links ]
28. Vizcaíno MJ, Herruzo R, Fernández MJ. Comparison of the disinfectant efficacy of Perasafe® and 2% glutaraldehyde in in vitro tests. J Hosp Infect. 2002;53:124-8. [ Links ]
29. World Health Organization. Environmental Health Criteria, No 216; Disinfectants and disinfectants by-products. Geneva: WHO; 2000. Fecha de consulta: 1 de diciembre de 2010. Disponible: http://www.who.int/ipcs/publications/ehc/ehc_216/en/ [ Links ]
30. LoBue P, Sizemore C, Castro KG. Plan to combat extensively drugresistant tuberculosis: Recommendations of the Federal Tuberculosis Task Force Centers for Disease Control and Prevention. MMWR Morb Mortal Wkly Rep. 2009;58(RR-3). [ Links ]
31. Department of Health and Human Services, Centers for Disease Control and Prevention, National Institute for Occupational Safety and Health. Environmental Control for Tuberculosis: Basic upperroom ultraviolet germicidal irradiation guidelines for healthcare settings. Atlanta: DHHS (NIOSH); 2009. [ Links ]














