Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Infectio
Print version ISSN 0123-9392
Infect. vol.15 no.4 Bogotá Oct./Dec. 2011
Recibido: 06/09/2011; Aceptado: 09/11/2011
Resumen
Introducción. La vigilancia serológica de la toxoplasmosis no se incluye comúnmente en el control prenatal de las mujeres gestantes del departamento de Sucre; además, las técnicas usadas para el diagnóstico de la toxoplasmosis congénita no tienen suficiente sensibilidad para detectar los casos activos con el fin de instaurar un tratamiento oportuno y, así, reducir las secuelas en el recién nacido. El objetivo de este trabajo fue utilizar la amplificación de ADN de T. gondii mediante la técnica de reacción en cadena de la polimerasa (PCR) anidada en muestras de sangre de mujeres gestantes seronegativas de Sincelejo, para detectar la presencia del parásito.
Materiales y métodos. La PCR anidada se realizó durante un período de 17 meses a partir del ADN extraído de las muestras de sangre de 100 mujeres gestantes de Sincelejo, seronegativas por la prueba ELFA (Enzyme-Linked Fluorescent Assay) IgG ant-Toxoplasma.
Resultados. Se detectó ADN de T. gondii en 12 de las 100 mujeres gestantes incluidas en el estudio. Fue posible contactar para seguimiento a siete de ellas; en cuatro se detectaron títulos de anticuerpos IgG, que correspondían a la seroconversión de mujeres gestantes positivas por PCR.
Conclusiones. La utilidad de la técnica de PCR en la detección de ADN de T. gondii en muestras de sangre periférica de mujeres gestantes con resultados negativos por la prueba ELFA IgG anti-Toxoplasma. Esta investigación demuestra la importancia de combinar las pruebas serológicas con técnicas moleculares para mejorar el diagnóstico de la infección por T. gondii.
Palabras clave: Toxoplasma gondii, PCR anidada, seronegativa, embarazada, Sincelejo.
Abstract
Introduction: Toxoplasmosis is a worldwide disease caused by the protozoan parasite Toxoplasma gondii, which can produce serious damage in immune compromised patients and congenitally infected newborns. Serological screening for T. gondii infection is not currently included in the routine prenatal control for pregnant women in the department of Sucre; moreover, techniques used for diagnosis of congenital toxoplasmosis do not show enough sensitivity in the detection of active cases of toxoplasmosis in order to offer opportune treatment and to reduce the consequences of this infection in the newborn.
Objective: To detect DNA of Toxoplasma gondii by nested PCR assay in peripheral blood samples of seronegative pregnant women from Sincelejo, Sucre.
Materials and methods: Nested PCR assay was done using DNA extracted from peripheral blood samples of 100 seronegative pregnant women by Elfa anti-Toxoplasma IgG assay from the city of Sincelejo, throughout a 17 month period.
Results: T. gondii DNA was detected in 12 of the 100 pregnant women included in this study. It was possible to follow 7 of them, and only 4 showed high titles of IgG antibodies obtaining an overall seroconversion of 57,1% in positive pregnant women by the PCR assay.
Conclusions: These results demonstrate the utility of a PCR test to detect Toxoplasma gondii DNA in peripheral blood samples of seronegative pregnant women by ELFA anti-Toxoplasma IgG test. This research also confirms the importance of combining serological tests with molecular techniques to improve the diagnosis of Toxoplasma gondii infection.
Key words: Toxoplasma gondii, nested PCR, seronegative, pregnant, Sincelejo.
Introducción
Toxoplasma gondii es un protozoario que se comporta como parásito intracelular obligado (1,2); sus huéspedes definitivos son los gatos, y los intermediarios son los humanos, mamíferos, aves y peces (3,4). Este protozoo es el agente causal de la toxoplasmosis, enfermedad parasitaria que en los adultos cursa casi siempre asintomática (5); sin embargo, los casos más graves se presentan en personas con depresión inmunitaria y en recién nacidos que han adquirido la infección congénitamente (6,7,8).
La toxoplasmosis congénita se debe a una infección aguda, generalmente asintomática. Cuando es adquirida por primera vez durante el embarazo, puede transmitirse al feto, ocasionándole problemas de salud que pueden presentarse al nacer o desarrollarse en etapas tardías de la vida (6,9). Cuando la madre se infecta en el último trimestre del embarazo, existe un riesgo de transmisión del 65 %; esta cifra disminuye a 30-54 % cuando la infección fue adquirida en el segundo trimestre y a 10-15 % si lo fue en el primer trimestre (10).
En aquellos casos en los que la infección se produce al principio del embarazo, se desarrolla la enfermedad en la vida intrauterina y puede ocasionar abortos, encefalomielitis, macrocefalia, hidrocefalia, trastornos oculares y retraso psicomotriz (7,11,12); si la infección es adquirida durante el segundo o tercer trimestre, se pueden presentar lesiones graves pero con manifestaciones tardías, como epilepsia, retardo en el desarrollo neurosíquico, retinocoroiditis y calcificaciones cerebrales (6,7). Teniendo en cuenta las consecuencias de la enfermedad, se considera indispensable hacer un seguimiento de las mujeres en gestación no sólo en sus primeros meses, sino durante todo el embarazo (13).
En Colombia, el Estudio Nacional de Salud de 1980 reportó que 47 % de la población general había tenido contacto con el parásito, evidenciado por la detección de anticuerpos IgG anti- Toxoplasma; en la Región Caribe se reportaron los títulos más altos del país (14,15). La infección por T. gondii se presenta en 1 a 2 % de la población de mujeres embarazadas, las cuales transmitirán la enfermedad al feto en el 50 % de los casos; de éstos, 90 % correspondería a infección asintomática en recién nacidos.
La toxoplasmosis congénita en el país es aún un problema de salud pública importante; se calcula que cada año aparecen de 2 a 10 casos de infección congénita por cada 1.000 recién nacidos (13); sin embargo, ni el Ministerio de la Protección Social, ente encargado de la vigilancia y control de la enfermedad, ni los comités reguladores de salud han autorizado o incluido el programa de control prenatal en los planes obligatorios de salud, que permita detectar oportunamente los casos de toxoplasmosis congénita y se disminuyan las secuelas de la enfermedad mediante un tratamiento clínico. Por ello, en ausencia de intervención terapéutica, cada año nacen entre 800 y 3.000 niños infectados (15).
En el primer estudio multicéntrico neonatal sobre toxoplasmosis realizado del 2009 al 2010 en Barranquilla, Bogotá, Florencia, Armenia, Riohacha, Cúcuta y Bucaramanga, se diagnosticaron 218 niños con infección congénita -sintomáticos y asintomáticos- con una letalidad del 25 % en los niños sin tratamiento clínico (16).
En Sincelejo se ha reportado 2 % de seroconversión en mujeres embarazadas (17), hecho que evidencia la necesidad de implementar los programas de prevención y control de las gestantes seropositivas y, aún más, en las seronegativas debido al alto riesgo de infección que éstas pueden presentar al no haber tenido contacto con el parásito, lo que las hace más propensas a adquirir la enfermedad en cualquier etapa de la gestación.
El seguimiento serológico de la infección por T. gondii no se incluye comúnmente en el control prenatal de las mujeres gestantes del departamento de Sucre; además, las técnicas utilizadas en el diagnóstico de la toxoplasmosis congénita no son lo suficientemente sensibles para detectar los casos activos de toxoplasmosis con miras a implementar un tratamiento oportuno con el fin de reducir las secuelas en el recién nacido. Por esta razón, el objetivo del presente estudio fue evaluar la técnica de reacción en cadena de la polimerasa (PCR) anidada en muestras de sangre periférica de 100 mujeres gestantes de Sincelejo, seronegativas por la técnica ELFA (Enzyme- Linked Fluorescent Assay) IgG anti-Toxoplasma, con el fin de determinar casos de infección.
Materiales y métodos
El estudio se llevó a cabo en el municipio de Sincelejo, departamento de Sucre, localizado a 9° 18" latitud norte y 75° 23" longitud oeste, con un clima de bosque seco y una altura de 213 metros sobre el nivel del mar.
Se incluyeron en el estudio 100 mujeres gestantes seronegativas para la prueba de IgG anti- Toxoplasma mediante ELFA, realizada en tres laboratorios clínicos especializados de Sincelejo, en un período de 17 meses. Todas las mujeres gestantes incluidas en el estudio firmaron el consentimiento informado.
Detección molecular del parásito. A partir de las muestras de sangre seronegativas para la prueba de IgG anti-Toxoplasma, se hizo la extracción de ADN total utilizando el protocolo de concentraciones moderadas de sales (18).
El ADN del parásito se detectó mediante PCR anidada con el fin de aumentar la especificidad y la sensibilidad de la técnica, para lo cual se utilizaron dos pares de cebadores que amplifican una región del gen B1 de T. gondii. El proceso de amplificación se llevó a cabo en dos etapas. La primera fase consistió en la amplificación de un fragmento de 193 pb utilizando los iniciadores Toxo N1 y Toxo C1, y la segunda ronda se llevó a cabo mediante la amplificación de un fragmento de 96 pb con los iniciadores Toxo N2 y Toxo C2.
Para evitar resultados falsos negativos se empleó, como control interno positivo, ADN de la cepa RH de T. gondii y ADN de una muestra de sangre cebada con cepa RH de T. gondii positiva por PCR; el control interno negativo consistió en ADN obtenido de una muestra de sangre de una paciente seronegativa, que no amplifica con los iniciadores usados en la PCR anidada y un volumen de agua filtrada estéril, que indica posibles contaminaciones.
Visualización de los productos de PCR
Los productos de PCR se separaron mediante electroforesis en gel de agarosa al 2,5 % en solución tampón al 0,5 % de tris-ácido bórico-EDTA (TBE) a 80 voltios durante 90 minutos y se visualizaron en un transiluminador de luz ultravioleta (UV Transilluminator®, UVP), teñidos previamente con 0,5 μg/ml de bromuro de etidio.
En cada electroforesis se utilizaron un control positivo, un control negativo y un marcador de peso molecular 100 pb (CIB Corpogen), con el fin de determinar el tamaño de los fragmentos amplificados.
La PCR anidada se consideró positiva cuando el fragmento de amplificación correspondía a un peso de 96 pb.
Análisis estadístico
Para el análisis de los datos, las variables obtenidas en la encuesta se relacionaron en una base de datos, en forma individual y en relación con la infección. En primer lugar, se determinaron las frecuencias de cada una de las variables y luego se relacionaron con la presencia de la infección por medio del análisis estadístico: prueba de ji al cuadrado y prueba P, utilizando el software EpiInfo, versión 3.3.2, del 9 de febrero de 2005 y Excel® 2003 de Microsoft.
Resultados
De las 100 muestras de sangre periférica de mujeres gestantes seronegativas procesadas mediante PCR anidada y analizados los productos obtenidos en los geles de agarosa, fue posible detectar la presencia del parásito por identificación del fragmento de ADN de 96 pb de T. gondii en 12 muestras, de pacientes en un rango de edad de gestación entre el primero y segundo trimestre. Esto equivale a una frecuencia de detección del 12 %. Al ser analizadas por duplicado, estas muestras siempre fueron positivas, y los controles negativos siempre fueron negativos (figura 1).
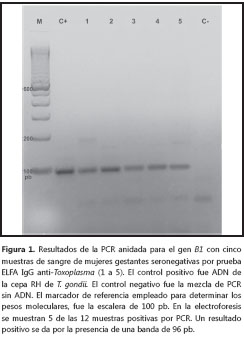
Determinación de seroconversión por prueba ELFA IgG en mujeres gestantes positivas por PCR anidada
De las 12 mujeres gestantes positivas por PCR anidada, sólo fue posible localizar siete de ellas para tomar una nueva muestra de sangre periférica a los dos meses; a estas muestras se les practicó nuevamente la prueba IgG anti-Toxoplasma mediante la técnica ELFA con el fin de determinar seroconversión, y PCR anidada para verificar si aún era posible detectar el parásito en sangre (figura 2). De las siete muestras, cuatro resultaron positivas por la prueba ELFA, y se detectó ADN del parásito en sangre en cinco de las siete muestras analizadas nuevamente por PCR anidada (tabla 1).
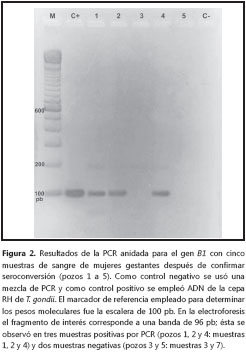
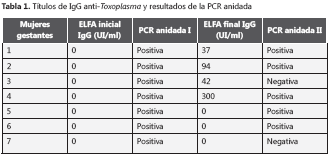
Las mujeres gestantes con seroconversión determinada por títulos de IgG fueron remitidas para manejo clínico, con el fin de diagnosticar infección aguda mediante la prueba IgM anti-Toxoplasma y suministrar el tratamiento específico para disminuir las secuelas de la infección en el niño.
Discusión
Los resultados del presente estudio demuestran la importancia del seguimiento serológico de las mujeres durante el embarazo, especialmente en las mujeres gestantes seronegativas debido a que podrían adquirir la infección por T. gondii en cualquier etapa de la gestación. El estudio demostró que, por PCR anidada, había sido posible detectar infección reciente en 12 de 100 mujeres gestantes con prueba ELFA IgG negativa durante el primero y segundo trimestre de gestación, períodos durante los cuales las manifestaciones clínicas en el niño son más graves una vez el parásito atraviesa la placenta (19,20,21). Estos resultados aportaron información valiosa que permitió suministrar tratamiento oportuno a las mujeres gestantes para disminuir las secuelas en los recién nacidos.
Los resultados positivos por PCR anidada en muestras negativas por ELFA IgG demostraron la presencia de parásitos en sangre, lo que in dica que se está frente a una infección reciente en la cual, posiblemente, no se ha producido una respuesta inmunitaria humoral secundaria anti-Toxoplasma (22); es recomendable, entonces, evaluar los títulos de IgG anti-Toxoplasma, cuatro semanas más tarde para determinar si hay seroconversión en las mujeres gestantes. Según estos resultados, se demuestra la utilidad de la prueba de PCR en el diagnóstico temprano de la toxoplasmosis congénita.
En este estudio se logró detectar títulos de anticuerpos IgG anti-Toxoplasma en cuatro de las siete mujeres gestantes positivas por la técnica de PCR. La seroconversión encontrada mediante la técnica ELFA IgG en las mujeres gestantes de este estudio, demuestra la exposición de la población a T. gondii en el departamento; en este sentido, se plantea la necesidad de instituir programas de prevención y seguimiento serológico periódico en las mujeres gestantes para evitar la primoinfección durante el embarazo y disminuir la prevalencia e incidencia de la enfermedad (11,20,23).
Los resultados positivos por PCR anidada en mujeres gestantes que no presentaron seroconversión, podrían explicarse por una baja respuesta de anticuerpos debido a factores genéticos o a la inmunosupresión parcial que sufren las embarazadas (22); por lo tanto, es probable que los bajos niveles de anticuerpos no sean detectables por el método empleado. Esto sugiere la necesidad de una segunda prueba de IgG con un estuche de otra marca o prueba de referencia y una prueba de detección de anticuerpos de tipo IgM anti-Toxoplasma; además, al emplear controles negativos, como el ADN obtenido de una muestra de sangre de una paciente seronegativa que no amplifica con los iniciadores usados en la PCR anidada y un volumen de agua filtrada estéril, podría descartarse una posible contaminación durante el proceso de extracción de ADN.
Después de confirmar la seroconversión en las mujeres gestantes, se practicó nuevamente una PCR anidada para evaluar la detección de ADN del parásito en sangre. Los resultados positivos por ELFA y negativos por PCR demuestran que el período de circulación de T. gondii en sangre es muy corto, debido a que después de la fase aguda el parásito se enquista en diferentes órganos, particularmente en retina, músculo esquelético, miocardio, tejido linfático, placenta y, más frecuentemente, en el sistema nervioso central (10). Además, los resultados negativos por PCR no excluyen una infección reciente por T. gondii debido a posibles variaciones en la manipulación durante el proceso de extracción de ADN; también, es probable que después de extraer el ADN persistan agentes inhibidores que influyan en los resultados de la PCR.
Según los resultados obtenidos en este estudio, se demostró la utilidad de la técnica de PCR anidada en muestras de sangre para el diagnóstico temprano de casos de toxoplasmosis congénita (24), evidenciado por la obtención de 12 resultados positivos por PCR en mujeres gestantes seronegativas por la técnica ELFA. Este hecho refleja la gran sensibilidad y especificidad de la PCR que es capaz de detectar ADN del parásito en pequeñas cantidades (25). La gran sensibilidad de la PCR también se explica por el empleo de cebadores dirigidos a la amplificación de un segmento del gen B1 que se repite 35 veces en el genoma del parásito (26).
Este estudio demuestra la importancia que podría tener la combinación de la técnica de PCR con las pruebas serológicas para establecer el diagnóstico temprano de los casos de toxoplasmosis congénita, y la posibilidad de incluirlas como herramientas diagnósticas en los programas de vigilancia epidemiológica de la toxoplasmosis en el país.
Agradecimientos
Al Laboratorio de Investigaciones Biomédicas de la Universidad de Sucre; al Laboratorio Clínico Especializado Yamina Cumplido, Sincelejo; al Laboratorio Clínico Especializado Ford Ltda., Sincelejo; al grupo GEPAMOL de la Universidad del Quindío, y a Víctor Gómez del grupo GIEPI de la Universidad de Antioquia.
Correspondencia: Pedro José Blanco, Grupo de Investigaciones Biomédicas, Universidad de Sucre, Carrera 14 N° 16B-32, Apartado aéreo 406, Sincelejo, Colombia. Teléfono: (095) 282-0830; fax: (095) 281-8130. Dirección electrónica: pblancot@gmail.com
Referencias [ Links ]
2. El-On J, Peiser J. Toxoplasma and toxoplasmosis. Harefuah. 2003;142: 48-55, 77. [ Links ]
3. Ospina S. Toxoplasmosis. En: Londoño M, editor. Clínica y complicaciones de las parasitosis. Medellín: Universidad de Antioquia; 1993. p. 591-611. [ Links ]
4. Hide G, Gerwash O, Morley E, Williams R, Hughes J, Thomasson D, et al. Does vertical transmission contribute to the prevalence of toxoplasmosis? Parasitologia. 2007;49:223-26. [ Links ]
5. Botero D, Restrepo M. Toxoplasmosis. En: Botero D, Restrepo M. Parasitosis humanas. Cuarta edición. Medellín: Corporación para Investigaciones Biológicas; 2003. p. 262-79. [ Links ]
6. Rodríguez M, Rodríguez D, Ginorio D, Martínez R, Casanova P, Fraga J, et al. Primoinfección por Toxoplasma gondii durante el embarazo. Revista Panamericana de Infectología. 2006;8:43-6. [ Links ]
7. Martín I. Toxoplasmosis congénita: una mirada al problema. Revista Biomédica. 2004;15:181-90. [ Links ]
8. Colombo F, Vidal J, Augusto C, Penalva D, Hernandez A, Bonasser- Filho F, et al. Diagnosis of cerebral toxoplasmosis in AIDS patients in Brazil: Importance of molecular and immunological methods using peripheral blood samples. J Clin Microbiol. 2005;43:5044-7. [ Links ]
9. Gómez-Marín J, González M, Montoya M, Giraldo A, Castaño J. A newborn screening programme for congenital toxoplasmosis in the setting of a country with less income. Arch Dis Child. 2007;92:88. [ Links ]
10. Martín I, García S. Toxoplasmosis en el hombre. Bioquímica. 2003;28:19-27. [ Links ]
11. De Miguel J, Cavero A, Montero J, Toxoplasmosis: principales problemas materno-fetal. Actualidad Obstétrico Ginecológica. 2002;14:45-51. [ Links ]
12. Klaren V, Kijlstra A. Toxoplasmosis: An overview with emphasis on ocular involvement. Ocular Immunol Inflam. 2002;10:1-26. [ Links ]
13. Gómez J. Guía de práctica clínica para toxoplasmosis durante el embarazo y toxoplasmosis congénita en Colombia. Infectio. 2007;11:129-41. [ Links ]
14. Juliao O, Corredor A, Moreno G. Toxoplasmosis en Colombia, Bogotá: Instituto Nacional de Salud; 1988. [ Links ]
15. Gómez J, Piñón J. Virulencia en Toxoplasma gondii: las presentaciones clínicas inusuales en la Amazonia pueden poner en evidencia factores de virulencia. Rev Salud Pública (Bogotá). 2001; 3(Supl.1):35-41. [ Links ]
16. Gómez-Marin J, De la Torre A, Angel-Muller A, Rubio J, Arenas J, et al. First Colombian Multicentric Newborn Screening for Congenital Toxoplasmosis. PLoS Negl Trop Dis. 2011;5:1-10. [ Links ]
17. Machado N, Manrique E, Ruiz B, Blanco P. Alta frecuencia de seroconversión toxoplásmica en gestantes de Sincelejo, Sucre. Infectio. 2004;8:263-6. [ Links ]
18. Katovich C, Fernández M, Gao X, Middleton D, Ng J, Noreen H, et al. HLA class I and II DNA based typing sequence specific oligonucleotide probe typing. Technical Manual/Reference Protocols. Version 1.1. Seattle, USA. Thirteenth International Histocompatibility Workshop; 1998. p. 4-11. [ Links ]
19. Carrada T. Toxoplasmosis: parasitosis reemergente del nuevo milenio. Revista Mexicana de Patología Clínica. 2005;52:151-62. [ Links ]
20. Rosso F, Agudelo A, Isaza A, Montoya J. Toxoplasmosis congénita: aspectos clínicos y epidemiológicos de la infección durante el embarazo. Colombia Médica. 2007;38:316-37. [ Links ]
21. Nimri L, Peloux H, Elkhatib L. Detection of Toxoplasma gondii DNA and specific antibodies in high risk pregnant women. Am J Trop Med Hyg. 2004;71:831-5. [ Links ]
22. Kompalic-Cristo A, Frotta C, Suárez-Mutis M, Fernandes O, Britto C. Evaluation of a real-time PCR assay based on the repetitive B1 gene for the detection of Toxoplasma gondii in human peripheral blood. Parasitol Res. 2007;101:619-25. [ Links ]
23. Mombro M, Perathoner C, Leone A, Buttafuoco V, Zotti C, Lievre M, et al. Congenital toxoplasmosis: Assessment of risk to newborns in confirmed and uncertain maternal infection. Eur J Pediatr. 2003;162:703-6. [ Links ]
24. Mattos C, Meira C, Ferreira A, Frederico F, Hiramoto R, Almeida G, et al. Contribution of laboratory methods in diagnosing clinically suspected ocular toxoplasmosis in Brazilian patients. Diagn Microbiol Infect Dis. 2011;70:362-6. [ Links ]
25. Ponce N, Gómez J. Estandarización y validación clínica de la prueba de reacción en cadena de la polimerasa (PCR) para el diagnóstico de toxoplasmosis cerebral en pacientes infectados por el VIH. Infectio. 2003;7:8-14. [ Links ]
26. Jones C, Okhravi N, Adamson P, Tasker S, Lightman S. Comparison of PCR detection methods for B1, P30, and 18S rDNA genes of T. gondii in aqueous humor. Invest Ophthalmol Vis Sci. 2000;41:634-44. [ Links ]














