Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Infectio
Print version ISSN 0123-9392
Infect. vol.16 no.2 Bogotá June/Dec. 2012
Ana Lucía Correa1, Luz María Mazo1, Mónica Patricia Valderrama1, Alejandra Restrepo2, Fabián Jaimes3
1 Comité de Prevención de Infecciones, Hospital Pablo Tobón Uribe, Medellín, Colombia
2 Grupo de Farmacovigilancia, Hospital Pablo Tobón Uribe, Medellín, Colombia
3 Unidad de Investigaciones, Hospital Pablo Tobón Uribe. Departamento de Medicina Interna, Universidad de Antioquia, Medellín, Colombia
Recibido: 29/05/2012; Aceptado: 13/06/2012
Resumen
Leclercia adecarboxylata es una enterobacteriácea reportada ocasionalmente como un germen oportunista que compromete pacientes con algún tipo de inmunosupresión como neutropenia, cirrosis o cáncer. Se reporta un brote de cinco casos de bacteriemia por L. adecarboxylata en pacientes con diversas condiciones de inmunosupresión, probablemente asociado con el uso de viales de heparina contaminados. Se hace una revisión actualizada de la literatura y una discusión sobre los aspectos particulares del brote y del microorganismo.
Palabras clave: heparina, Leclercia adecarboxylata, bacteriemia, brote
Abstract
Leclercia adecarboxylata is part of the Enterobacteriaceae family occasionally reported as an opportunist microorganism in patients with any kind of immunosuppression as neutropenia, cirrhosis or cancer. We report an outbreak with five cases of Leclercia adecarboxylata bacteremia in patients with several immune conditions, most likely associated to contaminated heparin vials. We also present an updated literature review and discussion regarding the particular characteristics of the outbreak and the microorganism.
Keywords: heparin, L. adecarboxylata, bacteremia, outbreak
Introducción
Leclercia adecarboxylata es una bacteria de la familia Enterobacteriaceae encontrada en la flora gastrointestinal normal de animales y humanos (1). Se ha cultivado también de la piel de individuos sanos, el agua, los alimentos, la leche y en diversas fuentes ambientales como reservas de grasas y aceites industriales (2-4).
El microorganismo es cosmopolita, pero su verdadero significado clínico y su virulencia no son claros dado el escaso número de publicaciones relacionadas con este tema. En la mayoría de casos informados se presenta como un germen oportunista que compromete pacientes con algún tipo de inmunosupresión, como neutropenia, cirrosis o cáncer, y suele aislarse de infecciones polimicrobianas (3,5,6).
En este reporte se describe un brote de bacteriemias por L. adecarboxylata, probablemente asociado al uso de heparina premezclada contaminada utilizada para permeabilizar los accesos venosos centrales y periféricos, y se presenta, además, una revisión actualizada de la literatura.
Métodos y resultados
El hospital donde se presentaron los casos es una institución universitaria de tercer nivel de complejidad con 380 camas, 60 de las cuales son de cuidados intensivos. Cuenta con todas las especialidades médico-quirúrgicas, excepto obstetricia y es, además, un centro de trasplantes de médula ósea, hígado, riñón y multivisceral.
Se identificó el caso índice en una mujer de 51 años con diagnóstico de leiomiosarcoma de útero, estado IV, con metástasis retroperitoneal y en progresión pulmonar, que consultó al Servicio de Urgencias la noche del 30 de abril de 2011 por una semana de evolución de fiebre y escalofrío. La paciente estaba en tratamiento con quimioterapia desde el 23 de febrero del mismo año, fecha en la que se le implantó un catéter central de inserción periférica, y 13 días antes de la consulta había recibido un tercer ciclo de quimioterapia.
En la valoración inicial de urgencias no se detectó un foco evidente de infección; el recuento de blancos al ingreso era de 1.100 leucocitos totales con 56 % de polimorfonucleares neutrófilos, y después de 657 minutos de tomados los hemocultivos a través del catéter central de inserción periférica se detectó crecimiento de un bacilo gramnegativo. El 6 de mayo se hizo el reporte definitivo de crecimiento de L. adecarboxylata y no se obtuvo crecimiento de germen en los otros dos cultivos tomados simultáneamente de sangre periférica. Desde el ingreso por urgencias se inició tratamiento empírico con piperacilina-tazobactam y el catéter central de inserción periférica se retiró el 4 de mayo. La paciente estuvo estable durante toda su hospitalización, no requirió manejo en cuidado crítico y fue dada de alta en buenas condiciones el 16 de mayo.
El mismo 6 de mayo, el Laboratorio de Microbiología informó crecimiento de L. adecarboxylata en un hemocultivo tomado por catéter de cámara implantable en un niño de 5 años con diagnóstico de leucemia linfoide aguda. El niño estaba hospitalizado desde el 11 de abril por recaída de su leucemia recibiendo quimioterapia de rescate, y ya había presentado un episodio de neutropenia febril con cultivos negativos y tratamiento empírico con cefepime entre el 17 y el 24 de ese mes. El 2 de mayo presentó nuevo episodio de neutropenia febril con 400 leucocitos totales, por lo que se solicitaron hemocultivos tomados a través del catéter de cámara implantable (N°1) y de sangre periférica (N°2). Luego de 467 minutos de incubación del hemocultivo tomado a través del catéter se obtuvo crecimiento de Pantoea spp. y L. adecarboxylata. Al tratamiento iniciado el 2 de mayo con cefepime se agregó posteriormente clindamicina y amikacina; el catéter de cámara implantable se retiró el 4 de mayo y el niño fue dado de alta en buenas condiciones el 16 de mayo.
Ante el hallazgo en un mismo día en muestras de hemocultivos de dos pacientes diferentes, de un germen no conocido previamente en la institución, se hizo una revisión exhaustiva de todos los resultados microbiológicos reportados con anterioridad. Antes del 6 de mayo sólo se encontró un reporte del 18 de abril de ese año en un hemocultivo positivo para L. adecarboxylata, tomado por catéter de cámara implantable en una niña de 9 años con diagnóstico de anemia de Diamond- Blackfan desde los 6 meses de edad (hipoplasia selectiva de glóbulos rojos), además de diabetes mellitus tipo 1, hipertensión pulmonar y sordera neurosensorial. La paciente tenía el catéter de cámara implantable desde el 17 de diciembre de 2009 por la necesidad de trasfusiones a repetición, y la muestra del 18 de abril tomada para el hemocultivo se hizo como parte de un control microbiológico por un episodio previo de bacteriemia asociada a catéter, dado que para esa fecha no se referían síntomas ni signos que sugiriesen infección. Con la evolución clínica satisfactoria de la niña, el resultado fue interpretado como contaminación, por lo que no se realizaron cambios en el esquema antibiótico iniciado anteriormente para grampositivos y la paciente fue dada de alta en buenas condiciones el 30 de abril. Posterior al 6 de mayo se documentaron dos casos adicionales en muestras de sangre tomadas el 4 de mayo y el 18 de mayo, también en pacientes con diversas condiciones de inmunosupresión (tabla 1).
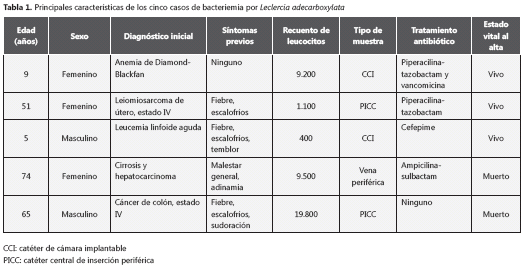
A partir de los dos casos adicionales identificados y evaluados, se interrogó de nuevo a la paciente del caso índice sobre su enfermedad actual. La paciente relacionaba claramente la aparición de los episodios de fiebre y escalofrío con la aplicación de los bolos de heparina indicados ambulatoriamente para mantener permeable el catéter central de inserción periférica.
En el periodo correspondiente al brote estaban circulando en la institución cinco lotes diferentes de viales de heparina premezclada de la marca A y un lote de la marca B. Todos los lotes se retiraron de los diferentes servicios del hospital y de la farmacia, y se enviaron diferentes muestras para cultivo al laboratorio de la institución y a un laboratorio independiente. Cada laboratorio recibió para los análisis diferentes viales, aunque correspondientes al mismo lote. Los resultados evidenciaron crecimiento de diversos microorganismos, entre ellos L. adecarboxylata, en algunas de las muestras recolectadas (tabla 2).
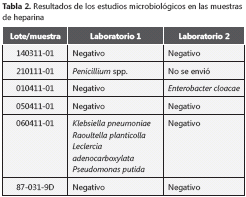
El procedimiento actual del hospital no permite el registro y el seguimiento individual de cada unidad de medicamento desde que ingresa a la farmacia hasta su disposición final, ya sea un paciente determinado, devolución a la farmacia o desecho, razón por la que es imposible determinar qué lote se aplicó a cada paciente. Lo que sí es claro es que todos los pacientes con acceso venoso, periférico o central, estuvieron en riesgo de estar expuestos a los viales contaminados. Además, no se almacenaron las cepas de L. adecarboxylata que se obtuvieron de las muestras de sangre de los pacientes, por lo que no es posible determinar la epidemiología molecular de dichas cepas ni su potencial concordancia con las cepas obtenidas de las muestras de heparina. Por lo anterior, y a pesar de no haber tenido nuevos episodios de bacteriemia por L. adecarboxylata después de 9 meses de retirar todos los lotes de heparina, no podemos estimar con exactitud y precisión una relación causal entre la heparina y los episodios infecciosos descritos.
Revisión de la literatura y discusión
Leclercia adecarboxylata es un bacilo pequeño que crece bien en los medios usados para la bacteriología de los bacilos entéricos. Lleva su nombre en honor a H. Leclerc, bacteriólogo francés, quien en 1962 reconoció una bacteria que describió como "bacteria coliforme pigmentada de amarillo" que era similar a E. coli en las reacciones IMViC pero difería por la producción de un pigmento amarillo y su capacidad de fermentar varios azúcares (7). Inicialmente, Leclerc propuso que se reconociera como una especie aparte dentro del género Escherichia como E. adecarboxylate. En varias ocasiones posteriores se intentó cambiar su clasificación hasta que, finalmente, en 1986 Tamura, et al., basados en el estudio de hibridación de ADN-ADN de su colecciones de bacterias y en las características fenotípicas, propusieron un nuevo género llamado Leclercia con una especie, adecarboxylata (8).La mayoría de las cepas son sensibles a colistina, ácido nalidíxico, sulfadiazina, gentamicina, estreptomicina, tetraciclina, cloranfenicol, carbenicillinas, cefalosporinas y ampicilina (por el método de difusión de disco en el medio de Mueller-Hinton) y resistentes a la penicilina.
El primer caso clínico reportado en el Index Medicus (Medline-PubMed) se documentó en España en 1993, en un hombre de 45 años con cirrosis alcohólica a quien se le practicó una paracentesis evacuante (9). Seis horas después presentó dolor abdominal intenso, hipotensión, taquicardia y diaforesis, por lo que fue llevado a laparotomía con diagnóstico de hemoperitoneo. Cuatro días después de la cirugía presentó fiebre hasta 38,6 °C y en tres hemocultivos de sangre periférica se identificó L. adecarboxylata. A pesar del tratamiento antibiótico instaurado, el paciente desarrolló insuficiencia renal aguda y falleció a los 6 días del episodio. En el 2000 se reportó el primer caso de peritonitis debida a este microorganismo en un niño de 5 años que estaba en diálisis peritoneal continua desde 9 meses antes del episodio (10). La enfermedad se describió como 24 horas de dolor abdominal progresivo, fiebre, diarrea acuosa y vómito. En el examen físico se encontró fiebre, taquicardia, taquipnea, distensión abdominal con dolor difuso, defensa voluntaria y ausencia de ruidos intestinales. El líquido peritoneal tenía 48.000 leucocitos/mm3 y menos de un eritrocito, la tinción de Gram no evidenció bacterias pero en el cultivo se encontró un bacilo gramegativo identificado posteriormente como L. adecarboxylata. El niño recibió tratamiento parenteral y a través del catéter de diálisis peritoneal continua con ceftazidima y gentamicina durante 10 días. Los cultivos posteriores fueron negativos, el catéter de la diálisis no se retiró y ante una evolución clínica satisfactoria se reinició la diálisis (10).
En el 2001, De Baere, et al., reportaron dos casos de infecciones por este germen: una paciente de 78 años con pancreatitis biliar y colecistitis crónica, en la cual se aisló la bacteria de la pieza quirúrgica, y una paciente de 80 años que en la cuarta semana de un postoperatorio de cuatro puentes de coronarias presentó una bacteriemia polimicrobiana con aislamiento de Enterococcus faecalis, Escherichia hermannii y L. adecarboxylata (11). En este mismo reporte se describió también, por primera vez, un análisis de filogenia de las cepas obtenidas de los aislamientos clínicos. Por medio de la determinación de la secuencia genética del ARN ribosómico 16S de ambas cepas de L. adecarboxylata se detectó una similitud del 98 % con Pantoea agglomerans, otro bacilo gramnegativo de la familia Enterobacteriaceae (11). En el 2009, Lee, et al, reportaron el primer caso, confirmado por ecocardiografía, dos hemocultivos y embolismos sépticos, de endocarditis por L. adecarboxylata en una mujer de 48 años con cáncer endometrial (6). Aunque el esquema óptimo de tratamiento y su duración no están definidos, los aislamientos de sangre mostraron sensibilidad a todos los antimicrobianos y la paciente fue tratada exitosamente con ampicilina-sulbactam más gentamicina durante 4 semanas sin necesidad de cirugía valvular.
Por otra parte, se han reportado varios brotes de bacteriemias asociados al uso de heparina, bien sea en soluciones preparadas con suero salino o en jeringas llenadas previamente (12-19). Prospero, et al., lograron identificar por medio de electroforesis en gel de campo pulsado (PFGE) la misma clona de Pseudomonas aeruginosa en cuatro pacientes con bacteriemia asociada a catéter y en una muestra tomada de la mezcla de solución salina y heparina empleada para permeabilizar los catéteres (18).También, por medio de PFGE, Yang, et al., confirmaron los mismos tipos moleculares de Burkholderia cepacia en nueve hemocultivos y en 10 muestras de la preparación diaria de solución de heparina diluida (16). Souza Dias reportó tres diferentes genotipos de Pseudomonas putida que coincidían en 32 aislamientos de bacteriemias asociadas a catéter y jeringas llenadas previamente con heparina (17). El brote más reciente y más impactante se presentó entre noviembre de 2007 y enero de 2008 en nueve estados de los Estados Unidos, con 162 casos reportados de bacteriemia por Serratia marcescens debidas al uso de heparina o suero salino de jeringas llenadas previamente por la misma compañía farmacéutica (12,14,15). Dicha compañía, en una inspección posterior realizada por la Food and Drug Administration (FDA), fue reconvenida por el incumplimiento en las normasde control de calidady de los controles necesarios para garantizar la esterilización adecuada de sus jeringas llenadas previamente (14). En todos los casos, al igual que en nuestro brote, parece claro que los pacientes inmunosuprimidos con catéteres vasculares centrales tienen un mayor riesgo de infección que los pacientes con catéteres periféricos, probablemente, debido a los mayores volúmenes de heparina requeridos en los bolos lo que aumenta el inóculo bacteriano.
Finalmente, y en consideración a los riesgos potenciales en la aplicación de cualquier sustancia a seres humanos, se resalta la importancia para una institución hospitalaria de establecer un procedimiento que permita hacerle seguimiento a cada medicamento desde que ingresa en la farmacia hasta su disposición final, con un código de barras, un mecanismo de identificación única o con cualquier sistema dirigido hacia la seguridad de los pacientes.
Correspondencia: Ana Lucía Correa, Comité de Prevención de Infecciones, Hospital Pablo Tobón Uribe, Calle 78B N° 69-240, Medellín, Colombia. Teléfono: 445-9000, extensión 9387 Correo electrónico: acorrea@hptu.org.co
Referencias
1. Pérez-Moreno MO, Anguera J, Carulla M, Pérez-Moreno M. Artritis séptica por Leclercia adecarboxylata de origen probablemente yatrogénico. Enferm Infecc Microbiol Clin. 2003;21:167-8. [ Links ]
2. Davenport P, Land KJ. Isolation of Leclercia adecarboxylata from the blood culture of an asymptomatic platelet donor. Transfusion. 2007;47:1816-9. [ Links ]
3. Dalamaga M, Pantelaki M, Karmaniolas K, Daskalopoulou K, Migdalis I. Isolation of Leclercia adecarboxylata from blood and burn wound after a hydrofluoric acid chemical injury. Burns. 2009;35:443- 5. [ Links ]
4. Sarma PM, Bhattacharya D, Krishnan S, Lal B. Degradation of polycyclic aromatic hydrocarbons by a newly discovered enteric bacterium, Leclercia adecarboxylata. Appl Environ Microbiol. 2004;70:3163-6. [ Links ]
5. Fernández-Ruiz M, López-Medrano F, García-Sánchez L, García- Reyne A, Ortuno de Solo T, Sanz-Sanz F, et al. Successful management of tunneled hemodialysis catheter-related bacteremia by Leclercia adecarboxylata without catheter removal: Report of two cases. Int J Infect Dis. 2009;13(6):e517-8. [ Links ]
6. Lee B, Sir JJ, Park SW, Kwak CH, Kim SM, Kim SB, et al. A case of Leclercia adecarboxylata endocarditis in a woman with endometrial cancer. Am J Med Sci. 2009;337:146-7. [ Links ]
7. Leclerc H. Biochemical study of pigmented Enterobacteriaceae. Ann Inst Pasteur (Paris). 1962;102:726-41. [ Links ]
8. Tamura K, Sakazaki R, Kosako Y, Yoshizaki E. Leclercia adecarboxylata Gen. Nov., Comb. Nov., formerly known as Escherichia adecarboxylata. Curr Microbiol. 1986;13:179-84. [ Links ]
9. Daza RM, Iborra J, Alonso N, Vera I, Portero F, Mendaza P. Aislamiento de Leclercia adecarboxylata en paciente cirrotico. Enferm Infecc Microbiol Clin. 1993;11:53-4. [ Links ]
10. Fattal O, Deville JG. Leclercia adecarboxylata peritonitis in a child receiving chronic peritoneal dialysis. Pediatr Nephrol. 2000;15:186- 7. [ Links ]
11. de Baere T, Wauters G, Huylenbroeck A, Claeys G, Peleman R, Verschraegen G, et al. Isolations of Leclercia adecarboxylata from a patient with a chronically inflamed gallbladder and from a patient with sepsis without focus. J Clin Microbiol. 2001;39:1674-5. [ Links ]
12. Chemaly RF, Rathod DB, Sikka MK, Hayden MK, Hutchins M, Horn T, et al. Serratia marcescens bacteremia because of contaminated prefilled heparin and saline syringes: A multi-state report. Am J Infect Control. 2011;39:521-4. [ Links ]
13. Liu D, Zhang LP, Huang SF, Wang Z, Chen P, Wang H, et al. Outbreak of Serratia marcescens infection due to contamination of multiple-dose vial of heparin-saline solution used to flush deep venous catheters or peripheral trocars. J Hosp Infect. 2011;77:175-6. [ Links ]
14. Blossom D, Noble-Wang J, Su J, Pur S, Chemaly R, Shams A, et al. Multistate outbreak of Serratia marcescens bloodstream infections caused by contamination of prefilled heparin and isotonic sodium chloride solution syringes. Arch Intern Med. 2009;169:1705-11. [ Links ]
15. Su JR, Blossom DB, Chung W, Gullion JS, Pascoe N, Heseltine G, et al. Epidemiologic investigation of a 2007 outbreak of Serratia marcescens bloodstream infection in Texas caused by contamination of syringes prefilled with heparin and saline. Infect Control Hosp Epidemiol. 2009;30:593-5. [ Links ]
16. Yang CJ, Chen TC, Liao LF, Ma L, Wang CS, Lu PL, et al. Nosocomial outbreak of two strains of Burkholderia cepacia caused by contaminated heparin. J Hosp Infect. 2008;69:398-400. [ Links ]
17. Souza Dias MB, Habert AB, Borrasca V, Stempliuk V, Ciolli A, Araujo MR, et al. Salvage of long-term central venous catheters during an outbreak of Pseudomonas putida and Stenotrophomonas maltophilia infections associated with contaminated heparin catheter-lock solution. Infect Control Hosp Epidemiol. 2008;29:125-30. [ Links ]
18. Prospero E, Barbadoro P, Savini S, Manso E, Annino I, D´Errico MM. Cluster of Pseudomonas aeruginosa catheter-related bloodstream infections traced to contaminated multidose heparinized saline solutions in a medical ward. Int J Hyg Environ Health. 2006;209:553-6. [ Links ]
19. Kimura AC, Calvet H, Higa JI, Pitt H, Frank C, Padilla G, et al. Outbreak of Ralstonia pickettii bacteremia in a neonatal intensive care unit. Pediatr Infect Dis J. 2005;24:1099-103. [ Links ]














