Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Infectio
versión impresa ISSN 0123-9392
Infect. v.16 n.2 Bogotá jun./dic. 2012
1Grupo Infettare. Facultad de Medicina. Universidad Cooperativa de Colombia, Medellín, Colombia
Recibido: 13/12/2011; Aceptado: 09/05/2012
Resumen
Desde que se conoció la infección por el virus de la inmunodeficiencia humana (VIH), se han diagnosticado más de 2,5 millones de niños infectados a nivel mundial. Con este conocimiento vino también la generación del tratamiento HAART (Highly Active Antiretroviral Therapy), que logró mejorar la calidad de vida y la expectativa de vida de los lactantes infectados. Sin embargo, los individuos que reciben tratamiento presentan condiciones particulares que los hacen constituir un grupo de individuos con necesidades de atención y cuidado diferentes. En esta revisión se abordan los aspectos clínicos más relevantes que aquejan a los niños infectados por VIH que reciben tratamiento antirretroviral altamente activo.
Palabras claves: infantes, VIH, HAART.
Abstract
Since the human immunodeficiency virus (HIV) was known, more than 2.5 million infected children around the world have been diagnosed. With this knowledge also came the advent of the Highly Active Antiretroviral Therapy (HAART) which has achieved a better quality of life and greater life expectancy of unweaned infected babies. However, people receiving this therapy present particular conditions that make them a population with different attention and care needs. This review addresses the most relevant clinical aspects present in HIV infected children receiving HAART.
Key words: child, HIV, HAART
Introducción
El VIH-1 y el VIH-2, como agentes causales de la inmunodeficiencia humana, han sido responsables de la infección de más de 2,5 millones de niños desde su aparición (1) y de la infección de, aproximadamente, 370.000 menores de 15 años en el 2009 (1).
En los últimos años, la incidencia de esta infección en lactantes ha tenido un gran descenso en los países desarrollados gracias a la implementación de estrategias que permiten el diagnóstico temprano de la infección en mujeres embarazadas y, por consiguiente, el tratamiento antirretroviral para la prevención de la transmisión vertical (2). En cambio, a pesar del establecimiento de estrategias similares, en la mayoría de países en desarrollo otras condiciones, como la falta de recursos, la poca disponibilidad de los medicamentos y de las pruebas diagnósticas en los servicios de salud, principalmente en áreas rurales, han impedido que la tasa de transmisión vertical haya tenido el mismo impacto (2). Esto se ve reflejado en regiones como Asia central con 3.400 niños infectados en 2009, el este asiático con 1.900 niños, y Centroamérica y Suramérica con cerca de 4.300 niños infectados en ese mismo año, sin contar en Colombia con este dato (1).
A finales de 2004, se estimaba que en Colombia había entre 4.000 y 8.000 niños infectados (3), y un reporte no oficial en el año 2009 indicaba que se habían registrado 2.074 niños y adolescentes con la infección; incluso, allí se señala que hay un gran subregistro y que, posiblemente, el número real sea mayor (4). Es precisamente esta población de lactantes infectados la que se constituye en un grupo particular de atención, haciéndose necesario e indispensable tener un conocimiento amplio sobre los aspectos inmunológicos, clínicos, metabólicos y neurológicos relacionados con el tratamiento antirretroviral, debido a que esta población aún sigue en crecimiento en nuestro departamento y en el país.
Los diversos medicamentos contra el VIH se han clasificado, según la molécula sobre la que actúan, en inhibidores de proteasas, inhibidores de la transcriptasa inversa, inhibidores de la integrasa e inhibidores de la fusión o de la entrada (tabla 1). El tratamiento antirretroviral de gran actividad (Highly Active Antiretroviral Therapy, HAART) consiste en el uso de tres fármacos, como mínimo, que pertenecen a los diferentes grupos mencionados anteriormente, y que consta, generalmente, de dos inhibidores de la transcriptasa: uno nucleósido y otro no nucleósido. Al ser un tratamiento contra varios blancos, el impacto sobre la replicación viral es bastante efectivo y logra disminuir la cantidad de ácido ribonucleico (ARN) viral plasmático hasta niveles indetectables. Por consiguiente, la baja cantidad de progenie viral repercute en un mínimo daño celular y permite que los individuos infectados puedan restablecer sus niveles de linfocitos T CD4+ y otras poblaciones celulares también afectadas.
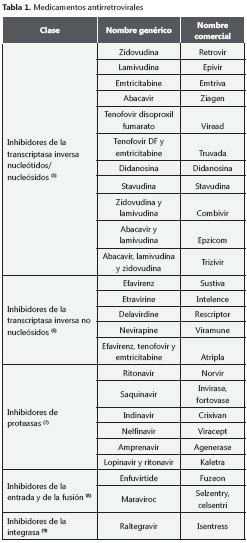
La Organización Mundial de la Salud (OMS) recomienda que todos los niños menores de dos años, reciban tratamiento antirretroviral (1). El protocolo recomendado para los países en desarrollo consiste en dosis fijas de estaduvina, lamiduvina y nevirapina (2). Para la implementación de este esquema, se debe tener en cuenta que, si la madre recibió nevirapina durante el embarazo, hay mayores probabilidades de que el virus transmitido al niño ya haya creado resistencia a este medicamento y, por lo tanto, no se recomienda este fármaco a esos lactantes. Además, se ha retirado el uso de la estaduvina por sus efectos tóxicos.
El establecimiento del tratamiento antirretroviral ha permitido que los individuos infectados mejoren notablemente su calidad de vida. Por ejemplo, las manifestaciones clínicas típicas observadas en los individuos infectados, especialmente las enfermedades asociadas a un bajo recuento de linfocitos T CD4+, se presentan con menor frecuencia en los individuos que reciben tratamiento (10). No obstante, las personas infectadas que están bajo tratamiento presentan nuevos síndromes asociados con su uso.
Esta revisión se enfoca en revisar varios aspectos relacionados con la terapia HAART en niños infectados. Para su elaboración se hizo una búsqueda en las bases de datos Pubmed, Medline, Ovid, utilizando los siguientes términos: HIV infection, children, HAART, metabolic disorders, endocrinologic disorders, lypodistrophy, immunization y adverse effects. Se combinaron los términos y se restringió la bibliografía a artículos originales y a algunas revisiones.
Alteraciones metabólicas y endocrinas
En varios estudios se ha demostrado que el tratamiento antirretroviral se asocia con la aparición de efectos secundarios metabólicos, tales como dislipidemias (11-13), resistencia a la insulina (14) y diabetes mellitus (15), los cuales son factores de riesgo para la enfermedad cardiovascular (16).
Las dislipidemias están estrechamente ligadas al síndrome de redistribución de grasas, conocido como lipodistrofia, el cual se asocia a la raza, al estado clínico grave previo al tratamiento, a la duración de la infección por VIH y al tratamiento con inhibidores de nucleósidos de la transcriptasa inversa (17) o con inhibidores de proteasas, como el ritonavir y el nelfinavir (18). La lipodistrofia se caracteriza por lipoatrofia periférica, redistribución de la grasa visceral y anormalidades en el metabolismo de las grasas y de la glucosa en los individuos infectados bajo tratamiento. Los mecanismos fisiopatológicos que explican los cambios metabólicos son complejos y difíciles de elucidar, debido a la dificultad de separar los efectos de la infección per se de los efectos de la terapia HAART, además de las enfermedades concomitantes y la vulnerabilidad individual.
En la mayoría de niños infectados por VIH se han encontrado bajas concentraciones de lipoproteínas de alta densidad (HDL) y en la minoría de ellos se han observado altos niveles de colesterol total, de triglicéridos y de lipoproteínas de baja densidad (LDL), asociados al uso de inhibidores de proteasas (11,13). Los niños menores de diez años presentan las concentraciones más altas de colesterol total y lipoproteínas LDL, comparadas con las de niños mayores (11). También, se han observado bajos niveles de adiponectina y aumento de la liberación de ácidos grasos libres por el tejido adiposo resistente a la insulina en los niños (19), lo cual estaría relacionado con la presencia de grasa abdominal, la lipohipertrofia y la resistencia a la insulina (20).
La resistencia a la insulina fue una de las primeras complicaciones metabólicas reportadas con el uso de la terapia HAART. Los niños positivos para VIH tratados con inhibidores de nucleósidos de la transcriptasa inversa son quienes presentan una mayor prevalencia de resistencia a la insulina, al ser comparados con adolescentes infectados bajo el mismo tratamiento (11); esto, sumado a la presencia de otros factores de riesgo, tales como familiares con diabetes, un índice de masa corporal incrementado y la edad, puede conllevar a la aparición de diabetes mellitus (15,17). Se han postulado varios mecanismos de acción de los antirretrovirales para incrementar la resistencia a la insulina: directamente, al causar disfunción mitocondrial en el músculo y con ello alterar la respuesta a la insulina (21), o indirectamente, como una consecuencia de defectos en el metabolismo de los lípidos derivados de la toxicidad antirretroviral, como la resistencia a la insulina observada en los pacientes con lipodistrofia asociada al VIH (14).
Alergias
Hay una mayor incidencia de enfermedades alérgicas en niños positivos para VIH tratados con la terapia HAART que en aquellos sin tratamiento. En estudios recientes se demuestra que los niños en tratamiento antirretroviral presentan más asma y dermatitis atópica, igualando la incidencia y prevalencia de estas enfermedades en niños sin VIH, lo que se debe a la reconstitución inmunológica lograda después del tratamiento antirretroviral (22,23).
Complicaciones neurológicas y psiquiátricas
La complejidad de los sistemas neurológico y psicológico ha hecho difícil determinar los efectos de la infección e, incluso, del tratamiento antirretroviral en ellos. A pesar de ello, en varios estudios de adultos infectados se demuestra que en el curso de la infección se observan cambios cognitivos moderados, como déficit en la atención, en la memoria, en el procesamiento de la información y en la función motora fina (24), pero, aunque algunas de estas manifestaciones desaparecen con el tratamiento, también se pueden presentar otras complicaciones a causa de la terapia HAART, tales como alteraciones psiquiátricas y del humor, alteraciones neuromusculares y deterioro neurológico (25). Como prueba de ello, el grupo de Neuenburg analizó 436 cerebros post mórtem y concluyó que, desde el uso de la terapia HAART, la incidencia de la encefalopatía por VIH se incrementó significativamente (26), lo que puede sugerir que el tratamiento podría estar generando un daño cerebral o que no evita el daño causado por el virus per se.
Los niños infectados por VIH presentan graves alteraciones del sistema nervioso central y, a menudo, son progresivas y se reflejan en déficit cognitivo, del lenguaje, motor y del comportamiento. Entre ellas se encuentran la encefalopatía observada en menores de un año (27), el trastorno hipercinético, el trastorno de tics transitorios y el retraso mental ligero en niños mayores (28), las alteraciones emocionales relacionadas con el conocimiento del diagnóstico, y la depresión y tristeza en adolescentes (28).
Varios grupos estadounidenses quisieron evaluar el impacto de los inhibidores de proteasas en las deficiencias neuropsicológicas que presentaban los lactantes infectados antes del tratamiento, mediante un seguimiento por 48 semanas después de establecido el tratamiento. Los investigadores encontraron que, en los niños que presentaban un diagnóstico neurológico anormal antes del tratamiento, era más probable que desarrollaran nuevos síntomas neurológicos en las siguientes semanas de tratamiento (27). Además, llegaron a la conclusión de que, aunque el tratamiento tenía un impacto notorio en la carga viral, su efecto en el funcionamiento neuropsicológico fue mínimo.
Algunas de las manifestaciones más comunes de deterioro neurológico asociado al tratamiento antirretroviral en adultos, son el delirio (24), la manía (29) y la polineuropatía simétrica distal (30). El uso de análogos de nucleósidos, como la estavudina, la didanosina y el zalcitabine, puede ser predictor de la presencia de neuropatía periférica sensorial (31,32). Algunos efectos en el sistema nervioso central de la zidovudina son insomnio, mialgia e intensos dolores de cabeza (33).
Los inhibidores no nucleósidos de la transcriptasa inversa han demostrado mejorar la función del sistema nervioso central en individuos que presentan anormalidades en la función motora (34). A pesar de ello, el efavirenz es el único medicamento que presenta efectos adversos en el sistema nervioso central, como la depresión profunda y la ideación suicida (35, 36); también, se ha asociado con insomnio, alteraciones del sueño (37), irritabilidad y nerviosismo (38). Además, se ha observado que los individuos con alteraciones neuropsiquiátricas de base pueden tener un mayor riesgo de sufrir alteraciones debidas al uso del efavirenz (25,39).
Teniendo en cuenta que los inhibidores de proteasas tienen muy poca capacidad de traspasar la barrera hematoencefálica y penetrar en el cerebro, son medicamentos que no se asocian a efectos neurológicos. Sin embargo, en sus estudios, Bonfanti (40) y Gatti (41) reportaron que los altos niveles en plasma de ritonavir o de la combinación ritonavir-saquinavir se correlacionan con aumento de la incidencia de efectos colaterales neurológicos, lo que sugiere que estos medicamentos sí pueden estar ejerciendo algún efecto sobre el sistema nervioso. Dado que estos medicamentos se usan en combinación con los inhibidores de la transcriptasa inversa y a que no son una primera línea de tratamiento, se ha hecho difícil determinar los efectos reales de los inhibidores de proteasas.
Los datos anteriores demuestran que los medicamentos usados en la terapia HAART presentan un potencial daño a nivel neuropsicológico; infortunadamente, no hay estudios que analicen los efectos adversos de la terapia HAART en el sistema nervioso de los niños infectados que reciben este tratamiento.
Acidosis láctica e hiperlactatemia
La acidosis láctica es definida como niveles de lactato sérico altos, pH menor de 7,34, bicarbonato sérico y CO2 en cantidades bajas, mientras que la hiperlactatemia sintomática corresponde a lactato sérico alto y niveles de CO2, pH y bicarbonato séricos normales, además de la presencia de los correspondientes signos y síntomas, que incluyen anorexia, pérdida de peso, neuropatía periférica, disnea, cansancio y síntomas gastrointestinales inespecíficos, como naúseas, vómito, dolor y distensión abdominal. Estas dos alteraciones han sido ampliamente descritas en adultos que reciben tratamiento antirretroviral, con tasas de incidencia que varían entre 2,2 % (42) y 10 % (43) y tasas de mortalidad hasta de 30,4 % por acidosis láctica (43), mientras que, en el único estudio en niños, de un total de 80, se hallaron 23 con hiperlactatemia asintomática, los cuales recibían inhibidores de nucleósidos de la transcriptasa inversa; además, encontraron la edad como un factor de riesgo para la presentación de hiperlactatemia (44). Alimenti y su grupo (45) estudiaron el potencial tóxico del tratamiento en recién nacidos no infectados expuestos al tratamiento antirretroviral perinatalmente, y encontraron acidemia láctica transitoria en la mayoría de ellos, cuando se suministraba zidovudina.
Infecciones
Si bien la presencia de enfermedades infecciosas ha disminuido en los niños infectados por VIH gracias al establecimiento del tratamiento antirretroviral, en algunos estudios se ha demostrado que, aun bajo estas circunstancias, ellos siguen siendo una población vulnerable.
Aunque esta situación no representa un efecto adverso del tratamiento antirretroviral, es un aspecto importante que vale la pena analizar en los pacientes infectados. Mediante el análisis de una gran cohorte de niños positivos para VIH provenientes de varios países de América Latina, se encontró que presentaban varios procesos infecciosos, como neumonía bacteriana, varicela, infecciones por dermatofitos, herpes simplex y herpes zóster oral; en ese mismo estudio, se comparó esta cohorte con una de los Estados Unidos, y se observó que los niños presentaban las mismas infecciones pero que las incidencias eran mayores en el primer grupo (46, 47).
Resultados similares se obtuvieron en un estudio en Brasil, donde las infecciones por bacterias, la neumonía por Pneumocystis jirovecii, la sepsis y la meningitis bacteriana, fueron las enfermedades por microorganismos oportunistas más comunes entre 1.859 niños en tratamiento antirretroviral (48). Estos resultados demuestran que, a pesar del tratamiento, en estos niños pueden presentarse varias enfermedades infecciosas que dependerán de la región geográfica en la que estén ubicados, cuyas condiciones de vida precarias repercutirán inevitablemente en la población infantil infectada por VIH.
Discusión
La terapia HAART ha permitido un apropiado manejo de la infección por VIH con un impacto importante en la supervivencia a largo plazo y en la calidad de vida de los niños infectados. Sin embargo, deben considerarse varias limitaciones de este tratamiento con el fin de evitar o atenuar la aparición de los efectos adversos. Varios de los efectos aquí descritos deben tenerse en cuenta y ser controlados eficientemente por el personal de la salud que atiende esta población, con el fin de garantizar una buena atención y calidad de vida de ellos. Es por ello que las Empresas Prestadoras de Salud (EPS) deberían fortalecer el manejo clínico de los niños infectados, e incluir el manejo de las complicaciones derivadas del tratamiento con cambios en el estilo de vida, acompañamiento psicológico y modificación del tratamiento.
Correspondencia: Xiomara Usuga Perilla, Calle 48 #28-00. Facultad de Medicina, Medellín, Colombia. Teléfono: (574) 215-9000, extensión 527 Correo electrónico: xiomara.usuga@campusucc.edu.co
Referencias
1. UNAIDS. UNAIDS Report on the global AIDS epidemic. 2010. Fecha de consulta: 1° de noviembre de 2011. Disponible en: http://www. unaids.org/globalreport/Epi_slides.htm. [ Links ]
2. Lallemant M, Chang S, Cohen R, Pecoul B. Pediatric HIV - A neglected disease? N Engl J Med. 2011;365:381-3. [ Links ]
3. Programa de las Naciones Unidas para el desarrollo - Colombia. Combatir el VIH/SIDA, la malaria y el dengue. Fecha de consulta: 3 de noviembre de 2011. Disponible en: http://www.pnud.org.co/img_up load/33323133323161646164616461646164/Combatir%20el%20 VIH%20SIDA,%20la%20Malaria%20y%20el%20Dengue.pdf. [ Links ]
4. Caracol Radio. Nota periodística: Colombia tiene más de 2 mil niños con VIH Sida. Fecha de consulta: 1° de noviembre de 2011. Disponible en: www.caracol.com.co/nota.aspx?id=834310. [ Links ]
5. Vivet-Boudou V, Didierjean J, Isel C, Marquet R. Nucleoside and nucleotide inhibitors of HIV-1 replication. Cell Mol Life Sci. 2006;63:163- 86. [ Links ]
6. Blas-García A, Esplugues JV, Apostolova N. Twenty years of HIV-1 non-nucleoside reverse transcriptase inhibitors: Time to reevaluate their toxicity. Curr Med Chem. 2011;18:2186-95. [ Links ]
7. Pérez-Valero I, Arribas JR. Protease inhibitor monotherapy. Curr Opin Infect Dis. 2011;24:7-11. [ Links ]
8. Kuritzkes DR. HIV-1 entry inhibitors: An overview. Curr Opin HIV AIDS. 2009;4:82-7. [ Links ]
9. Powderly WG. Integrase inhibitors in the treatment of HIV-1 infection. J Antimicrob Chemother. 2010;65:2485-8. [ Links ]
10. Gautam H, Bhalla P, Saini S, Dewan R. Correlation between baseline CD4 + T-lymphocyte count and plasma viral load in AIDS patients and their early clinical and immunological response to HAART: A preliminary study. Indian J Med Microbiol. 2008;26:256-8. [ Links ]
11. Cardoso L, de Carvalho PH, de Sousa HH, de Andrade SB. Dyslipidaemia and insulin resistance in vertically HIV-infected children and adolescents. Trans R Soc Trop Med Hyg. 2011;105:197-203. [ Links ]
12. Sprinz E, Kuhmmer R, Kuhmmer R, Pinto J. Dyslipidemia in HIV-infected individuals. Braz J Infect Dis. 2010;14:575-88. [ Links ]
13. López P, Caicedo Y, Rubiano LC, Cortés CA, Valencia A, Ramírez O, et al. Alteraciones metabólicas con terapia antirretroviral altamente efectiva en niños positivos para VIH, Cali, Colombia. Infectio. 2009;13:283-92. [ Links ]
14. Feeney ER, Mallo PWG. Insulin resistance in treated HIV infection. Best Pract Res Clin Endocrinol Metab. 2011;25:443-58. [ Links ]
15. Brown TT, Li X, Cole SR, Kingsley LA, Palella FJ, Riddler SA, et al. Cumulative exposure to nucleoside analogue reverse transcriptase inhibitors is associated with insulin resistance markers in the multicenter AIDS cohort study. AIDS. 2005;19:1375-83. [ Links ]
16. Guzmán-Fulgencio M, Micheloud D, Lorente R, Bellón JM, Gómez MI, Gurbindo MD, et al. Cardiovascular risk markers are increased in HIV-infected children with lipodystrophy syndrome. J Infect. 2011;62:240- 3. [ Links ]
17. Beregszaszi M, Dollfus C, Levine M, Faye A, Deghmoun S, Bellal N, et al. Longitudinal evaluation and risk factors of lipodystrophy and associated metabolic changes in HIV-infected children. J Acquir Immune Defic Syndr. 2005;40:161-8. [ Links ]
18. Fiore P, Donelli E, Boni S, Pontali E, Tramalloni R, Bassetti D. Nutritional status changes in HIV-infected children receiving combined antiretroviral therapy including protease inhibitors. Int J Antimicrob Agents. 2000;16:365-9. [ Links ]
19. Viganò A, Zuccotti GV, Cerini C, Stucchi S, Puzzovio M, Giacomet V, et al. Lipodystrophy insulin resistance, and adiponectin concentration in hiv-infected children and adolescents. Curr HIV Res. 2011;9:321-6. [ Links ]
20. Lagathu C, Kim M, Maachi M, Vigouroux C, Cervera P, Capeau J, et al. HIV antiretroviral treatment alters adipokine expression and insulin sensitivity of adipose tissue in vitro and in vivo. Biochimie. 2005;87:65-71. [ Links ]
21. Gerschenson M, Brinkman K. Mitochondrial dysfunction in AIDS and its treatment. Mitochondrion. 2004;4:763-77. [ Links ]
22. Foster SB, McIntosh K, Thompson B, Lu M, Yin W, Rich KC, et al. Increased incidence of asthma in HIV-infected children treated with highly active antiretroviral therapy in the National Institutes of Health Women and Infants Transmission Study. J Allergy Clin Immunol. 2008;122:159-65. [ Links ]
23. Siberry GK, Leister E, Jacobson DL, Foster SB, Seage III GR, Lipshultz ST, et al. Increased risk of asthma and atopic dermatitis in perinatally HIV-infected children and adolescents. Clin Immunol. 2012;142:201- 8. [ Links ]
24. Fernández F. Neuropsychiatric aspects of human immunodeficiency virus (HIV) infection. Curr Psychiatry Rep. 2002;4:228-31. [ Links ]
25. Raines C, Radcliffe O, Treisman GJ. Neurologic and psychiatric complications of antiretroviral agents. J Assoc Nurses AIDS Care. 2005;16:35-48. [ Links ]
26. Neuenburg JK, Brodt HR, Herndier BG, Bickel M, Bacchetti P, Price RW, et al. HIV-related neuropathology, 1985 to 1999: Rising prevalence of HIV encephalopathy in the era of highly active antiretroviral therapy. J Acquir Immune Defic Syndr. 2002;31:171-7. [ Links ]
27. Jeremy RJ, Kim S, Nozyce M, Nachman S, McIntosh K, Pelton SI, et al. Neuropsychological functioning and viral load in stable antiretroviral therapy-experienced HIV-infected children. Pediatrics. 2005;115:380- 7. [ Links ]
28. Castro P, Martínez MY, González I, Velásquez J, Castillo G, Sánchez L. Evaluación neuropsicológica, factores psicosociales y co-morbilidad psiquiátrica en pacientes pediátricos infectados con el VIH. Rev Chil Infect. 2011;28:248-54. [ Links ]
29. Kieburtz K, Zettelmaier AE, Ketonen L, Tuite M, Caine ED. Manic syndrome in AIDS. Am J Psychiatry. 1991;148:1068-70. [ Links ]
30. Williams D, Geraci A, Simpson DM. AIDS and AIDS-treatment neuropathies. Curr Pain Headache Rep. 2002;6:125-30. [ Links ]
31. López OL, Becker JT, Dew MA, Caldararo R. Risk modifiers for peripheral sensory neuropathy in HIV infection/AIDS. Eur J Neurol. 2004;11:97-102. [ Links ]
32. Dragovic G, Jevtovic D. Nucleoside reverse transcriptase inhibitor usage and the incidence of peripheral neuropathy in HIV/AIDS patients. Antivir Chem Chemother. 2003;14:281-4. [ Links ]
33. Richman DD, Fischl MA, Grieco MH, Gottlieb MS, Volderbing PA, Laskin OL, et al. The toxicity of azidothymidine (AZT) in the treatment of patients with AIDS and AIDS-related complex. A double-blind placebo-controlled trial. N Engl J Med. 1987;317:192-7. [ Links ]
34. Arendt G, von Giesen HJ. Antiretroviral therapy regimens for neuro- AIDS. Curr Drugs Targets-Infect Disorders. 2002;2:187-92. [ Links ]
35. Hawkins T, Geist C, Young B, Giblin A, Mercier RC, Thornton K, et al. Comparison of neuropsychiatric side effects in an observational cohort of Efavirenz and protease inhibitor-treated patients. HIV Clin. Trials. 2005;6:187-96. [ Links ]
36. Puzantian T. Central nervous system adverse effects with efavirenz: Case report and review. Pharmacotherapy.2002;22:930-3. [ Links ]
37. Gallego L, Barreiro P, del Rio R, González D, Rodríguez A, et al. Analyzing sleep abnormalities in HIV-infected patients treated with efavirenz. Clin Inf Dis. 2004;38:430-2. [ Links ]
38. Fumaz CR, Tuldrá A, Ferrer MJ, Paredes R, Bonjoch A, Jou T, et al. Quality of life, emotional status and adherence of HIV-1-infected patients treated with efavirenz versus protease inhibitor-containing regimens. JAIDS. 2002;29:244-53. [ Links ]
39. Guest JL, DeSilva KE, Flaherty TD, Le Flore DB, Rimland D. Incidence of CNS effects in patients with a history of mental health disorders and/ or substance abuse starting an efavirenz-containing regimen: Data from HA-VACS. Abstracts, XIV International AIDS Conference, 2002. Abstract N° TuPeB4502. [ Links ]
40. Bonfanti P, Valsecchi L, Parazzini F, Carradori S, Pusterla L, Fortuna P, et al. Incidence of adverse reactions in HIV patients treated with protease inhibitors: A cohort study. Coordinamento Italiano Studio Allergia e Infezione da HIV (CISAI) Group. JAIDS. 2000;23:236-45. [ Links ]
41. Gatti G, Di Biagio A, Casazza R, De Pascalis C, Bassetti M, Cruciani M, et al. The relationship between ritonavir plasma levels and side-effects: Implications for therapeutic drug monitoring. AIDS. 1999;13:2083-9. [ Links ]
42. Boulassel MR, Morales R, Murphy T, Lalonde RG, Klein MB. Gender and long-term metabolic toxicities from antiretroviral therapy in HIV- 1-infected persons. J Med Virol. 2006;78:1158-63. [ Links ]
43. Bolhaar MG, Karstaedt AS. A high incidence of lactic acidosis and symptomatic hyperlactatemia in women receiving highly active antiretroviral therapy in Soweto, South Africa. CID. 2007;45:255-60. [ Links ]
44. Noguera A, Fortuny C, Sánchez E, Artuch R, Vilaseca MA, Muñoz- Almagro C, et al. Hyperlactatemia in human immunodeficiency virus-infected children receiving antiretroviral treatment. Pediatr Infect Dis J. 2003;22:778-82. [ Links ]
45. Alimenti A, Burdge DR, Ogilvie GS, Money DM, Forbes JC. Lactic acidemia in human immunodeficiency virus-uninfected infants exposed to perinatal antiretroviral therapy. Pediatr Infect Dis J. 2003;22:782-9. [ Links ]
46. Alarcon J, Freimanis-Hance L, Krauss M, Reyes M, Cardoso C, Mussi- Pinhata M, et al. Opportunistic and other infections in HIV-infected children in Latin America compared to a similar cohort in the United States. AIDS Res Hum Retroviruses. 2012;28:282-8. [ Links ]
47. Gona P, van Dyke RB, Williams PL, Dankner WM, Chernoff MC, Nachman SA, et al. Incidence of opportunistic and other infections in HIV-infected children in the HAART era. JAMA. 2006;296:292-300. [ Links ]
48. Ramos AN Jr, Matida LH, Hearst N, Heukelbach J. Opportunistic illnesses in Brazilian children with AIDS: Results from two national cohort studies, 1983-2007. AIDS Res Ther. 2011;18;8:23. [ Links ]














