Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Infectio
Print version ISSN 0123-9392
Infect. vol.16 no.4 Bogotá Oct./Dec. 2012
REVISIÓN
Grupo de Investigación en Bacterias Anaerobias y Aerobias de Importancia Clínica, Escuela de Microbiología,
Universidad de Antioquia, Medellín, Colombia
Recibido el 21 de abril de 2012; aceptado el 19 de septiembre de 2012
Resumen
Clostridium difficile es un bacilo gram positivo, anaerobio estricto, capaz de formar esporas que le permiten su supervivencia en aguas, suelos y en ambientes hospitalarios, donde puede permanecer hasta años. Inicialmente, fue descrito en 1935 como un agente normal de la microbiota intestinal de recién nacidos sanos.
El presente escrito pretende revisar las generalidades del microorganismo y de la enfermedad asociada a C. difficile , enfatizando la prevalencia de ambos en nuestro medio, la problemática, el vacío del conocimiento que se presenta y los métodos de laboratorio que permiten su diagnóstico y estudio.
PALABRAS CLAVE Clostridium difficile; Enfermedad asociada a Clostridium difficile; Diarrea asociada a Clostridium difficile; Colitis seudomembranosa; Diarrea asociada al cuidado de la salud
2012 ACIN. Publicado por Elsevier España, S.L. Todos los derechos reservados.
Clostridium difficile associated disease: Prevalence and diagnostic laboratory
AbstractClostridium difficile is a gram-positive, strictly anaerobic, bacillus capable of forming spores that enable it to survive in waters, soils, and in hospital environments, where it can remain for years. It was initially described in 1935 as a normal microorganism of the intestinal microbiota of healthy newborns.
This article reviews the general features of the microorganism and the disease associated with C. difficile , emphasising the prevalence of both in our environment, the problems, the lack of knowledge on it, and the laboratory methods that help in its diagnosis and study.
KEYWORDS: Clostridium difficile; Clostridium difficile associated disease; Clostridium difficile associated diarrhea; Pseudomembranous colitis; Diarrhea associated with health care
© 2012 ACIN. Published by Elsevier España, S.L. All rights reserved
Introducción
Clostridium difficile (C. difficile) es un bacilo grampositivo, anaerobio estricto, capaz de formar esporas que le permiten su supervivencia en aguas, suelos y en ambientes hospitalarios, donde puede permanecer hasta años. Inicialmente, fue descrito en 1935 como un agente normal de la microbiota intestinal de recién nacidos sanos.
Su transmisión por vía fecal-oral convierte al personal de la salud, objetos médicos y superficies infectadas en una importante fuente de infección intrahospitalaria 1,2, llegando a considerarse, actualmente, el principal agente causal de diarrea nosocomial asociada al tratamiento con antibióticos, donde además de la diarrea, puede causar colitis seudomembranosa (CSM), enfermedad atribuida, en la mayoría de los casos, a C. difficile , e incluso complicaciones como la colitis fulminante, todas ellas englobadas en el termino de enfermedades asociadas a C. difficile (EACD).
Con la aparición en 2002 del brote causado por la cepa hipervirulenta BI/NAP1/027/toxinotipo III, las cifras de morbimortalidad en el ámbito mundial aumentaron, viéndose afectados, principalmente, los países de Norteamérica y Europa. Al reconocer a C. difficile como un patógeno importante para la salud, con alto potencial epidémico, se han desarrollado herramientas diagnósticas y de estudio que han permitido conocer a fondo la fisiopatología de la enfermedad, factores de riesgo asociados, prevalencias, resistencia bacteriana y medidas adecuadas de promoción y prevención.
La implementación de métodos de tipificación molecular, como la electroforesis de campo pulsado en gel (PFGE: Pulsed field gel electrophoresis ), el análisis con endonucleasas de restricción (REA: Restriction Endonuclease Analysis ), la toxinotipificación, el análisis de repeticiones en tándem de número variable en locus múltiples (MLVA: Multiple - locus variable - number ) , la ribotipificación y el análisis de secuencias de locus múltiples (MLST: Multilocus sequence typing ) han permitido el estudio a fondo de esas características de C. difficile , enfocados principalmente al estudio de brotes.
El presente escrito pretende revisar las generalidades del microorganismo y de la EACD, enfatizando la prevalencia de ambos en nuestro medio, la problemática, el vacío del conocimiento que se presenta y los métodos de laboratorio que permiten su diagnóstico y estudio.
Reseña histórica
Los primeros reportes de C. difficile como causante de enfermedad se dieron en 1893, cuando Finney describió el caso de una mujer joven con diarrea hemorrágica y seudomembranas a nivel del colon 3 . Sin embargo, la bacteria fue aislada por primera vez en 1935 por Hall y O´toole como microbiota normal del tracto gastrointestinal (TGI) de neonatos, denominándola en ese momento Bacillus difficilis por su dificultad para crecer en medio in vitro 4.
Bartlett et al. (1978) determinaron que C. difficile era el principal agente causal de CSM en pacientes en tratamiento con antibióticos 5; en este estudio, encontraron que estos pacientes presentaban altos niveles de citotoxicidad en las muestras de materia fecal, atribuyéndolo en un principio a un agente viral, Mycoplasma , o a la toxina de algún otro tipo de bacteria, sin poderlos aislar en el laboratorio. Utilizando un pool de antisueros para varios clostridios, se logró en los pacientes en estudio la neutralización de la actividad citotóxica con suero anti- C. sordelli , logrando aislar con posterioridad a C. difficile de la materia fecal de esos pacientes, y gracias a esto, hoy en día, se puede asociar con el 90 a 100% de los casos de CSM, donde la población más susceptible son los ancianos mayores de 65 años 6-10.
Patogénesis
Como mecanismo de infección, la forma esporulada de C. difficile , la cual es resistente a la desecación, químicos y temperaturas extremas, ingresa por vía oral, atraviesa el sistema digestivo y se establece en el colon, donde encuentra el ambiente propicio para adoptar su forma vegetativa. La bacteria se adhiere a la capa mucosa del enterocito y la atraviesa con ayuda del flagelo, adhesinas y proteasas que produce 11.
En condiciones normales, el TGI del humano posee una microbiota indígena característica que le proporciona el equilibrio necesario para poder inhibir el crecimiento de ciertos patógenos para él, lo que se ha llamado "resistencia a la colonización" 12. Sin embargo, ciertas condiciones (ver factores de riesgo asociados al desarrollo de EACD), como el tratamiento con antibióticos de amplio espectro, pueden ocasionar en el individuo una alteración de esta microbiota permitiendo que C. difficile aproveche este desequilibrio para replicarse en grandes cantidades y causar daño a través de la producción de sus toxinas.
Toxinas
Fue a finales de los años setenta cuando varios autores empezaron a describir la presencia de una toxina en un hámster infectado por la bacteria con un efecto diferente, enterotóxica, a la citotoxina antes mencionada por otros autores 13,14, y a principios de los ochenta fueron aisladas de materia fecal de humanos enfermos por C. difficile las 2 clases de toxinas 15,16. Hoy en día, se conoce que la bacteria, a nivel del colon, produce una toxina A o enterotoxina y toxina B o citotoxina, ambas tienen efecto citotóxico, causando permeabilidad vascular y hemorragias, pero además, la enterotoxina induce la acumulación de líquidos y células inflamatorias a través de la activación de la respuesta inflamatoria, mientras que la citotoxina causa destrucción del citoesqueleto del enterocito, siendo más potente que la primera 16-18.
Las cepas de C. difficile que no producen toxinas no son patógenas 18; pero las que tienen los genes tcdA y tcdB , que codifican la expresión de la toxina A y B, respectivamente, sí lo son. Estos genes se encuentran ubicados en una región del cromosoma llamada locus de patogenicidad (PaLoc) , el cual contiene también 3 genes accesorios: tcdR, tcdE y tcdC . tcdR ha demostrado tener la capacidad de modular positivamente la expresión de los genes de las toxinas, mientras que tcdC modula negativamente tal expresión, al interferir con la capacidad de la ARN polimerasa de reconocer los promotores de tcdA y tcdB . Esto se ha sugerido al encontrar que tcdA , tcdB y tcdR se transcriben durante la fase de crecimiento estacionaria, mientras que tcdC se expresa ya en la fase de crecimiento exponencial. En cuanto a tcdE , su función aún no está bien definida 19-21( ver fig. 1).
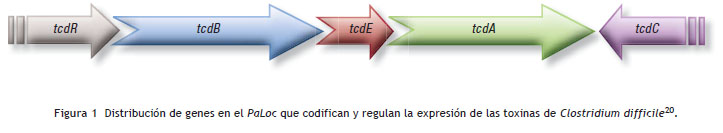
El receptor al cual se unen las toxinas a nivel del epitelio intestinal aún no está bien definido. Se presume que cada toxina tiene tropismo por diferentes sitios en la célula hospedera: la toxina A se enlaza más efectivamente hacia el lado apical de la célula, mientras que la toxina B se enlaza mejor a un receptor aún desconocido en la zona basolateral de la célula. En animales, la toxina A se ha evidenciado que se puede enlazar al trisacárido Gal1(a1-3)Gal(ß1-4) GlcNac, mientras que en humanos se ha propuesto a la glicoproteína gp96 como correceptor para la adherencia de la toxina A a la célula 22,23.
Desde que Hall y O'toole, en 1935, describieron por primera vez a C. difficile como microbiota comensal del TGI de recién nacidos, se ha establecido que esta población puede estar infectada sin desarrollar la enfermedad hasta en un 80%, mientras que en los adultos esta cifra es menor del 5% 18,24. Se han planteado varias hipótesis de por qué los recién nacidos se infectan pero no padecen la enfermedad: a) el calostro proveniente de la madres puede contener anticuerpos que contribuyan a neutralizar las toxinas A y B 25; b) las células intestinales fetales son mucho menos sensibles al efecto de las toxinas que las células intestinales de los adultos 26, y c) los recién nacidos pueden carecer de receptores específicos para la unión de las toxinas a nivel de los enterocitos 27,28.
Cepa BI/NAP1/027/toxinotipo III
Hacia 2002, la Universidad de Pittsburg Medical Center, en los Estados Unidos, reportó un aumento de los casos de EACD en Norteamérica, inicialmente en Canadá, posteriormente, en EE. UU. y Europa 29-32. Tales casos llevaron a la aparición de un brote causado por una cepa hipervirulenta de C. difficile , que en 2005 fue caracterizada como BI/ NAP1/027/toxinotipo III, BI por REA, NAP1 por PFGE y 027 por ribotipificación, y cuyas características principales son:
a) Deleción en el gen tcdC , por lo cual no se puede controlar la expresión de los genes, lo que conlleva la hiperproducción toxigénica 33,34.
b) Hiperproducción de toxina binaria. Esta toxina es codificada en una región llamada locus CDT (CdtLoc) , separada del PaLoc , y comprende 3 genes en lugar de 5. Las toxinas que producen, CdtA y CdtB , se encuentran reguladas por el gen CtdR y no poseen relación alguna con las toxinas del PaLoc . La CdtB es la encargada de unirse a la célula hospedera, permitiendo la traslocación de CdtA al interior 22,35,36 ( ver fig. 2).
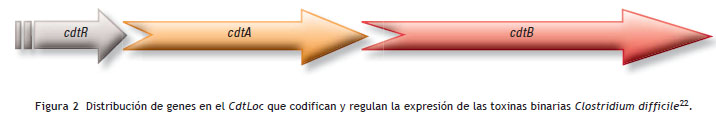
c) Resistencia a las fluoroquinolonas 30,34,37,38. Se ha sugerido que un factor importante que potenció el desarrollo del brote por este ribotipo 027 resistente a las fluoroquinolonas fue que al mismo tiempo, en los hospitales de Canadá, se empezaba a utilizar comúnmente estos antibióticos 39
Además, in vitro , se ha demostrado que estas cepas tienen alta capacidad de esporulación, en comparación con las cepas que no causan brotes 40.
Prevalencia
El sistema nacional de estadísticas vitales del CDC publicó, en marzo de 2011, el reporte preliminar para muertes en 2009, siendo la enterocolitis la causa número 19 de muerte en la población mayor de 65 años 41; en 1999, se presentaron 793 muertes causadas por C. difficile , mientras que en 2009, se reportaron 7.285 muertes, con una tasa de muerte ajustada a la edad de 2,2 muertes por 100.000 personas 42. Según la Guía práctica para la infección por C. difficile en adultos, publicada por la Sociedad Americana de Epidemiología para el Cuidado de la Salud y la Sociedad Americana de Enfermedades Infecciosas, C. difficile es el principal patógeno causante de la colitis asociada a antibióticos y del 20-30% de los casos de diarrea nosocomial asociada a antibióticos 43.
Después de la aparición de los brotes en Canadá por la cepa BI/NAP1/027/toxinotipo III, las cifras de incidencia y la severidad de la EACD en el ámbito mundial han ido en aumento: en los hospitales canadienses, entre 1997 y 2005, las tasas de incidencia aumentaron de 3,8 a 9,5 casos por cada 10.000 pacientes diarios, o 3,4 a 8,4 casos por cada 1.000 ingresos en cuidados intensivos 43; mientras en niños hospitalizados en Estados Unidos, entre 2001 y 2006, la incidencia anual de EACD tuvo un incremento de 2,6 a 4,0 casos por 1.000 admisiones, o de 4,4 a 6,5 casos por 10.000 pacientes diarios 44. Según McFarland et al. (2008), la incidencia de EACD a partir del brote en Canadá cambió drásticamente, de 35,6 casos por 100.000 pacientes en 1991 a 156,3 casos por 100.000 pacientes en el 2004, con un aumento en la mortalidad de 4,5% de casos en 1991 a 22% de casos en el 2004 45. Loo et al. (2004), describieron en varios hospitales de Canadá una incidencia de 22,5 por 1.000 casos de diarrea nosocomial asociada a C. difficile , con una tasa de mortalidad de 6,9% a los 30 días y de 16,7% al año de haber sido diagnosticados 30.
Tal vez el ribotipo más ampliamente descrito como causante de infección por C. difficile , especialmente en Europa, es el ribotipo 001, el cual ha sido asociado a altas tasas de resistencia a antibióticos como eritromicina, ciprofloxacina y moxifloxacina 46, 47. En los últimos años, ha aumentado el reporte de casos de EACD causada por el ribotipo 017, el cual expresa toxinas A-/B+ debido a una deleción del gen tcdA 46,48,49, lo cual limita el diagnóstico del laboratorio para aquellas técnicas que detecten la expresión de este gen, resaltando la importancia de implementar o complementar con técnicas moleculares.
Goorhuis et al. (2008), describieron en los Países Bajos una nueva cepa hipervirulenta, ribotipo 078, causante de una EACD de similar severidad a la enfermedad causada por la cepa 027, con un incremento en la incidencia entre 2005 y 2008 del 3 al 13%, afectando principalmente a la población joven y asociada a la comunidad 50.
En Latinoamérica, en Costa Rica, también se ha descrito a C. difficile como el principal agente causal de diarrea nosocomial, con una tasa de infección cercana al 30% de los casos de diarrea 51,52, mientras que la cepa NAP1 fue encontrada, por primera vez, en otro centro hospitalario de este país con una prevalencia del 54% del total de los aislamientos 53.
En Brasil, Souza Dias et al. (2010) describieron un seudobrote en su país en el 2002-2003, donde evaluaron 138 casos de EACD, con una incidencia de 3,3 por 1.000 pacientes hospitalizados, y obteniendo 16 tipos diferentes de C. difficile por reacción en cadena de la polimerasa (PCR: Polymerase Chain Reaction ) 54. En un estudio de casos y controles, se determinó por ensayo inmunoenzimático (EIA) que 22 casos de 49 estudiados eran positivos para las toxinas de C. difficile 55. Balassiano et al. (2011), aislaron y caracterizaron cepas de C. difficile de un hospital de Rio de Janeiro, encontrando a través de EIA, una prevalencia de 27,1% (19 de 70) en los pacientes sujetos a estudios, donde la mayoría de las cepas presentaban los genes tcdA y tcdB , ninguna cepa deleción en el gen tcdC , y el ribotipo 133 fue aislado en el 50% de esas cepas 56. El mismo autor, en el 2010, ya había descrito la prevalencia de infección por C. difficile en un grupo de pacientes hospitalizados en una unidad de cuidados intensivos (UCI) en Rio de Janeiro, de los cuales, 43 (19,7%) de los pacientes presentaron EACD, con una incidencia de 1,8 casos por 1.000 pacientes diarios que ingresan en la UCI 57.
En Argentina, Legaria et al. (2003), describieron que de 87 pacientes con sospecha de EACD, el 40% eran positivos para la determinación toxigénica de C. difficile a través de EIA 58. En Chile, Gardilcic et al. (2000), evaluaron por EIA 27 pacientes hospitalizados con 31 episodios de diarrea asociada a C. difficile durante 4 meses, de los cuales solo murió 1 (4%) paciente por megacolon tóxico 59; mientras que en Uruguay, evaluaron 78 pacientes de UCI con diarrea, a los cuales se les evaluó la presencia de C. difficile por aglutinación en látex y EIA, encontrando una prevalencia del 26% 60.
Willingham et al. (1998), determinaron por EIA, que de 126 pacientes peruanos con sida, con y sin diarrea, 27 (21,4%) estaban infectados por C. difficile , de los cuales 11 (42%) murieron en el transcurso del estudio 61. Más recientemente, en 2007, García et al. (2007), reportaron que de 156 pacientes de un hospital de Lima con diarrea nosocomial, 55 (35,2%) fueron diagnosticados de EACD 62.
En Colombia, hasta la fecha, se han realizado pocos estudios que permitan determinar la prevalencia de la infección y enfermedad por C. difficile . En 2008, se publicó una revisión bibliográfica realizada por Otero- Rengino, la cual actualiza la epidemiología, patogénesis y tratamiento de la infección por C. difficile 10, y en 2009, el mismo autor determinó mediante un estudio observacional la prevalencia y la causa de colitis en adultos mayores, atribuyéndole a C. difficile el 40% de las causas infecciosas de la enfermedad 63.
En Medellín, recientemente Becerra et al. (2011), publicaron el estudio "Factores epidemiológicos y clínicos asociados a infección por C. difficile" , el cual estudia los principales factores clínicos y epidemiológicos asociados al desarrollo de EACD 64 y Escobar Díaz et al. (2011), desarrollaron el estudio "Diagnóstico de Clostridium difficile por toxina y cultivo en pacientes con diarrea hospitalizados en la IPS Universitaria Clínica León XIII", encontrando que de 48 muestras, 8 (16,7%) fueron positivas para toxina y cultivo (estudio aún sin publicar).
Formas clínicas
Los individuos que padecen la EACD pueden desarrollar cualquiera de estos estados:
Colitis simple
La colitis se define como un proceso inflamatorio del colon que puede ser causado por diferentes etiologías: isquémica, infecciosa, ulcerativa, entre otras. En este caso, se presenta una diarrea abundante, de 3 o más deposiciones diarias, liquida, con moco y sangre, acompañada de dolor abdominal; generalmente, autolimitada, que se controla con hidratación y la suspensión de la terapia antimicrobiana 18,63.
Colitis seudomembranosa (CSM)
Causada por C. difficile se caracteriza por lesiones con eritema, edema, pérdida del patrón vascular, sangrado, placas amarillentas elevadas de 2 a 10 mm 18,63.
En el estudio de Martin-Alva et al. (2007), sobre la asociación de la toxina A de C. difficile y el daño histopatológico causado en los pacientes, se clasificaron los resultados de las biopsias colónicas y se dividieron en 3 tipos de lesiones 65:
Tipo I: se pueden apreciar acumulaciones focales de polimorfonucleares con áreas de necrosis epitelial focalizada y exudación de fibrina y neutrófilos en la luz colónica.
Tipo II: presenta un exudado más prominente que se origina en un área de ulceración epitelial, manteniéndose intacta la mucosa circundante.
Tipo III: consiste en la necrosis epitelial difusa (no focal, como sucedía en los tipos anteriores), cubierta por una seudomembrana formada por polimorfonucleares, fibrina y detritus celulares.
Colitis fulminante
Manifestación grave y altamente letal de la enfermedad, que aparece aproximadamente en el 3% de los infectados con C. difficile . Se caracteriza, además de lo descrito en la CSM, por presentar una alteración del estado general del individuo, acompañado por letargo, fiebre, leucocitosis, acidosis láctica, taquicardia, dolor abdominal, tono muscular ausente, íleo paralítico, megacolon tóxico, entre otras manifestaciones, hasta llegar a la colectomía e incluso la muerte 18,24,66,67.
Recurrencias
Aproximadamente entre un 15-45% de los pacientes tratados de EACD sufren recaídas en un período de 2 meses. Esto se puede deber, además de las constantes alteraciones de la microbiota a nivel del TGI, a la posible presencia de esporas de la bacteria no erradicadas por el tratamiento y a que la inmunidad que se genera a partir de la primera exposición no es especifica, ya que estas reinfecciones pueden ser por cepas diferentes a la inicial 68.
Infecciones extraintestinales
Rara vez, se han reportado casos de infecciones extraintestinales; se han descrito casos de bacteremias, peritonitis, osteomielitis, abscesos viscerales y cerebrales, infección en piel y tejidos, entre otros. En la bacteremia, el daño que las toxinas, especialmente la enterotoxina A, causan a nivel del epitelio del TGI puede llevar a una perforación del mismo y al paso de las toxinas al torrente sanguíneo, donde la acción de la citotoxina puede ser potencialmente letal 69,70.
Factores de riesgo asociados al desarrollo de enfermedad asociada al Clostridium difficile
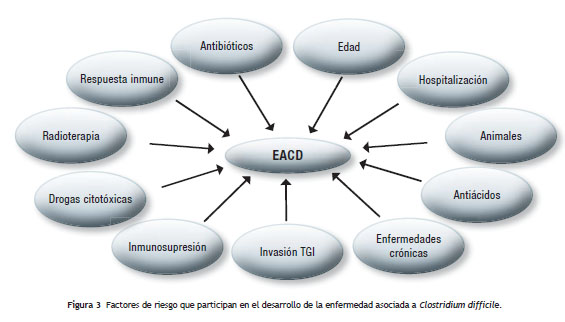
El principal factor de riesgo que influye en el desarrollo de la EACD es la terapia prolongada con antibióticos de amplio espectro. Esto se empezó a evidenciar en 1968, cuando Small demostró en hámster inyectados con lincomicina el desarrollo de enterocolitis, y posteriormente su muerte 71, mientras otros estudios, en los setenta, encontraron en materia fecal de hámster tratados con antibióticos, especialmente con clindamicina, y que murieron por inflamación del ciego, un alto número de toxinas de C. difficile 72-74 . Posteriormente, otras investigaciones determinaron que otros antibióticos, aminoglicósidos y betalactámicos, especialmente ampicilina y cefalosporinas, también incidían en el desarrollo de la EACD en pacientes hospitalizados 75-77.
La edad avanzada, especialmente en ancianos hospitalizados, juega un papel muy importante en el desarrollo de la EACD. Este factor de riesgo se ha visto muy asociado con la respuesta del sistema inmune, especialmente la de tipo humoral, que pueda presentar cada individuo ante la infección; en pacientes con edad avanzada, se presenta una falla en la producción de inmunoglobulina G antitoxina A, como respuesta inicial a la infección 78-80, además de otras afecciones que se presentan con la edad y que le dificultan la respuesta contra esta clase de patógenos. Karas et al. (2010), en un revisión de la literatura estableció que en 27 estudios, con 10.975 casos de EACD, la mortalidad calculada era menor de 5,99% en esos pacientes con 3 meses de diagnóstico, siendo esta cifra asociada fuertemente a la edad avanzada, donde el 13,5% de los pacientes tenían más de 80 años de edad 81.
Entre otros factores de riesgo que participan en el desarrollo de la EACD están: estancia prolongada en hospitales, especialmente en centros para personas de la tercera edad y en las UCI, pacientes con enfermedades crónicas severas (renales y hepáticas), estados de inmunosupresión y quimio/ radioterapia, drogas citotóxicas, antiácidos, inhibidores de la bomba de protones, cirugías gastrointestinales y otros procedimientos invasivos en el TGI 1,8,24.
Como enfermedad mayormente asociada al cuidado de la salud, la presencia de esporas en el medio ambiente hospitalario salud 82-84.
Los animales también establecen una importante ruta de infección para el humano, ya sea que padezcan de la enfermedad o como portadores asintomáticos; se han descrito animales domésticos como gatos y perros, caballos, terneros y lechones como posibles agentes diseminadores de la enfermedad 85-88. Se ha descubierto, por técnicas moleculares, que algunos ribotipos de C. difficile encontrados tanto en humanos como en animales se encuentran genéticamente relacionados 50 (ver fig. 3).
Diagnóstico por laboratorio y tipificación bacteriana
El diagnóstico de la EACD debe estar basado en una combinación de la clínica del paciente, exámenes de rutina como la colonoscopia o estudios histológicos y el laboratorio. En el laboratorio, existen diferentes métodos para establecer el diagnóstico de la enfermedad: ensayos de neutralización de citotoxina por cultivo celular, aglutinación en látex, cultivo anaerobio más pruebas de identificación y EIA.
En cuanto a las pruebas moleculares, estas pueden ser utilizadas, ya sea como herramientas diagnósticas, siendo el caso de la PCR convencional, o como herramientas de estudio epidemiológico y filogenético, como se va a describir más adelante.
Cultivo celular
El ensayo de neutralización de citotoxina es la prueba de referencia para la identificación de la toxina B en materia fecal, gracias a que en más del 90% de los pacientes con CSM se puede identificar el efecto citopático que la toxina produce sobre tejido humano in vitro . La técnica posee una sensibilidad y una especificidad de casi el 100%. Entre sus limitaciones, encontramos su elevado costo, el tiempo para la entrega de los resultados (2-3 días), la escasez de centros especializados en la técnica y que no existe relación entre la presencia de la toxina y la gravedad de la enfermedad 42,43,89.
Tricota-Lee et al. (1987), determinaron que los fibroblastos humanos, en comparación con otras líneas celulares, son los más sensibles para la detección de la toxina 90.
Cultivo anaerobio
Permite el crecimiento de cepas morfológicamente compatibles con la bacteria; se utilizan medios selectivos y diferenciales incubados en anaerobiosis, el medio más ampliamente utilizado es el de agar cicloserina-cefoxitina- fructosa, descrito por primera vez por George et al. (1979) 89,91,92. Está técnica permite el aislamiento de la colonia y su posterior manipulación para utilizarla en la identificación de fenotipos, y el estudio de su perfil de resistencia. Por ejemplo, la identificación confirmatoria se puede realizar mediante las pruebas de indol negativo, L-prolina-aminopeptidasa positiva y métodos comerciales (Crystal ID Systems Becton Dickinson, Loveton Circle Sparks, MD) 92. Sin embargo, esta técnica puede ser ineficaz para fines diagnósticos debido la dificultad para que este tipo de bacterias crezcan, desarrollo de cepas no toxigénicas o que no expresen la toxina in vitro .
También se han utilizado otros medios de cultivo para el aislamiento de C. difficile : agar cicloserina manitol, agar sangre manitol cicloserina, agar cefoxitina cicloserina con suplementos de sangre, entre otros. Mundy et al. (1995), compararon el agar cicloserina-cefoxitina-fructosa con el agar sangre manitol cicloserina, donde este último presentó menos inhibición de la flora normal presente en la materia fecal, siendo el agar cicloserina-cefoxitinafructosa más indicado para el asilamiento de C. difficile 93.
Ensayos inmunoenzimáticos
Desde los años ochenta hasta la fecha, los EIA han sido ampliamente utilizados y modificados para detectar, dependiendo de la casa comercial, la presencia de la toxina A, la toxina B o ambas en materia fecal.
Son pruebas diagnósticas comerciales, rápidas y económicas, con una sensibilidad cercana al 63-94% y una especificidad del 75-100%; los resultados deben ser comparados a la luz de la historia clínica, debido a que hay cepas que pueden no expresar la toxina que se está evaluando, siendo los EIA que aplican ambas toxinas en su detección las mejores pruebas diagnósticas 42,43,89,94-96.
Aglutinación en látex
Inicialmente, se pensó que la aglutinación en látex para detectar C. difficile detectaba la toxina A en las muestras de material fecal; sin embargo, estudios posteriores demostraron que cepas bacterianas no toxigénicas o a las cuales se les ha extraído la toxina son positivas igualmente con el test, sugiriendo que es otra la proteína la causante de la reacción 97. Lyerly et al. (1991), comprobaron que la proteína causante de la aglutinación era un antígeno común en C. difficile : la glutamato deshidrogenasa 98.
Esta técnica tiene una especificidad del 94-98% y una baja sensibilidad, 58-68% 43,89, lo cual la hace poco idónea para ser utilizada como test diagnóstico de rutina en el laboratorio.
Técnicas moleculares
En el caso de C. difficile , las técnicas de biología molecular pueden ser utilizadas para fines epidemiológicos, entender los modos de transmisión, evaluar los factores de virulencia y los mecanismos de resistencia bacteriana.
Los primeros pasos para detectar cepas toxigénicas de C. difficile se dieron a principios de los noventa, mediante la implementación de la PCR como método más sensible y rápido que permitió detectar los genes que codificaban para la expresión de las toxinas A y B 99-101.
Los métodos, y algunas técnicas, más utilizados para la tipificación de cepas de C. difficile son: Métodos basados en restricción: PFGE 102,103, REA 103,104, toxinotipificación 105.
Métodos basados en amplificación: análisis de repeticiones en tándem de MLVA 106, ribotipificación 103,107-109.
Métodos basados en secuenciación: MLST 106.
Diferentes estudios han comparado varias de estas metodologías para determinar cuál de ellas presenta un mayor poder discriminatorio en cepas de C. difficile aisladas en pacientes con diarrea asociada a antibióticos provenientes de diversos hospitales. La mayoría de trabajos coinciden en que MLVA y PFGE presentan el mayor poder discriminatorio, seguidos de REA y MLST 106,110-112.
La electroforesis en campo pulsado en gel
La PFGE es uno de los primeros métodos implementados para la tipificación de C. difficile , siendo considerada la técnica estándar en Canadá y Estados Unidos 103.
Esta técnica emplea una enzima que se encarga de cortar y fragmentar el genoma bacteriano; se han utilizado enzimas como la Sma-I o Sac-II , dependiendo del autor. Estos fragmentos son separados en un gel de poliacrilamida que es sometido a un campo eléctrico, lo que permite a los fragmentos migrar a través del gel de acuerdo con su tamaño y ser analizados visualmente o a través de un software . Patrones de banda con una similaridad = 80% les permite clasificar como un solo pulsotipo; en Norteamérica, cada pulsotipo se designa NAP y el número del tipo (por ejemplo, NAP1, NAP2, etc.) 22,103.
Para citar un ejemplo de la aplicación de esta técnica, Gal et al. (2005), desarrollaron y aplicaron un protocolo de PFGE a 50 aislamientos del ribotipo 001 de C. difficile , donde la digestión con la enzima de restricción Sma-I le proporcionó bandas patrones diferentes y reproducibles 102.
Análisis con endonucleasas de restricción
El REA, al igual que en PFGE, utiliza enzimas específicas que cortan el ADN bacteriano en muchos más fragmentos que son separados por electroforesis en un gel de agarosa. La enzima más utilizada es la Hind-III , una enzima "cortadora" de 6 pb con numerosos sitios de restricción en el genoma. Este método arroja resultados bastante discriminatorios, pero el patrón de bandas obtenido es más difícil de interpretar y de reproducir comparado con la PFGE 22,103. Los aislamientos que muestran 6 o menos diferencias visibles en las bandas de restricción son nombrados con el mismo grupo y designados por letras, mientras que los patrones idénticos de restricción son nombrados con números (por ejemplo, CF1, CF2) 103.
En 1987, Kuijper et al., usando un análisis de digestión con enzimas de restricción, describieron en 2 pacientes con CSM adquirida en el ámbito hospitalario, patrones de restricción del ADN bacteriano muy similares a los hallados en otros aislamientos de la bacteria del mismo ambiente hospitalario, demostrando así la utilidad que tiene la técnica para estudiar la epidemiología de C. difficile 113.
Clabots et al. (1993), con su grupo de investigación, desarrollaron un sistema de tipificación con REA Hin dIII para el ADN completo de 1.965 aislamientos de C. difficile . Los resultados obtenidos de esta colección de aislamientos permitieron organizarlos en 75 grupos, de los cuales 43 fueron citotoxina positiva, 28 citotoxina negativa y 4 grupos fueron incluidos en cepas toxigénicas y no toxigénicas. La tipificación con REA fue capaz de discriminar las diferencias obtenidas con cepas de referencia y con otros tipos de C. difficile identificados por otras técnicas, concluyendo que la técnica es sensible, discriminatoria, reproducible y rápida 104. Este grupo de investigación mantiene una colección de aislamientos clínicos de C. difficile de varios sitios del mundo, obtenidos en un período de 20 años, aproximadamente. Esta colección fue importante en el momento de identificar la cepa epidémica BI/NAP1/027 y poder demostrar que ya se había aislado en el pasado, pero que otros factores favorecieron el incremento de su virulencia, como por ejemplo, la utilización de fluoroquinolonas 103.
Toxinotipificación
La toxinotipificación es un método basado en PCR en el cual las cepas de C. difficile , de acuerdo con la longitud y patrones de restricción de 2 fragmentos (el B1 y A3) del PaLoc , son clasificadas en toxinotipos.
Rupnik et al. (1998), estudiaron en 219 aislamientos de 22 serogrupos de C. difficile los cambios en los genes que codifican para la producción de toxinas. Comparando los genes de las cepas problema con la cepa de referencia para C. difficile VPI 10463, y utilizando polimorfismos de longitud de fragmentos de restricción (RFLPs), se reconocieron 5 patrones diferentes en tcdB y 2 en tcdA . De acuerdo con los cambios y delecciones encontradas en los genes, las cepas fueron divi didas en 10 grupos, del toxinotipo del I al X 105. Actualmente, se conocen 27 toxinotipos diferentes (del I al XXVII) 22.
Análisis de repeticiones en tándem de número variable en locus múltiples
El análisis de repeticiones en tándem de MLVA es un método que cuenta el número de alelos repetidos en el genoma para una serie de loci conservados que son amplificados por PCR 22.
Marsh et al. (2006), implementaron un MLVA para subtipificar cepas de C. difficile obtenidas de un brote en el 2001 en un hospital de cuidado terciario; los loci identificados fueron comparados con REA, encontrando el mismo tipo esperado. La técnica es un método que permite la detección de brotes de C. difficile y contribuye en el estudio de la epidemiología de la transmisión nosocomial 114.
Ribotipificación
Así como PFGE es la técnica más utilizada en Norteamérica, la ribotipificación es la más utilizada en Europa. Es el método de tipificación molecular universal de bacterias, utilizada para la discriminación de los diferentes serotipos bacterianos. El ribotipo se define como un grupo de cepas con idénticas bandas patrones, donde una diferencia en una sola banda representa un nuevo ribotipo. Esta técnica se basa en la amplificación, por medio de primers específicos, de la región espaciadora interna transcrita que se encuentra entre el rARN 16S y 23S. El resultado de estas amplificaciones son bandas entre 200 y 700 pb visualizadas, normalmente, sobre un gel de agarosa o también a través de un software 46,103,108,115 .
Muchas investigaciones han implementado la ribotipificación para el desarrollo de sus estudios, siendo las condiciones de Stubbs et al. (1999) o Bidet et al. (1999), las más utilizadas hasta el momento 46,103,115. Stubbs et al. describieron por PCR una librería de 116 ribotipos de la bacteria, donde el tipo 001 fue el más común asociado a infecciones intrahospitalarias en el Reino Unido 46.
Análisis de secuencias de locus múltiples
El MLST es una técnica muy similar al MLVA, que permite el estudio de la epidemiología y filogenia de C. difficile . Esta técnica permite el estudio de la relación entre especies de bacterias, a través de la amplificación y secuenciación de aproximadamente 450-500 pb de fragmentos internos del genoma de, generalmente, 5 a 7 genes housekeeping . La diferencia encontrada en la secuencia de cada housekeeping se considera un alelo diferente, y cada alelo define un tipo de secuencia 103.
MLST tiene la ventaja de que los tipos de secuencias arrojados no son ambiguos y fácilmente comparables a través de Internet con una base de datos de otros aislamientos 103.
Tratamiento y susceptibilidad antimicrobiana
El tratamiento para el manejo de la CSM está basado en hidratación y la suspensión de los antibióticos causantes de la diarrea, esto con el fin de restaurarle al paciente la microbiota normal del TGI y su resistencia a la colonización por patógenos como C. difficile .
Desde comienzos de los años ochenta hasta la actualidad, el tratamiento con metronidazol y vancomicina ha demostrado ser efectivo contra la bacteria. Para complicaciones clínicas de la EACD, vancomicina provee una mayor respuesta a la enfermedad que el metronidazol 43,116-119. El manejo de estas formas complicadas y recurrentes puede ir desde el suministro de fluidos intravenosos, vasopresores, vancomicina oral o intravenosa, metronidazol intravenoso, enemas, restablecimiento de la flora intestinal, hasta llegar, como única opción, a la colectomía 22,120,121.
La susceptibilidad de la bacteria a ciertos antibióticos varía de un lugar a otro. Diversos estudios han reportado cifras diferentes de resistencia de la bacteria al metronidazol, además de cefotaxime, ciprofloxacina, moxifloxacina, levofloxacina, eritromicina, clindamicina, tetraciclina, rifampicina, imipenem y ácido fusídico 122,123.
Impacto de las enfermedades asociadas a Clostridium difficile en la sociedad, salud y economía
Históricamente, la mortalidad atribuible a infección por C. difficile ha sido baja, como un resultado directo o indirecto de infección, que ocurre aproximadamente en menos del 2% de casos. Sin embargo, los sobrecostos atribuibles a infección por C. difficile sugieren una carga sustancial sobre los sistemas de salud médica. De 1999 a 2003 en Massachusetts, se atribuyó a EACD un total de 55,380 días de hospitalización y 55,2 millones de dólares 43 . Se estima que en la actualidad, en EE. UU., hay 250.000 casos cada año, los cuales producen mayor estancia hospitalaria, con un costo adicional de 1,1 billones de dólares 124.
Actualmente, la EACD constituye un problema creciente de salud pública en este entorno debido, principalmente, a los siguientes factores:
a) La vulnerabilidad de los ancianos a la enfermedad 6,8,9.
b) En la mayoría de casos, el tratamiento para la diarrea, independiente de la presencia o no de la CSM, es empírico, basado en hidratación y manejo con antimicrobianos como metronidazol y vancomicina principalmente 43, lo que puede llevar a la no resolución de la enfermedad, estancias hospitalarias prolongadas y recurrencias.
c) La eliminación de la microbiota autóctona y el aumento de resistencia en C. difficile por el uso indiscriminado de antibióticos 122,123, tanto en el ámbito hospitalario como de la comunidad.
Conclusiones
La EACD se considera la principal enfermedad del TGI asociada al cuidado de la salud en pacientes hospitalizados > 65 años y que reciban tratamientos con antibióticos de amplio espectro. Debido al modo de transmisión de la bacteria, sus factores de virulencia, mecanismos de patogenicidad, y la aparición de posibles cepas epidémicas o resistentes a antibióticos, este tipo de enfermedad podría considerarse un problema de salud pública en las instituciones de salud.
Sin embargo, la ausencia de información e investigaciones en el medio no ha logrado evidenciar la verdadera prevalencia del microorganismo y de la EACD. Por tanto, esta revisión pretende retomar esta temática, contextualizar y dilucidar la importancia de realizar investigaciones aplicadas al futuro que permitan resolver esta problemática.
Conflicto de intereses
Los autores manifiestan que no tienen conflictos de intereses para la publicación de este artículo * Autor para correspondencia. Universidad de Antioquia. Calle 69 No. 51C – 24, Laboratorio de anaerobios, IPS Universitaria Clínica León XIII. Medellín, Antioquia, Colombia. Tel. +57(4) 5167300 ext. 3064, +57(4) 3771948 Correo electrónico: jhonriver28@hotmail.com (J.W. Zea) 0123-9392/$ - see front matter © 2012 ACIN. Publicado por Elsevier España, S.L. Todos los derechos reservados.
Bibliografía
1. Sehulster L, Chinn RY; CDC; HICPAC. Guidelines for environmental infection control in health-care facilities. Recommendations of CDC and the Healthcare Infection Control Practices Advisory Committee (HICPAC). MMWR Recomm Rep. 2003;52(RR-10):1-42. [ Links ]
2. Dubberke ER, Reske KA, Noble-Wang J, Thompson A, Killgore G, Mayfield J, et al. Prevalence of Clostridium difficile environmental contamination and strain variability in multiple health care facilities. Am J Infect Control. 2007;35:315-8. [ Links ]
3. Finney JMT. Gastroenterostomy for cicatrizing ulcer of the pylorus. Johns Hopkins Hosp Bull.1893;4:53-55. [ Links ]
4. Hall I, O'Toole E. Intestinal flora in newborn infants with a description of a new pathogenic anaerobe. Bacillus difficilis. 1935;49:390-402. [ Links ]
5. Bartlett JG, Moon N, Chang TW, Taylor N, Onderdonk AB. Role of Clostridium difficile in antibiotic-associated pseudomembranous colitis. Gastroenterology. 1978;75:778-82. [ Links ]
6. George RH, Symonds JM, Dimock F, Brown JD, Arabi Y, Shinagawa N, et al. Identification of Clostridium difficile as a cause of pseudomembranous colitis. Br Med J. 1978;1:695. [ Links ]
7. Barbut F, Corthier G, Charpak Y, Cerf M, Monteil H, Fosse T, et al. Prevalence and pathogenicity of Clostridium difficile in hospitalized patients. A French multicenter study. Arch Intern Med. 1996;156:1449-54. [ Links ]
8. Asha NJ, Tompkins D, Wilcox MH. Comparative analysis of prevalence, risk factors, and molecular epidemiology of antibiotic-associated diarrhea due to Clostridium difficile, Clostridium perfringens , and Staphylococcus aureus . J Clin Microbiol. 2006;44:2785-91. [ Links ]
9. Wilcox MH, Mooney L, Bendall R, Settle CD, Fawley WN. A casecontrol study of community-associated Clostridium difficile infection. J Antimicrob Chemother. 2008;62:388-96. [ Links ]
10. Otero W. Enfermedad asociada a Clostridium difficile : nuevas amenazas de un viejo enemigo. En: Sánchez ALCJE, ed. Clostridium difficile associated disease: New threats of and old foe. Rev Col Gastroenterol. 2008. p. 142-59. [ Links ]
11. Denève C, Janoir C, Poilane I, Fantinato C, Collignon A. New trends in Clostridium difficile virulence and pathogenesis. Int J Antimicrob Agents. 2009;33 Suppl 1:S24-8. [ Links ]
12. Donskey CJ. The role of the intestinal tract as a reservoir and source for transmission of nosocomial pathogens. Clin Infect Dis. 2004;39:219-26. [ Links ]
13. Rifkin GD, Silva J Jr, Fekety R. Gastrointestinal and systemic toxicity of fecal extracts from hamsters with clindamycininduced colitis. Gastroenterology. 1978;74:52-7. [ Links ]
14. Humphrey CD, Condon CW, Cantey JR, Pittman FE. Partial purification of a toxin found in hamsters with antibiotic-associated colitis. Reversible binding of the toxin by cholestyramine. Gastroenterology. 1979;76:468-76. [ Links ]
15. Taylor NS, Thorne GM, Bartlett JG. Comparison of two toxins produced by Clostridium difficile . Infect Immun. 1981;34:1036-43. [ Links ]
16. Banno Y, Kobayashi T, Kono H, Watanabe K, Ueno K, Nozawa Y. Biochemical characterization and biologic actions of two toxins (D-1 and D-2) from Clostridium difficile . Rev Infect Dis. 1984;6 Suppl 1:S11-20. [ Links ]
17. Riegler M, Sedivy R, Pothoulakis C, Hamilton G, Zacherl J, Bischof G, et al. Clostridium difficile toxin B is more potent than toxin A in damaging human colonic epithelium in vitro . J Clin Invest. 1995;95:2004-11. [ Links ]
18. Hurley BW, Nguyen CC. The spectrum of pseudomembranous enterocolitis and antibiotic-associated diarrhea. Arch Intern Med. 2002;162:2177-84. [ Links ]
19. Hundsberger T, Braun V, Weidmann M, Leukel P, Sauerborn M, Von Eichel-Streiber C. Transcription analysis of the genes tcdA-E of the pathogenicity locus of Clostridium difficile . Eur J Biochem. 1997;244:735-42. [ Links ]
20. Dupuy B, Govind R, Antunes A, Matamouros S. Clostridium difficile toxin synthesis is negatively regulated by TcdC. J Med Microbiol. 2008;57(Pt 6):685-9. [ Links ]
21. Kim SJ, Kim H, Seo Y, Yong D, Jeong SH, Chong Y, et al. Molecular characterization of toxin A-negative, toxin B-positive variant strains of Clostridium difficile isolated in Korea. Diagn Microbiol Infect Dis. 2010;67:198-201. [ Links ]
22. Rupnik M, Wilcox MH, Gerding DN. Clostridium difficile infection: new developments in epidemiology and pathogenesis. Nat Rev Microbiol. 2009;7:526-36. [ Links ]
23. Na X, Kim H, Moyer MP, Pothoulakis C, LaMont JT. gp96 is a human colonocyte plasma membrane binding protein for Clostridium difficile toxin A. Infect Immun. 2008;76:2862-71. [ Links ]
24. Biel FJ. Diarrea por Clostridium difficile . Clostridium difficile associated diarrhea. Gastroenterol. latinoam;2010:2:260-7. [ Links ]
25. Kim K, Pickering LK, DuPont HL, Sullivan N, Wilkins T. In vitro and in vivo neutralizing activity of human colostrum and milk against purified toxins A and B of Clostridium difficile . J Infect Dis. 1984;150:57-62. [ Links ]
26. Chang TW, Sullivan NM, Wilkins TD. Insusceptibility of fetal intestinal mucosa and fetal cells to Clostridium difficile toxins. Zhongguo Yao Li Xue Bao. 1986;7:448-53. [ Links ]
27. Lyerly DM, Krivan HC, Wilkins TD. Clostridium difficile : its disease and toxins. Clin Microbiol Rev. 1988;1:1-18. [ Links ]
28. Eglow R, Pothoulakis C, Itzkowitz S, Israel EJ, O'Keane CJ, Gong D, et al. Diminished Clostridium difficile toxin A sensitivity in newborn rabbit ileum is associated with decreased toxin A receptor. J Clin Invest. 1992;90:822-9. [ Links ]
29. Pépin J, Valiquette L, Alary ME, Villemure P, Pelletier A, Forget K, et al. Clostridium difficile -associated diarrhea in a region of Quebec from 1991 to 2003: a changing pattern of disease severity. CMAJ. 2004;171:466-72. [ Links ]
30. Loo VG, Poirier L, Miller MA, Oughton M, Libman MD, Michaud S, et al. A predominantly clonal multi-institutional outbreak of Clostridium difficile -associated diarrhea with high morbidity and mortality. N Engl J Med. 2005;353:2442-9. [ Links ]
31. Labbé AC, Poirier L, Maccannell D, Louie T, Savoie M, Béliveau C, et al. Clostridium difficile infections in a Canadian tertiary care hospital before and during a regional epidemic associated with the BI/NAP1/027 strain. Antimicrob Agents Chemother. 2008;52:3180-7. [ Links ]
32. Kuijper EJ, Coignard B, Tüll P; ESCMID Study Group for Clostridium difficile ; EU Member States; European Centre for Disease Prevention and Control. Emergence of Clostridium difficile -associated disease in North America and Europe. Clin Microbiol Infect. 2006;12 Suppl 6:2-18. [ Links ]
33. MacCannell DR, Louie TJ, Gregson DB, Laverdiere M, Labbe AC, Laing F, et al. Molecular analysis of Clostridium difficile PCR ribotype 027 isolates from Eastern and Western Canada. J Clin Microbiol. 2006;44:2147-52. [ Links ]
34. Warny M, Pépin J, Fang A, Killgore G, Thompson A, Brazier J, et al. Toxin production by an emerging strain of Clostridium difficile associated with outbreaks of severe disease in North America and Europe. Lancet. 2005;366:1079-84. [ Links ]
35. Stubbs S, Rupnik M, Gibert M, Brazier J, Duerden B, Popoff M. Production of actin-specific ADP-ribosyltransferase (binary toxin) by strains of Clostridium difficile . FEMS Microbiol Lett. 2000;186:307-12. [ Links ]
36. Carter GP, Lyras D, Allen DL, Mackin KE, Howarth PM, O'Connor JR, et al. Binary toxin production in Clostridium difficile is regulated by CdtR, a LytTR family response regulator. J Bacteriol. 2007;189:7290-301. [ Links ]
37. McDonald LC, Killgore GE, Thompson A, Owens RC Jr, Kazakova SV, Sambol SP, et al. An epidemic, toxin gene-variant strain of Clostridium difficile . N Engl J Med. 2005;353:2433-41. [ Links ]
38. Kuijper EJ, Van den Berg RJ, Debast S, Visser CE, Veenendaal D, Troelstra A, et al. Clostridium difficile ribotype 027, toxinotype III, the Netherlands. Emerg Infect Dis. 2006;12:827-30. [ Links ]
39. Muto CA, Pokrywka M, Shutt K, Mendelsohn AB, Nouri K, Posey K, et al. A large outbreak of Clostridium difficile -associated disease with an unexpected proportion of deaths and colectomies at a teaching hospital following increased fluoroquinolone use. Infect Control Hosp Epidemiol. 2005;26:273-80. [ Links ]
40. Fawley WN, Underwood S, Freeman J, Baines SD, Saxton K, Stephenson K, et al. Efficacy of hospital cleaning agents and germicides against epidemic Clostridium difficile strains. Infect Control Hosp Epidemiol. 2007;28:920-5. [ Links ]
41. Kochanek KD, Xu J, Murphy SL, Miniño AM, Kung HC. Deaths: Preliminary data for 2009. National vital statistics reports; vol 59 no 4. Hyattsville, MD: National Center for Health Statistics. 2011. [ Links ] 42. Arnold A, Pope C, Bray S, Riley P, Breathnach A, Krishna S, et al. Prospective assessment of two-stage testing for Clostridium difficile . J Hosp Infect. 2010;76:18-22. [ Links ]
43. Cohen SH, Gerding DN, Johnson S, Kelly CP, Loo VG, McDonald LC, et al; Society for Healthcare Epidemiology of America; Infectious Diseases Society of America. Clinical practice guidelines for Clostridium difficile infection in adults: 2010 update by the society for healthcare epidemiology of America (SHEA) and the infectious diseases society of America (IDSA). Infect Control Hosp Epidemiol. 2010;31:431-55. [ Links ]
44. Kim J, Smathers SA, Prasad P, Leckerman KH, Coffin S, Zaoutis T. Epidemiological features of Clostridium difficile -associated disease among inpatients at children's hospitals in the United States, 2001-2006. Pediatrics. 2008;122:1266-70. [ Links ]
45. McFarland LV. Update on the changing epidemiology of Clostridium difficile -associated disease. Nat Clin Pract Gastroenterol Hepatol. 2008;5:40-8. [ Links ]
46. Stubbs SL, Brazier JS, O'Neill GL, Duerden BI. PCR targeted to the 16S-23S rRNA gene intergenic spacer region of Clostridium difficile and construction of a library consisting of 116 different PCR ribotypes. J Clin Microbiol. 1999;37:461-3. [ Links ]
47. Borgmann S, Kist M, Jakobiak T, Reil M, Scholz E, Von Eichel- Streiber C, et al. Increased number of Clostridium difficile infections and prevalence of Clostridium difficile PCR ribotype 001 in southern Germany. Euro Surveill. 2008;13. pii: 19057. [ Links ]
48. Drudy D, Fanning S, Kyne L. Toxin A-negative, toxin B-positive Clostridium difficile . Int J Infect Dis. 2007;11:5-10. [ Links ]
49. Goorhuis A, Legaria MC, Van den Berg RJ, Harmanus C, Klaassen CH, Brazier JS, et al. Application of multiple-locus variable-number tandem-repeat analysis to determine clonal spread of toxin A-negative Clostridium difficile in a general hospital in Buenos Aires, Argentina. Clin Microbiol Infect. 2009;15:1080-6. [ Links ]
50. Goorhuis A, Bakker D, Corver J, Debast SB, Harmanus C, Notermans DW, et al. Emergence of Clostridium difficile infection due to a new hypervirulent strain, polymerase chain reaction ribotype 078. Clin Infect Dis. 2008;47:1162-70. [ Links ]
51. Ruiz MA, Altamirano P, Rodríguez E, Gamboa MM. Clostridium perfringens y Clostridium difficile como agentes etiológicos de diarrea nosocomial asociada a antibióticos en niños costarricenses. Rev Biomed. 2007; 18;81-7 52. [ Links ] Zumbado-Salas R, Gamboa-Coronado Mdel M, Rodríguez-Cavallini E, Chaves-Olarte E. Clostridium difficile in adult patients with nosocomial diarrhea in a Costa Rican hospital. Am J Trop Med Hyg. 2008;79:164-5. [ Links ]
53. Quesada-Gómez C, Rodríguez C, Gamboa-Coronado Mdel M, Rodríguez-Cavallini E, Du T, Mulvey MR, et al. Emergence of Clostridium difficile NAP1 in Latin America. J Clin Microbiol. 2010;48:669-70. [ Links ]
54. Souza Dias MB, Yamashiro J, Borrasca VL, Stempliuk VA, Araújo MR, Costa SF, et al. Pseudo-outbreak of Clostridium difficile associated diarrhea (CDAD) in a tertiary-care hospital. Rev Inst Med Trop Sao Paulo. 2010;52:133-7. [ Links ]
55. Marcon AP, Gamba MA, Vianna LA. Nosocomial diarrhea in the intensive care unit. Braz J Infect Dis. 2006;10:384-9. [ Links ]
56. Balassiano IT, Dos Santos-Filho J, Vital-Brazil JM, Nouér SA, Souza CR, Brazier JS, et al. Detection of cross-infection associated to a Brazilian PCR-ribotype of Clostridium difficile in a university hospital in Rio de Janeiro, Brazil. Antonie Van Leeuwenhoek. 2011;99:249-55. [ Links ]
57. Balassiano IT, Dos Santos-Filho J, De Oliveira MP, Ramos MC, Japiassu AM, Dos Reis AM, et al. An outbreak case of Clostridium difficile -associated diarrhea among elderly inpatients of an intensive care unit of a tertiary hospital in Rio de Janeiro, Brazil. Diagn Microbiol Infect Dis. 2010;68:449-55. [ Links ]
58. Legaria MC, Lumelsky G, Rosetti S. Clostridium difficile associated diarrhea from a general hospital in Argentina. Anaerobe. 2003;9:113-6. [ Links ]
59. Gardilcic M, Fica A, Chang M, Llanos C, Luzoro A. Diarrea asociada a Clostridium difficile en un hospital de adultos. Estudio descriptivo. Rev Chil Infect. 2000. p. 307-12. [ Links ]
60. Grille P, Olano E, Bertullo H, Bagnulo H. Estudio sobre diarrea en una unidad de cuidados intensivos quirúrgica. Rev Med Urug. 2006. p. 136-42. [ Links ]
61. Willingham FF, Ticona Chavez E, Taylor DN, Bowen AB, Crane AR, Gottlieb AL, et al. Diarrhea and Clostridium difficile infection in Latin American patients with AIDS. Working Group on AIDS in Peru. Clin Infect Dis. 1998;27:487-93. [ Links ]
62. García C, Samalvides F, Vidal M, Gotuzzo E, Dupont HL. Epidemiology of Clostridium difficile -associated diarrhea in a Peruvian tertiary care hospital. Am J Trop Med Hyg. 2007;77:802-5. [ Links ]
63. William OR. Prevalencia de diferentes tipos de colitis en personas adultas mayores. En: González Angélica G-ZM, ed. Prevalence of different types of colitis among the elderly. Rev Col Gastroenterol. 2009. p. 272-8. [ Links ]
64. Becerra MG, Ospina S, Atehortúa SL, Berbesi DY. Factores de riesgo para la infección por Clostridium difficile . Infectio; 2011. p. 220-6. [ Links ]
65. Martin-Alva E. Asociación de Clostridium difficile , su toxina A y el daño histopatológico en pacientes con diarrea nosocomial. En: Chávez Flora MP, ed. Association of Clostridium difficile , its toxin A and histopathological damage in patients with nosocomial diarrhea. Rev Peru Boil. 2007. p. 287-90. [ Links ]
66. Dallal RM, Harbrecht BG, Boujoukas AJ, Sirio CA, Farkas LM, Lee KK, et al. Fulminant Clostridium difficile : an underappreciated and increasing cause of death and complications. Ann Surg. 2002;235:363-72. [ Links ]
67. Al-Abed YA, Gray EA, Rothnie ND. Outcomes of emergency colectomy for fulminant Clostridium difficile colitis. Surgeon. 2010;8:330-3. [ Links ]
68. Barbut F, Richard A, Hamadi K, Chomette V, Burghoffer B, Petit JC. Epidemiology of recurrences or reinfections of Clostridium difficile -associated diarrhea. J Clin Microbiol. 2000;38:2386-8. [ Links ]
69. García-Lechuz JM, Hernangómez S, Juan RS, Peláez T, Alcalá L, Bouza E. Extra-intestinal infections caused by Clostridium difficile . Clin Microbiol Infect. 2001;7:453-7. [ Links ]
70. Lee NY, Huang YT, Hsueh PR, Ko WC. Clostridium difficile bacteremia, Taiwan. Emerg Infect Dis. 2010;16:1204-10. [ Links ]
71. Small JD. Fatal enterocolitis in hamsters given lincomycin hydrochloride. Lab Anim Care. 1968;18:411-20. [ Links ]
72. Bartlett JG, Onderdonk AB, Cisneros RL. Clindamycinassociated colitis in hamsters: protection with vancomycin. Gastroenterology. 1977;73(4 Pt 1):772-6. [ Links ]
73. Bartlett JG, Chang TW, Moon N, Onderdonk AB. Antibioticinduced lethal enterocolitis in hamsters: studies with eleven agents and evidence to support the pathogenic role of toxinproducing Clostridia. Am J Vet Res. 1978;39:1525-30. [ Links ]
74. Allo M, Silva J Jr, Fekety R, Rifkin GD, Waskin H. Prevention of clindamycin-induced colitis in hamsters by Clostridium sordellii antitoxin. Gastroenterology. 1979;76:351-5. [ Links ]
75. Pierce PF Jr, Wilson R, Silva J Jr, Garagusi VF, Rifkin GD, Fekety R, et al. Antibiotic-associated pseudomembranous colitis: an epidemiologic investigation of a cluster of cases. J Infect Dis. 1982;145:269-74. [ Links ]
76. Rocca JM, Pieterse AS, Rowland R, Hecker R, Rich GE. Clostridium difficile colitis. Aust N Z J Med. 1984;14:606-10. [ Links ]
77. Silva J, Fekety R, Werk C, Ebright J, Cudmore M, Batts D, et al. Inciting and etiologic agents of colitis. Rev Infect Dis. 1984;6 Suppl 1:S214-21. [ Links ]
78. Warny M, Vaerman JP, Avesani V, Delmée M. Human antibody response to Clostridium difficile toxin A in relation to clinical course of infection. Infect Immun. 1994;62:384-9. [ Links ]
79. Kyne L, Warny M, Qamar A, Kelly CP. Asymptomatic carriage of Clostridium difficile and serum levels of IgG antibody against toxin A. N Engl J Med. 2000;342:390-7. [ Links ]
80. Kyne L, Warny M, Qamar A, Kelly CP. Association between antibody response to toxin A and protection against recurrent Clostridium difficile diarrhoea. Lancet. 2001;357:189-93. [ Links ]
81. Karas JA, Enoch DA, Aliyu SH. A review of mortality due to Clostridium difficile infection. J Infect. 2010;61:1-8. [ Links ]
82. McFarland LV, Mulligan ME, Kwok RY, Stamm WE. Nosocomial acquisition of Clostridium difficile infection. N Engl J Med. 1989;320:204-10. [ Links ]
83. Kaatz GW, Gitlin SD, Schaberg DR, Wilson KH, Kauffman CA, Seo SM, et al. Acquisition of Clostridium difficile from the hospital environment. Am J Epidemiol. 1988;127:1289-94. [ Links ]
84. Fekety R, Kim KH, Brown D, Batts DH, Cudmore M, Silva J Jr. Epidemiology of antibiotic-associated colitis; isolation of Clostridium difficile from the hospital environment. Am J Med. 1981;70:906-8. [ Links ]
85. Rupnik M. Is Clostridium difficile -associated infection a potentially zoonotic and foodborne disease? Clin Microbiol Infect. 2007;13:457-9. [ Links ]
86. Songer JG, Anderson MA. Clostridium difficile : an important pathogen of food animals. Anaerobe. 2006;12:1-4. [ Links ]
87. Rodríguez-Palacios A, Stämpfli HR, Duffield T, Peregrine AS, Trotz-Williams LA, Arroyo LG, et al. Clostridium difficile PCR ribotypes in calves, Canada. Emerg Infect Dis. 2006;12:1730-6. [ Links ]
88. Keel K, Brazier JS, Post KW, Weese S, Songer JG. Prevalence of PCR ribotypes among Clostridium difficile isolates from pigs, calves, and other species. J Clin Microbiol. 2007;45:1963-4. [ Links ]
89. Wren M. Clostridium difficile isolation and culture techniques. Methods Mol Biol. 2010;646:39-52. [ Links ]
90. Tichota-Lee J, Jaqua-Stewart MJ, Benfield D, Simmons JL, Jaqua RA. Effect of age on the sensitivity of cell cultures to Clostridium difficile toxin. Diagn Microbiol Infect Dis. 1987;8:203-14. [ Links ]
91. George WL, Sutter VL, Citron D, Finegold SM. Selective and differential medium for isolation of Clostridium difficile . J Clin Microbiol. 1979;9:214-9. [ Links ]
92. Jousimies HR, Summanen P, Baron EJ, Citron DM, Wexler HM, Finegold SM. Wadsworth-KTL anaerobic bacteriology manual. 6th ed. Belmont, CA: Star Publishing, 2002. [ Links ].
93. Mundy LS, Shanholtzer CJ, Willard KE, Gerding DN, Peterson LR. Laboratory detection of Clostridium difficile . A comparison of media and incubation systems. Am J Clin Pathol. 1995;103:52-6. [ Links ]
94. Laughon BE, Viscidi RP, Gdovin SL, Yolken RH, Bartlett JG. Enzyme immunoassays for detection of Clostridium difficile toxins A and B in fecal specimens. J Infect Dis. 1984;149:781-8. [ Links ]
95. Aronsson B, Granström M, Möllby R, Nord CE. Enzyme immunoassay for detection of Clostridium difficile toxins A and B in patients with antibiotic-associated diarrhoea and colitis. Eur J Clin Microbiol. 1985;4:102-7. [ Links ]
96. Herrera-Cáceres JO, Camacho-Ortiz A, Galindo-Fraga A, Hernández- Durán M, Cordero-Rangel A, Hernández-Cruz A, et al. Concordance between two enzyme immunoassays for the detection of Clostridium difficile toxins. Arch Med Res. 2010;41:92-6. [ Links ]
97. Lyerly DM, Wilkins TD. Commercial latex test for Clostridium difficile toxin A does not detect toxin A. J Clin Microbiol. 1986;23:622-3. [ Links ]
98. Lyerly DM, Barroso LA, Wilkins TD. Identification of the latex test-reactive protein of Clostridium difficile as glutamate dehydrogenase. J Clin Microbiol. 1991;29:2639-42. [ Links ]
99. Kato N, Ou CY, Kato H, Bartley SL, Brown VK, Dowell VR Jr, et al. Identification of toxigenic Clostridium difficile by the polymerase chain reaction. J Clin Microbiol. 1991;29:33-7. [ Links ]
100. McMillin DE, Muldrow LL, Laggette SJ. Simultaneous detection of toxin A and toxin B genetic determinants of Clostridium difficile using the multiplex polymerase chain reaction. Can J Microbiol. 1992;38:81-3. [ Links ]
101. Wren B, Clayton C, Tabaqchali S. Rapid identification of toxigenic Clostridium difficile by polymerase chain reaction. Lancet. 1990;335:423. [ Links ]
102. Gal M, Northey G, Brazier JS. A modified pulsed-field gel electrophoresis (PFGE) protocol for subtyping previously non- PFGE typeable isolates of Clostridium difficile polymerase chain reaction ribotype 001. J Hosp Infect. 2005;61:231-6. [ Links ]
103. Janezic S, Rupnik M. Molecular typing methods for Clostridium difficile : pulsed-field gel electrophoresis and PCR ribotyping. Methods Mol Biol. 2010;646:55-65. [ Links ]
104. Clabots CR, Johnson S, Bettin KM, Mathie PA, Mulligan ME, Schaberg DR, et al. Development of a rapid and efficient restriction endonuclease analysis typing system for Clostridium difficile and correlation with other typing systems. J Clin Microbiol. 1993;31:1870-5. [ Links ]
105. Rupnik M, Avesani V, Janc M, Von Eichel-Streiber C, Delmée M. A novel toxinotyping scheme and correlation of toxinotypes with serogroups of Clostridium difficile isolates. J Clin Microbiol. 1998;36:2240-7. [ Links ]
106. Marsh JW, O'Leary MM, Shutt KA, Sambol SP, Johnson S, Gerding DN, et al. Multilocus variable-number tandem-repeat analysis and multilocus sequence typing reveal genetic relationships among Clostridium difficile isolates genotyped by restriction endonuclease analysis. J Clin Microbiol. 2010;48:412-8. [ Links ]
107. Huang H, Wu S, Wang M, Zhang Y, Fang H, Palmgren AC, et al. Clostridium difficile infections in a Shanghai hospital: antimicrobial resistance, toxin profiles and ribotypes. Int J Antimicrob Agents. 2009;33:339-42. [ Links ]
108. Goldenberg SD, Dieringer T, French GL. Detection of toxigenic Clostridium difficile in diarrheal stools by rapid realtime polymerase chain reaction. Diagn Microbiol Infect Dis. 2010;67:304-7. [ Links ]
109. De Boer RF, Wijma JJ, Schuurman T, Moedt J, Dijk-Alberts BG, Ott A, et al. Evaluation of a rapid molecular screening approach for the detection of toxigenic Clostridium difficile in general and subsequent identification of the tcdC ? 117 mutation in human stools. J Microbiol Methods. 2010;83:59-65. [ Links ]
110. Bidet P, Lalande V, Salauze B, Burghoffer B, Avesani V, Delmée M, et al. Comparison of PCR-ribotyping, arbitrarily primed PCR, and pulsed-field gel electrophoresis for typing Clostridium difficile . J Clin Microbiol. 2000;38:2484-7. [ Links ]
111. Killgore G, Thompson A, Johnson S, Brazier J, Kuijper E, Pépin J, et al. Comparison of seven techniques for typing international epidemic strains of Clostridium difficile : restriction endonuclease analysis, pulsed-field gel electrophoresis, PCRribotyping, multilocus sequence typing, multilocus variablenumber tandem-repeat analysis, amplified fragment length polymorphism, and surface layer protein A gene sequence typing. J Clin Microbiol. 2008;46:431-7. [ Links ]
112. Kuijper EJ, Van den Berg RJ, Brazier JS. Comparison of molecular typing methods applied to Clostridium difficile . Methods Mol Biol. 2009;551:159-71. [ Links ]
113. Kuijper EJ, Oudbier JH, Stuifbergen WN, Jansz A, Zanen HC. Application of whole-cell DNA restriction endonuclease profiles to the epidemiology of Clostridium difficile -induced diarrhea. J Clin Microbiol. 1987;25:751-3. [ Links ]
114. Marsh JW, O'Leary MM, Shutt KA, Pasculle AW, Johnson S, Gerding DN, et al. Multilocus variable-number tandem-repeat analysis for investigation of Clostridium difficile transmission in hospitals. J Clin Microbiol. 2006;44:2558-66. [ Links ]
115. Bidet P, Barbut F, Lalande V, Burghoffer B, Petit JC. Development of a new PCR-ribotyping method for Clostridium difficile based on ribosomal RNA gene sequencing. FEMS Microbiol Lett. 1999;175:261-6. [ Links ]
116. Burdon DW, Brown JD, Youngs DJ, Arabi Y, Shinagawa N, Alexander-Williams J, et al. Antibiotic susceptibility of Clostridium difficile . J Antimicrob Chemother. 1979;5:307-10. [ Links ]
117. Fekety R, Silva J, Armstrong J, Allo M, Browne R, Ebright J, et al. Treatment of antibiotic-associated enterocolitis with vancomycin. Rev Infect Dis. 1981;3 suppl:S273-81. [ Links ]
118. Teasley DG, Gerding DN, Olson MM, Peterson LR, Gebhard RL, Schwartz MJ, et al. Prospective randomized trial of metronidazole versus vancomycin for Clostridium difficile associated diarrhoea and colitis. Lancet. 1983;2:1043-6. [ Links ]
119. Bolton RP, Culshaw MA. Faecal metronidazole concentrations during oral and intravenous therapy for antibiotic associated colitis due to Clostridium difficile . Gut. 1986;27:1169-72. [ Links ]
120. Aas J, Gessert CE, Bakken JS. Recurrent Clostridium difficile colitis: case series involving 18 patients treated with donor stool administered via a nasogastric tube. Clin Infect Dis. 2003;36:580-5. [ Links ]
121. Lamontagne F, Labbé AC, Haeck O, Lesur O, Lalancette M, Patiño C, et al. Impact of emergency colectomy on survival of patients with fulminant Clostridium difficile colitis during an epidemic caused by a hypervirulent strain. Ann Surg. 2007;245:267-72. [ Links ]
122. John R, Brazier JS. Antimicrobial susceptibility of polymerase chain reaction ribotypes of Clostridium difficile commonly isolated from symptomatic hospital patients in the UK. J Hosp Infect. 2005;61:11-4. [ Links ]
123. Huang H, Weintraub A, Fang H, Wu S, Zhang Y, Nord CE. Antimicrobial susceptibility and heteroresistance in Chinese Clostridium difficile strains. Anaerobe. 2010;16:633-5. [ Links ]
124. Sánchez AL, Otero W, Caminos JE. Enfermedad asociada a Clostridium difficile : nuevas amenazas de un viejo enemigo. Gastroenterología. 2009:181. [ Links ]













