Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Infectio
versão impressa ISSN 0123-9392
Infect. vol.17 no.1 Bogotá jan./mar. 2013
CONSENSO
Consenso colombiano de neumonía nosocomial 2013☆ Abraham Alí Munive*, Guillermo Ortiz Ruiz y Carmelo Dueñas Castell de la Asociación Colombiana de Neumología y Cirugía de Tórax (ACNCT), la Asociación Colombiana de Medicina Crítica y Cuidado Intensivo (AMCI) y la Asociación Colombiana de Infectología (ACIN) ◊ Recibido el 2 de marzo de 2013; aceptado el 15 de marzo de 2013 Resumen La neumonía asociada al ventilador (NAV) y la neumonía nosocomial (NN), definidas como aquellas infecciones pulmonares adquiridas durante la ventilación mecánica, son entidades comunes en las unidades de cuidado intensivo; están asociadas a una alta morbimortalidad y complican la evolución de al menos 8 al 28% de los pacientes que reciben ventilación mecánica (VM). La incidencia de neumonía es considerablemente más alta en las unidades de cuidado intensivo que en los otros servicios hospitalarios y el riesgo es 3 a 10 veces mayor en los pacientes con intubación orotraqueal. A diferencia de otras infecciones nosocomiales, cuya mortalidad oscila entre 4 y 7%, la mortalidad por neumonía adquirida en las 48 horas posteriores a la intubación orotraqueal asciende a una mortalidad atribuible de 27,1%, con un riesgo relativo de 5,0. © 2013 ACIN. Publicado por Elsevier España, S.L. Todos los derechos reservados. PALABRAS CLAVE Infección hospitalaria; Neumonía; Neumonia asociada al ventilador Colombian Consensus on Nosocomial Pneumonia 2013 Abstract Ventilator-Associated Pneumonia (VAP) and Nosocomial Pneumonia (NP), defined as those lung infections acquired during mechanical ventilation, are common entities in intensive care units. They are associated with high morbidity and complicate the course of at least 8% to 28% of patients receiving mechanical ventilation (MV). The incidence of pneumonia is significantly higher in intensive care units (ICU) than in other hospital services and the risk is 3-10 times higher in patients with endotracheal intubation. Unlike other nosocomial infections with mortality ranging between 4% and 7%, mortality from pneumonia acquired in the 48 hours after intubation amounts to an attributable mortality of 27.1%, with an RR of 5.0. © 2013 ACIN. Publicado por Elsevier España, S.L. Todos los derechos reservados. KEYWORDS: Cross Infection; Pneumonia; Pneumonia, Ventilator-Associated Introducción Diferentes estudios han demostrado que el diagnóstico precoz y el tratamiento antimicrobiano adecuado mejoran los desenlaces clínicos, en especial la mortalidad (6). El panorama es aún más preocupante, al considerar que algunos trabajos recientes vinculan la presencia de neumonía asociada al ventilador (NAV) no solo con aumento en la mortalidad sino también con la prolongación de la estancia de los pacientes, tanto en la unidad de cuidados intensivos (UCI) como en el hospital, e incremento de los costos totales de la atención (alrededor de 40.000 dólares por episodio infeccioso). La ausencia de un "patrón de oro" para el diagnóstico de la NAV permanece como la gran limitante en la universalización de la definición, por lo que los datos de incidencia, prevalencia y mortalidad exhiben una gran variabilidad. Por definición, esta entidad corresponde a una inflamación del parénquima pulmonar causada por agentes infecciosos no presentes previamente o que están apenas incubándose en el momento de iniciarse la ventilación mecánica (VM); sin embargo, cuando se analizan estudios que incluyen información histopatológica es usual que aun en presencia de evidente inflamación del parénquima pulmonar los estudios microbiológicos sean negativos; tal circunstancia no ha permitido, hasta la fecha, establecer un consenso universal sobre los criterios diagnósticos. Es conveniente realizar una diferenciación entre la NAV temprana, es decir, aquella que tiene lugar durante los primeros 4 días después de iniciada la VM y la tardía, que se presenta después del cuarto día, pues existen diferencias importantes entre una y otra en términos de agentes causales, severidad y pronóstico. Los diferentes estudios han mostrado incidencias variables de esta entidad, que oscilan entre 9 y 64%, según el método diagnóstico utilizado, y la mortalidad asociada es alrededor de 25%. La intubación orotraqueal prolongada (definida como > 48 h) es el principal factor de riesgo para su desarrollo en los pacientes hospitalizados en las UCI, pues la incidencia de neumonía es 3 veces superior entre los individuos intubados, respecto a aquellos manejados con ventilación no invasiva. Cook et al. establecieron, en un gran estudio prospectivo de 1.014 pacientes ventilados, que si bien el riesgo acumulado de desarrollar NAV aumenta con el tiempo, el riesgo diario disminuye después de 5 días, pues en esta investigación, el riesgo por día fue de 3% al día 5, de 2% para el día 10 y de 1% al día 15, en tanto que los predictores independientes de desarrollo de esta complicación fueron: ingreso a la UCI por quemaduras o trauma, presencia de enfermedades respiratorias, cardíacas o del sistema nervioso central, VM durante las 24 h previas, broncoaspiración y uso de agentes paralizantes. De manera inesperada, los investigadores encontraron que la exposición previa a un antibiótico podría ser un factor protector inicial (RR 0,4; IC 95% 0,3-0,5) aunque dicha protección no se mantenía en el tiempo. En relación con la mortalidad atribuible a NAV, los porcentajes en las diferentes publicaciones son muy variables de acuerdo con el tipo de población, el método diagnóstico empleado y las condiciones patológicas asociadas, pero en términos generales, dicha complicación incrementa entre 2 y 10 veces la probabilidad de un desenlace fatal. Ello evidencia, entre otras cosas, la gran dificultad estadística para establecer la mortalidad atribuible a esta infección. Otros resultados de estudios de cohortes, que evalúan mortalidad y riesgo atribuible reportan una mortalidad por NAV superior a 25%, con un riesgo relativo de muerte de 5,0, cifras que aumentan, respectivamente, a 40% y 7,0, cuando las bacterias aisladas son Pseudomonas o Acinetobacter. Algunas condiciones vinculadas al aumento en el riesgo de muerte son: • Empeoramiento de la falla respiratoria existente • Presencia de una condición rápidamente fatal • Choque de cualquier origen • Inicio de terapia antibiótica inadecuada • Paciente manejado en UCI médica Criterios diagnósticos • La neumonía nosocomial (NN) es aquella que aparece a las 48 h de ingreso en el hospital. La neumonía asociada a ventilación mecánica (NAVM) es aquella que aparece después de 48 h de instaurada una vía aérea artificial. • Debe descartarse el diagnóstico de neumonía en ausencia de los criterios clínicos (criterios de Johanson). Evidencia según GRADE 1B. • Debe sospecharse el diagnóstico de NN en presencia de infiltrados en la radiografía de tórax, en conjunto con 2 de los siguientes criterios: fiebre o hipotermia, leucocitosis o leucopenia, secreciones purulentas y trastorno de oxigenación. Evidencia según GRADE 1B. • Se sugiere aplicar la escala de infección clínica pulmonar e iniciar antibióticos de forma inmediata si el resultado de esta es > 6, a todo paciente con sospecha de NN y asociada a ventilador. Evidencia según GRADE 1B. • Se debe hacer seguimiento con escala de infección clínica pulmonar al tercer día, y si es < 6, se deben descontinuar los antibióticos. Evidencia según GRADE 1B. • La procalcitonina y la PCR no son sensibles ni específicas para confirmar el diagnóstico de NN y, por lo tanto, no deben ser utilizadas para decidir el inicio o no de antibiótico. Evidencia según GRADE 1B. • La NN ha tenido varios enfoques en cuanto a su definición; los más utilizados están basados en la unión de criterios clínicos, hallazgos radiológicos y bacteriológicos y criterios de oxigenación. Clasificación • Se sugiere adaptar la clasificación de neumonía de inicio temprano y la neumonía de inicio tardío. • Se deben tomar en cuenta los factores de riesgo que se relacionan con mortalidad, entre los que cabe mencionar: antibiótico previo, momento del inicio de antibiótico, diferencias epidemiológicas locales, factores de riesgo relacionados con el huésped y diferenciar entre la NN en la UCI y no UCI. • La neumonía adquirida en comunidad es la segunda causa más frecuente de infección nosocomial, y corresponde a la cuarta parte de todas las infecciones en UCI. Neumonía de inicio temprano: cuando se presenta en los primeros 4 días de hospitalización (aunque este límite no está claramente definido), los gérmenes no son del entorno hospitalario ( Streptococcus pneumoniae, Haemophilus influenzae, Staphylococcus aureus sensible a meticilina, etc.). Neumonía de inicio tardío: cuando la neumonía se desarrolla después del cuarto día y, por tanto, los patógenos corresponden a los colonizados nosocomialmente. La verdadera utilidad de una clasificación de NN es determinar los factores relevantes que proveen cambios en mortalidad o en pronóstico. El enfoque terapéutico es totalmente diferente entre la NAV y la NN que no requiere UCI; en estos casos, la escogencia de un antibiótico adecuado disminuye la resistencia bacteriana. Gérmenes causales La información generada en el ámbito nacional sobre la etiología y perfiles de susceptibilidad antimicrobiana proviene en su mayoría de redes que incluyen hospitales de tercer nivel de las principales ciudades del país y en los últimos años de subsistemas de vigilancia de salud pública como el de la Secretaría Distrital de Salud y el Sistema Nacional de Vigilancia de infecciones asociadas a la atención en salud y resistencia bacteriana. La información consolidada ha permitido conocer el comportamiento general de organismos de origen hospitalario; la información específica sobre etiología y resistencia, según las principales patologías asociadas a la atención en salud, como en el caso de NN, es más limitada (tabla 1).
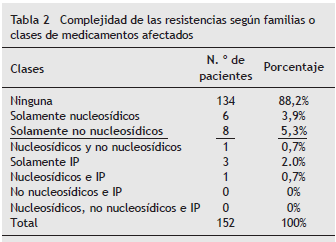
La dificultad en la interpretación de los resultados microbiológicos radica en la representatividad de las muestras que aseguren que los microorganismos corresponden a procesos infecciosos y no a colonización.
Cada institución debe contar con un sistema que le permita, a partir de la información del laboratorio, generar un consolidado de los datos de susceptibilidad antimicrobiana. Evidencia según GRADE 1B.
Los sistemas de colección, análisis de la información y difusión de esta deben ser estandarizados para generar un reporte o antibiograma acumulado que apoye la selección de la terapia empírica más adecuada.
Características del informe de antibiograma acumulado
• Debe hacerse como mínimo anualmente.
• Debe incluir únicamente los resultados finales de las pruebas de sensibilidad verificados y confirmados.
• Solo se debe incluir un aislamiento por paciente.
• Debe incluir los agentes antimicrobianos que se prueban de manera rutinaria en la institución.
• Debe informar porcentajes de sensibilidad y no incluir porcentajes de aislamientos intermedios al realizar el análisis.
• Debe incluir especies bacterianas cuyo número de aislamientos permita la representatividad en los análisis. De ser posible, incluir especies con 30 o más aislamientos para análisis generales de la institución.
• El antibiograma acumulado puede estratificarse por el tipo de localización o unidad donde se presenten el mayor número de casos y donde ayude, por ejemplo, a desarrollar los algoritmos de tratamiento.
Escanografía
La escanografía aporta información útil en pacientes en quienes no se ha cultivado germen, en aquellos con hallazgos inconclusos en otra modalidad de imagen, o con radiografías difíciles de interpretar, ya sea por mala técnica o por hallazgos inespecíficos. Evidencia según GRADE 2B.
La escanografía tiene mayor especificidad que la radiografía en la aproximación diagnóstica del agente etiológico, pero su costo es 12 veces superior al de una radiografía de tórax.
En pacientes mayores, postrados, con cifosis, debilidad muscular y problemas neurológicos, está limitada la inspiración forzada necesaria para una adecuada radiografía.
El neumococo es el agente causal más frecuente de consolidación lobar. Otros agentes que producen consolidación completa lobar son la Klebsiella pneumoniae y otros bacilos gramnegativos. Las neumonías redondas son más frecuentemente causadas por S. pneumoniae, y la bronconeumonía es más común por S. aureus y por H. influenza.
La escanografía puede demostrar con precisión la configuración y morfología del derrame pleural si corresponde a derrame pleural simple o tabicado. Además, es muy útil como guía para la realización de biopsias percutáneas en caso de que esta sea necesaria.
La radiología convencional sigue siendo el procedimiento inicial en el algoritmo para el diagnóstico de neumonía.
Mejor método de toma de muestras
No existen patrones de referencia "únicos" establecidos (Gold standard) para el diagnóstico de la NN.
Se recomienda la realización de pruebas diagnósticas invasivas (fibrobroncoscopia con lavado broncoalveolar [LBA]) en el paciente con sospecha diagnóstica de NAV. Evidencia según GRADE 2C.
Si no existe el recurso humano o técnico disponible para la realización de pruebas invasivas, se recomienda la toma de aspirado traqueal en el paciente con sospecha diagnóstica de NAV. Evidencia según GRADE 2B.
No se recomienda la realización de cultivo de esputo en pacientes con sospecha diagnóstica de NN no asociada a la VM. Evidencia según GRADE 1B.
Se recomienda la realización de pruebas diagnósticas invasivas (fibrobroncoscopia con LBA) en el paciente con sospecha diagnóstica de NN no asociada a la VM en quienes la evolución clínica es inadecuada a pesar de un tratamiento antibiótico dirigido de acuerdo con la epidemiología local de cada institución. Evidencia según GRADE 1B.
La realización de pruebas invasivas ciegas puede ser llevada a cabo en pacientes con lesiones pulmonares difusas y que no hayan recibido tratamientos antibióticos previos. Evidencia según GRADE 2C.
La identificación microbiológica se ha convertido en uno de los pilares de los programas de control y optimización del uso de antibióticos.
Deben realizarse siempre cultivos cuantitativos y considerarse su significancia a partir de un valor mayor a 10 6 UFC/ml.
El LBA es bien tolerado. Los efectos adversos más frecuentemente observados están en relación con el deterioro de la oxigenación y el umbral diagnóstico aceptado es 10 4 de al menos 1 de los gérmenes aislados.
El uso de las técnicas ciegas se limita a pacientes con compromiso pulmonar difuso, en especial de lóbulos inferiores, y que no hayan recibido tratamiento antibiótico previo.
Lavado broncoalveolar negativo o subumbral
El LBA cuantitativo es un método confiable para el diagnóstico de la NAV. Sin embargo, hay una tasa de falsos negativos que va del 10 al 15%, especialmente en estafilococos o gérmenes nosocomiales gramnegativos. Evidencia según GRADE 2B.
Los falsos negativos, generalmente ocurren en el período posterior a la primera semana de hospitalización. Evidencia según GRADE 2B.
Los pacientes que reúnan los criterios clínicos para el diagnóstico de NAV, que tengan más de una semana de hospitalización y en quienes se demuestre el crecimiento de alguno de estos microorganismos (con cualquier fuerza de crecimiento) deben ser sometidos a evaluación cuidadosa y tenidos en cuenta para recibir terapia antimicrobiana continuada. Evidencia según GRADE 2B.
Es importante tener en cuenta en pacientes con lavado cuantitativo subumbral la modificación o suspensión del tratamiento antibiótico, el uso previo de antibióticos, la alta o baja probabilidad clínica de neumonía, la presencia de otras infecciones concomitantes o causas de respuesta sistémica inflamatoria de causa no infecciosa. Evidencia según GRADE 2B.
La demora en el inicio de una adecuada terapia antimicrobiana se asocia con peores desenlaces clínicos.
En la fase temprana de la hospitalización (menos de 7 días), los microorganismos cultivados con fuerza umbral o subumbral son los adquiridos en la comunidad, que son más sensibles. A medida que la duración de la hospitalización se aleja de la primera semana, los microorganismos cultivados empiezan a ser los nosocomiales, más difíciles de tratar/erradicar.
Factores de riesgo que hacen el abordaje diferente
Los pacientes con diagnóstico de NN requieren un abordaje terapéutico que cubra patógenos multirresistentes (MDR). Evidencia según GRADE 1B.
El uso previo de antibióticos como ciprofloxacina, cefalosporinas y carbapenems anti- pseudomonas impacta significativamente en los patrones de susceptibilidad antimicrobiana y en la etiología, llevando a un predominio de bacilos gramnegativos. Evidencia según GRADE 1B.
Pacientes con tratamientos prolongados o ciclos múltiples de polimixina B/colistina tienen riesgo de infección con Burkholderia cepacia y Stenotrophomonas maltophilia. Evidencia según GRADE 1B.
Los pacientes hospitalizados en instituciones con alta prevalencia de gramnegativos no fermentadores como Pseudomonas y Acinetobacter tienen riesgo de colonización e infección por estos microorganismos. Evidencia según GRADE 1B.
El abordaje inicial debe ajustarse con los resultados de los cultivos y antibiogramas para individualizar los casos y disminuir la presión selectiva que ejerce el uso de antibióticos de amplio espectro. Evidencia según GRADE 1B.
El conocimiento de la epidemiología local es la piedra angular para la toma de decisiones. Evidencia según GRADE 1B.
Se deben considerar factores como perfiles de susceptibilidad individual, epidemiología local, comorbilidades y posibles limitaciones técnicas en los procedimientos para el abordaje etiológico y de diagnóstico.
La estratificación del riesgo para P. aeruginosa de acuerdo con el uso de antibiótico previo presenta un odds ratio de 11,0 para fluoroquinolonas; con dispositivos invasivos como VM tiene un odds ratio de 27 y ubicación del paciente un odds ratio 17 para estancia en UCI.
Papel de muestras semicuantitativas y su relación con las cuantitativas
En el diagnóstico de NN y NAVM, todas las muestras del tracto respiratorio inferior pueden ser enviadas a cultivo. Evidencia según GRADE 1C.
Los estudios broncoscópicos y no broncoscópicos, así como las muestras cuantitativas y semicuantitativas derivadas de ellos son aceptables, y a pesar de tratarse de métodos diagnósticos, no se han hallado, en general, diferencias en cuanto a mortalidad, tiempo de estancia hospitalaria o días de VM en los pacientes en los que unos u otros han sido empleados. Evidencia según GRADE 1C.
En consecuencia, la elección dependerá de la disponibilidad del recurso humano y técnico necesario en cada caso. Sin embargo, cuando este se encuentre disponible, deben preferirse los cultivos cuantitativos, pues permiten un mayor ajuste y uso más apropiado de los antibióticos que puede contribuir a que se minimice el impacto sobre la resistencia microbiana. Evidencia según GRADE 1C.
Las muestras cuantitativas se interpretan como positivas si hay crecimiento en el cultivo de 10 6 en especímenes obtenidos por aspirado traqueobronquial, 10 4 para el LBA y 10 3 UFC/ml con cepillo protegido.
El crecimiento microbiano en las muestras semicuantitativas usualmente se reporta como ninguno, leve, moderado o severo si es apreciable a partir del segundo cuadrante de la siembra; es razonable considerar las muestras con resultado moderado o severo como positivas para el diagnóstico.
En comparación con los cultivos cuantitativos, los semicuantitativos tienen menor capacidad para discriminar entre colonización o infección de la vía aérea inferior y pueden condicionar el uso innecesario de antibióticos. Sin embargo, este hecho se compensa con la mayor sensibilidad de la técnica.
Puede ser apropiado considerar como significativo un crecimiento microbiano inferior a los puntos de corte establecidos cuando el riesgo de pasar por alto un diagnóstico de neumonía sea mayor que la posibilidad de ofrecer un tratamiento antibiótico no indicado.
Para el diagnóstico microbiológico de la NAVM los estudios broncoscópicos y no broncoscópicos, así como los cultivos cuantitativos o cualitativos son de utilidad, y su utilización no modifica la mortalidad ni otros desenlaces clínicos como días de VM o estancia en UCI.
Los métodos cuantitativos parecen permitir un uso más juicioso de los antibióticos que podría, eventualmente, tener impacto en la reducción de los costos de la atención médica y la generación de resistencia microbiana.
Papel de los hemocultivos
A pesar de que los hemocultivos son negativos en la mayoría de los casos de NN, cuando estos son positivos tienen alto impacto en mortalidad, estancia hospitalaria y mayores índices de severidad, por tanto está indicado solicitarlos ante este diagnóstico. Evidencia según GRADE 2B.
Existen factores de riesgo para tener hemocultivos positivos en NN: edad avanzada, patología médica, estar infectado por S. aureus resistente a meticilina o Acinetobacter baumannii y la mayor duración en VM. Evidencia según GRADE 2B.
La NAV es junto a la bacteriemia la infección nosocomial más frecuente en los pacientes críticos, y se asocia a importante morbimortalidad.
Medidas multisistémicas
Recomendamos los cristaloides como los líquidos de elección en la resucitación. Esto, basado en la ausencia de un beneficio claro con la administración de coloides en comparación con los cristaloides, junto con un incremento asociado en sus costos. Evidencia según GRADE 1B.
No recomendamos el uso de almidones tipohydroxyethylstarches para la reanimación con líquidos. Evidencia según GRADE 1B.
Recomendamos el uso de la albúmina cuando los pacientes requieren considerables cantidades de cristaloides durante la resucitación. Evidencia según GRADE 1B .
En pacientes con NAV que desarrollan síndrome de distrés respiratorio agudo (SDRA), el uso de una estrategia conservadora de fluidos mejora la oxigenación, acorta la duración de la VM y de la estancia hospitalaria en cuidados intensivos, aunque no disminuya su mortalidad. Evidencia según GRADE 1B.
Administración de la alimentación oral o enteral (si es necesario) según tolerancia, en lugar de ayuno completo o de solo dextrosa intravenosa, dentro de las primeras 48 h del diagnóstico de NN. Evidencia según GRADE 1B.
Evitar la alimentación calórica total en la primera semana en los pacientes con NN y sepsis severa; más bien, una dosis baja de alimentación (por ejemplo, hasta 500 kcal por día). Evidencia según GRADE 1B.
Utilizar la glucosa intravenosa y la nutrición enteral en lugar de la parenteral total en los primeros 7 días después de un diagnóstico de NN con sepsis severa o choque séptico. Evidencia según GRADE 1B.
No recomendamos utilizar nutriciones con inmunomodulador en pacientes con NN. Evidencia según GRADE 1B.
La estrategia de VM con bajos volúmenes pulmonares ha mejorado la sobrevida en el SDRA.
Se recomienda, por lo tanto, una estrategia de protección pulmonar en la NN asociada a SDRA. Evidencia según GRADE 1B.
Se recomienda una estrategia de protección pulmonar con presión positiva al final de la espiración alta en la NN asociada a SDRA moderado o severo. Evidencia según GRADE 1B.
Corticoides para el tratamiento
No se recomiendan los corticoides en el manejo de NN o NAVM, pues se asocian a aumento en la mortalidad. Evidencia según GRADE 1B.
En cuidado intensivo existen indicaciones en las cuales se ha demostrado ampliamente que el uso de corticoides mejora la respuesta clínica, como son el choque séptico que no responde a reanimación con cristaloides y a vasopresores, y las exacerbaciones agudas de la enfermedad pulmonar obstructiva crónica, como lo demuestran las más recientes guías publicadas.
La evidencia disponible sugiere que el uso de corticoides en manejo de la NAV aumenta la mortalidad a los 28 días, y la incidencia de infecciones pulmonares por hongos y bacterias MDR.
Mejor método de ventilación mecánica en un paciente con diagnóstico de neumonía nosocomial
Se recomienda la VM protectora "profiláctica" con volúmenes corrientes de 6-8 ml/kg (peso ideal). Evidencia según GRADE 1B.
Se recomienda la VM con una presión positiva al final de la espiración inicial de 8 cm titulada de acuerdo con el comportamiento de la oxigenación de cada paciente. Evidencia según GRADE 2B.
La humidificación es un factor clave para disminuir el riesgo utilizados en conjunto con altas frecuencias respiratorias.
Factores que orientan la selección de antibióticos de modo empírico
La terapia empírica debe ajustarse idealmente según los perfiles locales de susceptibilidad si están disponibles. Evidencia según GRADE 1C.
La terapia empírica combinada contra Pseudomonas no ha demostrado ser superior a la monoterapia. Evidencia según GRADE 1A.
Se recomienda adicionar un aminoglucósido (amikacina o tobramicina) a la terapia empírica inicial (idealmente un betalactámico) en el paciente en choque séptico . Evidencia según GRADE 1C.
Se recomienda cubrimiento de enterobacterias BLEE en pacientes expuestos previamente a antibióticos o si la prevalencia local de este tipo de enterobacterias es elevada. Evidencia según GRADE 1C.
No se recomienda cubrimiento empírico contra S. aureus meticilino resistente dada la baja prevalencia en nuestro medio. Evidencia según GRADE 1C.
En nuestro medio se desaconseja el manejo con fluoroquinolonas por la elevada resistencia de enterobacterias y Pseudomonas a esta clase de antibióticos, además del impacto que tienen sobre la flora bacteriana de la institución y del paciente.
Tratamiento empírico sugerido en nuestro país y situaciones especiales en que no se aplica
Se recomienda que el tratamiento empírico se ajuste a los microorganismos y patrones de resistencia locales. Evidencia según GRADE 1C.
La elección de la terapia empírica inicial debe ser recomendada o revisada por infectología o el comité de infecciones institucional. Evidencia según GRADE 1C.
La terapia definitiva debería ser determinada por los resultados de cultivo y susceptibilidad. Evidencia según GRADE A.
Para pacientes con infección temprana (< 5 días desde el ingreso en el hospital) que no han recibido previamente antibióticos y en ausencia de otros factores de riesgo, el uso de amoxacilina-clavulanato o cefuroxime debería ser apropiado. Evidencia según GRADE BPC.
Para pacientes con inicio temprano (< 5 días desde el ingreso en el hospital) que han recibido antibióticos recientemente y que tienen otros factores de riesgo, una cefalosporina de tercera generación (cefotaxime o ceftriaxona), una fluoroquinolona o piperacilina/tazobactam serían apropiadas. Evidencia según GRADE BPC.
Tiempo para inicio de tratamiento antibiótico
En pacientes con sepsis secundaria a NN se debe iniciar antibiótico en la primera hora. Evidencia según GRADE 1C.
En pacientes con choque séptico, se debe iniciar tratamiento antibiótico en la primera hora. Evidencia según GRADE 1B.
El inicio adecuado de tratamiento antibiótico en los pacientes con NN, NAV y neumonía asociada al cuidado de la salud ha demostrado mejoría significativa en la mortalidad.
El inicio tardío o inadecuado de tratamiento antibiótico incrementa la posibilidad de desenlaces que empeoran el pronóstico clínico y aumentan la mortalidad.
El retraso en el inicio del tratamiento antibiótico empírico hasta la obtención de los resultados del cultivo se asocia con peores desenlaces (5) en términos de estancia y recursos en UCI.
La evidencia existente acerca del tratamiento adecuado y el impacto del retraso en el inicio de tratamiento antibiótico establece las primeras 24 h como límite a partir del cual se incrementa la mortalidad en los pacientes con NN.
El retraso en el inicio del tratamiento de la neumonía aumenta el riesgo de muerte en neumonía adquirida en la comunidad y nosocomial.
Principios farmacocinéticos/farmacodinámicos específicos que se han de tener en cuenta para el tratamiento
Sí hay evidencia de principios específicos para tener en cuenta en pacientes con NN.
La NN, usualmente ocurre en pacientes muy enfermos, en los cuales hay cambios fisiológicos que alteran los parámetros farmacocinéticos, principalmente la depuración y el volumen de distribución de los antibióticos. De otro lado, hay evidencia de la existencia de diferencias farmacodinámicas entre los distintos grupos de antibióticos.
Basado en estos principios, es posible conseguir la optimización del efecto antimicrobiano así:
• Para antibióticos dependientes de la concentración área bajo la curva/concentración inhibitoria mínima como aminoglucósidos y fluoroquinolonas se conseguirá el mejor efecto utilizando las dosis más altas descritas.
• Para antibióticos tiempo/concentración inhibitoria mínima como los betalactámicos se conseguirá el mejor efecto utilizando infusiones continuas o extendidas hasta que se conozca el MIC del germen. Para el cálculo de la duración de la infusión se debe tener en cuenta la estabilidad del betalactámico y la temperatura ambiental de cada sitio. Evidencia según GRADE 1B.
La farmacocinética se encarga de estudiar los procesos mediante los cuales un fármaco tiene cambios en la concentración en los diferentes compartimientos del organismo, a través del tiempo. Este proceso incluye la liberación, absorción, distribución, metabolismo y depuración del fármaco.
La farmacodinamia se refiere a la relación entre la concentración del fármaco y su efecto, incluyendo el tiempo y la intensidad, tanto de los efectos terapéuticos como de las reacciones adversas.
El conocimiento de las características farmacocinéticas/ farmacodinámicas permite optimizar el tratamiento de los pacientes con NN.
Utilidad al adicionar macrólidos al manejo
Adicionar macrólidos al manejo de la NN no se recomienda como una estrategia de uso rutinario. Evidencia según GRADE 1B.
No hay estudios clínicos abiertos en la actualidad que determinen la utilidad de macrólidos en NAV.
Utilidad de los antibióticos inhalados en el tratamiento
De acuerdo con la evidencia actual, los antibióticos inhalados y específicamente colistina y tobramicina pueden ser de utilidad para el tratamiento de NN por gérmenes gramnegativos MDR como coadyuvante a terapia intravenosa. Evidencia según GRADE IIC.
Se requieren estudios controlados aleatorizados para poder evaluar la verdadera eficacia y seguridad de estos fármacos en el tratamiento de NN.
En teoría, un antibiótico inhalado ideal debe cumplir con las siguientes características: penetrancia, no ser inhibido por el esputo, estabilidad térmica durante la aerolización, costo-efectivo, mínima presencia de tos o broncoespasmo, ausencia de exposición sistémica y bajo riesgo ambiental.
Diferencias en la duración del tratamiento de acuerdo con el germen aislado
No hay diferencia en los resultados finales al administrar un curso corto de terapia antimicrobiana cuando se compara contra cursos prolongados. Evidencia según GRADE 1B.
Tradicionalmente, se ha considerado una duración diferencial en el tratamiento de la NN de acuerdo con el tiempo de aparición, basado en la frecuencia incrementada de bacilos gramnegativos no fermentadores en las neumonías de aparición tardía. Esto hace que se sugieran 8 a 10 días para las neumonías de aparición temprana y hasta 21 días para las de aparición tardía.
Seguridad al implementar la terapia antibiótica secuencial o terapia switch (cambio en vía de administración de venosa a oral)
No se ha establecido suficiente evidencia que justifique la terapia secuencial antibiótica (terapia switch ) en el manejo de la NN. Esta decisión debe ser tomada individualizando cada caso, de acuerdo con patrones locales de resistencia, respuesta clínica terapéutica y presencia de perfil microbiológico. Evidencia según GRADE 1C.
Dentro de los beneficios aportados por la terapia secuencial en el manejo de la NN está acortar el tiempo de estancia hospitalaria al facilitar el manejo ambulatorio mediante la ruta oral, disminuyendo el riesgo de daño colateral o resistencia antibiótica, no hay evidencia sustentada mediante ensayos clínicos con óptima asignación aleatoria o enmascaramiento ni tampoco revisiones sistemáticas o metanálisis.
Implementar la terapia secuencial debe partir de cada grupo tratante, individualizando la atención de cada caso, considerando, además, el conocimiento de la flora local en caso de NN temprana y sin factores de riesgo para gérmenes resistentes, y apoyados en datos microbiológicos en casos de NN de aparición tardía o asociada a riesgo de bacterias problema, siempre y cuando se establezca la ausencia de bacteriemia agregada.
Manejo antibiótico sugerido en las situaciones en las que hay aislamiento de gérmenes y necesidad de reconsiderar el manejo
Una vez se tiene el resultado microbiológico del o los gérmenes causantes de la NN, se recomienda ajustar la terapia teniendo en cuenta el antibiótico de elección para dicho germen, el antibiograma, las comorbilidades del paciente, los conceptos de farmacocinética y farmacodinamia y las interacciones con los demás medicamentos que esté recibiendo el paciente.
La subsecuente modificación del tratamiento con base en el resultado del cultivo no ha demostrado disminución de la mortalidad, pero sirve para contener la resistencia de los gérmenes hospitalarios, reduce costos y mejora la epidemiología local a largo plazo.
En los casos en los que se presente aislamiento de A. baumannii o bacterias Klebsiella Pneumoniae Carbapenemasa, la tigeciclina es una alternativa en terapia combinada. Evidencia según GRADE 2B.
Se recomienda que la terapia dirigida para gérmenes MDR sea seleccionada con la participación de un especialista en enfermedades infecciosas.
En neumonía por P. aeruginosa , se recomienda dar terapia combinada entre los días 3 y 5 del tratamiento, principalmente si hay bacteriemia concomitante o sepsis severa, con el fin de evitar el desarrollo de resistencia.
La terapia combinada para Pseudomona debe incluir un betalactámico elegido según las pruebas de sensibilidad y prefiriendo el de menor espectro y concentración inhibitoria mínima más baja, sumado a un aminoglucósido. La combinación betalactámico con quinolona si el aminoglucósido está contraindicado.
Se debe recordar que ertapenem carece de actividad frente a P. aeruginosa .
El uso de colistina o polimixina B está indicado cuando Pseudomonas es resistente a betalactámicos anti- pseudomonas , carbapenems y quinolonas.
Colistina debe iniciarse siempre en terapia combinada. Evidencia según GRADE 1B.
Para el A. baumannii , los antibióticos más activos son quinolonas, carbapenems, sulbactam, colistina y polimixina.
Para la Enterobacteriaceae sensible a penicilinas debe utilizarse la de más corto espectro.
Para Enterobacteriacea productora de BLEE, los antimicrobianos más activos son los carbapenems y las quinolonas. Evidencia según GRADE 1B.
El antibiótico de elección para el tratamiento de NN S. maltophilia es trimetoprim-sulfametoxazol. Evidencia según GRADE 1B.
Para S. aureus meticilino resistente, uso de vancomicina y en riesgo de falla renal o que estén recibiendo otro medicamento nefrotóxico que no pueda ser suspendido usar linezolid.
Para Enterococcus resistente a vancomicina, el tratamiento ideal es ampicilina, y en caso de resistencia o presencia de Enterococcus faeciuma debe utilizarse vancomicina.
El aislamiento de Candida albicans y otras especies de los aspirados endotraqueales es común, pero usualmente representa colonización de la vía aérea, y rara vez se requiere tratamiento antifúngico. Para el tratamiento de Aspergillus , el voriconazol es el tratamiento de elección.
La mejoría clínica toma usualmente 48 a 72 h, por tanto, la terapia no debería ser cambiada a menos que se observe un rápido deterioro en el paciente.
Medidas de prevención que deberían utilizarse en la práctica clínica
La neumonía asociada a la ventilación mecánica (NAVM) es una causa importante de morbilidad, mortalidad y costos; la prevención de esta complicación infecciosa es un reto importante.
El efecto beneficioso de la VMNI en la supervivencia del paciente se ha demostrado en estudios aleatorizados. Evidencia según GRADE 1A.
No se recomiendan los protocolos de destete e interrupción de sedación de forma rutinaria en todos los pacientes ventilados con la intención de prevenir NAV. Evidencia según GRADE 2B.
Se podría pensar en utilizar si se agotan todas las otras medidas efectivas de prevención. Incrementa costos y no es accesible en nuestro medio fácilmente. Evidencia según GRADE 2B.
En un reciente metanálisis de Muscedere et al., 13 de ellos, ensayos clínicos aleatorizados, se confirmó que el drenaje de la secreción subglótica no solo era eficaz para la prevención de la NAV entre los pacientes > 24 h en VM, sino que también se asocia con una reducción de la duración de la estancia en la UCI, reducción de la duración de la VM y un aumento del tiempo para el primer episodio de NAV. Ningún efecto sobre mortalidad en el hospital y en la UCI. Evidencia según GRADE 1B.
Mantener la presión del Cuff entre 20-30 cm H 2 O previene el escape de secreciones orotraqueales y contenido gástrico. Evidencia según GRADE 2C.
Una reciente revisión sistemática y metanálisis evaluó el efecto de la descontaminación oral con clorhexidina, el antiséptico principal evaluado, en la incidencia de NAV y otros resultados. Evidencia según GRADE 1B.
Medidas de control que deberían utilizarse en la práctica clínica
Se requiere que todos los hospitales tengan un grupo o comité de control de infecciones, el cual es el encargado de la vigilancia de infecciones nosocomiales. Es un estándar de calidad hospitalaria.
En las UCI se debe realizar vigilancia activa de las infecciones asociadas a la atención en salud, en especial de las infecciones asociadas a dispositivos, entre ellas NAV.
Cada mes, se debe realizar la medición de la tasa de NAV. Esta es una tasa de infección ajustada por el tiempo de VM, y no por el número de pacientes en VM.
La tasa de NAV se calcula: # infecciones por NAV/1.000 días de ventilación.
Tasa de utilización de ventilación mecánica (= # días VM/total días paciente). Este indicador sirve para saber si hay sobreuso o subuso de VM.
Se recomienda hacer una comparación mensual para ver la tendencia de la unidad.
Es recomendable hacer comparaciones o Benchmarking con referentes internacionales, nacionales o locales. Evidencia según GRADE 1A.
Este consenso recomienda continuar con la definición de vigilancia de NAV establecida por CDC 2012, ya que el Ministerio de Salud y el Instituto Nacional de Salud iniciaron la notificación de infecciones asociadas a dispositivos con estas definiciones. Sin embargo, este conceso recomienda fuertemente la utilización de estas nuevas definiciones NHSN/CDC 2013 de acuerdo con los recursos de cada institución.
Vigilar variables de proceso como el cumplimiento de normas de prevención de infecciones podría impactar tempranamente en la reducción de las tasas de infección, y la vigilancia activa (in vivo) de adherencia a normas de prevención podría reducir aún más la tasa de infección. Este tipo de vigilancia la denominamos supervisión. Evidencia según GRADE 1B.
Los pacientes con riesgo de NAV deben ser abordados con una serie o conjunto de medidas preventivas (bundle) para tener un mayor impacto. Evidencia según GRADE 1B.
La supervisión puede dirigirse a normas generales de control de infecciones como la higienización de manos, o el cumplimiento de normas de aislamiento de contacto, o dirigirse a cumplimiento de bundles específicos para prevenir NAV. Usualmente, ambas complementan la acción de prevención de infecciones. Evidencia según GRADE 1B.
Lo importante es recordar que el personal se debe adherir al cumplimiento de un paquete o bundle y la supervisión debe ser activa. Evidencia según GRADE 1B.
El seguimiento de los organismos MDR y su asociación a la infección ayuda a evaluar las tendencias locales y los cambios en la incidencia de estos patógenos y las infecciones relacionadas.
Esta vigilancia de organismos MDR no tiene un impacto directo en el número de neumonías totales, pero orienta la adecuada escogencia antibiótica empírica y puede tener un impacto importante en morbilidad y mortalidad de NAV. Evidencia según GRADE 1C.
La vigilancia del consumo de antibióticos es importante complemento a la vigilancia de resistencia bacteriana.
Uso adecuado de antibióticos, en términos de tener guías de prescripción de antibióticos y la adherencia a las mismas. Evidencia según GRADE 1C.
Utilidad de las vacunas
Las vacunas contra el virus de la influenza y el neumococo podrían ser útiles en la prevención de la neumonía temprana.
El mayor impacto se ha visto en adultos mayores en el escenario de hogares geriátricos y hospitales para pacientes crónicos.
La inmunización contra la influenza y el neumococo en pacientes de alto riesgo en adultos es recomendable según las guías nacionales, como medida de disminución de la neumonía adquirida en la comunidad y posiblemente NN temprana. Evidencia según GRADE 1C.
La inmunización anual contra influenza de los trabajadores de la salud involucrados con los pacientes. Evidencia según GRADE 1C.
¿Disminuye el riesgo de neumonía la ventilación mecánica no invasiva?
La utilización de la VM no invasiva ha cobrado gran aceptación en las UCI y la principal razón considerada es la disminución en el riesgo de NN asociada a la VM. Evidencia según GRADE 1C.
La VM no invasiva tiene unas indicaciones específicas para su aplicación y quizá estas son per se indicativas de un grupo de pacientes con menores índices de severidad.
Participación de terapeutas respiratorios y fisioterapeutas en la reducción de neumonía nosocomial
Sí se recomienda la participación de terapeutas respiratorios y fisioterapeutas en el manejo de los pacientes en VM, ya que su intervención en la aplicación de protocolos reduce la frecuencia de NAV. Evidencia según GRADE 1C.
Realizan una adecuada higiene bronquial, optimizan la oxigenación, mejoran el volumen pulmonar y previenen complicaciones respiratorias, que en el paciente intubado son de especial interés pues se presentan alteraciones en el aclaramiento de las secreciones, que lleva a la retención de esputo, aumento de la resistencia de la vía aérea y del trabajo respiratorio y mayor riesgo de presentar NAV.
La terapia respiratoria realizada por las fisioterapeutas o terapeutas respiratorios es de trascendental importancia. Evidencia según GRADE 1C.
Papel de la succión cerrada en la prevención de la neumonía asociada a ventilación mecánica
La evidencia disponible hasta el momento no ha demostrado que la succión cerrada reduzca la frecuencia de NAV. Evidencia según GRADE 1B.
La aspiración endotraqueal se realiza en pacientes intubados con VM como una parte rutinaria de la atención esencial para eliminar las secreciones endotraqueales.
La comparación de los sistemas de succión abierta y cerrada muestra que tienen efectos similares en términos de seguridad y eficacia.
El catéter de succión cerrada tiene varios efectos benéficos en el paciente en VM, especialmente en pacientes con presión positiva al final de la espiración alta, con SDRA y en quienes abrir los circuitos del ventilador pueda generar problemas como de reclutamiento, atelectasias, etc. Sin embargo, hasta el momento, los sistemas de succión cerrada no previenen la NAV.
La succión subglótica cumple un papel preventivo
Se recomienda el uso de tubos con succión subglótica en los pacientes que se presuma requerirán VM por más de 3 días. Evidencia según GRADE 1A.
La aspiración de secreciones que contengan bacterias patógenas en el tracto superior es la principal causa de la NAV.
Los tubos endotraqueales con drenaje de secreción subglótica pueden disminuir potencialmente la incidencia de la NAV.
Su uso puede estar asociado con la reducción de la duración de la VM y eventualmente con la estancia en UCI.
Uso de descontaminación selectiva como papel preventivo
La descontaminación selectiva como una medida para evitar la aparición de NN no se recomienda como una estrategia de uso rutinario, por su riesgo latente de inducción de resistencia antimicrobiana. Evidencia según GRADE 1B.
¿ Cuál es el medicamento de elección para la profilaxis de sangrado de vías digestivas teniendo en cuenta el riesgo de neumonía nosocomial: ranitidina, sucralfate u omeprazol ?
La profilaxis con medicamentos para el sangrado de vías digestivas debe hacerse orientada al riesgo del paciente. Evidencia según GRADE 1B.
Ante la necesidad de escoger uno de los medicamentos, se recomienda implementar la utilización de inhibidores de la bomba de protones en todos aquellos pacientes de riesgo alto de sangrado de vías digestivas. Evidencia según GRADE 1B.
En todos aquellos casos en los que el riesgo de sangrado digestivo sea bajo no se recomienda la utilización de profilaxis. Evidencia según GRADE 1B.
Se recomienda el inicio temprano de la nutrición enteral, que por sí sola puede reducir el riesgo de sangrado gastrointestinal, especialmente en el grupo de pacientes de bajo riesgo, y que posiblemente no se benefician de profilaxis. Evidencia según GRADE 1C.
Siempre que sea clínicamente apropiado, se debe evitar la profilaxis de úlcera de estrés para ayudar a preservar la función gástrica.
Papel de los paquetes de atención en el control de la neumonía nosocomial
Bundle o paquete de atención es una ayuda para el personal de la salud, que contiene el mejor cuidado posible para un paciente con un tratamiento particular con riesgos inherentes. Además, es una forma estructurada de mejoramiento en el proceso de cuidado de los pacientes: práctica basada en la videncia (nivel 1) pequeña y sencilla, generalmente 3 a 5, que usada colectivamente mejora el desenlace del paciente; son una serie de intervenciones obtenidas de guías basadas en evidencia científica que cuando son aplicadas en conjunto mejoran la calidad de la atención y evolución de los enfermos.
Los paquetes de atención descritos en la literatura incluyen diferentes medidas de prevención que han demostrado impacto en la disminución de la tasa de neumonía, así como en otros desenlaces como tiempo de VM, menor uso de antibiótico y reducción en estancia hospitalaria, pero no en mortalidad. Evidencia según GRADE 1B.
Se recomienda como paquete de atención: higiene de manos, elevación de la cabecera 30-45º, enjuague oral con clorhexidina, uso de un protocolo de sedación y destete, aspiración de secreciones subglóticas y no realizar cambio del circuito del ventilador de manera rutinaria. Evidencia según GRADE 1B.
Se hace necesario que estas medidas no sean implementadas de manera independiente, sino que las intervenciones formen parte de un paquete de cuidado con el fin de mejorar la calidad de atención y dichos desenlaces. Además, se requiere mantener tasas de adherencia que garanticen su cumplimento, integrando a todo el equipo de trabajo que forma parte del tratamiento de los pacientes, para obtener mejores resultados en el control de la infección nosocomial. Evidencia según GRADE 1B.
Se recomienda, por lo tanto, que la profilaxis para TVP se haga desde la admisión, de ser posible, o tener presente los dispositivos de comprensión en el caso de pacientes con alto riesgo de sangrado, en el cual los anticoagulantes estén contraindicados.
Aplicar profilaxis para úlcera péptica de estrés es necesario como intervención en el paciente crítico, pues es la causa más frecuente de sangrado digestivo en la UCI, y se relaciona con una mortalidad 5 veces mayor que en el paciente en el cual no ocurre.
Pronóstico de mortalidad de la enfermedad y qué factores generan diferencia
Aunque existe controversia sobre si la neumonía es un factor de riesgo independiente de muerte, la mortalidad asociada a NN varía entre 20-76%, mientras que la mortalidad atribuible se encuentra entre 20 y 33%. Evidencia según GRADE 1B.
Se recomienda considerar los siguientes factores como predictores de mortalidad en pacientes con NN y NAV. Evidencia según GRADE 1C.
Factores para tener en cuenta
Inicio y concordancia de la terapia antibiótica con el patógeno aislado, tipo de microorganismo infectante ( P. aeruginosa, A. baumannii, S. maltophilia ), edad, comorbilidades, tiempo de estancia hospitalaria, choque séptico, falla de órganos, presencia de bacteriemia, presentación tardía (> 96 h), puntaje en las escalas de severidad (APACHE II > 16).
La terapia antibiótica adecuada ha mostrado ser un factor implicado en la reducción de la mortalidad asociada a neumonía.
Costos de la neumonía nosocomial
La NN genera sobrecostos entre 4.000 hasta 57.000 dólares por caso. Evidencia según GRADE 1B.
Hay un paquete de medidas que puede reducir la frecuencia de NAV y los costos atribuidos a ella. Evidencia según GRADE 1B.
El no pago por evento adverso de NN no reduce la frecuencia de ella. Evidencia según GRADE 1C.
Algunos episodios de NN no son prevenibles. Evidencia según GRADE 1C.
La NN es la segunda causa de infección nosocomial más frecuente y la primera causa de mortalidad, con una mortalidad atribuible del 30%.
Los costos atribuibles a la NN se derivan de una lista que incluye los exámenes adicionales para su diagnóstico y seguimiento, el manejo antibiótico, el uso de recursos técnicos y humanos adicionales, la estancia prolongada en VM, en la UCI y en el hospital.
El microcosteo es un método usado para capturar los costos asociados con patrones de uso de recursos.
Los programas de seguridad del paciente y las guías de buenas prácticas pretenden el reporte de incidentes y eventos adversos para generar planes de mejoramiento que lleven a optimizar los indicadores de calidad. Esto se basa en que el reporte es voluntario, puede ser anónimo y no punitivo.
La estrategia diagnóstica elegida debe ser factible y de rápida ejecución ya que varios estudios han demostrado que una demora en el uso del antibiótico adecuado lleva a desenlaces adversos. Así, el mini-LBA es probablemente la estrategia más costo-efectiva.
La NAV en particular se asocia a una sobrecarga de uso de recursos estadísticamente significativa, lo que aumenta la necesidad de implementar intervenciones costo-efectivas para prevenirla.
Se ha propuesto el término de complicaciones asociadas a la ventilación como un objetivo para evaluar la calidad de cuidado para esta población. Igualmente, se han planteado paquetes de medidas para reducir las complicaciones asociadas a la ventilación.
Las guías y los consensos ayudan a mejorar los desenlaces
Las guías y consensos en NN pueden mejorar los desenlaces si están muy bien diseñados y adaptados al ambiente local. Evidencia según GRADE 1B.
La intención que se busca al desarrollar una guía clínica es mejorar la calidad del cuidado y permitir una mejor toma de decisiones clínicas y no el seguimiento estricto de la guía (o consenso).
Nuestro consenso se verá sometido a una aceptación y aplicación que dependerá de que las recomendaciones sean generadas en su mayoría con base en la evidencia de ensayos clínicos, más que en la naturaleza de la fuente de las guías.
Para persistir como creíbles, las guías deben ser revisadas de modo frecuente y es ideal que se mantenga un espacio en Internet para discusión y para diseminar la información.
Grupos especiales
Factores diferenciadores que se han de tener en cuenta en el diagnóstico de neumonía nosocomial de pacientes inmunosuprimidos
Los factores considerados son los siguientes:
• Alta sospecha de infección en situaciones poco aparentes.
• Coinfección con mayor frecuencia.
• Gérmenes poco usuales.
• Virus y tuberculosis entre las causas.
• La etiología depende de la profundidad de inmunosupresión.
• La búsqueda intensa del germen causal debe ser una meta. Evidencia según GRADE 1C.
Se recomienda que se haga un abordaje diferente en los pacientes inmunosuprimidos al que se hace en los inmunocompetentes, fundamentado en la realización de broncoscopia con LBA.
El grupo de pacientes en constante aumento está conformado por los trasplantados de órgano sólido, de médula ósea y los que reciben corticoides y terapias inmunomoduladoras. Constituyen una población diferente a los inmunocompetentes y tienen mayor riesgo de estar infectados por microorganismos oportunistas.
En una revisión japonesa sobre pacientes inmunosuprimidos, se plantea una clasificación en 3 grandes grupos:
1) Neutropenia (< 500 neutrófilos/ul) o disfunción de los neutrófilos, asociada a malignidad hematológica, uso de agentes antineoplásicos o medicamentos inductores de esta. Usualmente, una infección por S. aureus resistente a meticilina, Klebsiella o P. aeruginosa .
2) Inmunodeficiencia humoral (gammaglobulina < 500 mg/dl o disfunción en la producción de anticuerpos específicos) secundaria a malignidad hematológica, esplenectomía y uso de anticuerpos anti-CD20. En pacientes con virus de la inmunodeficiencia humana (VIH), la inmunodeficiencia humoral se presenta solo en estados avanzados. Los gérmenes más frecuentes son S. pneumoniae, H. influenzae y K. pneumoniae .
3) Inmunodeficiencia celular , se presenta en pacientes con VIH positivo y conteo CD4 < 200 células/ul. Pero la severidad no puede ser calculada por el conteo de CD4 en las siguientes situaciones: uso de inmunosupresores como esteroides, agentes antineoplásicos y preparaciones biológicas (antifactor de necrosis tumoral alfa, etc.), malignidad hematológica, diabetes mellitus y falla renal.
Los gérmenes causales más frecuentes son Pneumocystis jirovecci , citomegalovirus y criptococosis. En caso de que los CD4 bajen de 100 aparece la neumonía por toxoplasma, y en menos de 50 CD4 el Mycobacterium avium complex y Aspergillus.
La biopsia pulmonar temprana ha sido la piedra angular del abordaje de los pacientes inmunosuprimidos en los cuales no hay claridad diagnóstica.
El aspirado traqueobronquial ha sido útil de modo persistente en pacientes inmunocomprometidos y es un complemento del LBA; en caso de que este no pueda realizarse, el aspirado traqueal sigue siendo una herramienta fiable.
La biopsia transbronquial no es segura debido a que estos pacientes pueden tener complicaciones como sangrado y neumotórax, de modo más frecuente.
El estudio del esputo en los inmunosuprimidos debe ser obtenido siempre que sea posible para guiar la terapia empírica; el esputo inducido o espontáneo ha tenido una especificidad diagnóstica de 31%, confirmando su utilidad como primera línea diagnóstica, fundamentado en su simplicidad y costo-efectividad.
El galactomanan es un antígeno polisacárido de la pared del Aspergillus fumigatus que aumenta su rendimiento cuando se está en presencia de aspergilosis diseminada, al ser medido en sangre; idealmente, tomarlo de modo seriado, pero también se puede evaluar en LBA.
Los pacientes neutropénicos con fiebre y radiografía de tórax normal deberían tener una tomografía axial computarizada de tórax de alta resolución.
Al comparar pacientes VIH negativo que necesitan VM con pacientes VIH positivo, estos últimos tienen mayor morbilidad y mortalidad.
Para llegar al diagnóstico con mayor precisión, es necesario tener en cuenta el período en que se encuentra el paciente, luego del trasplante:
• Menos de un mes postrasplante: hay que asumirlo como un proceso nosocomial y en ese caso se presentan gérmenes como S. aureus resistente a meticilina, ERV y Candida no albicans . O puede tener infecciones secundarias a colonización previa por su relación con el hospital, como Aspergillus y Pseudomonas .
• Uno a seis meses después puede infectarse por adenovirus, influenza, Criptococcus neoformans y tuberculosis (asumiendo que tiene profilaxis contra pneumocistosis).
• Mayor que 6 meses, las infecciones vienen de la comunidad y se presentan Aspergillus , bacterias atípicas, mucor y nocardia.
• La incidencia de neumonía en pacientes ancianos es mayor debido al aumento en los factores que facilitan la entrada de los agentes infecciosos al pulmón y a la disminución e la capacidad del sistema inmune. En este grupo etáreo se centra principalmente en bacterias gramnegativas.
Abordaje diagnóstico y terapéutico adecuado en pacientes en ventilación mecánica crónica
El diagnóstico de NAV en VM crónica es clínico. Evidencia según GRADE 1C.
Se recomienda la escala de infección clínica pulmonar para definir toma de cultivos e inicio de antibióticos. Evidencia según GRADE 1C.
Se recomienda el cultivo de secreción orotraqueal como abordaje válido en el manejo de pacientes con VM crónica. Evidencia según GRADE 1B.
Se recomienda el tratamiento antibiótico inicial empírico basado en la flora local. Evidencia según GRADE 1C.
Se recomienda que la duración del tratamiento antibiótico sea de 7-10 días. Evidencia según GRADE 1C.
La ventilación mecánica prolongada (VMP) es la que se aplica por más de 21 días seguidos. Si bien es posible que estos pacientes se encuentren en cuidado intensivo, en general son trasladados a servicios de cuidados especiales, unidades de VM crónica o a sus domicilios.
La incidencia de NAV es de 1,5 a 1,9 casos por cada 1.000 días de ventilador; la menor incidencia se atribuye a la traqueostomía y a la aplicación de las estrategias de prevención de NAV.
Generalmente, luego de 7 días de VM, la mayoría de los pacientes está colonizado.
Paradójicamente, la baja frecuencia de NAV en VMP, al considerar que estos pacientes tienen, en condiciones basales, una alta carga bacteriana en las vías aéreas distales, sobrepasa los niveles diagnósticos aceptados para NAV.
El uso rutinario del LBA invasivo o del cepillado protegido en pacientes en VMP es controversial y poco práctico en la mayoría de los casos.
Los gérmenes más frecuentes reportados en la literatura en NAV en VMP son polimicrobianos de: S. aureus, Pseudomona, Acinetobacter y Klebsiella.
Se recomienda iniciar antibióticos de amplio espectro, de acuerdo con los patrones de sensibilidad y resistencia locales, y luego, cuando se recibe el cultivo, se desescala a un antibiótico específico. El tratamiento, en general, debe durar de 7 a 10 días.
☆ El Consenso colombiano de neumonía nosocomial ha sido fruto de la unión de 3 asociaciones científicas de Colombia: Infectología, Medicina Crítica-Cuidado Intensivo y Neumología. Treinta profesionales, 8 especialidades y un grupo de colaboradores adicionales que permitieron lograr un producto de la mejor calidad a la luz de la evidencia actual. Se efectuó un trabajo multidisciplinario, con una búsqueda rigurosa de la literatura y enfocado en que los conceptos emitidos tuvieran aplicación en la realidad colombiana. Esperamos que sea un documento útil para el cuerpo médico que atiende a pacientes con esta patología, que se adapte al personal administrativo para usarlo como instrumento de las mejores prácticas médicas, pero lo principal es que sirva a nuestros pacientes para lograr mejorar los resultados en la práctica clínica diaria.
◊ En el anexo 1 se indican los participantes en el Consenso colombiano de neumonía nosocomial 2013.
* Autor para correspondencia.
Correo electrónico: aali@neumologica.org (A. Alí Munive).

0123-9392/$ - see front matter © 2013 ACIN. Publicado por Elsevier España, S.L. Todos los derechos reservados.
Bibliografía general
1. Bercault N, Boulain T. Mortality rate attributable to ventilator associated nosocomial pneumonia in an adult intensive care unit: a prospective case control study. Crit Care Med 2001;29:2303-9. [ Links ]
2. Celis R, Torres A, Gatell JM. Nosocomial pneumonia. A multivariate analysis of risk and prognosis. Chest 1988;93(2):318-324. [ Links ]
3. Centers for Diseases Control and Prevention. Monitoring hospital acquired infections to promote patient safety: United States 1990-1999. MMWR 2000;49:149-53. [ Links ]
4. National Nosocomial Infections Surveillance (VAPIS) System report, data summary from January 1990- May 1999, issued June 1999. Am J Infect Control 1999;27:520-32. [ Links ]
5. Chevret S, Hemmer M, et al. Results from a multicenter prospective study on 996 patients. European Cooperative Group on Nosocomial Pneumonia. Intensive Care Med 1993;19:256-64. [ Links ]
6. Cook DJ, Walter SD, Cook RJ, et al. Incidence of and risk factors for ventilator associated pneumonia in critically ill patients. AVAP Intern Med 1998;129:433-40. [ Links ]
7. Fagon JY, Chastre J, Vuagnat A, et al. Nosocomial pneumonia and mortality among patients in intensive care units. JAMA 1996;275:866-9. [ Links ]
8. Heyland DK, Cook DJ, Griffith L, et al. The attributable morbidity and mortality of ventilator-associated pneumonia in the critically ill patient. The Canadian Critical trials group. Am J Respir Crit Care Med 1999;159:1249-56. [ Links ]
9. Kollef MH. Ventilator associated pneumonia. A multivariate analysis. JAMA 1999;270:1965-70. [ Links ]
10. Leone M, Garcin F, Bouvenot J, Boyadjev I, et al. Ventilator associated pneumonia: breaking the vicious circle of antibiotic overuse. Crit Care Med 2007;35:379-85. [ Links ]
11. Marquete CH, Copin MC, Walter F, et al. Diagnostics test for pneumonia in ventilated patients: prospective evaluation of diagnostic accuracy using histology as a diagnostic gold standard. Am J Respir Crit Care Med 1995;151:1878-88. [ Links ]
12. Rello J, Ollendorf DA, Oster G, Vera-Llonch M, Bellm L, et al. Epidemiology and outcomes of ventilator-associated pneumonia in a large US database. Chest 2002;122:2115-21. [ Links ]
13. Tejada Artigas A, Bello Dronda S, Chacon Valles E, et al. Risk factors for nosocomial pneumonia in critically ill trauma patients. Crit Care Med 2001;29:304-9. [ Links ]
14. Vallés J, Pobo A, García-Esquirol O, Mariscal D, Real J, Fernández R. Excess ICU mortality attributable to ventilador-associated pneumonia: the role of early vs. late onset. Intensive Care Med 2007;33:1363-8. [ Links ]
15. Vincent JL, Bihari DJ, Suter PM, et al. The prevalence of nosocomial infections in intensive care units in Europe. Results of the European Prevalence of Infections in Intensive Care. (EPIC) Study. EPIC International Advisory Committee. JAMA 1975;274:639-44. [ Links ]













