Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Infectio
Print version ISSN 0123-9392
Infect. vol.17 no.1 Bogotá Jan./Mar. 2013
ORIGINAL Diagnóstico de enfermedad de Chagas en mujeres embarazadas y recién nacidos de Moniquirá y Miraflores, Boyacá, Colombia Fred Manrique-Abril a, *, Juan Manuel Ospina a , Giomar Herrera A c , Astrid Carolina Florezb, Paula Ximena Pavia c , Marleny Montilla b, Rubén Santiago Nicholls by Concepción Puerta Bula c a Grupo de investigación en Salud Pública, Universidad Pedagógica y Tecnológica de Colombia, Tunja, Colombia b Grupo de Parasitología, Instituto Nacional de Salud, Bogotá, Colombia c Laboratorio de Parasitología Molecular, Departamento de Microbiología, Pontificia Universidad Javeriana, Bogotá, Colombia Recibido el 10 de diciembre de 2012; aceptado el 19 de febrero de 2013 Resumen Objetivo: Estudiar la infección por Trypanosoma cruzi en mujeres embarazadas en Moniquirá y Miraflores, en Boyacá, Colombia y su transmisión transplacentaria. Materiales y métodos: Se programó la tamización de 826 mujeres embarazadas en los 2 municipios; se logró un total de 689 participantes, de las cuales se procesaron 659 muestras (358 de Moniquirá y 301 de Miraflores), mediante técnicas de Elisa en muestras de sangre en papel de filtro. A las mujeres embarazadas positivas y a sus hijos se les aplicaron las pruebas de Elisa e inmunofluorescencia indirecta en suero, hemocultivo y reacción en cadena de la polimerasa. Resultados: La prevalencia total de enfermedad de Chagas en mujeres embarazadas fue de3,34% (22/659), de 3,99% (12/301) en Miraflores y de 2,79% (10/358) en Moniquirá. De 22 mujeres embarazadas en seguimiento, se logró obtener datos de 18 de los recién nacidos (RN), de los cuales 6 fueron positivos para las pruebas de hemocultivo. Se consideró el hemocultivo como la técnica confirmatoria de parasitemia en RN antes de 8 meses. Por lo tanto, la tasa de transmisión de infección congénita fue de 33,33% (6/18). Luego del seguimiento del entorno hogar y peridomicilio, búsqueda de triatomíneos y fumigación de la vivienda, se inició tratamiento de los recién nacidos infectados con benzonidazole a una dosis de 5-8 mg/kg/día durante 60 días. Conclusiones: La prevalencia en mujeres embarazadas obtenida fue similar a la reportada en Casanare (4%). La tasa de transmisión de la infección congénita fue similar a la reportada en Chile (16 al 28%), superior a la de Brasil (1%), Argentina (1,5% a 4,5%), Uruguay (0,5 a 3%), Bolivia y Paraguay (7%). PALABRAS CLAVE Enfermedad de Chagas; Trypanosoma cruzi; Transmisión transplacentaria; Colombia © 2013 ACIN. Publicado por Elsevier España, S.L. Todos los derechos reservados. Diagnosis of Chagas disease in Pregnant Women and Newborns in Moniquirá and Mira-Florez, Boyacá, Colombia Abstract Objective: To study Trypanosoma cruzi infection in pregnant women and its transplacental transmission in Moniquira and Miraflores, Boyaca, Colombia. Materials and methods: Screening of 862 pregnant women in both municipalities was planned; 689 participants were screened by Elisa technique on blood samples drawn on filter paper from whom 659 samples were processed (358 from Moniquira and 301 from Miraflores). Elisa and IFAT in serum, blood cultures and PCR were carried out in positive pregnant women and their children. Results: The total prevalence of Chagas disease in pregnant women was 3.3% (22/659), 3.9% (12/301) in Miraflores and 2.7% (10/358) in Moniquira. Of the 22 pregnant women who were followed, data was obtained from 18 of their newborns, 6 of whom had positive blood culture tests. Blood cultures were considered as the confirmatory technique for parasitemia in newborns before 8 months of age. Therefore, the overall rate of transmission of congenital infection was 33.3% (6/18). After following-up at the homes and peridomiciles, searching for triatomine bugs and spraying the homes, we began treatment for the infected newborns with benznidazole at a dose of 5-8 mg/kg/day for 60 days. Conclusions: The prevalence found in pregnant women was similar to that reported for Casanare. The rate of transmission of congenital infection was similar to that reported in Chile (16%-28%) and higher than those in Brazil (1%), Argentina (1.5%-4.5%), Uruguay (0.5%-3%), Bolivia (7%) and Paraguay (7%). KEYWORDS: Chagas disease; Trypanosoma cruzi ; Transmisión transplacentaria; Colombia © 2013 ACIN. Published by Elsevier España, S.L. All rights reserved. Introducción La enfermedad de Chagas es una parasitosis causada por el flagelado Trypanosoma cruzi , que afecta a alrededor de 10 millones de personas en 21 países endémicos en Centro y Sudamérica 1. T. cruzi es un parásito heterogéneo clasificado en seis Unidades Discretas de Tipificación (DTU, por sus siglas en inglés) I-VI, las cuales parecen estar asociadas con los ciclos de transmisión, manifestaciones clínicas y gravedad de la enfermedad 2,3. En Colombia se considera que la población del parásito de mayor circulación es la DTU I seguida de la DTU II 4,5. Aunque la principal vía de transmisión de esta enfermedad es a través de los insectos vectores de la familia Reduviidae , el parásito también puede ser transmitido de madres infectadas al feto in utero 6-10. La infección intrauterina puede ocurrir tanto en la etapa aguda como crónica de la infección materna y afectar a embarazos sucesivos y gemelares. Los recién nacidos (RN) infectados pueden presentar un amplio espectro de manifestaciones que van desde RN aparentemente sanos y de peso adecuado para la edad gestacional (90%) hasta cuadros graves que pueden conducir a la muerte, especialmente de los RN prematuros, siendo la hepatoesplenomegalia el hallazgo más común 6-8,11 . Otras observaciones menos frecuentes son síntomas neurológicos tales como convulsiones, hipotonía y temblor de brazos y piernas. También se pueden presentar fiebre, ictericia, anemia y edemas 7. A pesar de que la transmisión vertical de T. cruzi no puede ser prevenida, el diagnóstico rápido y oportuno de los RN infectados es prioritario por cuanto se sabe que, cuanto más temprano se inicie el tratamiento antiparasitario específico, mayor es la probabilidad de eliminar el parásito, llegando a presentarse tasas de curación hasta del 100% tras el tratamiento, con lo cual se evita el desarrollo posterior de cardiopatía chagásica crónica 10,12. Los medicamentos de elección actualmente son el benzonidazole (Rochagan ® ) y el nifurtimox (Lampit ® , Bayer), los cuales tienen muy pocos efectos secundarios en RN 10,13,14. El diagnóstico de la infección materna se basa en la serología convencional, en tanto que el diagnóstico en el RN se realiza por exámenes parasitológicos directos que demuestren la presencia del parásito 8,10,15, de manera que se utilizan tanto exámenes directos como examen en fresco, frotis sanguíneo seguido de tinción de Giemsa y de métodos de concentración tales como el método de Strout, microhematocrito, gota gruesa y hemocultivo, entre otros. Estos métodos no presentan ningún inconveniente en el caso de RN con elevadas parasitemias. No obstante, en el caso de RN asintomáticos con bajos niveles de parásitos circulantes se hace necesario el uso de otras técnicas que tengan una mayor sensibilidad. Es así como la reacción en cadena de la polimerasa (PCR) se ha constituido en una herramienta útil para el diagnóstico de la infección en los RN, la cual está siendo ampliamente utilizada en países como Chile y Argentina 12,16-18. Entre las reacciones de PCR más utilizadas para la detección de T. cruzi en muestras biológicas, se encuentran las basadas en la amplificación del ADN del cinetoplasto 19,20 y la secuencia repetida nuclear de 195 pb del parásito 12. Por su parte, en el laboratorio de Parasitología Molecular de la Pontificia Universidad Javeriana se diseñó y estandarizó la prueba histona H2A de T. cruzi , la cual mostró un buen desempeño en la detección del parásito en muestras de insectos vectores y de sangre de pacientes crónicos. Sus resultados fueron concordantes con los obtenidos con los iniciadores S35-S36, cebadores que amplifican el ADN del cinetoplasto 21,22. Asimismo, en los últimos años se han propuesto diferentes pruebas de PCR en tiempo real 23,24, las cuales tienen la ventaja de cuantificar la carga parasitaria 25,26. La enfermedad de Chagas transplacentaria no se limita a las áreas rurales, en donde ocurre transmisión vectorial, sino que cada vez con mayor frecuencia se tienen reportes de ciudades a las cuales han migrado desde el campo mujeres infectadas en edad fértil 10. Es así como se han notificado casos en Argentina, Bolivia, Brasil, Chile, Honduras, Guatemala, Paraguay, Uruguay, Venezuela y Colombia 6. Por ejemplo, en Buenos Aires (Argentina), como resultado de la migración desde zonas endémicas, la infección se detecta en un 2,6 a 6,7% de las mujeres embarazadas 11. La tasa de transmisión de la infección congénita de la enfermedad de Chagas, definida como el cociente resultante de dividir el número de casos congénitos por el número de madres chagásicas, puede variar en diferentes zonas geográficas, incluso dentro de un mismo país 6. Por ejemplo, en Brasil se ha reportado una tasa del 1% 6, en Uruguay del 0,5 al 3,5% 27, en Argentina del 1,5 al 4,5% 10,13, en algunas regiones de Bolivia y Paraguay se han encontrado tasas mayores del 7% 6 y en Chile varía del 16 al 28% dependiendo de la localidad 8. En Colombia, aun cuando se estima que 427.000 personas residentes en las áreas endémicas se encuentran infectadas y un 11% de la población en general se encuentra en riesgo de adquirir la infección 28,29 , existen pocos reportes de estudios de infección materna por T. cruzi , así como de la transmisión transplacentaria de esta enfermedad. Así, el primer caso de enfermedad de Chagas transplacentaria en Colombia, analizado por AP-PCR, se presentó en Moniquirá, Boyacá 30 y los factores de riesgo asociados con la infección por T. cruzi en mujeres embarazadas en Casanare fueron descritos en 2012 16. Este trabajo presenta la prevalencia en mujeres embarazadas y la incidencia en RN de la enfermedad transplacentaria en los municipios de Miraflores y Moniquirá de Boyacá, municipios que representan zonas de alta endemia. Materiales y métodos Tipo de estudio El estudio Enfermedad de Chagas transplacentaria en los municipios de Miraflores y Moniquirá, Boyacá tuvo 3 fases en 2 diseños, uno de corte transversal y el segundo longitudinal. En la primera se realizó, como prueba de tamización, serología mediante ensayo inmunoenzimático (Elisa) en muestras de sangre tomada en papel de filtro Whatmann # 3 a mujeres embarazadas de los municipios de Miraflores y Moniquirá en el segundo o último trimestre del embarazo, según la metodología del Instituto Nacional de Salud 31 (INS) y protocolo estandarizado. En la segunda fase, se aplicaron las pruebas serológicas confirmatorias a las madres positivas en la tamización, dos pruebas convencionales de principio diferente, Elisa 32 e inmunofluorescencia indirecta (IFI) en muestras de suero, según lineamientos de la Organización Mundial de Salud 6 , y se realizó toma de muestras de sangre total para diagnóstico parasitológico, por microhematocrito, hemocultivo y PCR a los hijos de madres seropositivas. En la tercera fase, se realizó el tratamiento de los niños infectados. En los casos en que se encontraron hemocultivos positivos, se realizó PCR para tipificación molecular de los aislamientos de T. cruzi . Población de estudio Se trabajó en los municipios de Miraflores y Moniquirá, los cuales constituyen zonas de alta endemia para la enfermedad de Chagas. En la primera fase del estudio, se incluyó a las mujeres embarazadas que asistieron a control prenatal durante un año (abril de 2006-marzo de 2007) a los Hospitales Regional de Moniquira y Hospital Regional de Miraflores que cumplieron el criterio de inclusión y firmaron el consentimiento informado en conjunto con su pareja. El criterio de inclusión fue mujeres embarazadas que asistieron a control prenatal en los municipios objeto de estudio. A todas las mujeres embarazadas se les tomó una muestra de sangre mediante punción capilar en papel filtro para la tamización mediante la prueba de Elisa y aquellas muestras que resultaron positivas fueron confirmadas mediante Elisa e IFI en muestras de suero, procedimientos realizados en el Laboratorio de Parasitología del INS 31,32. Se calculó una muestra de 826 (600 a 950) mujeres embarazadas en ambos municipios durante el año de estudio, según indicadores históricos de control prenatal y atención del parto. En la segunda fase del estudio, se estudiaron tanto los niños RN de las madres positivas para la infección como sus respectivas madres. Se esperaba una muestra de 95 (25 a 165) madres positivas para la infección. Todos los niños se evaluaron clínicamente, fueron pesados, y se les tomó una muestra de sangre total entre el séptimo y décimo día de nacimiento, para las pruebas parasitológicas de microhematocrito y hemocultivo y las pruebas serológicas de Elisa e IFI, las cuales fueron realizadas en el Laboratorio de Parasitología del INS, y para las pruebas de PCR que se realizaron en el Laboratorio de Parasitología Molecular, Pontificia Universidad Javeriana. Teniendo en cuenta una incidencia de infección transplacentaria del 3-20% al año se esperaba en ambos municipios una ocurrencia de 9 (3 a 19) RN infectados. El criterio de positividad determinado por el grupo de investigadores y la asesora internacional de la Universidad de Chile se definió como los RN con resultado parasitológico positivo en las pruebas de microhematocrito o hemocultivo. A los RN negativos se les repitieron todas las pruebas entre los 8 y 10 meses de nacidos para descartar definitivamente la infección. Finalmente, en la tercera y última etapa del estudio, los niños RN infectados fueron sometidos a tratamiento de la infección. Pruebas serológicas Las pruebas convencionales de Elisa en suero y en eluídos de sangre en papel de filtro e IFI a partir de suero fueron estandarizadas en el Laboratorio de Parasitología del INS. Ambas utilizan antígeno total de cepas de T. cruzi colombianas. Para este estudio fue utilizada la cepa MHOM/CO/03/CG de T. cruz i 32. Pruebas parasitológicas Se realizaron las pruebas de microhematocrito 33 y hemocultivo 34. Los hemocultivos se hicieron con muestras de sangre anticoagulada con citrato de sodio de la madre a los 9 meses de gestación, y de su hijo, a los 2 y 4 meses del nacimiento. Se sembraron, aproximadamente, 1,5 ml de cada muestra en 3 tubos con medio Tobie para la madre y 2 tubos para el bebé. Los hemocultivos se observaron en microscopio invertido cada 8 días después del día de siembra durante un periodo de hasta 6 meses. Pruebas de reacción en cadena de la polimerasa A partir de las muestras de sangre y de las cepas aisladas de los hemocultivos positivos de madres e hijos, se obtuvo el ADN con los métodos que utilizan clorhidrato de guanidina, en el caso de las muestras de sangre, o NP40 al 10% para las cepas aisladas en cultivo, seguido de extracción con fenol-cloroformo-alcohol isoamílico 21,35. Con el fin de comprobar la integridad del ADN y descartar la presencia de inhibidores en la muestra, se corrió la PCR que amplifica una región del gen de la ß-globina 36. Para la identificación de T. cruzi, se utilizaron los iniciadores TcH2AF-R 21,35 y S35- S36 37 . Para determinar la DTU de los parásitos aislados por hemocultivo, se realizaron diferentes reacciones de PCR. En primer lugar, con los iniciadores Tc/TcI/TcII, se amplificó una región del gen miniexón, la cual permite la discriminación de la DTU I (fragmento de 350 pb) de las DTU II, V y VI 38 (fragmento de 300 pb). También se utilizaron los iniciadores V1-V2 que amplifican una región del dominio variable del gen codificante para el ARNr 18S, la cual arroja el siguiente perfil de amplificación: un fragmento de 155 pb para el caso de la DTU IV y uno de 165 pb para las DTU II, III y V. Finalmente, se usaron los iniciadores D71-D72, que amplifican una región del dominio divergente del gen codificante para el ARNr 24S del parásito amplificando un fragmento de 110 pb para el caso de la DTU I y III, uno de 125 pb para la DTU II y VI, ambos fragmentos para la DTU V y una serie de fragmentos de 120, 125 y 130 pb para la DTU IV 39. En todas las reacciones de PCR se incluyeron los siguientes controles: de reacción (adición de agua como templado en el cuarto de preparación de la mezcla de reacción), control negativo (ADN de un individuo sano) y positivo (1 ng de ADN genómico de T. cruzi I para las PCR de identificación y para las de genotipificación, ADN genómico de cepas de las DTU I-VI). Todos los productos de amplificación se analizaron en geles de agarosa teñidos con bromuro de etidio. Tratamiento y seguimiento de los recién nacidos Se inició tratamiento a los RN con 5-8 mg/kg/peso/día de benzonidazole (Rochagan ® ), por vía oral después de las comidas, en 2 dosis diarias, con la intención de administrarlo durante 60 días 10,12,17. Los niños prematuros o con bajo peso iniciaron el tratamiento con la mitad de la dosis durante 72 horas, al cabo de las cuales se administró la dosis total. El protocolo del estudio incluyó la realización, a los RN tratados, de exámenes clínicos semanales, control de peso y talla, observación de aparición de síntomas adversos colaterales y análisis de laboratorio como hemograma, creatinina, transaminasas y parcial de orina al inicio, a la mitad y al final del tratamiento. También se inició tratamiento a las madres seropositivas una vez terminado su embarazo, con el mismo esquema y protocolo de seguimiento. Análisis estadístico Los datos fueron consignados en un formulario de recolección de datos individual precodificado, de forma independiente y ciega. Se realizó una base de datos en computador utilizando el programa EPIINFO 2002. El análisis estadístico tuvo por objeto describir en primera instancia las proporciones de infección de las madres en los municipios de Miraflores y Moniquirá y su respectiva comparación. En segundo lugar, se determinaron las incidencias de la enfermedad de Chagas transplacentaria en los RN de los municipios bajo estudio y su respectiva comparación. El análisis de datos se llevó a cabo a través de los programas estadísticos Epiinfo y SPSS 11.5. Se procedió a la descripción de las características sociodemográficas de la población de estudio previa evaluación de la distribución de las variables del estudio y los cálculos de las variables anteriormente mencionadas. Resultados Se incluyeron 689 mujeres embarazadas en el estudio, de las cuales en 11 la muestra resultó insuficiente para el tamizaje y se perdieron o se dañó la muestra en el transporte de 19 de ellas, quedando 659 muestras tamizadas en la primera fase del estudio a través de papel filtro. La edad media de las participantes en el estudio fue de 24,7 años con una desviación estándar (DS) de 6,7; la edad mínima fue de 14 años y la máxima de 43. De las 659 mujeres embarazadas en tamización, resultaron positivas a Elisa en papel de filtro 22 de ellas, lo cual indica un positividad para T. cruzi del 3,34% (intervalo de confianza [IC] 95%: 2,2-5,1%). Las positivas ingresaron en el estudio para confirmación del diagnóstico y seguimiento hasta el momento del parto; estas tenían una edad media de 26,5 años, DS 5,17, con edad mínima de 17 años y máxima de 38. La absorbancia registrada en las negativas estuvo entre 0,0030 y 0,3960 con una media de 0,16 y DS de 0,08. De acuerdo con el protocolo de lectura, la absorbancia registrada para las positivas estuvo entre 0,40 y 0,845 con una media de 0,48, DS 0,01, con diferencia estadística significativa p < 0,01. La prevalencia global de la enfermedad de Chagas en mujeres embarazadas fue de 3,34% (22/659), 3,99% (12/301) en Miraflores y 2,79% (10/358) en Moniquirá. De 22 mujeres embarazadas positivas en la tamización, se obtuvieron muestras para confirmación de 18 de ellas mediante las pruebas de Elisa e IFI en suero, hemocultivo y PCR (tabla 1). Las 4 restantes se perdieron por cambio de residencia de las participantes.
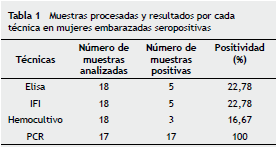
De las 18 mujeres embarazadas en seguimiento, se lograron datos de todos sus RN, de los cuales 6 fueron positivos para las pruebas de hemocultivo. Se consideró el hemocultivo como la técnica confirmatoria de parasitemia en RN antes de 8 meses. Por lo tanto, la tasa de transmisión de la infección congénita por T. cruzi fue del 33,33% (6/18) (tabla 2). A 3 embarazadas y 6 bebés procedentes de los municipios de Moniquirá y Miraflores se les logró aislar el parásito a partir de muestras de sangre.

La prueba directa de hematocrito en los RN fue totalmente ineficaz, probablemente por falta de acogimiento al protocolo y homogenización del mismo en su realización por parte de los diferentes hospitales.
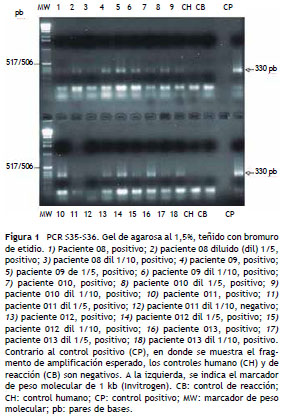
En cuanto a los resultados obtenidos con las pruebas de PCR TcH2AF-R y S35-S36, se encontró que en las 17 mujeres embarazadas la positividad fue del 100% con ambas parejas de iniciadores, observando los fragmentos esperados de amplificación de 234 pb y 330 pb, respectivamente (tabla 1, fig. 1). En el caso de los RN, para los iniciadores TcH2AF-R la positividad fue del 94,1% y para la PCR S35- S36 fue del 100% (tabla 2). Todas las muestras de ADN fueron amplificadas con los iniciadores de la ß-globina para descartar la presencia de inhibidores de la PCR que pudieran generar resultados falsos negativos. Así, se observó el fragmento esperado de aproximadamente 210 pb en todas las muestras analizadas.
La tipificación molecular de los 9 aislados de los hemocultivos positivos mostró, de acuerdo con los resultados de la PCR TC/TCI/TCII, que 6 de estos pertenecían a aislados de la DTU I (fragmento específico de 350 pb), 2 a las DTU II-VI (fragmento específico de 300 pb) y 1 resultó ser una mezcla de varias poblaciones. Posteriormente, con las pruebas de PCR que utilizan los iniciadores V1-V2 y D71- D72 se identificaron los dos aislados DTU II-VI como pertenecientes a la DTU II (productos de amplificación específicos de 165 y 125 pb, respectivamente). En el caso de la mezcla de varias DTU, se amplificaron fragmentos de 165 y 110 pb, respectivamente, lo cual sugiere una infección mixta por las DTU I y II.
De acuerdo con el protocolo de seguimiento y tratamiento, se inició la terapia a un RN luego del tiempo de lactancia, consistente en la administración de 5-8 mg/kg de peso de benzonidazole por día durante 60 días. Antes de iniciar el tratamiento, se practicaron las pruebas de laboratorio clínico, valoración médica y se realizó desinfección y fumigación de vivienda.
Por aceptación voluntaria de los padres, se inició el tratamiento en otros 2 de los 6 niños infectados. Sin embargo, los padres decidieron suspender el tratamiento tras 15 días de administración por presentación de náuseas y dolor de cabeza en las madres que igualmente habían iniciado el tratamiento. Por estas razones, no fue posible evaluar la eficacia del tratamiento.
Vale la pena señalar que, en general, durante el tiempo de tratamiento, no se presentaron reacciones adversas graves en los RN y que tan solo una de las madres completó el tratamiento, mitad con benzonidazole y mitad con nifurtimox. Los resultados de las pruebas de función hepática y renal, el electrocardiograma y la valoración pediátrica fueron normales luego de interrupción del tratamiento tras 1 mes de su aplicación.
Discusión
Este es el primer estudio epidemiológico de transmisión transplacentaria de enfermedad de Chagas en Colombia. La prevalencia total de la enfermedad de Chagas en mujeres embarazadas fue estimada mediante tamización con la técnica de Elisa en papel de filtro, de acuerdo con los lineamientos de la OMS de utilizar una prueba convencional en estudios de encuestas epidemiológicas utilizando muestras de suero, plasma o sangre recogidas en papel de filtro 6,31,40. La prevalencia fue similar a la del 4% obtenida en un estudio realizado en Casanare, Colombia 16. Aunque se logró tomar sangre total venosa para realizar la confirmación serológica en suero de 18 mujeres seropositivas de las 22 obtenidas en la tamización, la concordancia entre los resultados de ambas pruebas fue muy baja, posiblemente por problemas externos como hemólisis de las muestras, y no por inconvenientes intrínsecos de la prueba 31,32.
La tasa de transmisión de la infección congénita obtenida en este estudio, 33,3%, fue similar a la reportada en Chile 8 (16 al 28%), pero muy superior a la de Brasil 6 (1%), Argentina 10,13 (1,5% a 4,5%), Uruguay 27 (0,5 a 3%) y Bolivia y Paraguay 6 (7%).
En concordancia con lo descrito en la literatura, las pruebas serológicas que detectan IgG no constituyen criterio diagnóstico al momento del nacimiento, a menos que su positividad se mantenga después de los 9 meses de edad 10 . Antes de esta edad, el estudio serológico detecta anticuerpos de clase IgG que o bien pueden ser producidos directamente por el RN o bien pueden provenir de la madre y ser transmitidos al RN a través de la placenta 10,11. De acuerdo con lo anterior, en este estudio se consideró el hemocultivo como la prueba confirmatoria diagnóstica, siendo positiva en 6 de 18 RN. Llamativamente, no se encontró concordancia entre los resultados del hemocultivo y los de las pruebas serológicas confirmatorias en suero de los RN, hecho que concuerda con un estudio en Argentina que mostró que entre los 6 y 9 meses de edad la parasitemia detectó un 36,2% de más casos que las pruebas serológicas 41.
Contrario al desempeño del microhematocrito en estudios realizados en Bolivia y en otros países del Cono Sur 41,42, en este trabajo, el microhematocrito no logró detectar ninguno de los casos de Chagas congénito. Este resultado podría explicarse bien por una baja carga parasitaria o por fallas en la metodología empleada.
Aun cuando las pruebas de PCR fueron positivas en todos los casos de los RN, dado que su positividad puede obedecer a la presencia de detritos del parásito que pasaron de la madre al feto, mas no a infección activa, se tiene como criterio de apoyo y se recomienda su repetición a los 9 meses de vida de los infantes.
De hecho, en este estudio se pudo evidenciar en 3 RN, a quienes se les tomó muestra en 2 o 3 oportunidades durante su primer año de vida, que mientras el RN positivo por hemocultivo presentó pruebas de PCR positivas en todos los muestreos, en el caso de los 2 niños negativos por hemocultivo, sus PCR se negativizaron tras el año de vida.
En relación con el tratamiento, no hubo adherencia al mismo tanto de parte de los RN como de las madres a quienes se les inició una vez terminado su embarazo. En el caso de los RN esto podría atribuirse, al menos parcialmente, a la falta de disponibilidad de presentaciones pediátricas del medicamento.
En conclusión, se demostró por primera vez la transmisión transplacentaria de T. cruzi en Colombia, la cual se presenta por cepas de las DTU I y II del parásito, existiendo además la presencia de infecciones mixtas. Se recomienda realizar estudios similares en otras zonas endémicas de transmisión de enfermedad de Chagas en Colombia para determinar la prevalencia de infección en mujeres embarazadas y la incidencia de la infección congénita. Los resultados de estos estudios serán útiles para formular e implementar programas de tamización de embarazadas y diagnóstico y tratamiento a los recién nacidos de madres infectadas para evitar que ellos desarrollen las formas crónicas e incapacitantes de la enfermedad.
Financiación
Proyecto financiado por COLCIENCIAS, Código del Proyecto: 1109-04-18231; Contrato UPTC-Colciencias RC 439-2005. Cofinanciado por la Universidad Pedagógica y Tecnológica de Colombia, Tunja, Boyacá, la Pontificia Universidad Javeriana, Bogotá, D.C., y el Instituto Nacional de Salud, Bogotá, D.C.
Agradecimientos
A la Dirección de Investigaciones de la Universidad Pedagógica y Tecnológica de Colombia, a los jóvenes investigadores Leonardo Cely, Diego Manrique y Marlon Tejedor y a la Dra. Myriam Lorca por su papel como asesora internacional del proyecto.
* Autor para correspondencia.
Correo electrónico: fgma75@hotmail.com (F. Manrique-Abril).
0123-9392/$ - see front matter © 2013 ACIN. Publicado por Elsevier España, S.L. Todos los derechos reservados.
Bibliografía
1. World Health Organization (WHO). Working to overcome the global impact of neglected tropical diseases, First WHO report on neglected tropical diseases. Ginebra: WHO; 2010. p. 75-81. [ Links ]
2. Zingales B, Andrade SG, Briones MR, Cambpell DA, Chiari E, Fernandes O, et al. A new consensus for Trypanosoma cruzi intraspecific nomenclature: second revision meeting recommends Tc I to Tc VI. Mem Inst Oswaldo Cruz. 2009;104:1051-4. [ Links ]
3. Zingales B, Miles MA, Campbell DA, Tibayrenc M, Macedo AM, Teixeira MM, et al. The revised Trypanosoma cruzi subspecific nomenclature: Rationale, epidemiological relevance and research applications. Infect Genet Evol. 2012;12:240-53. [ Links ]
4. Zafra G, Mantilla JC, Valadares HM, Macedo A M, González CI. Evidence of Trypanosoma cruzi II infection in Colombian chagasic patients. Parasitol Res. 2008;103:731-4. [ Links ]
5. Zafra G, Mantilla J C, Jácome J, Macedo A M, González C I. Direct analysis of genetic variability in Trypanosoma cruzi populations from tissues of Colombian chagasic patients. Hum Pathol. 2011;42:1159-68. [ Links ]
6. World Health Organization: Control of Chagas Disease: Report of a WHO Expert Committee, Vol. 905. Ginebra: World Health Organization; 2002. [ Links ]
7. World Health Organization: Control of Chagas Disease: Report of a WHO Expert Committee, Vol. 811. Ginebra: World Health Organization; 1991. [ Links ]
8. Lorca M. Enfermedad de Chagas transplacentaria en América Látina. Experiencias de intervención en Chile. En: Guhl F, editor. Primer Taller Internacional Sobre Control de la enfermedad de Chagas, Curso de Diagnóstico, Manejo y Tratamiento de la Enfermedad de Chagas, VI Reunión de la Iniciativa Andina para el Control de la Enfermedad de Chagas. Bogotá: Corcas Editores; 2005. p. 237-40. [ Links ]
9. Neto EC, Rubin R, Schulte J, Giugliani R. Newborn screening for congenital infectious diseases. Emerg Infect Dis. 2004;10:1068-73. [ Links ]
10. Carlier Y, Torrico F, Sosa-Estani S, Russomando G, Luquetti A, Freilij H, et al. Congenital Chagas disease: recommendations for diagnosis, treatment and control of newborns, siblings and pregnant women. PLoS Negl Trop Dis. 2011;5:e1250. [ Links ]
11. Freilij H, Altcheh J. Congenital Chagas' disease: diagnostic and clinical aspects. Clin Infect Dis Off Publ Infect Dis Soc Am. 1995;21:551-5. [ Links ]
12. Russomando G, De Tomassone MM, De Guillén I, Acosta N, Vera N, Almiron M, et al. Treatment of congenital Chagas' disease diagnosed and followed up by the polymerase chain reaction. Am J Trop Med Hyg. 1998;59:487-91. [ Links ]
13. Blanco SB, Segura EL, Cura EN, Chuit R, Tulián L, Flores I, et al. Congenital transmission of Trypanosoma cruzi : an operational outline for detecting and treating infected infants in northwestern Argentina. Trop Med Int Health. 2000;5:293-301. [ Links ]
14. Organización Panamericana de la Salud (OPS), Organización Mundial de la Salud. Tratamiento etiológico de la enfermedad de Chagas. Conclusiones de una consulta técnica. Washington DC. 1999. p. 1-32. [ Links ]
15. Lorca M, Thiermann E. Congenital Chagas disease and its serological diagnosis through conventional serology and methods of molecular biology. En: Erlich R, Nieto A, editores. Biology of parasitism. Montevideo: Ediciones Trilce; 1995. p. 160-6. [ Links ]
16. Cucunubá ZM, Flórez AC, Cárdenas A, Pavía P, Montilla M, Aldana R, et al. Prevalence and risk factors for Chagas disease in pregnant women in Casanare, Colombia. Am J Trop Med Hyg. 2012;87:837-42. [ Links ]
17. Schijman AG, Altcheh J, Burgos JM, Biancardi M, Bisio M, Levin MJ, et al. Aetiological treatment of congenital Chagas' disease diagnosed and monitored by the polymerase chain reaction. J Antimicrob Chemother. 2003;52:441-9. [ Links ]
18. Virreira M, Torrico F, Truyens C, Alonso-Vega C, Solano M, Carlier Y, et al. Comparison of polymerase chain reaction methods for reliable and easy detection of congenital Trypanosoma cruzi infection. Am J Trop Med Hyg. 2003;68:574-82. [ Links ]
19. Sturm NR, Degrave W, Morel C, Simpson L. Sensitive detection and schizodeme classification of Trypanosoma cruzi cells by amplification of kinetoplast minicircle DNA sequences: use in diagnosis of Chagas' disease. Mol Biochem Parasitol. 1989;33:205-14. [ Links ]
20. Vallejo GA, Guhl F, Chiari E, Macedo AM. Species specific detection of Trypanosoma cruzi and Trypanosoma rangeli in vector and mammalian hosts by polymerase chain reaction amplification of kinetoplast minicircle DNA. Acta Trop. 1999;72:203-12. [ Links ]
21. Pavia PX, Vallejo GA, Montilla M, Nicholls RS, Puerta CJ. Detection of Trypanosoma cruzi and Trypanosoma rangeli infection in triatomine vectors by amplification of the histone H2A/SIRE and the sno-RNA-C11 genes. Rev Inst Med Trop São Paulo. 2007;49:23-30. [ Links ]
22. Gil J, Pavía P, Montilla M, Florez AC, Quintero C, Mercado M, et al. Comparison of a PCR test based on the histone H2A/ SIRE genes with classical serological tests for the diagnosis of chronic Chagas disease in Colombian patients. Biomédica. 2007;27:83-91. [ Links ]
23. Piron M, Fisa R, Casamitjana N, López-Chejade P, Puig L, Vergés M, et al. Development of a real-time PCR assay for Trypanosoma cruzi detection in blood samples. Acta Trop. 2007;103:195-200. [ Links ]
24. Duffy T, Bisio M, Altcheh J, Burgos, JM, Diez M, et al. Accurate real-time PCR strategy for monitoring bloodstream parasitic loads in Chagas disease patients. Plos Neg Trop Dis. 2009;3:e419. [ Links ]
25. Schijman AG, Bisio M, Orellana L, Sued M, Duffy T, Mejia AM et al. International study to evaluate PCR methods for detection of Trypanosoma cruzi DNA in blood samples from Chagas disease patients. PLoS Negl Trop Dis. 2011;5:e931 [ Links ]
26. Duffy T, Cura CI, Ramirez JC, Abate T, Cayo NM, Parrado R, et al. Analytical performance of a multiplex Real-Time PCR assay using TaqMan probes for quantification of Trypanosoma cruzi satellite DNA in blood samples. PLoS Negl Trop Dis. 2013;7:e2000. [ Links ]
27. Rosa R, Basmadjián Y, González Murguiondo M, González Arias M, Salvatella R. Actualización clínico-epidemiológica y terapéutica de la enfermedad de Chagas en Uruguay. Rev Med Uruguay. 2001;17:125-32. [ Links ]
28. Organización Panamericana de la salud (OPS). Estimación cuantitativa de la enfermedad de Chagas en las Américas. OPS. 2006;1-28. [ Links ]
29. Moncayo A, Silveira A. Current epidemiological trends for Chagas disease in Latin America and future challenges in epidemiology, surveillance and health policy. Mem Inst Oswaldo Cruz. 2009;104(Suppl 1):17-30. [ Links ]
30. Pavia PX, Montilla M, Flórez C, Herrera G, Ospina JM, Manrique F, et al. The first case of congenital Chagas' disease analyzed by AP-PCR in Colombia. Biomédica. 2009;29:513-22. [ Links ]
31. Orozco LC, Camargo D, Lopez MC, Duque S, Gualdron LE, Cáceres E, et al. Inmunodiagnóstico de la infección en humanos por Trypanosoma cruzi mediante Elisa utilizando sangre recolectada en papel de filtro. Biomédica. 1999;19:164-8. [ Links ]
32. Lopez MC, Duque S, Orozco LC, Camargo D, Gualdron LE, Cáceres E, et al. Inmunodiagnóstico de la infección chagasica por Elisa. Biomédica. 1999;19:159-63. [ Links ]
33. Freilij H, Muller L, Gonzalez Cappa SM. Direct micromethod for diagnosis of acute and congenital Chagas' disease. J Clin Microbiol. 1983;18:327-30. [ Links ]
34. Duque S, Pelaez D, Corredor A. Cultivo in vitro de parásitos de la familia Tripanosomatidae. Manual de Procedimientos. Bogotá: Editorial Instituto Nacional de Salud; 1993. [ Links ]
35. Pavia P, Cuervo C, Montilla M, Nicholls RS, Puerta C. Diseño y estandarización de una prueba de PCR para la detección específica de Trypanosoma cruzi . Infectio. 2003;7:129-36. [ Links ]
36. Virreira M, Torrico F, Truyens C, Alonso-Vega C, Solano M, Carlier Y, et al. Comparison of PCR methods for the diagnosis of congenital Trypanosoma cruzi infection. Rev Soc Bras Med Trop. 2005;38(Suppl 2):65-7. [ Links ]
37. Barrera YK, Guevara JM, Pavía PX, Montilla M, Nicholls RS, Parra E, et al. Evaluation of TcH2AF-R and S35-S36 primers in PCR tests for the detection of Trypanosoma cruzi in mouse cardiac tissue. Biomédica. 2008;28:616-26. [ Links ]
38. Souto RP, Zingales B. Sensitive detection and strain classification of Trypanosoma cruzi by amplification of a ribosomal RNA sequence. Mol Biochem Parasitol. 1993;62:45-52. [ Links ]
39. Brisse S, Verhoef J, Tibayrenc M. Characterization of large and small subunit rRNA and mini-exon genes further supports the distinction of six Trypanosoma cruzi lineages. Int J Parasitol. 2001;31:1218-26. [ Links ]
40. Contreras MC, Salinas P, Sandoval L, Solís F, Rojas A. Utilidad de la Elisa-IgG en muestras de sueros y eluidos de sangre en papel filtro en el inmunodiagnóstico de la enfermedad de Chagas. Bol Chil Parasitol. 1992;47:76-81. [ Links ]
41. De Rissio AM, Riarte AR, García MM, Esteva MI, Quaglino M, Ruiz AM. Congenital Trypanosoma cruzi infection. Efficacy of its monitoring in an urban reference health center in a non-endemic area of Argentina. Am J Trop Med Hyg. 2010;82:838-45. [ Links ]
42. Torrico MC, Solano M, Guzmán JM, Parrado R, Suarez E, Alonzo-Vega C, et al. Estimation of the parasitemia in Trypanosoma cruzi human infection: high parasitemias are associated with severe and fatal congenital Chagas disease. Rev Soc Bras Med Trop. 2005;38(Suppl 2):58-61. [ Links ]













