Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Infectio
Print version ISSN 0123-9392
Infect. vol.17 no.1 Bogotá Jan./Mar. 2013
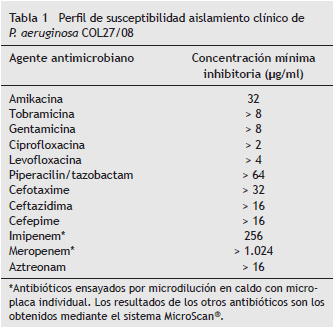
COMUNICACIÓN BREVE Aislamiento clínico de Pseudomonas aeruginosa productor de KPC-2 en la ciudad de Montería, Córdoba, Colombia Francisco Alberto Buelvas Doria a,* , Miguel Ángel Díaz Osorio b , Ángela Bibiana Muñoz Delgado b y Catalina Tovar Acero b b Grupo de Resistencia Bacteriana y Enfermedades Tropicales, Universidad del Sinú, Montería, Córdoba, Colombia Recibido el 20 de septiembre de 2012; aceptado el 15 de julio de 2013 Resumen Objetivo: Caracterizar mediante métodos microbiológicos y moleculares un aislamiento de Pseudomona aeruginosa , productor de la enzima KPC, procedente de una institución hospitalaria de la ciudad de Montería. Métodos: Se determinó la resistencia a los antibióticos (ATB) imipenem y meropenem mediante la técnica de microdilución en caldo; asimismo, se realizaron pruebas de sinergia con EDTA y test 3D para detectar la presencia de enzimas hidrolíticas, las cuales se confirmaron por PCR y secuenciación a partir de ADN plasmídico. Resultados: La secuenciación de un fragmento amplificado de 802 pb en el aislamiento de P. aeruginosa (COL27-08) procedente de la ciudad de Montería permitió identificarlo como portador del gen que codifica para la variante de la enzima KPC-2. Este aislamiento presentó multirresistencia y valores de concentración mínima inhibitoria de 126 ug/ml y > 1024 ug/ml para imipenem y meropenem, respectivamente. Discusión: La detección de este aislamiento de P. aeruginosa , productor de KPC-2, se convierte en el segundo reporte de este tipo en el Caribe colombiano y el primero en esta ciudad. El personal médico y los microbiólogos deben estar atentos a la amenaza planteada por las enzimas KPC, incluso en zonas que no se consideren endémicas de cepas productoras. El uso de la técnica 3D en aislamientos de P. aeruginosa puede tener mayor especificidad que el método de Hodge. PALABRAS CLAVE Pseudomonas aeruginosa ; Carbapenemes; ß -lactamasa; KPC-2; PCR © 2013 ACIN. Publicado por Elsevier España, S.L. Todos los derechos reservados. Clinical Isolation of KPC-2-Producing Pseudomonas aeruginosa in the City of Montería, Córdoba, Colombia Abstract Objective: To use molecular and microbiological methods on a P. aerugi nosa isolate to produce the KPC-2 enzyme at a hospital in the city of Monteria. Methods: Antibiotic resistance to imipenem and meropenem was determined by the broth microdi lution technique. EDTA synergy and 3D tests were performed to detect the pres ence of hydrolytic enzymes, which were confirmed by PCR and sequencing from plasmid DNA. Results: Sequencing of an amplified fragment of 802pb found in the P. aeruginosa (COL27-08) isolate from the city of Monteria showed it carried the genetic code for the enzyme variant KPC-2. This isolation showed multidrug resistance and MIC values of 126 ug/ml and >1024 ug/ml to imipenem and meropenem, respectively. Discussion: The detection of P. aeruginosa producing KPC-2 in this isolate is the second report of its kind in the Caribbean and the first in this city. Medical staff and microbiologists should be aware of the threat posed by KPC enzymes, even in areas where KPC-producing strains are not endemic. By using the 3D technique, isolates of P. aeruginosa can have greater specificity than by using the Hodge method. © 2013 ACIN. Published by Elsevier España, S.L. All rights reserved. KEYWORDS: Pseudomonas aeruginosa ; Carbapenems; ß -lactamase; KPC-2; PCR Introducción Pseudomonas aeruginosa es probablemente uno de los mayores problemas en el ámbito nosocomial, ya que es un patógeno capaz de causar infecciones complicadas en pacientes de cuidado crítico, y adicionalmente presenta varios mecanismos de resistencia a los antibióticos (ATB) tales como mutaciones cromosomales, adquisición de genes de resistencia, sobreexpresión de bombas de eflujo y cambios en las proteínas de la membrana externa (porinas) 1. Los carbapenemes, incluyendo imipenem y meropenem, han sido los ATB ß -lactámicos más usados para el tratamiento de las infecciones por P. aeruginosa, sin embargo , la resistencia a estos medicamentos ha empezado a emerger en varios lugares del mundo y ha involucrado varios mecanismos, entre ellos la producción de enzimas capaces de hidrolizar carbapenemes 1 . En P. aeruginosa se ha reportado en todo el mundo la presencia de enzimas que hidrolizan los carbapenémicos, entre las cuales encontramos las de tipo metalo- ß - lactamasas y serin-carbapenemasas. Las enzimas serincarbapenemasas del tipo KPC son capaces de hidrolizar todos los ATB ß -lactámicos (incluyendo carbapenemes) a excepción de las cefamicinas; estas enzimas fueron descritas por primera vez en un aislamiento de Klebsiella pneumoniae en los Estados Unidos 2 y han sido reportadas desde su aparición en varios países del mundo, principalmente en la familia Enterobactereacea 3, pero su aparición en otras familias de bacterias ha ido en aumento en los últimos años debido a la gran facilidad de transferencia del gen codificante por encontrarse principalmente en elementos genéticos móviles como son los plásmidos. La presencia de este tipo de enzimas implica en aislamientos hospitalarios una fuente importante de diseminación y aparición de brotes con bacterias resistentes a los ATB ß -lactámicos y, por tal motivo, dificultad en el tratamiento de las infecciones 4. En Colombia, la primera detección de aislamientos productores de KPC-2 se reportó en el año 2006 en la ciudad de Medellín, presente en aislamientos de K. pneumoniae 5, y luego, en 2007, fue encontrada en 3 aislamientos clínicos de P. aeruginosa en la misma ciudad 6. La presencia de aislamientos de P. aeruginosa en una ciudad del Caribe colombiano fue reportada en 2011 en la ciudad de Barranquilla 7. El presente estudio buscó detectar la presencia de un aislamiento de P. aeruginosa productor de la enzima KPC-2 en una institución hospitalaria de la ciudad de Montería mediante métodos microbiológicos y moleculares. Metodología Aislamientos bacterianos Se obtuvieron 32 aislamientos de P. aeruginosa con susceptibilidad intermedia o resistencia a alguno de los carbapenemes colectados de varias instituciones hospitalarias de la región Caribe colombiana entre los años 2007-2008. La identificación bioquímica se realizó mediante el sistema MicroScan ® (Dade Bering, EE. UU.), que de forma simultánea evalúa susceptibilidad antibiótica. Se lograron obtener 10 aislamientos con expresión fenotípica de enzimas tipo carbapenemasas mediante la técnica tridimensional (3D); nueve de ellas con test de sinergia EDTA positivos (metalo- ß -lactamasas). Tras el aislamiento negativo para el test de sinergia con EDTA se le realizaron pruebas moleculares mediante PCR y secuenciación para establecer el tipo de serin-carbapenemasa presente. Determinación de la concentración mínima inhibitoria en los carbapenemes Para la confirmacion de la concentración mínima inhibitoria (CIM) obtenida de los paneles de MicroScan, se realizó microdilución en caldo utilizando diluciones de los ATB imipenem (Tienam ® , 500 mg) y meropenem (Vitalis ® , 500 mg) en microplacas con caldo Mueller Hinton teniendo en cuenta las recomendaciones del Clinical and Laboratory Standards Institute 8. Detección fenotípica de carbapenemasas Se realizaron las metodologías de sinergia con discos de papel impregnados con EDTA 0,5 M (10 µ l) 9 y test 3D 4,10, el cual consistió en obtener extractos enzimáticos por sonicación de la bacteria que se debía evaluar y colocándolo en un surco que se encontraba a una distancia de 0,5 cm de un sensidisco de imipenem 10 µ g (Oxoid), previa inoculación en la caja de petri de un aislamiento sensible a los carbapenemes ( Escherichia coli DH5 a ) por método de Kirby-Bauer. Extracción de ADN plasmídico, PCR y secuenciación del producto A partir de un cultivo fresco en 10 ml de caldo Luria Bertani suplementado con 2 µ g/ml de meropenem se obtuvo por centrifugación el pellet bacteriano para la extracción mediante el kit PureLink HiPure Plasmid Miniprep (Invitrogen-EE. UU.), siguiendo las indicaciones del fabricante. El producto de ADN plasmídico fue usado como molde y se amplificó un fragmento por PCR utilizando pares de iniciadores que flanquean la secuencia variable del gen KPC (F-5´- CGCCGTCTAGTTCTGCTGTCTTGT-3´ y R-5´- TCGCTGTGCTTGTCATCCTTGT-3´). Mediante un corrido electroforético se evidenció la presencia de un fragmento de amplificación de 809 pb que correspondía al esperado. Posteriormente, una alícuota del producto de amplificación fue purificada mediante el Wizard ® SV Gel and PCR Clean-Up System (Promega-EE. UU.) y enviada a secuenciación. Resultados El aislamiento mostró perfil de multirresistencia teniendo mayor hidrólisis para el meropenem dentro de los carbapenémicos ensayados y susceptibilidad intermedia a amikacina (tabla 1). El análisis de la secuencia obtenida realizado mediante la herramienta ClustalW permitió comparar nuestra secuencia con las previamente descritas en la base de datos del GenBank, y se confirmó la presencia de la variante KPC-2 en nuestro aislamiento (fig. 1). La secuencia del fragmento COL27-08 se encuentra en el GenBank con el código de acceso numero JN204272.

Los números indican el código de acceso a la base de datos del GenBank para cada uno de los genes descritos hasta la fecha. Se puede observar la similitud que existe entre las secuencias COL27-08 y EU176013 correspondiente a la variante KPC-2.
Discusión
La detección de este aislamiento de P. aeruginosa productor de KPC-2 se convierte en el segundo reporte en el Caribe colombiano después del aislamiento de la ciudad de Barranquilla y el onceavo en Colombia 7. Esto, sin duda, demuestra la importancia de plantear estrategias para la contención de este fenómeno, y frente a este hallazgo, los médicos y microbiólogos deben estar atentos a la amenaza planteada por las enzimas KPC, incluso en zonas que no se consideren endémicas de cepas productoras. Adicionalmente, es primordial establecer la vigilancia de cepas similares teniendo en cuenta su relación conocida con elementos genéticos móviles 4.
Para la detección fenotípica de las enzimas tipo carbapenemasas, se deben usar necesariamente métodos combinados teniendo en cuenta los cofactores enzimáticos que requieren algunas de ellas en su sitio activo 3. Hasta el período de hallazgo de nuestro aislamiento, en 2008, no se conocía del reporte de otros aislamientos productores distintos a los reportados en 2007. La sospecha de un aislamiento productor de KPC era evidente por la referencia previamente descrita de la circulación de aislamientos productores y la combinación de los resultados del test 3D que evidenciaba la presencia de una enzima con actividad carbapenemasa y los de sinergia con EDTA, que descartaban que fuera una tipo metalo- ß -lactamasa, igual que ocurrió con el aislamiento descrito por Akpaka et al., en Trinidad y Tobago en el año 2009 4.
La inclusión en 2009 del test de Hodge para la detección de KPC en enterobacterias por parte del Clinical and Laboratory Standards Institute 11 demostró la importancia que fue adquiriendo implementar estrategias para el diagnostico rápido de estas enzimas. Aunque el método no está indicado para bacilos no fermentadores como P. aeruginosa , es de igual forma reproducible para este género, pero la limitante de obtener resultados indeterminados también se encuentra en P. aeruginosa , sobre todo las que son productoras de ß -lactamasas de espectro extendido, ampliamente encontradas en nuestra región 12. El uso de la técnica 3D en aislamientos de P. aeruginosa puede tener mayor especificidad que el método de Hodge, sin embargo, su realización es más dispendiosa y la disponibilidad de equipos y reactivos se encuentran al alcance de pocos laboratorios de microbiología del país.
Conflicto de intereses
Los autores declaran no tener conflictos de intereses.
Agradecimientos
Esta investigación fue financiada por la Universidad del Sinú, Escuela de Medicina, Facultad de Ciencias de la Salud y Colciencias mediante el proyecto 1283-344-19088.
Los resultados hacen parte del proyecto de grado de Maestría en Microbiología Tropical de Francisco Alberto Buelvas Doria.
Agradecemos al doctor Alejandro Giraldo, por su ayuda en la revisión del manuscrito.
* Autor para correspondencia.
Correo electrónico :molbio1984@gmail.com (F.A. Buelvas Doria).
0123-9392/$ - see front matter © 2013 ACIN. Publicado por Elsevier España, S.L. Todos los derechos reservadosBibliografía
1. Wolter DJ, Khalaf N, Robledo IE, Vázquez GJ, Santé MI, Aquino EE, et al. Surveillance of Carbapenem-Resistant Pseudomonas aeruginosa Isolates from Puerto Rican Medical Center Hospitals: Dissemination of KPC and IMP-18 ß -Lactamases. Antimicrob Agents and Chemother. 2009;53:1660-4. [ Links ]
2. Yigit H, Queenan AM, Anderson GJ, Domenech-Sanchez A, Biddle JW, Steward CD, et al. Novel carbapenem hydrolyzing ß -lactamase, KPC-1, from a carbapenem-resistant strain of Klebsiella pneumoniae. Antimicrob Agents Chemother. 2001;45:1151-61. [ Links ]
3. Jacoby GA, Munoz-Price LS. The new ß -lactamases. N Engl J Med. 2005;352:380-91. [ Links ]
4. Akpaka PE, Swanston WH, Ihemere HN, Correa A, Torres JA, Tafur JD, et al. Emergence of KPC-Producing Pseudomonas aeruginosa in Trinidad and Tobago. Journal of Clinical Microbiology. 2009;47:2670-1. [ Links ]
5. Villegas MV, Lolans K, Correa A, Suarez CJ, Vallejo M, Quinn JP, et al. First detection of the plasmid-mediated class A carbapenemase KPC-2 in clinical isolates of Klebsiella pneumoniae from South America. Antimicrob. Agents Chemother. 2006;50:2880-2. [ Links ]
6. Villegas MV, Lolans K, Correa A, Kattan JN, Lopez JA, Quinn JP, et al. First identification of Pseudomonas aeruginosa isolates producing a KPC-type carbapenem-hydrolyzing ß -lactamase. Antimicrob. Agents Chemother. 2007;51:1553-5. [ Links ]
7. Cuzon G, Naas T, Villegas MV, Correa A, Quinn JP, Nordmann P. Wide dissemination of Pseudomonas aeruginosa producing ß -lactamase blaKPC-2 gene in Colombia. Antimicrob. Agents Chemother. 2011;55:5350-3. [ Links ]
8. Clinical and Laboratory Standards Institute. Methods for dilution antimicrobial susceptibility tests for bacteria that grow aerobically. Approved standard 8th ed. M07-A8. Wayne, PA: Clinical and Laboratory Standards Institute; 2009. [ Links ]
9. Subcomisión de Antimicrobianos (SADEBAC-AAM). Asociación Argentina de Microbiología. Caracterización fenotípica de la resistencia a los ß -lactamicos en Pseudomonas aeruginosa y Acinetobacter spp . Disponible en: http://www.aam.org.ar/descarga2.asp?CaracPaeyAcineto.pdf [ Links ]
10. Coudron P, Moland E, Thomson K. Occurrence and Detection of AmpC Beta-Lactamases among Escherichia coli, Klebsiella pneumoniae, and Proteus mirabilis Isolates at a Veterans Medical Center. Journal of Clinical Microbiology. 2000;38:1791-6. [ Links ]
11. Clinical and Laboratory Standards Institute. Performance standards for antimicrobial susceptibility testing; Nineteenth informational supplement M100-S19: Wayne, PA: Clinical and Laboratory Standards Institute; 2009. [ Links ]
12. Martínez P, Mercado M, Mattar S. Determinación de ß -lactamasas de espectro extendido en gérmenes nosocomiales Del Hospital San Jerónimo de Montería. Colombia Médica. 2003;34:196-205. [ Links ]













