Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Infectio
Print version ISSN 0123-9392
Infect. vol.17 no.1 Bogotá Jan./Mar. 2013
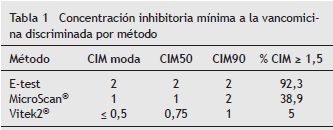
COMUNICACIÓN BREVE Identificación de Staphylococcus aureus meticilino resistente con concentración inhibitoria mínima elevada a la vancomicina mediante los métodos de E-test y automatizados Adriana Jiménez Rojas* y Claudia Fajardo Uribe Hospital de San José-Fundación Universitaria de Ciencias de la Salud, Bogotá, Colombia Recibido el 1 de octubre de 2012; aceptado el 3 de febrero de 2012 Resumen Objetivo: Comparar la identificación del Staphylococcus aureus meticilino resistente (SAMR) con concentración inhibitoria mínima (CIM) elevada a la vancomicina ( = 1,5 mg/L) obtenida mediante las pruebas de suceptibilidad realizadas con equipos automatizados y el método manual de E-test. Materiales y métodos: Determinación de la CIM a la vancomicina por los métodos de E-test, MicroScan ® y Vitek-2 ® en 118 aislamientos de SAMR identificados entre 2009 y 2010 en un hospital de tercer nivel de Bogotá, Colombia. Resultados: La prevalencia de SAMR con CIM = 1,5 mg/L fue de 92,3% por E-test, 38,9% por MicroScan ® y 5% por Vitek-2 ® . Las CIM de un mismo aislamiento, obtenidas por los 3 métodos fueron significativamente diferentes según la prueba de Friedman (P < 0,001). La correlación entre los 3 métodos fue escasa o nula. Conclusiones: El método de E-test permite identificar el mayor número de cepas de SAMR con CIM elevada a la vancomicina. Teniendo en cuenta que esta prueba es la que se relaciona mejor con el aumento en el riesgo de mortalidad, los laboratorios de microbiología deberían considerar su realización en aislamientos provenientes de sangre. © 2013 ACIN. Publicado por Elsevier España, S.L. Todos los derechos reservados. PALABRAS CLAVE Staphylococcus aureus; Vancomicina; Prueba de sensibilidad Bacteriana Identification of Methicillin-Resistant Staphylococcus aureus with High Minimum Inhibitory Concentrations for Vancomycin by E-test and Automated methods Abstract Objective: The aim of this study is to compare the methods of identification of methicillin-resistant Staphylococcus aureus (MRSA) with high vancomycin minimum inhibitory concentrations (MICs) ( = 1.5 mg/L) using automated testing methods and a manual E-test. Materials and Methods: We examined the vancomycin MIC among 118 MRSA isolates from 2009 to 2010 in a level 3 Hospital in Bogotá, Colombia, employing the E-test, MicroScan ® and Vitek-2 ® . Results: The prevalence of MRSA with MIC = 1.5 mg/L was 92.3% by E-test; 38.9% by MicroScan ® and 5% by Vitek-2 ® . The MICs obtained from the same isolate by the three methods were significantly different (P<0.001). The agreement between methods was little to null. Conclusions: The E-test method yielded the highest number of MRSA with high vancomycin MIC. This method best determines the increase in mortality risk; microbiology laboratories should consider implementing this test with blood isolates. © 2013 ACIN. Published by Elsevier España, S.L. All rights reserved. KEYWORDS: Staphylococcus aureus; Vancomycin; Microbial Sensitivity Test Introducción En el año 2006, el Instituto de Estándares Clínicos y de Laboratorio disminuyó el punto de corte de sensibilidad a la vancomicina del Staphylococcus aureus de 4 a 2 µ g/ml debido a que se detectaron 60% de fallas terapéuticas con las cepas que tenían concentración mínima inhibitoria (CIM) de 4 µ g/ml 1. Sin embargo, desde entonces, ha aumentado la evidencia que relaciona un aumento en la mortalidad y la morbilidad de los pacientes con infecciones por S. aureus meticilino resistente (SAMR) con CIM > 1 mg/L y el tratamiento con vancomicina, al parecer, derivadas de la dificultad de alcanzar el parámetro farmacológico área bajo la curva/CIM = 400 2. La incidencia del SAMR con CIM elevada a la vancomicina ( = 1,5 mg/L) varía según la localización geográfica, y ha sido establecida por los sistemas de vigilancia de algunos países, encontrando un rango amplio de distribución con porcentajes bajos como los del estudio SENTRY, realizado entre 1998-2003 (4,5-6,7%), que contrasta con el resultado de un estudio en un centro de la ciudad de Nueva York que fue de 96% 3,4 . También se ha logrado detectar una tendencia en el tiempo de aumento gradual de la CIM a la vancomicina del SAMR, fenómeno denominado con el vocablo creep por los angloparlantes. En España, el estudio VIRA, realizado entre 2001 y 2006, mostró un aumento gradual de las cepas de SAMR con CIM > 1:6,5% en 2001; 21% en 2004 y 31% en 2006 5. Adicionalmente, la determinación de la CIM a la vancomicina del SAMR difiere según el método microbiológico empleado. El método de microdilución en caldo (MDC) constituye la prueba de oro para la determinación de la CIM, sin embargo, este método no se realiza de manera rutinaria en los laboratorios clínicos debido a la dificultad en la preparación de los paneles; en su lugar, el método más empleado es el automatizado, siendo el E-test reservado para algunas pruebas confirmatorias y laboratorios de investigación. El E-test establece valores de CIM para vancomicina 1 o 2 diluciones más altas que los métodos automatizados y que el de MDC. El estudio de Hsu en Estados Unidos evidenció que la determinación de la CIM elevada a la vancomicina por el método de E-test es la que mejor se relaciona con el desenlace clínico 6. El objetivo de este estudio fue comparar la identificación del SAMR con CIM elevada a la vancomicina ( = 1,5 mg/L) obtenida mediante las pruebas de susceptibilidad realizadas con equipos automatizados (Vitek2 ® y MicroScan ® ) y el método manual de E-test en el Hospital San José de Bogotá, Colombia. Material y métodos Se diseñó un estudio observacional en el Hospital San José de Bogotá (Colombia), un hospital universitario de tercer nivel y 300 camas. Se estableció la CIM a la vancomicina de aislamientos consecutivos no repetidos de SAMR provenientes de diferentes muestras de pacientes entre el año 2009 y 2010 empleando el método de E-test (tiras plásticas fabricadas por bioMérieux, Marcy- I´Etoile, Francia) con una escala de concentraciones de 0,016 a 256 µ g/mL y los métodos automatizados Vitek-2 ® (tarjeta de susceptibilidad antimicrobiana AST-P577 bioMérieux, Marcy-I´Etoile, Francia), rango de concentraciones de 0,5 a 32 µ g/mL para vancomicina, y MicroScan WalkAway ® System (panel para grampositivo tipo 29 B1017-209 Siemens Healthcare Diagnostics Inc. EE. UU.), rango de concentración para vancomicina de 0,25 a 16 g/mL. Como control de calidad se empleó la cepa de S. aureus ATCC 29213. Para establecer diferencias en la CIM de cada aislamiento obtenida por cada método, se empleó la prueba no paramétrica de Friedman para comparación de 3 o más grupos pareados, y para establecer el grado de variación (o grado de asociación sin establecer causalidad) entre los 3 métodos, la prueba de correlación de rangos de Kendall, empleando el programa StatsDirect 2.7.8. Resultados Se procesaron un total de 118 aislamientos de SAMR provenientes de diferentes muestras así: 63 de secreciones de tejidos blandos, 9 de hueso y articulaciones, 4 de colección intraabdominal, 13 de vía respiratoria, 4 de líquido cefalorraquídeo, 3 de orina, 2 de punta de catéter central, 17 de sangre, 2 de secreción ocular, y otra muestra. El mayor porcentaje de cepas con CIM = 1,5 mg/L se obtuvo mediante el método de E-test, mientras que la CIM50 y 90 más bajas se obtuvieron por el método Vitek-2 ® . La distribución de la CIM a la vancomicina comparativa por los 3 métodos se observa en la figura 1, y en la tabla 1 se presenta la CIM50, 90, la moda y el porcentaje de cepas con CIM = 1,5. No se encontró ninguna cepa con CIM > 2 mg/L por ninguno de los métodos empleados.
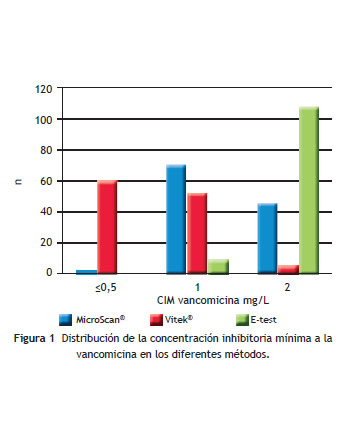
Las CIM de un mismo aislamiento, obtenidas por los 3 métodos, fueron significativamente diferentes según la prueba de Friedman ( × 2 [2 grados de libertad] = 204,30287; P < 0,001). La CIM por el método de E-test fue superior que la obtenida por los métodos MicroScan ® (p < 0,001) y Vitek-2 ® (p< 0,001), y la obtenida por MicroScan ® superior a la de Vitek-2 ® (p < 0,001).
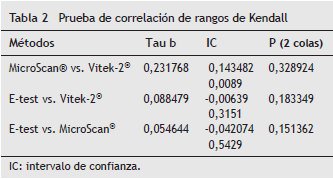
La correlación obtenida entre los 3 métodos fue escasa o nula. En la tabla 2 se presentan los resultados de la prueba de correlación de rangos de Kendall.
Discusión
En este estudio, la prevalencia de cepas de SAMR con CIM elevada a la vancomicina ( = 1,5 mg/L) establecida por el método de E-test fue de 92,3%. Este alto porcentaje es similar al encontrado en estudios provenientes de Estados Unidos y superior a lo hallado en España. En Latinoamérica, se desconoce la magnitud del fenómeno 4,5,7.
La CIM establecida por E-test fue en promedio 0,5 y 1 mg/L superior a la encontrada por los métodos automatizados MicroScan ® y Vitek-2 ® , respectivamente (resultados obtenidos al aproximar la CIM por E-test a la dilución doble superior). La CIM determinada por MicroScan ® fue en promedio 0,6 mg/L superior a la de Vitek-2 ® ; estas diferencias alcanzaron la significancia estadística según la prueba de Friedman. Se encontró una significativa ausencia de independencia al correlacionar los 2 métodos automatizados.
Los hallazgos de este estudio son similares a los reportados por las pocas investigaciones que han comparado el método de E-test con los automatizados. El estudio de Hsu en Japón estableció la CIM elevada a la vancomicina en 71% por E-test; 72% por MicroScan ® ; 41% por Vitek-2 ® y 7% por MDC 6. Los estudios de Edwards en Reino Unido y van Hal en Australia encontraron que la CIM por Vitek-2 ® fue inferior a la de E-test, pero no compararon con MicroScan ® 8,9. Bland estableció CIM = 1,5 mg/L en 90 y 56% por E-test y MicroScan ® , respectivamente, pero sin comparar con Vitek-2 ®10. Las CIM50 y 90 determinadas en este estudio para los métodos E-test y MicroScan ® son iguales a las encontradas en el estudio de Nakashima en Japón 11.
Este estudio tiene como limitante que no se determinó la CIM por el método de MDC; sin embargo, diferentes estudios han reportado concentraciones inhibitorias mínimas 0,5-1 log 2 diluciones superiores por E-test comparadas con MDC 12-14.
El aumento en la frecuencia de aislamientos de SAMR con una CIM elevada a la vancomicina ( = 1,5 mg/L) es un fenómeno en aumento en el ámbito mundial al que se debe prestar particular atención debido a la dificultad de alcanzar el parámetro farmacológico área bajo la curva/CIM para este antibiótico, lo que se traduce en un aumento en el riesgo de mortalidad en los pacientes infectados con estas cepas.
Teniendo en cuenta la pobre correlación que existe entre las diferentes pruebas de susceptibilidad, que la CIM por los métodos automatizados arroja valores inferiores a las obtenidas por el método E-test y el hecho de que la CIM obtenida por este último método es la que mejor se relaciona con un aumento en el riesgo de mortalidad en particular en los pacientes con bacteremia, los laboratorios de microbiología deberían considerar la implementación de la realización de la prueba de E-test para los aislamientos de SAMR provenientes de sangre. Esta medida conduciría a la detección de un mayor número de SAMR con CIM elevada a vancomicina, lo que permitiría al clínico vigilar con rigurosidad la evolución de los pacientes en tratamiento con este antibiótico, evaluar oportunamente la posibilidad de cambiar el antimicrobiano y obtener un mejor desenlace.
Financiación
Este estudio fue financiado por la Fundación Universitaria de Ciencias de la Salud, Bogotá, Colombia.
Conflicto de intereses
Los autores declaran que no tienen ningún conflicto de intereses.
* Autor para correspondencia.
Correo electrónico: ajimenez@hospitaldesanjose.org.co (A. Jiménez Rojas).
0123-9392/$ - see front matter © 2013 ACIN. Publicado por Elsevier España, S.L. Todos los derechos reservados.
Bibliografía
1. Rybak M, Lomaestro B, Rotschafer J, Moellering R, Willam R, Craig A, et al. Vancomycin Therapeutic Guidelines: A Summary of Consensus Recommendations from the Infectious Diseases Society of America, the American Society of Health-System Pharmacists, and the Society of Infectious Diseases Pharmacists. Clin Infect Dis. 2009;49:325-7. [ Links ]
2. Van Hal SJ, Lodise TI, Paterson DL. The clinical significance of vancomycin minimum inhibitory concentrations in Staphylococcus aureus infections: a systematic review and meta-analysis. Clin Infect Dis. 2012;54:755-71. [ Links ]
3. Jones RN. Microbiological features of vancomycin in the 21st century: minimum inhibitory concentration creep, bactericidal/static activity, and applied breakpoints to predict clinical outcomes or detect resistant strains. Clin Infect Dis. 2006;42(Suppl 1);S13-24. [ Links ]
4. Kim A, Sakoulas G, Kuti J, Nicolau D. Prevalence of Methicillin-Resistant Staphylococcus aureus Strains With Vancomycin Minimum Inhibitory Concentration 2 µ g/mL in New York City Area Hospitals and Implications on pharmacodynamic Target Attainment. Infect Dis Clin Pract. 2009;17:95-8. [ Links ]
5. Picazo JJ, Betriu C, Rodríguez-Avial I, Culebras E, Gómez M, López F. Antimicrobial resistance surveillance: VIRA STUDY 2006. Enferm Infecc Microbiol Clin. 2006;24:617-28. [ Links ]
6. Hsu DI, Hidayat LK, Quist R, Hindler J, Karlsson A, Yusof A, et al. Comparison of method-specific vancomycin minimum inhibitory concentration values and their predictability for treatment outcome of meticillin-resistant Staphylococcus aureus (MRSA) infections. Int J Antimicrob Agents. 2008;32:378-85. [ Links ]
7. Rojas L, Bunsow E, Muñoz P, Cercenado E, Rodríguez-Créixems M, Bouza E. Vancomycin MICs do not predict the outcome of methicillin-resistant Staphylococcus aureus bloodstream infections in correctly treated patients. J Antimicrob Chemother. 2012;67:1760-8. [ Links ]
8. Edwards B, Milne K, Lawes T, Cook I, Robb A, Gould IM. Is Vancomycin MIC ´Creep´´ Method Dependent? Analysis of methicillin- Resistant Staphylococcus aureus Susceptibility Trends in Blood Isolates from North East Scotland from 2006 to 2010. J Clin Microbiol. 2012;50:318-25. [ Links ]
9. Van Hal SJ, Barbagiannakos T, Jones M, Wehrhahn MC, Mercer J, Chen D, et al. Methicillin-resistant Staphylococcus aureus vancomycin susceptibility testing: methodology correlations, temporal trends and clonal patterns. J Antimicrob Chemother. 2011;66:2284-7. [ Links ]
10. Bland CM, Porr WH, Davis KA, Mansell KB. Vancomycin MIC susceptibility testing of methicillin-susceptible and methicillin-resistant Staphylococcus aureus isolates: a comparison between E-test and an automated testing method. South Med J. 2010;103:1124-8. [ Links ]
11. Nakashima H, Kameko M, Takahashi H, Saito H. Comparing antimicrobial susceptibility of meticillin-resistant Staphylococcus aureus (MRSA) to vancomycin using MicroScan ® (Pos Combo 3.1J) and conventional methods. Int J Antimicrob Agents. 2010;36:291-3. [ Links ]
12. Sader HS, Rhomberg PR, Jones RN. Nine-hospital study comparing broth microdilution and Etest method results for vancomycin and daptomycin against methicillin-resistant Staphylococcus aureus . Antimicrob Agents Chemother. 2009;53:3162-5. [ Links ]
13. Ip M, Chau S, Lai Lui S, Leung E, Ling T. Vancomycin minimum inhibitory concentrations (MICs) for meticillin-resistant Staphylococcus aureus (MRSA) in Hong Kong. Int J Antimicrob Agents. 2010;36:386-7. [ Links ]
14. Prakash V, Lewis JS, Jorgensen JH. Vancomycin MICs for methicillin- resistant Staphylococcus aureus isolates differ based upon the susceptibility test method used. Antimicrob Agents Chemother. 2008;52:4528. [ Links ]













