Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Infectio
Print version ISSN 0123-9392
Infect. vol.17 no.2 Bogotá Jan./June 2013
ORIGINAL
Estrategias para la implementación y reporte de los puntos de corte CLSI vigentes y pruebas fenotípicas confirmatorias para BLEE y carbapenemasas en bacilos Gram negativos en laboratorios clínicos de Colombia
Germán Esparzaa,*, Beatriz Arizab, Ana María Bedoyac, Ingrid Bustosd, Claudia Rocío Castañeda-Ramireze, Elsa De la Cadenaf, María Nilse González de Ariasg, Liliana Guerrero Mónicah, Aura Lucia Leali, Adriana Marínj, Marta Patricia Meléndezk, Clara Luz Ricol, María Virginia Villegasfy Comité de Resistencia Bacteriana e IAAS ACIN
a Programa de aseguramiento de la Calidad en el Laboratorio. PROASECAL SAS, Bogotá, Colombia
b Sección de Microbiología, Laboratorio Clínico, Hospital Universitario San Ignacio, Bogotá, Colombia
c Sección de Microbiología, Laboratorio Clínico, Hospital Pablo Tobón Uribe, Medellín, Colombia
d Sección de Microbiología, Laboratorio Clínico, Fundación Clínica Shaio, Bogotá, Colombia
e Sección de Microbiología, Laboratorio Clínico, Fundación Clínica Valle del Lili, Cali, Colombia
f Centro Internacional de Entrenamiento e Investigaciones Médicas CIDEIM, Cali, Colombia
g Sección de Microbiología, Laboratorio Clínico, Hospital Militar Central, Bogotá, Colombia
h Sección de Microbiología, Laboratorio Clínico, Fundación Hospital San Pedro, Pasto, Colombia
i Facultad de Medicina, Universidad Nacional, Bogotá, Colombia
j Sección de Microbiología, Laboratorio Clínico, Clínica General del Norte, Barranquilla, Colombia
k Sección de Microbiología, Laboratorio Clínico, Hospital Central de la Policía, Bogotá, Colombia
l Sección de Microbiología, Laboratorio Clínico, Fundación Santa Fe, Bogotá, Colombia
Recibido el 3 de febrero de 2013; aceptado el 6 de septiembre de 2013
Resumen En 2010, el Instituto Americano de Estándares Clínicos y de Laboratorio (CLSI) inició un proceso de revisión y actualización de los puntos de corte para microdilución y disco difusión para cefalosporinas (cefazolina, cefotaxima, ceftriaxona, ceftizoxima, ceftazidima), monobactámicos (aztreonam) y carbapenémicos (imipenem, meropenem, ertapenem, doripenem). Los cambios se basaron en modelos PK/PD que buscan predecir la respuesta clínica con el uso exclusivo de la concentración inhibitoria mínima (CIM) y esquemas específicos de dosificación de forma independiente al mecanismo de resistencia expresado. Este nuevo paradigma eliminaría la necesidad de realizar pruebas fenotípicas para beta-lactamasas de espectro extendido (BLEE) y carbapenemasas para tomar decisiones terapéuticas y permitiría utilizarlas únicamente para fines epidemiológicos. Sin embargo, ante las limitaciones de las metodologías actuales para pruebas de susceptibilidad en Colombia, el desconocimiento de estos cambios y la alarma epidemiológica por la aparición de nuevas ß-lactamasas en el país, se hace necesario generar recomendaciones para los laboratorios clínicos, con el fi n de unifi car los criterios para la realización e informe de los antibiogramas en bacilos Gram negativos, incluyendo la implementación de los puntos de corte actuales y la aplicación de las pruebas fenotípicas para la detección de BLEE y carbapenemasas.
© 2013 ACIN. Publicado por Elsevier España, S.L. Todos los derechos reservados.
PALABRAS CLAVE
Puntos de corte; ß-lactamasas; Cefalosporinas; Carbapenemasas; Interpretación
Strategies for implementation and reporting of current CLSI Breakpoints and phenotypic confirmatory tests for ESBLs and carbapenemases in Gram-negative bacilli in Colombian clinical laboratories
Abstract
In 2010, the Clinical and Laboratory Standards Institute (CLSI) began a process to revise and update the breakpoints for broth microdilution and disk diffusion for cephalosporins (Cefazolin, Cefotaxime, Ceftriaxone, Ceftazidime), monobactams (Aztreonam) and carbapenems (Imipenem, Meropenem, Ertapenem and Doripenem). The changes made were based on PK/PD models that attempt to predict clinical outcomes using minimum inhibitory concentration (MIC) and specific dosage regimens, regardless of the resistance mechanism expressed by the organism. The new breakpoints would eliminate the need to perform screening and confirmatory testing for ESBLs and carbapenemases for treatment decisions, and thus they would be used only for infection control purposes. Nevertheless, there are limitations to current methods in Colombia, a lack of knowledge regarding the recent changes and epidemiologic alarm over new B-lactamases spreading in our country. Therefore it was necessary to formulate and issue recommendations for clinical laboratories, with the aim of standardizing the criteria for reports on antibiograms in Gram-negative bacilli, including the current CLSI breakpoints and applying phenotypic confirmatory testing to detect ESBLs and Carbapenemases.
© 2013 ACIN. Published by Elsevier España, S.L. All rights reserved.
KEYWORDS:
Breakpoint; ß-lactamases; Cephalosporins; Carbapenemases; Interpretation
Introducción
Los puntos de corte (PC) que se utilizan para categorizar a una bacteria como sensible, intermedia o resistente a la acción de un antimicrobiano específico son establecidos entre otros por el Instituto Americano de Estándares Clínicos y de Laboratorio (CLSI) y por el Comité Europeo de Pruebas de Susceptibilidad Antimicrobiana (EUCAST). Estos puntos de corte se revisan con base en la aparición de nuevos mecanismos de resistencia, un mejor entendimiento de los determinantes farmacológicos de respuesta terapéutica y la necesidad de mejorar la práctica clínica 1-5.
En 2010, el CLSI inició un proceso de revisión y actualización de los puntos de corte para microdilución y difusión con disco para cefalosporinas (cefazolina, cefotaxima, ceftriaxona, ceftizoxima, ceftazidima), monobactámicos (aztreonam) y carbapenémicos 1,2 (imipenem, meropenem, ertapenem, doripenem). Los PC para cefepima, cefuroxima parenteral, cefoxitina y cefotetan fueron revisados pero no modificados 1,2.
Los cambios se basaron en modelos PK/PD que buscan predecir la respuesta clínica con el uso exclusivo de la concentración inhibitoria mínima (CIM) y esquemas específicos de dosificación de forma independiente al mecanismo de resistencia expresado. Este nuevo paradigma eliminaría la necesidad de realizar pruebas fenotípicas de BLEE y carbapenemasas para tomar decisiones terapéuticas y permitiría utilizarlas con fines epidemiológicos únicamente 1-3,6-8.
Sin embargo, dichos cambios han generado controversia, en relación con los siguientes aspectos:
• Datos clínicos limitados: el desenlace terapéutico es incierto con similar número de éxitos y fracasos en el tratamiento de productores de BLEE con cefalosporinas y de productores de KPC con carbapenémicos 9 .
• Consideraciones técnicas: los sistemas automatizados son incapaces de implementar los nuevos criterios interpretativos y hay variabilidad en los resultados obtenidos por metodologías manuales 10-12 (ej., difusión).
• Impacto sobre la epidemiología: eliminar el reporte de los mecanismos de resistencia puede tener repercusiones negativas en el control de infecciones 13.
El panorama colombiano de la resistencia antimicrobiana en bacilos Gram negativos es dinámico y se extiende de manera alarmante 14-18. Los mecanismos de resistencia de tipo enzimático ( ß -lactamasas) se han diversificado y aparecen en especies inusuales de la familia Enterobacteriaceae y también en microorganismos no fermentadores como P. aeruginosa y A. baumannii.
Este documento busca generar recomendaciones para el tamizaje de la resistencia bacteriana de mayor impacto clínico y epidemiológico en bacilos Gram negativos incluyendo la adherencia a los puntos de corte vigentes y la aplicación e informe de las pruebas confirmatorias para BLEE y carbapenemasas.
Cefalosporinas de primera generación
a) Cefalotina: a partir del año 2010, CLSI ubicó cefalotina en el Grupo U de la tabla 1A (para reporte en aislamientos del tracto urinario), con base en la no disponibilidad de cefalotina EV en Estados Unidos. También eliminó los PC para infecciones sistémicas, estableciendo como su único objetivo predecir la actividad de las cefalosporinas orales (cefadroxilo, cefpodoxima, cefalexina, loracarbef) en el tratamiento de infección del tracto urinario 2 (ITU).

Sugerencia para el laboratorio
Con el objetivo único de predecir la actividad de las cefalosporinas orales empleadas en el manejo de ITU, puede probarse cefalotina utilizando los puntos de corte vigentes y extrapolar su resultado a las cefalosporinas orales como cefalexina (tabla 1).
Recomendaciones
• Revisar internamente en la Institución si existe prescripción de cefalotina endovenosa (EV) y discutir con el comité de infecciones institucional las acciones a seguir, ante la ausencia de PC para esta indicación.
• Para instituciones cuyo sistema automatizado no contiene cefalotina, se sugiere la aplicación de una metodología alternativa como disco difusión 19.
• Los resultados de cefazolina y cefalotina no son intercambiables 1,2 .
• El resultado de cefalotina y las cefalosporinas orales solo debe informarse en E. coli , Klebsiella species y Proteus mirabilis 7.
• Suprimir cefalotina del antibiograma en Enterobacteriaceae productor de BLEE o reportar como "R" si es solicitada por el médico tratante 20.
b) Cefazolina: para instituciones que tengan cefazolina en su formulario y en los pacientes candidatos a recibir terapia con esta molécula se sugiere considerar las siguientes dos situaciones 21:
• Infecciones del tracto urinario: Considerando la posibilidad de un aumento en la tasa de resistencia a cefazolina en bacterias tipo salvaje (sin mecanismos de resistencia adquirida) tan solo con la aplicación del punto de corte vigente, la concentración urinaria del fármaco y los datos clínicos disponibles en la literatura, se sugiere utilizar el PC CLSI 2009 (M100-S19) para aislamientos provenientes de cultivos de orina (tabla 2).

Recomendaciones para el laboratorio
• Incluir en el reporte el siguiente comentario: " La dosificación recomendada es 2 g c/8 horas ".
• El resultado de cefazolina solo debe informarse en E. coli , Klebsiella species y Proteus mirabilis . Eliminar su reporte en especies diferentes de Enterobacteriacea 21,22.
• Suprimir cefazolina del antibiograma en Enterobacteriaceae productor de BLEE o reportar como "R" si es solicitada por el médico tratante 20,23.
• Para instituciones cuyo sistema automatizado no contiene cefazolina, se sugiere la aplicación de una metodología alternativa como la disco difusión usando los PC CLSI 2009 como se describe en la tabla.
• Si el hospital tiene en su protocolo de manejo antibiótico cefazolina, las pruebas de susceptibilidad in vitro deben hacerse con este compuesto (cefazolina).
• Infección del torrente sanguíneo (Bacteriemia): siguiendo las recomendaciones actuales de la CLSI y los modelos de predicción basados en PK/PD para cefazolina, se sugiere utilizar el PC CLSI 2012 (M100-S22) para aislamientos no urinarios. Estos se describen a continuación 21 (tabla 3).
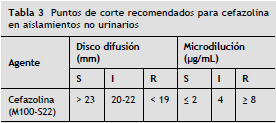
Recomendaciones para el laboratorio
• El uso de cefazolina en bacteremia está supeditado a criterio médico.
• Incluir en el reporte el siguiente comentario: " La dosificación recomendada es 2 g c/8 horas".
• El resultado de cefazolina solo debe informarse en E. coli , Klebsiella species y Proteus mirabilis. Eliminar su reporte en especies diferentes.
• Suprimir cefazolina del antibiograma en Enterobacteriaceae productor de BLEE o reportar como "R" si es solicitada por el médico tratante 20.
• Tener en cuenta que la especie Proteus mirabilis puede presentar resultados falsos "R" a cefazolina usando los PC vigentes. Discutir con el comité de infecciones las acciones a seguir para abordar este punto o considerar el uso de un agente alterno en esta especie 21 .
• Para instituciones cuyo sistema automatizado no contiene cefazolina o no se cuenta con las diluciones suficientes para implementar los puntos de corte vigentes, se sugiere la aplicación de una metodología alternativa como la disco difusión usando los PC 2012 (M100-S22) como se describe en este documento.
Cefalosporinas de tercera y cuarta generación enEnterobacteriaceae
Consideración: hasta el año 2009, CLSI recomendó la realización de la prueba de BLEE para aislamientos con susceptibilidad disminuida a una o múltiples cefalosporinas de tercera generación y/o aztreonam. La recomendación para aislamientos BLEE (+) era cambiar el resultado a R de todas las cefalosporinas (incluyendo cefepima) y aztreonam de forma independiente a la CIM obtenida 20.
Después de estudios PK/PD, distribuciones de CIM y datos clínicos limitados, CLSI resuelve en 2010 el cambio de los PC y recomienda el uso de la prueba confirmatoria de BLEE únicamente con fines epidemiológicos y de control de infecciones. No se requeriría la edición del resultado final 6-8.
Para la situación de la resistencia bacteriana en Colombia se considera importante implementar los PC vigentes en M100-S22 al menos para ceftriaxona/cefotaxima y ceftazidima (usar otras cefalosporinas y aztreonam puede aumentar la sensibilidad) y continuar con la confirmación de BLEE, teniendo como argumento la imposibilidad de basarse únicamente en los resultados del antibiograma (S/I/R) para predecir el éxito de una terapia con cefalosporinas 9,24-26, y la necesidad urgente de instaurar programas de gerenciamiento de antibióticos que garanticen un uso racional de los antimicrobianos utilizando moléculas con la menor presión selectiva posible.
a) Cefalosporinas de la clase III: se debe implementar el PC vigente de la CLSI 2012 (M100-S22) al menos para ceftriaxona/cefotaxima y ceftazidima como se describe a continuación (tabla 4):
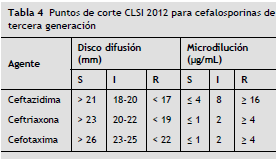
Aplicación de la prueba confirmatoria de beta-lactamasas de espectro extendido
Aún con la implementación de los PC CLSI vigentes, se debe continuar realizando la prueba confirmatoria para la detección de BLEE cuando se cumpla al menos una de las siguientes características (tabla 5 y tabla 6):
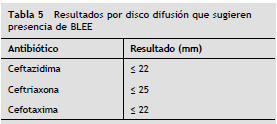

• Criterio de informe en aislamientos BLEE (+): para todos los aislamientos de Enterobacteriacea que sean positivos para la prueba de BLEE debe editarse el reporte final de todas las cefalosporinas y aztreonam a resistente e incluir el siguiente pie de nota: "Se sugiere aislamiento de contacto y consulta con el servicio de control de infecciones".
• Sugerencia: para microorganismos productores de AmpC cromosomal ( Enterobacter, Serratia, Morganella, Citrobacter freundii, Providencia, Hafnia alvei, Proteus vulgaris, Aeromonas, Yersinia) , puede incluirse el siguiente pie de nota en el reporte del antibiograma: "Este microorganismo puede desarrollar resistencia durante la terapia prolongada con cefalosporinas de tercera generación como resultado de la de-represión de la betalactamasa AmpC.
Se sugiere considerar un agente alterno" 1,22.
Recomendaciones para el laboratorio
• Realizar la prueba confirmatoria de BLEE disponible en su laboratorio (manual o automatizada).
• Discutir internamente con el comité de infecciones institucional, el reporte de las cefalosporinas de tercera generación en aislamientos BLEE (+) y en productores de AmpC cromosomal ( Enterobacter, Morganella, Serratia, Citrobacter freundii, etc.).
• Realizar un estricto control del inóculo para evitar falsos positivos y negativos en la prueba de BLEE.
• Validar sus resultados con base en el control de calidad interno y externo de las pruebas de susceptibilidad.
• No se recomienda la edición del resultado cuantitativo de las CIM. Debe conservarse como fue obtenido por el antibiograma.
Únicamente se modifica la interpretación final.
• Si el sistema utilizado en el laboratorio no permite una aplicación de los PC vigentes, puede emplearse un método alterno como disco difusión con los PC descritos en este documento.
Sugerencia: antes de validar el resultado final, se requiere confirmar con una metodología alterna (disco difusión o E-test) en las siguientes situaciones 23:
• Resultado BLEE (+) y sensibilidad a Amp/sulbactam y cefalosporinas de primera y segunda generación, ya que las beta-lactamasas de espectro extendido hidrolizan con eficiencia estas moléculas. Un resultado de sensibilidad puede significar un falso positivo por errores en el montaje o en el sistema automático utilizado para su detección.
• Resultado test BLEE (?) y resistencia a cefalosporinas, aztreonam, y piperacilina-tazobactam en productores no cromosomales de AmpC. Este fenómeno puede explicarse por una alta expresión de BLEE que no permite la detección in vitro al no conseguirse la reducción en 3 diluciones dobles recomendado por CLSI o también puede deberse a la co-expresión plasmídica de cefalosporinasas AmpC
• Se observa test BLEE (+), resistencia a combinación ß-lactamico + inhibidor de ß -lactamasa y cefalosporinas sensibles que puede sugerir hiperproducción de TEM o producción de TEM resistentes a inhibidores (IRT).
Comentarios
1. En los aislamientos productores de BLEE que presenten sensibilidad a piperacilina/tazobactam, las acciones sobre el resultado serán decisión del comité de infecciones institucional. Pueden obtenerse resultados adecuados en infecciones leves o de bajo inóculo (ejemplo: infección urinaria, tejidos blandos). Sin embargo, para infección severa como Bacteremia o neumonía, se sugiere la interconsulta con el servicio de Infectología 25,27.
2. La prueba de BLEE puede verse afectada por alguna de las siguientes circunstancias:
a ) BLEE con CIM por debajo del PC para las cefalosporinas de tercera generación, lo cual puede dificultar su detección.
b ) Alta producción de BLEE (MIC > 64 µg/mL), porque no consigue cumplir con la regla de reducir en 3 logs la CIM comparado con las concentraciones de ácido clavulánico.
c ) La co-existencia de BLEE + AmpC plasmídica puede dificultar la detección al comportarse como resistentes al ácido clavulánico y las cefamicinas 23,28.
3. Ante la posibilidad de falla terapéutica con resultados sensibles para cefalosporinas de tercera generación en productores de AmpC cromosomal como Enterobacter , Serratia, Citrobacter , Morganella, Providencia, etc., debe discutirse con el comité de infecciones institucional las acciones a tomar sobre estos resultados. Estas incluyen supresión, paso a resistente o una nota al pie en el antibiograma.
d ) Cefalosporinas de la clase IV: los PC de CLSI para cefepima no han sufrido modificaciones a la fecha de elaboración del presente manuscrito. Sin embargo se sugiere el cambio de la interpretación a "R" cuando se tengan resultados BLEE (+). Las CIM deben conservarse como se obtuvieron en el antibiograma 26.
NOTA: Para los laboratorios que utilizan sistemas automatizados y cuyos paneles/tarjetas no contienen las diluciones necesarias para implementar los puntos de corte vigentes, se recomienda consultar con la casa comercial para la adquisición de nuevas referencias y la actualización del software que permita una rápida incorporación a los criterios interpretativos objeto de este documento.
Carbapenémicos enEnterobacteriaceae
Consideración: hasta enero del año 2010, CLSI recomendó la realización de la prueba de Hodge modificada (MHT) para la detección de carbapenemasas en Enterobacteriaceae y en los resultados positivos, debía liberarse el reporte con la CIM obtenida sin interpretación de S/I/R y escribir un pie de nota sobre la falta de evidencia clínica en el uso de carbapenémicos en esta situación. Después de estudios PK/PD, distribuciones de CIM y datos clínicos limitados, CLSI resuelve en junio de 2010 el cambio de los PC, y recomienda el uso de la prueba de Hodge modificada (MHT) únicamente con fines epidemiológicos y de control de infecciones.
No se requieren acciones sobre el resultado final 1.
Para la situación colombiana se considera importante implementar los puntos de corte actuales para los carbapenémicos en CLSI M100-S22 (ertapenem, imipenem, meropenem y doripenem) y continuar con la realización del test de Hodge modificado (MHT), teniendo como argumento la imposibilidad de basarse únicamente en los resultados del antibiograma (S/I/R) para predecir el éxito de una terapia con carbapenémicos y la necesidad de apoyar el control de infecciones y evitar la expansión de productores de carbapenemasas 29.
Estrategia para el laboratorio
a) Implementar los PC vigentes (tabla 7).
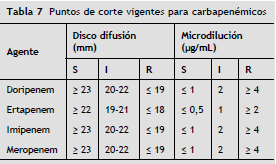
b) Aplicar la prueba de Hodge modificada (MHT).
Realizar la prueba de Hodge modificada únicamente para la familia Enterobacteriaceae (no realizar en P. aeruginosa o A.baumannii ) y cuando se cumpla con las siguientes
condiciones:
• Se obtenga un resultado resistente a una o más cefalosporinas de tercera generación (ceftriaxona/cefotaxima y ceftazidima). Aplicando los PC CLSI vigentes en M100-S22.
• Se obtenga un resultado resistente a ertapenem (CIM = 2 µg/mL o zona de diámetro = 18 mm) y/o un resultado intermedio o resistente a meropenem (CIM = 2 µg/mL o zona de diámetro 20-22 mm), de acuerdo a los PC CLSI vigentes en M100-S22.
Esta estrategia pretende reducir la aparición de falsos positivos ocasionados por mecanismos diferentes como AmpC y/o BLEE con impermeabilidad y además pretende detectar las carbapenemasas más importantes desde el punto de vista clínico 23,29-31. Adicionalmente, usar ertapenem en lugar de imipenem para la prueba de Hodge modificada favorece la detección de carbapenemasas en Klebsiella y la unificación y generalización de criterios, considerando que, con los nuevos PC, Proteus, Morganella y Providencia serían considerados intrínsecamente resistentes a imipenem.
NOTA: La disco difusión con imipenem es una metodología de baja sensibilidad para detectar carbapenemasas 1.
Recomendación: En las Enterobacteriaceae probadas por disco difusión que sean MHT (+) se sugiere realizar CIM antes de reportar los carbapenémicos, ya que este resultado tiene una mejor predicción de la respuesta terapéutica 32.
Proteus species, Providencia species y Morganella species pueden tener CIMs elevados a imipenem por mecanismos no relacionados a la producción de carbapenemasas, por lo cual la utilidad de la CIM de imipenem como prueba de tamizaje para carbapenemasas en estos géneros no se encuentra bien establecida. Se sugiere iniciar la búsqueda de carbapenemasas en estos géneros a partir de una CIM de 4 µg/mL para imipenem y 2 µg/mL para ertapenem y meropenem 1.
NOTA: En varios estudios doripenem ha demostrado ser muy estable a la acción de las carbapenemasas y tener baja sensibilidad para su detección. No se recomienda como prueba de tamizaje 33.
Criterio de reporte
a ) Para TODOS los aislamientos de Enterobacteriacea que sean positivos para una MHT, debe incluirse en el reporte la CIM obtenida para los carbapenémicos, conservar la interpretación de acuerdo a los puntos de corte vigentes e incluir el siguiente pie de nota: "Organismo con posible producción de carbapenemasas. Se sugiere aislamiento de contacto y consulta con el servicio de control de infecciones".
b ) Considerando las limitaciones del MHT para detectar carbapenemasas diferentes a KPC, se recomienda que, para los aislamientos de Enterobacteriaceae con resultados I/R para carbapenémicos que sean negativos para una MHT, debe incluirse en el reporte la CIM obtenida, conservar la interpretación de acuerdo a los PC vigentes e incluir el siguiente pie de nota: "Se sugiere aislamiento de contacto y consulta con el servicio de control de infecciones".
Comentario
No todos los aislamientos de Enterobacteriacea productores de carbapenemasas son MHT (+) y resultados de MHT (+) pueden encontrarse en aislamientos con mecanismos de resistencia a carbapenémicos diferentes a la producción de carbapenemasas 1,14. Pueden utilizarse pruebas con inhibidores de beta-lactamasas (ácido borónico, EDTA/SMA) de acuerdo a la disponibilidad del laboratorio y seguir las recomendaciones del Instituto Nacional de Salud para la notificación y remisión a los laboratorios de salud pública, departamentales o distritales, de cepas con el perfil que sugiera la presencia de metalocarbapenemasas (EDTA/SMA positivo), dada la emergente circulación de NDM en Colombia.
Recomendaciones
• Realizar un estricto control del inóculo para evitar falsos positivos y negativos en el test de Hodge modificado (MHT). Esto puede conseguirse con la implementación de turbidimetría.
• Validar sus resultados con base en el control de calidad.
Incluir siempre en el programa de control de calidad interno la cepa K. pneumoniae ATCC BAA-1705 MHT (+) 1.
• Vincularse a un programa de control de calidad externo que evalúe su desempeño de acuerdo con la metodología empleada en su laboratorio, que genere una calificación y asesoría personalizada y que apoye el alcance de sus objetivos de calidad.
• Para aislamientos MHT (+) no se recomienda la edición del resultado cuantitativo de las CIM ni la interpretación del resultado final a R; debe conservarse como fue obtenido por el antibiograma y siempre incluir el pie de nota para generar precauciones de contacto y ajustar el manejo terapéutico si se requiere.
• Si el sistema utilizado en el laboratorio no permite una aplicación de los PC vigentes, puede emplearse un método alterno como disco difusión con los PC descritos en este documento.
• Para aislamientos que sean MHT (+), el reporte de la CIM ofrece un mayor apoyo a la toma de decisiones terapéuticas 32 .
Sugerencia: antes de validar el resultado final, se requiere confirmar con una metodología alterna (Disco difusión, E-test, microdilución en caldo ) en las siguientes situaciones: • Resultado resistente para carbapenémicos y sensibilidad a cefalosporinas de tercera generación o aztreonam, que no corresponde con el perfil fenotípico clásico de expresión de carbapenemasas, a excepción de Serratia marcescens , en la cual se puede presentar este fenómeno por carbapenemasas cromosomales.
• Resultado resistente para carbapenémicos y sensibilidad a piperacilina-tazobactam.
Acciones sobre cefalosporinas de clase IV: para aislamientos de Enterobacteriacea sensibles a cefepima, que sean resistentes al menos a un (1) carbapenem o que tengan una prueba MHT (+), se sugiere el cambio de la interpretación de cefepima a R, debido a que no existe suficiente evidencia clínica que soporte el uso terapéutico de cefepima en estos aislamientos 26.
Nuevos puntos de corte enPseudomonas aeruginosa (tabla 8)
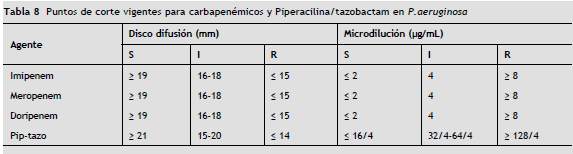
Recomendación: aplicar los nuevos puntos de corte para P. aeruginosa publicados en M100-S22 que se detallan a continuación (tabla 8).
Recomendaciones
a ) Utilizar en lo posible un método CIM para el reporte del antibiograma en P. aeruginosa ya que es un mejor predictor de la respuesta terapéutica 34.
b ) Advertir sobre la posibilidad de falla terapéutica en el tratamiento de P. aeruginosa con piperacilina-tazobactam cuando la CIM es 32 µg/mL-64 µg/mL 35 (resultados Intermedios únicamente).
c ) Incorporar la prueba de doripenem para este microorganismo y discutir su reporte selectivo con el comité de infecciones institucional.
d ) Algunos sistemas automatizados incluyen una sigla "IB" en el resultado de sensibilidad para piperacilina-tazobactam en P. aeruginosa ( = 16 µg/mL). Esta interpretación no corresponde a ninguna categoría interpretativa de la CLSI, EUCAST u otros organismos que establecen puntos de corte, por lo cual es inapropiada y este resultado debe ser informado como sensible de acuerdo a los puntos de corte vigentes. Los estudios PK/PD conducidos por el subcomité de pruebas de susceptibilidad de CLSI determinaron que una CIM = 16 µg/mL es suficiente para predecir el éxito terapéutico con piperacilina-tazobactam 1. No debe considerarse como un desplazamiento de la CIM.
e ) En P. aeruginosa resistente a carbapenémicos, se sugiere la implementación de métodos que incorporen inhibidores de metaloenzimas (EDTA, SMA) No se recomienda la aplicación del test de Hodge modificado. Incluir un pie de nota promoviendo el aislamiento apropiado del paciente e interconsulta con el servicio de Infectología.
Ciprofloxacina vs.Salmonella enterica
Consideración: de 2004 a 2011, CLSI recomendó realizar prueba de tamizaje con ácido nalidixico de los aislamientos extra-intestinales de Salmonella species con CIM de ciprofloxacina = 1 µg/mL como un marcador de susceptibilidad disminuida a fluoroquinolonas. Si la resistencia al ácido nalidixico era detectada, se sugería a los laboratorios advertir ante la posibilidad de ineficacia clínica en el tratamiento de esta especie con ciprofloxacina. A partir del año 2012, los PC para ciprofloxacina fueron actualizados y modificados con base en la circulación de mecanismos de resistencia plasmídicos (ej. qnr, aac-6´-lb-cr) y mutaciones en gyrB, que no eran detectadas eficientemente con el test de ácido nalidixico 36. Estos cambios se detallan en la tabla 9.

Recomendaciones
• Implementar el nuevo punto de corte CLSI para ciprofloxacina en todos los aislamientos de Salmonella species de forma independiente al serovar o al origen del mismo (tabla 9).
• Ante la incapacidad de los sistemas automatizados para realizar esta actualización, se sugiere realizar disco difusión para ciprofloxacina e implementar el punto de corte vigente descrito en la tabla. Adicionar la prueba con disco de ácido nalidixico puede aumentar la sensibilidad.
• Las cepas de Salmonella que sean resistentes al ácido nalidíxico y/o al nuevo punto de corte de ciprofloxacina pueden estar asociadas con falla terapéutica o respuesta retardada al tratamiento con ciprofloxacina en pacientes con salmonelosis.
• Se sugiere minimizar las variables de error en el Kirby Bauer para garantizar resultados de calidad.
Tamizaje de antibióticos adicionales
Teniendo en cuenta la alta prevalencia de bacilos Gram negativos productores de carbapenemasas en nuestro país y la posible emergencia de nuevas beta-lactamasas con alto poder hidrolítico, se hace necesario el tamizaje con antibióticos estables frente a la acción de estas enzimas. Se sugiere su informe selectivo y concertado con el comité de infecciones institucional 37.
a ) Polimixina B y colistina: el incremento en el uso de polimixina B y colistina para el tratamiento de infecciones por Gram negativos multi-resistentes, hace suponer una necesaria implementación de las pruebas de susceptibilidad para polipeptidos. Sin embargo este proceso involucra limitaciones técnicas que es importante considerar. Entre ellas están la adherencia al plástico con el cual se fabrican los paneles de los sistemas automatizados que disminuyen la concentración de principio activo en los pocillos de los automatizados, y la escogencia de la molécula para la prueba in vitro . En el caso de Polimixina, el agente preferido para los antibiogramas es el compuesto polimixina B sulfato. Se utilizan discos de 30 µg y se realiza una prueba de Kirby Bauer convencional. No obstante se han reportado falsos sensibles ante la limitada difusión del polipéptido debido a su elevado peso molecular. Las mismas limitaciones se han encontrado con E-test. Para colistina, se prefiere utilizar discos de 10 µg de colistin-sulfato, sin embargo su correlación in vitro con el desenlace clínico es incierta.
Colistimetato de sodio es una pro-droga inactiva que no debe emplearse en el antibiograma ya que es inestable y puede generar resultados difíciles de interpretar.
b ) Una preocupación adicional es el efecto inóculo que puede presentarse con estas moléculas y la pérdida de actividad de los polipétidos de acuerdo a la concentración de Mg y Ca en el medio de cultivo empleado 38-40.
Recomendaciones
• Preferir una metodología de CIM cuando sea necesario realizar pruebas de susceptibilidad con polimixina B o colistina. Evite el uso de disco difusión o E-test.
• No existen puntos de corte establecidos por la CLSI para polimixina B/colistina en Enterobacteriaceae . No hay evidencia de extrapolar los puntos de corte de no fermentadores ( P. aeruginosa o A. baumannii ) para predecir la respuesta terapéutica.
• No realice interpretación al resultado de polimixina B/ colistina frente a las siguientes especies: Proteus, Providencia, Serratia, Morganella .
• Tener precaución en el reporte de P. aeruginosa , A. baumannii, K. pneumoniae o E. coli resistentes a polimixina B/ colistina. Verificar la calidad de la metodología empleada y remitir a un laboratorio de referencia para confirmación.
• El clínico debe considerar siempre el uso de polimixina B/colistina en terapia combinada para el manejo de infecciones por Gram negativos multiresistentes de forma independiente al resultado de la prueba de susceptibilidad para estos agentes.
c ) Tigeciclina: es un antibiótico de la familia de las glicilciclinas con actividad contra Gram negativos y Gram positivos multi-resistentes. Está aprobado por la FDA para el tratamiento de infección intra-abdominal complicada e infección de piel y tejidos blandos. Es una opción terapéutica para el manejo de productores de carbapenemasas en infecciones severas, con aplicación preferencial en terapia combinada 41-43.
Estrategia: ante el rápido aumento y diseminación de productores de carbapenemasas (KPC y metalo-betalactamasas), se hace necesario realizar la prueba in vitro de Tigeciclina, adaptando su reporte a las necesidades institucionales (tabla 10).

Sugerencia
• Realice un tamizaje sistemático con tigeciclina, de los aislamientos Gram negativos utilizando los siguientes puntos de corte de la FDA (tabla 10).
Recomendaciones
• No debe interpretarse el resultado de tigeciclina en las siguientes especies: Proteus, Morganella, Providencia y P. aeruginosa.
• Reportar selectivamente en microorganismos con origen en sangre y muestras respiratorias.
• No reportar tigeciclina en aislamientos del tracto urinario.
• Los resultados resistentes o intermedios por disco difusión deben ser confirmados por CIM antes del informe final.
• Considerar las limitaciones de las marcas de agar Mueller Hinton en la realización de las pruebas de difusión 43 (Kirby-Bauer y E-test).
• Verificar el desempeño del sistema automatizado para la prueba de tigeciclina con el control de calidad interno y externo. Correlacionar la información obtenida con los insertos de producto en cada sistema automatizado.
• Frente a un resultado resistente, verifique preparación del inóculo, pureza del microorganismo y especie implicada.
Conclusión
El panorama de la resistencia antimicrobiana en bacilos Gram negativos en Colombia es dinámico y requiere una adaptación y educación continua por parte de los profesionales de Laboratorio Clínico para ofrecer resultados de calidad que permitan guiar la terapia más apropiada para el paciente. Es importante subrayar la necesidad de implementar los puntos de corte vigentes de la CLSI, pero además de continuar realizando las pruebas fenotípicas para la búsqueda de mecanismos de resistencia.
Estos nuevos criterios interpretativos exigen un estricto control de calidad interno y externo.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
* Autor para correspondencia.
Correo electrónico: gesparza@javeriana.edu.co (G. Esparza).
0123-9392/$ - see front matter © 2013 ACIN. Publicado por Elsevier España, S.L. Todos los derechos reservados.
Bibliografía
1. Clinical and Laboratory Standards Institute (CLSI). Performance standards for antimicrobial susceptibility testing; approved standard. Twenty-second informational supplement. CLSI Document M100-S22. Wayne, PA: CLSI, 2012. [ Links ]
2. Clinical and Laboratory Standards Institute (CLSI). Performance standards for antimicrobial susceptibility testing; approved standard. Twelfth informational supplement. CLSI Document M100-S20. Wayne, PA: CLSI, 2010. [ Links ]
3. Clinical and Laboratory Standards Institute (CLSI). Performance standards for antimicrobial disk susceptibility tests; approved standard. Eleventh edition. CLSI Document M02-A-11. Wayne, PA: CLSI, 2012. [ Links ]
4. Clinical and Laboratory Standards Institute (CLSI). Methods for dilution antimicrobial susceptibility tests for bacteria that grow aerobically; approved standard–ninth edition. CLSI Document M07-A9. Wayne, PA: CLSI, 2011. [ Links ]
5. Clinical and Laboratory Standards Institute (CLSI). Development of in vitro susceptibility testing criteria and quality control parameters; approved guideline–third edition. CLSI Document M23-A3. Wayne, PA: CLSI, 2008. [ Links ]
6. Kahlmeter G. Setting interpretive breakpoints for antimicrobial susceptibility testing using disk diffusion. Int J Antimicrob Agents. 2011;38:281-90 [ Links ]
7. Ambrose P, Bhavnani S, Drusano GL. Pharmacokinetics-pharmacodynamics of Antimicrobial Therapy: It´s Not Just for Mice Anymore. Clin Infect Dis.. 2007;44:79-86 [ Links ]
8. Dudley MN, Ambrose PG, Bhavnani SM, Craig WA, Ferraro MJ, Jones RN; for the Antimicrobial Susceptibility Testing Sub- Committee of the Clinical Laboratory Standards Institute. Background and rationale for revised Clinical Laboratory Standards Institute (CLSI) interpretive criteria (breakpoints) for Enterobacteriaceae and Pseudomonas aeruginosa: Cephalosporins and aztreonam. Clin Infect Dis. 2013;56:1301-9. [ Links ]
9. Livermore DM, Andrew JM, Hawkey P, Ho PL, Keness Y, Doi Y, et al. Are susceptibility tests enough, or should laboratories still seek ESBLs and carbapenemases directly? J. Antimicrob Chemoter. 2012;67:1569-77. [ Links ]
10. Organización Panamericana de la Salud. Manual para pruebas de susceptibilidad antimicrobiana. Washington DC: ASM; 2005. [ Links ]
11. Organización Panamericana de la Salud. Guía para el uso correcto de los equipos automatizados para identificación bacteriana y su correspondiente prueba de susceptibilidad. Washington DC: PAHO; 2011. [ Links ]
12. Instituto Nacional de Salud. Proceso Redes en Salud Pública. Prueba de idoneidad en microbiología clínica. PIMC 1-2-2011, 1-2-2010. [ Links ]
13. Gould IM. Antibiotic resistance: understanding how to control it. Int J Antimicrob Agents. 2012;40:193-5. [ Links ]
14. Montealegre MC, Correa A, Briceño DF, Rosas NC, De la Cadena E, Ruiz SJ, et al.; and the Colombian Nosocomial Resistance Study Group. Novel VIM metallo-ß-lactamase variant, VIM-24, from a Klebsiella pneumoniae isolate from Colombia. Antimicrob Agents Chemother. 2011;55:2428-30. [ Links ]
15. Correa A, Montealegre MC, Mojica MF, Maya JJ, Rojas LJ, De la Cadena EP, et al. First report of a Pseudomonas aeruginosa isolate co-harboring KPC and VIM carbapenemases. Antimicrob Agents Chemother. 2012;56:5422-3. [ Links ]
16. Informe Resistencia Bacteriana. Red de Hospitales GREBO 2011. [ Links ]
17. Leal AL, Cortés JA, Arias G, Ovalle MV, Saavedra SY, Buitrago GC, et al. Emergencia de fenotipos resistentes a cefalosporinas de tercera generación en Enterobacteriaceae causantes de infección del tracto urinario de inicio comunitario en hospitales de Colombia. Enferm Infecc Microbiol Clin. 2013;31:298-303. [ Links ]
18. Mojica MF, Correa A, Vargas DA, Maya JJ, Montealegre MC, Rojas LJ, et al. Molecular correlates of the spread of KPCproducing Enterobacteriaceae in Colombia. Int J Antimicrob Agents. 2012;40:277-9. [ Links ]
19. Jorgensen J, Ferraro M. Antimicrobial susceptibility testing: A review of general principles and contemporary practices. Clin Infect Dis. 2009;49:1749-55. [ Links ]
20. Livermore DM. Defining an extended-spectrum beta-lactamase. Clin Microbiol Infect. 2008;14(Suppl. 1):3-10. [ Links ]
21. Turnidge JD. Cefazolin and Enterobacteriaceae : Rationale for revised susceptibility testing breakpoints. Clin Infect Dis. 2011;52:917-24. [ Links ]
22. Jacoby GA. AmpC beta-lactamases. Clin Microbiol Rev. 2009;22:161-82. [ Links ]
23. Navarro F, Mirelis B. Detección fenotípica de mecanismos de resistencia en microorganismos gramnegativos. Enferm Infecc Microbiol Clin. 2011;29:524-34. [ Links ]
24. Nordqvist K, Zimmer B. Diagnostics as essential tools for containing antibacterial resistance. Drug Resist Updat. 2011;14:95-106. [ Links ]
25. Marchaim D, Sunkara B, Lephart PR, Gudur UM, Bhargava A, Mynatt RP, et al. Extended-spectrum beta-lactamase producers reported as susceptible to piperacillin-tazobactam, cefepime, and cefuroxime in the era of lowered breakpoints and no confirmatory tests. Infect Control Hosp Epidemiol. 2012;33:853-5. [ Links ]
26. Lee NY, Lee CC, Huang WH, Tsui KC, Hsueh PR, Ko WC. Cefepime therapy for monomicrobial bacteremia caused by cefepime-susceptible extended-spectrum beta-lactamaseproducing enterobacteriaceae: MIC Matters. Clin Infect Dis. 2013;56:488-95. [ Links ]
27. Rodrigues Baño J, Navarro MD, Retamar P, Pico E, Pascual A, and the Extended-Spectrum Beta-Lactamases–Red Española de Investigación en Patología Infecciosa/Grupo de Estudio de Infección Hospitalaria. Beta-lactam/beta-lactamase inhibitor combinations for the treatment of bacteremia due to extended-spectrum betalactamase–producing Escherichia coli : A post hoc analysis of prospective cohorts. Clin Infect Dis. 2012;54:167-74. [ Links ]
28. Nastro M, Piazza LM, Saposnik E, García S, Barberis C, Vay C, et al. Resistencia a cefalosporinas de espectro extendido en enterobacterias sin AmpC inducible. Evaluación de los nuevos puntos de corte. Rev Argent Microbiol. 2012;44:30-5. [ Links ]
29. Nordmann P, Gniadkowski M, Giske CG, Poirel L, Woodford N, Miriagou V, and the European Network on Carbapenemases. Identification and screening of carbapenemase-producing Enterobacteriaceae. Clin Microbiol Infect. 2012;18:432-8. [ Links ]
30. Endimiani A, Perez F, Bajaksouzian S, Windau AR, Good CE, Choudhary Y, et al. Evaluation of updated interpretative criteria for categorizing Klebsiella pneumoniae with reduced carbapenem susceptibility. J Clin Microbiol. 2010;48:4417-25. [ Links ]
31. Landman D, Salamera J, Manisha S, Quale J. Accuracy of carbapenem non susceptibility for identification of KPC-possessing Enterobacteriaceae by use of the revised CLSI breakpoints. J Clin Microbiol. 2011;49:3931-3. [ Links ]
32. Esterly JS, Wagner J, Milena M, McLaughlin MJ, Chao P, Scheetza MH. Evaluation of clinical outcomes in patients with bloodstream infections due to Gram-negative bacteria according to carbapenem MIC stratification. Antimicrob Agents Chemother. 2012;56:4885-90. [ Links ]
33. Viau R, Hujer AM, Marshall SH, Perez F, Hujer KM, Briceño DF, et al. "Silent" dissemination of Klebsiella pneumoniae isolates Bearing K. pneumoniae Carbapenemase in a long-term care facility for children and young adults in Northeast Ohio. Clin Infect Dis. 2012;54:1314-2. [ Links ]
34. Taccone FS, Cotton F, Roisin S, Vincent JL, Jacobs F. Optimal meropenem concentrations to treat multidrug-resistant Pseudomonas aeruginosa septic shock. Antimicrob Agents Chemother. 2012;56:2129-31. [ Links ]
35. Tam VH, Gamez EA, Weston JS, Gerard LN, Larocco MT, Caeiro JP, et al. Outcomes of bacteremia due to Pseudomonas aeruginosa with reduced susceptibility to piperacillin-tazobactam: implications on the appropriateness of the resistance breakpoint. Clin Infect Dis. 2008;46:862-7. [ Links ]
36. Humphries R, Fang F, Aarestrup F, Hindler J. In vitro susceptibility testing of fluoroquinolone activity against Salmonella: Recent changes to CLSI standards. Clin Infect Dis. 2012;55:1107-13. [ Links ]
37. Qureshi ZA, Paterson DL, Potoski BA, Kilayko MC, Sandovsky G, Sordillo E, et al. Treatment outcome of bacteremia due to KPC-producing Klebsiella pneumoniae : Superiority of combination antimicrobial regimens. Antimicrob. Agents Chemother. 2012;56:2108. [ Links ]
38. Landman D, Georgescu C, Martin DA, Quale J. Polymyxins revisted. Clin Microbiol Rev. 2008;21:449-65. [ Links ]
39. Kwa A, Kasiakou S, Tam VH, Falagas ME. Polymyxin B: Similarities to and differences from colistin (polymyxin E). Expert Rev Anti Infect Ther. 2007;5:811-21. [ Links ]
40. Jenkins SG, Lee J, Patel G, Huprikar S, Calfee D. Decreased susceptibility to polymyxin B during treatment for carbapenem- resistant Klebsiella pneumoniae infection. J Clin Microbiol. 2009;47:1611-2. [ Links ]
41. Kelesidis T, Karageorgopoulos E, Kelesidis L, Falagas ME. Tigecycline for the treatment of multidrug-resistant Enterobacteriaceae : a systematic review of the evidence from microbiological and clinical studies. J Antimicrob Chemother. 2008;62:895-904. [ Links ]
42. Fernandez F, Curcio D. Tigecycline disk diffusion breakpoints of Acinetobacter spp.: a clinical point of view. J Clin Microbiol. 2007;45:2095. [ Links ]
43. Leal Castro AL, Buitrago GC, Ovalle MV, Cortés JA, Alvarez- Moreno CA, La Rotta J, and the Colombian Tigecycline Susceptibility Surveillance Group. Comparing in vitro activity of tigecycline by using the disk diffusion test, the manual microdilution method, and the VITEK 2 automated system. Rev Argent Microbiol. 2010;42:208-11. [ Links ]













