Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Infectio
versión impresa ISSN 0123-9392
Infect. vol.17 no.2 Bogotá ene./jun. 2013
REVISIÓN
Plantas con actividad fotosensibilizadora y potencial terapéutico en leishmaniasis cutánea: hipericina, una alternativa prometedora
Viviana Milena Taylor O. a,*, Yesmit Karina Ríos R. b y Daniel Arturo León R. c
a Grupo de Investigación e Innovación Biomédica, GI2B, Instituto Tecnológico Metropolitano, Medellín, Colombia
b Programa de Bacteriología y Laboratorio Clínico, Universidad de Santander, Cúcuta, Colombia
c Departamento de Química, Universidad de Caldas, Manizales, Colombia
Recibido el 13 de diciembre de 2012; aceptado el 2 de octubre de 2013
Resumen
La leishmaniasis es una enfermedad endémica en 98 países, con más de 350 millones de personas en riesgo de adquirir la infección y 12 millones de personas infectadas. Numerosas desventajas asociadas a los tratamientos actuales promueven la falta de adherencia o abandono del tratamiento y la aparición de cepas resistentes al medicamento. Estos factores han estimulado la búsqueda de alternativas terapéuticas que sean rápidas, seguras, de fácil administración y económicas. Surge así la etnobotánica, que en combinación con la fototerapia puede convertirse en una estrategia innovadora para la búsqueda de compuestos de origen natural con actividad leishmanicida, donde productos como la hipericina pueden ser considerados candidatos prometedores en el descubrimiento y desarrollo de nuevos tratamientos.
La hipericina es una molécula de origen natural que presenta un rendimiento cuántico alto en su estado triplete y genera eficientemente especies reactivas de oxígeno, lo cual posiblemente la hace un buen agente leishmanicida al ser aplicado en los tejidos infectados, además de ser posiblemente un potencial agente cicatrizante, que otorga un efecto cosmético favorable en la resolución de la lesión, con amplias ventajas como bajo costo y fácil manejo, convirtiéndose en una alternativa favorable frente a otras usadas en el manejo de la enfermedad.
© 2013 ACIN. Publicado por Elsevier España, S.L. Todos los derechos reservados.
PALABRAS CLAVE
Fototerapia; Leishmania spp.; Plantas; Hipericina
Plants with photosensitizing activity and therapeutic potential in cutaneous leishmaniasis: Hypericin, a promising alternative
Abstract
Leishmaniasis is a disease endemic to 98 countries, with over 350 million people at risk of acquiring the infection and 12 million people already infected. The numerous disadvantages associated with current treatments encourage a lack of adherence and even abandonment of the disease treatment, resulting in the emergence of drug-resistant strains. These factors have stimulated the search for therapeutic alternatives that are fast, safe, easy to administer and economical. This has resulted in the emergence of ethnobotany, which, along with phototherapy, could become an innovative strategy for finding naturally occurring compounds with leishmanicidal activity. In this context, products such as hypericin could be considered promising candidates in the discovery and development of new treatments.
Hypericin is a naturally occurring molecule that has a high quantum yield in its triplet state and efficiently generates reactive oxygen species. These properties could make hypericin an effective leishmanicidal agent when applied over infected tissues and a potential healing agent that provides cosmetic effects favorable to lesion resolution. In addition, its significant advantages in terms of low cost and easy handling make hypericin a favorable alternative to other treatments for managing this disease.
© 2013 ACIN. Published by Elsevier España, S.L. All rights reserved.
KEYWORDS:
Phototherapy; Leishmania spp.; Plants; Hypericin
Introducción
La leishmaniasis es una enfermedad parasitaria de amplia distribución mundial, endémica en 98 países de regiones tropicales y subtropicales, con más de 350 millones de personas en riesgo de adquirir la infección, 12 millones de personas infectadas y 2 millones de nuevos casos por año1 (0,5 millones de leishmaniasis visceral y 1,5 millones de leishmaniasis cutánea).
En Colombia, durante el año 2012 se registraron 9.595 casos de leishmaniasis cutánea2 (LC), la forma clínica más prevalente en el país, y para el año 2013 se han reportado 4.386 nuevos casos3. Sin embargo, estas cifras no se ajustan a la realidad, pues la mayoría de los datos oficiales son reportados a partir de la detección pasiva de casos y la mayor parte de las infecciones no son diagnosticadas o informadas, por presentarse en zonas rurales de difícil acceso, lo cual dificulta tanto el diagnóstico como el tratamiento4.
Los compuestos de antimonio pentavalente, la anfotericina B, el isotianato de pentamidina y la miltefosina son los medicamentos de elección para el tratamiento de todas las formas de leishmaniasis1. No obstante, la utilización de dichos fármacos tiene desventajas, como el alto costo que representa para los gobiernos el suministro del medicamento a la población afectada, la duración del tratamiento, los efectos secundarios asociados a la toxicidad y las vías de aplicación de los fármacos5. Todos estos problemas estimulan la falta de adherencia al tratamiento, promoviendo la reactivación de la lesión, el compromiso de mucosas o la aparición de resistencia del parásito6.
A estas dificultades se suma la falta de motivación económica para que las compañías farmacéuticas que invierten en programas de investigación y desarrollo de medicamentos para el tratamiento de enfermedades como la leishmaniasis7.
Por lo anteriormente expuesto, la Organización Mundial de la Salud, a través de su Programa Especial para la Investigación en Enfermedades Tropicales (TDR) junto con varias Organizaciones No Gubernamentales (ONGs), ha establecido como prioridad el descubrimiento y desarrollo de nuevos tratamientos para la leishmaniasis que sean rápidos, seguros, de fácil administración y económicos8.
Surge así la etnobotánica, que en combinación con la fototerapia puede convertirse en una estrategia innovadora para la búsqueda de compuestos de origen natural con actividad leishmanicida, donde productos como la hipericina pueden ser considerados candidatos prometedores en el descubrimiento y desarrollo de nuevos tratamientos.
Para la realización de esta revisión, se hizo una búsqueda en las bases de datos Pubmed, Medline y Ovid, combinando los términos Hypericin , Phototherapy, Leishmania , Phototoxic, Phototoxicity Plants, Leishmanicidal and Natural Products. Se incluyeron 104 artículos, entre revisiones e investigaciones originales.
Plantas con actividad leishmanicida
La evaluación de productos naturales le ha dado a la medicina tradicional un renovado interés en la búsqueda de sustancias potencialmente activas, útiles para combatir enfermedades, y leishmaniasis no es la excepción8.
Las plantas han demostrado tener un amplio arsenal de sustancias usadas por pueblos indígenas para el tratamiento de la leishmaniasis cutánea. Así lo han mostrado estudios etnobotánicos como los realizados por Odonne et al. en el 2009, quienes documentaron plantas usadas por la comunidad Chayahuita en las selvas del Perú, para combatir la leishmaniasis desde la perspectiva tradicional de la comunidad9. De hecho, la OMS estima que aproximadamente el 80% de la población mundial acude continuamente a este tipo de tratamientos10.
Rocha et al. en el 2005 revisaron un amplio número de productos naturales con actividad leishmanicida, en su mayoría provenientes de plantas, que demuestran la relevancia de validar su uso en la medicina popular. A su vez, concluyen que el reporte de un importante número de moléculas aisladas (hasta el 2005, 239 moléculas definidas químicamente) de productos naturales representa un avance significativo en la búsqueda de nuevos agentes antiprotozoarios11.
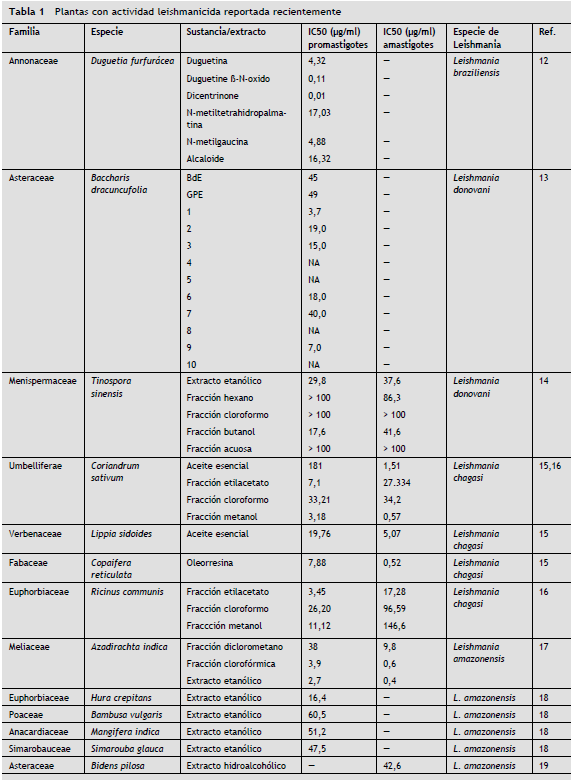
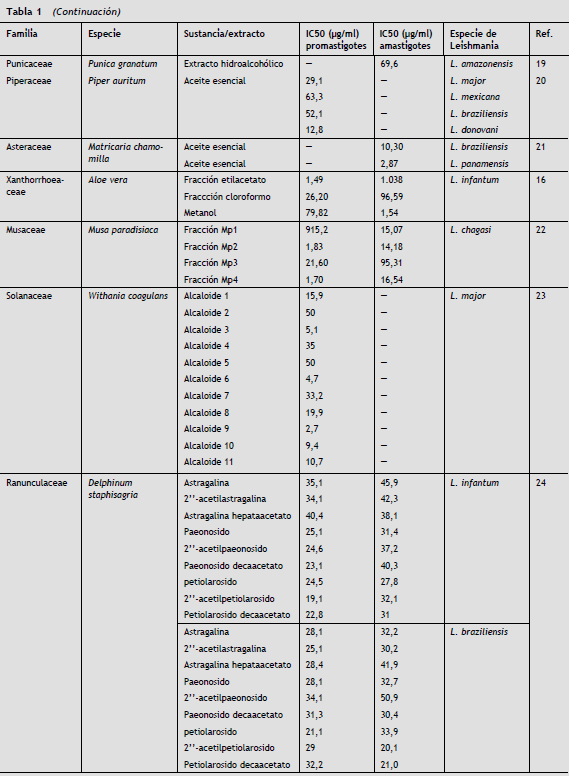
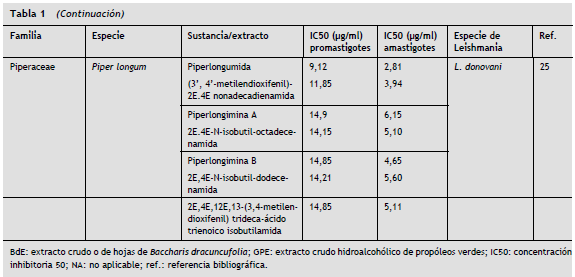
Entre los productos naturales con actividad leishmanicida reportada recientemente, se pueden citar alcaloides como la Dicentrinona de Duguetia furfurácea , que mostró una IC50 de 0,01 µM12, Baccharis dracunculifolia con IC50 de 3,7 µg/ml para el ácido ursólico y 7,0 µg/ml para el ácido hautriwaico, componentes activos de su extracto13. El extracto etanólico de Tinospora sinensis exhibió una actividad apreciable contra promastigotes y amastigotes intracelulares de Leishmania , con IC50 de 37,6 µg/ml y 29,8 µg/ml, respectivamente14.
Los aceites esenciales de Coriandrum sativum , Lippia sidoides y oleorresinas de Copaifera reticulata demostraron tener una acción importante sobre amastigotes y promastigotes de Leishmania chagasi . En este estudio, Copaifera reticulata mostró una IC50 de 7,88 µg/ml en promastigotes y 0,52 µg/ml en amastigotes intracelulares, Coriandrum sativum exhibió una IC50 de 181 µg/ml en promastigotes y 1,51 µg/ml en amastigotes intracelulares y Lippia sidoides mostró una IC50 de 19,76 µg/ml para promastigotes y 5,07 µg/ml para amastigotes15.
Fracciones de Coriandrum sativum y Ricinus communis mostraron tener actividad sobre amastigotes intracelulares de este mismo parásito, con IC50 de 27,334 µg/ml y 17,28 µg/ml, respectivamente16.
En especies de Leishmania , principalmente del nuevo mundo, los extractos y fracciones de hojas y frutos de Azadirachta indica se destacan por ser efectivas sobre amastigotes y promastigotes de Leishmania amazonensis . El extracto etanólico de las hojas y las fracciones diclorometano y clorofórmicas presentaron valores de IC50 de 38, 3,9 y 1,2 µg/ml sobre promastigotes y 9,8, 1,1 y 0,6 µg/ml para amastigotes, respectivamente. Por su parte el extracto etanólico y la fracción diclorometano del fruto presentaron una IC50 de 2,7 y 2,1 µg/ml para promastigotes y 0,4 y 0,6 µg/ml para amastigotes intracelulares17. También se resalta la actividad de los extractos alcohólicos de Hura crepitans , Bambusa vulgaris, Mangifera indica y Simarouba glauca 18 sobre amastigotes intracelulares de Leishmania amazonensis , e igualmente los extractos alcohólicos de Bidens pilosa L. y Punica granatum L. son altamente efectivos sobre amastigotes intracelulares de Leishmania amazonensis con IC50 de 42,6 y 69,6 µg/ml, respectivamente19.
Con el aceite de Piper auritum se ha observado actividad sobre promastigotes de L. major , L. mexicana, L. braziliensis y L. donovani con IC50 de 29,1, 63,3, 52,1 y 12,8 µg/ml, respectivamente20.
Extractos, aceites y fracciones de plantas comunes como manzanilla (Matricaria chamomilla) , banano (Musa paradisiaca) y Aloe vera , también han sido probados, con resultados muy prometedores16,21,22.
Biomoléculas extraídas de plantas han demostrado muy buena actividad in vitro sobre Leishmania , como lo expone la investigación realizada por Kuroyanagi et al. en 2012 con las withanolidas de Withania coagulans . En este estudio se evaluaron 11 withanolidas provenientes de esta planta sobre promastigotes de Leishmania major , de las cuales las withanolidas 3, 6, 9 y 10 mostraron la mejor actividad con IC50 de 5,1, 4,7, 2,7 y 9,4 µg/ml, respectivamente23.
Ramírez-Macías et al. en 2012 encontraron una buena actividad en los flavonoides de Delphinum staphisagria sobre promastigotes, amastigotes intracelulares y amastigotes axénicos de L. infantum , en especial los flavonoides identificados como 6, 8 y 924.
Otro hallazgo importante se reportó en el estudio de Ghosal et al. en 2012 con el hallazgo de actividad de alcaloides derivados de Piper longum , sobre promastigotes y amastigotes axénicos de Leishmania donovani , como una clara muestra del efecto leishmanicida de estas biomoléculas25.
En la tabla 1 se resumen las principales plantas con actividad leishmanicida.
Plantas con actividad fototóxica en fototerapia
La fototerapia es un procedimiento en el cual un agente fotosensibilizador, que corresponde a un compuesto con estructura macrocíclica de dobles dienos conjugados, es activado por luz en presencia de oxígeno molecular a longitudes de onda entre 600 y 850 nm e intensidades de 150 mW/cm2, con la producción directa o indirecta de especies reactivas del oxígeno26 (ROS), las cuales reaccionan con organelas, proteínas y ADN, causando apoptosis o necrosis de las células que contienen el agente fotosensibilizador27.
La fototerapia ha sido utilizada desde comienzos del siglo XX en el tratamiento de diferentes tipos de cáncer, vitíligo, psoriasis, herpes y otras enfermedades e infecciones localizadas28,29.
El desarrollo de la fototerapia como alternativa terapéutica, en la actualidad, ha promovido la búsqueda de nuevos agentes fotosensibilizadores a partir de la síntesis orgánica y, más recientemente, a partir de plantas y otros productos naturales30. La fototoxicidad de productos naturales es un fenómeno que se viene estudiando con detenimiento debido a que, si bien puede inducir daño a nivel celular, también puede producir efectos benéficos a nivel terapéutico como se observa en fototerapia. Como prueba de esto, en 2010 y 2011 Bark et al. estimaron que al menos un cuarto de las plantas medicinales usadas en la medicina oriental podrían ser fototóxicas, pero que esta propiedad puede ser aprovechada terapéuticamente31,32.
Un importante número de plantas han sido objeto de estudio en los últimos años por sus cualidades fototóxicas y se están considerando actualmente dentro de la investigación en fototerapia. Es así como los componentes aéreos de Ficus carica se están postulando como potenciales agentes fotosensibilizadores a partir de los estudios desarrollados por Conforti et al., 2012, quienes observaron una importante actividad anti-oxidante y antiproliferativa sobre células de melanoma humanas atribuidas a las cumarinas, fenoles y ácidos grasos obtenidos de las hojas de esta planta, haciendo que esta planta se destaque como fuente de componentes bioactivos de uso en fototerapia para tratamiento de cáncer de piel33.
Los floroglucinoles extraídos a partir de las hojas de Syzygium polyanthum , una planta de la familia Myrtaceae, reportados como antuminoato y antuminona por Har et al. (2012), mostraron una inhibición importante al ser probados sobre células tumorales y se presentan de esta forma como posibles agentes de uso en fototerapia34. De la misma manera Chee et al. (2005) encontraron en las hojas de Aglaonema simplex , otra planta de la biodiversidad de países tropicales, moléculas de tipo feoforbido con potencial fototoxicidad sobre células de leucemia humana HL6035.
Otro feoforbido aislado de Scutellaria barbata , al ser activado por la luz, mostró una importante acción sobre células MDA-MB-231 explicada por el aumento de la apoptosis por medio de la supresión de la autofagia mediada por la cinasa ERK36. Investigaciones con esta misma molécula describen su acción como agente fotosensibilizador en fototerapia sobre distintas líneas celulares cancerosas37,38.
Otras moléculas de reciente descubrimiento con actividad fototóxica y con potencial uso en fototerapia son las antraquinonas aisladas de Heterophyllaea pustulata 39 y los beta-glucanos de la cebada Hordeum vulgare L.40.
Mecanismo de acción de la hipericina en fototerapia
Recientemente la hipericina ha empezado a atraer la atención de los investigadores como un promisorio agente fotosensibilizador41. Este es un compuesto de origen natural extraído de Hypericum perforatum , una planta que ha sido usada por mucho tiempo para el tratamiento de trastornos depresivos, dolores abdominales, infecciones bacterianas, migraña y para favorecer la cicatrización42-44.
Los reportes acerca del uso potencial de la hipericina en fototerapia datan de hace casi 25 años45. Es una molécula que se caracteriza por tener alto rendimiento cuántico generando una alta producción de oxígeno singlete y otras especies reactivas de oxígeno, bajo fotoblanqueo y mínima toxicidad, características que son fundamentales para las aplicaciones biológicas y clínicas de un fotosensibilizador46-48.
La hipericina resulta útil para el tratamiento de enfermedades de la piel ya que no solo es una sustancia de origen natural que puede ser bien aceptada por los pacientes, sino que consiste en un tratamiento suave que induce apoptosis en las células afectadas sin provocar una respuesta inflamatoria exacerbada49.
El mecanismo de acción de la hipericina como agente fotosensibilizador permanece como motivo de estudio, al igual que su optimización en aplicaciones clínicas. Una de las razones es que, de manera similar a muchos de los fotosensibilizadores clínicamente usados, se ha informado que la hipericina se localiza en varios compartimentos celulares y subcelulares, incluyendo membrana plasmática, retículo endoplásmico, mitocondria, lisosoma y aparato de Golgi45.
Dependiendo de su localización la hipericina induce apoptosis cuando se concentra en mitocondria50 o puede predisponer a necrosis si se ubica en membrana citoplasmática o en los lisosomas51,52. Esta distribución subcelular puede ser atribuida a características físicas y químicas que incluyen carga iónica, hidrofobicidad o hidrofilicidad y simetría molecular53. En el caso de la hipericina, la distribución en la célula se vería influenciada por el hecho de ser una molécula altamente lipofílica, que estaría enlazándose preferencialmente a la matriz lipídica de la membrana celular por encima de otras rganelas54, por lo que se hace primordial el uso de transportadores que aumenten la selectividad del compuesto una vez sea internalizado por las células, como por ejemplo sucede al conjugar la hipericina con liposomas, nanopartículas o polifosfacanos biodegradables, que aumentan significativamente la solubilidad del compuesto en agua y etanol, en comparación con la molécula libre55.
En los últimos años, diversos estudios han revelado la multifacética actividad fotodinámica de la hipericina. Se ha registrado que al ser estimulada con la luz induce peroxidación de membranas lipídicas56, aumenta la actividad superóxido dismutasa, incrementa los niveles de glutatión57,58
y se almacena en membrana celular formando estructuras estrechamente empaquetadas con el colesterol, lo cual se constituye en un factor clave de selectividad de la hipericina59.
Actividad antitumoral de la hipericina
Algunas investigaciones in vitro han mostrado las propiedades fotosensibilizadoras y antitumorales de la hipericina.
En un estudio realizado sobre células de carcinoma de colon HT-29 expuestas a hipericina combinada con hiperforina o su derivado aristoforina, se observó alta letalidad de estas células, debido posiblemente a un arresto en la progresión del ciclo celular, por acción combinada de ambos compuestos de origen natural60. Otro estudio evaluó la efectividad de la hipericina versus el ácido delta aminolevulínico (ALA) sobre la línea celular tumoral U-937 utilizando diodos emisores de luz (LED) a 637 nm. Se observó que, mientras que las células tratadas con ALA proliferaban nuevamente, aquellas tratadas con hipericina mostraban y conservaban una viabilidad cercana al 0%61. De manera similar se observó en esta misma línea celular que la incubación por 3 horas con hipericina e irradiación durante 15 minutos resultó en una viabilidad del 0%, la cual se verificó luego de 5 horas post-irradiación, con un notable aumento en la tasa de apoptosis celular62.
Investigaciones que involucran a la hipericina combinada con otros fotosensibilizadores naturales o sintéticos u algunos tipos de inhibidores celulares han arrojado resultados interesantes. En un estudio que evaluó el efecto de la hipericina combinada con la clorina, se observó alta toxicidad sobre células de carcinoma de células escamosas de cabeza y cuello, efecto explicado por el mecanismo apoptótico de la hipericina y necrótico de la clorina, y que combinados disminuyen la toxicidad en la oscuridad y pueden ser benéficos en la aplicación de fototerapia clínica63. Otro estudio realizado en células de cáncer de seno expuestas a hipericina combinada con la isoflavona de soja, genisteína (inhibidor de la tirosina quinasa), mostró notable aumento en la producción de ROS y supresión de la proliferación celular64, resultado similar al observado con el inhibidor de la 5-lipoxigenasa, el MK-886, el cual combinado con la hipericina produjo un arresto masivo en el ciclo celular, con aumento de ciclina E y disminución de la ciclina A e incapacidad de transición de la fase G1/S del ciclo celular65.
En cuanto a estudios de acción antitumoral de la hipericina en modelo animal, se observó que en ratones con tumores de carcinoma nasofaríngeo humano, tratados durante 6 horas con hipericina, aumentó el nivel de apoptosis celular por una vía mediada por cinc y activada directamente por la hipericina66.
Aunque son numerosos los estudios in vitro que demuestran el papel de la hipericina en fototerapia, son los reportes clínicos los que más le han dado credibilidad a la hipericina como prometedor agente fotosensibilizador en fototerapia. Esta molécula ha sido usada en tratamientos contra diversos tipos de cáncer incluyendo cáncer de ovario67, cáncer nasofaríngeo68, cáncer pancreático69 y carcinomas de piel o melanoma, especialmente70,71.
En un estudio realizado en 12 pacientes con linfoma cutáneo de células T y en 12 pacientes con psoriasis, tratados con hipericina (con concentraciones de 0,1 y 0,25%) dos veces por semana durante 6 semanas, con una fluencia de 8-20 J/cm2, se observó una significativa mejoría en las lesiones de piel dependiente de la concentración72. Otro estudio realizado en 2 pacientes con poroqueratosis actínica superficial diseminada (PASD) tratados tópicamente con hipericina, con una fluencia de 90 J/cm2, no tuvo un resultado satisfactorio ya que solo 1 paciente mostró alguna mejoría. Sin embargo, el bajo número de pacientes del estudio y la diferencia etiológica e histológica entre PASD y la queratosis actínica, donde el tratamiento con hipericina en fototerapia ha sido exitoso, no permite hacer comparaciones claras ni dar explicaciones concluyentes73.
Finalmente es importante anotar que últimamente se viene utilizando la hipericina por sus propiedades fotosensibilizadoras, como herramienta eficaz en el diagnóstico de algunas formas de cáncer. En un ensayo para visualizar selectivamente gliomas malignos, a 5 pacientes se les aplicó hipericina vía intravenosa 6 horas antes del procedimiento quirúrgico, realizado bajo luz blanca. Durante el procedimiento se distinguió claramente el tejido tumoral, el cual se visualizó rojo fluorescente y no se presentaron efectos secundarios asociados74. Otros estudios han mostrado la utilización de la hipericina en combinación con sondas ópticas para el procesamiento de imágenes75.
Actividad antimicrobiana de la hipericina
Algunos estudios han evaluado in vitro el efecto antimicrobiano y fungicida de la hipericina en fototerapia. En un estudio realizado en varias especies de Candida expuestas a concentraciones de 0,625, 1,25, 2,5 y 40 µm de hipericina, con una fluencia de 18 J/cm2 por lámpara LED a 602 ± 10 nm, se observó un efecto tóxico sobre las levaduras, sin citotoxicidad directa sobre queratinocitos y fibroblastos, por lo cual, al parecer, la hipericina puede ser considerado un agente fungicida que no causa daño significativo a células de la piel76. Otra investigación evaluó el efecto antibacteriano de la hipericina en fototerapia. Colonias de S. aureus y E. coli fueron incubadas durante 30 minutos con hipericina y posteriormente irradiadas a 600-800 nm con una fluencia de 5-30 J/cm2. Se observó que la combinación de hipericina y luz indujo una significativa muerte en S. aureus , pero no en E. coli , debido posiblemente a la diferencia en la estructura de la pared/membrana entre ambos tipos bacterianos, lo cual puede influir directamente en la captación de la hipericina por parte de estos microorganismos77.
Fototerapia en leishmaniasis cutánea
Recientemente la fototerapia ha tomado importancia en el tratamiento de la leishmaniasis cutánea con amplios beneficios y bajos costos, sin efectos colaterales asociados y con grandes ventajas en cuanto a resultados cosméticos29.
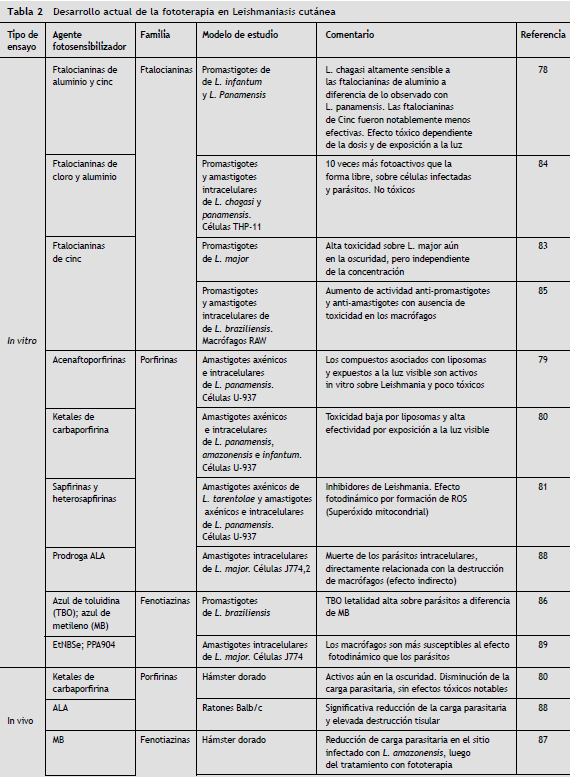
Son varios los estudios con fototerapia dirigidos al tratamiento de la LC. Desde las evaluaciones in vitro de compuestos libres y en formulación liposomal como las ftalocianinas de aluminio y cinc78, porfirinas y sus derivados79-81 y fenotiazinas, pasando por las evaluaciones in vivo , hasta finalizar en estudios piloto en humanos, se han observado amplias ventajas en la utilización de este procedimiento como alternativa prometedora en el tratamiento de la leishmaniasis cutánea82.
Investigaciones con ftalocianinas de aluminio83, cloroaluminio y cinc, libres y encapsuladas en liposomas ultradeformables, han mostrado alta efectividad in vitro sobre promastigotes y amastigotes de Leishmania . En un estudio realizado por Hernández et al. en 2012 que evaluó el efecto de las ftalocianinas de cloroaluminio en liposomas ultradeformables, sobre promastigotes y amastigotes intracelulares de L. chagasi y L. amazonensis infectando células THP-1, se observó que el compuesto encapsulado tuvo una mayor efectividad sobre promastigotes frente al compuesto libre, aunque en amastigotes intracelulares no se apreciaron diferencias significativas84. Otro estudio que evaluó la actividad leishmanicida in vitro de ftalocianinas de cinc en liposomas ultradeformables sobre L. braziliensis mostró 20% de actividad antipromastigote y antiamastigote, porcentaje bajo comparado con el resultado obtenido con la ftalocianina en su forma libre (100% de actividad antipromastigote y 80% de actividad antiamastigote). Sin embargo, la ftalocianina de cinc en liposomas ultradeformables exhibió un nivel de penetración más alto en el estrato córneo de la piel, frente al nivel observado con su forma libre, lo cual contempla, además del papel leishmanicida del compuesto, el papel sinérgico que este puede tener en profilaxis o en la terapia durante etapas tempranas de la infección85. Finalmente una investigación que evaluó el efecto en fototerapia de la fenotiazina y algunos derivados como el azul de toluidina O (TBO) y el azul de metileno (MB) sobre L. braziliensis en concentraciones de 5 y 10 mg/ml mostró un descenso significativo en el número de promastigotes viables en todos los grupos tratados frente a los grupos control, con mayor letalidad de todos los compuestos en concentraciones de 10 mg/ml86.
Los últimos estudios in vivo de fototerapia en leishmaniasis han evaluado la respuesta terapéutica en hámsteres infectados con L. amazonensis en planta de pata o en piel de dorso. Un grupo de hámsteres tratados con azul de metileno, como agente fotosensibilizador, una vez por semana durante tres semanas e irradiados con LED durante 1 hora, exhibieron una notable disminución en la carga parasitaria en los nódulos linfáticos de la planta de la pata87. Otro estudió evaluó la eficacia terapéutica en hámsteres infectados intradérmicamente en piel de dorso con L. amazonensis y tratados con Ketales de carbaporfirina. Se observó actividad del compuesto incluso en la oscuridad, sugiriendo que el compuesto, una vez que se metaboliza en el tejido animal, produce un ingrediente activo que no parece ser fotosensible. Adicionalmente se observó una considerable reducción del tamaño de la lesión y los resultados del análisis histopatológico y del frotis confirmaron la eficacia in vivo del compuesto, ya que la carga parasitaria disminuyó notablemente sin efectos tóxicos asociados al tratamiento80.
En otro estudio se observó que ratones Balb/c infectados en oreja con L. major, tratados 3 semanas post-infección con solución tópica de ALA e irradiados 4 horas después con una fluencia de 50 J/cm2, presentaron una notable disminución en la carga parasitaria al comparar este grupo con el grupo control, tratado con ALA pero no iluminado y con un grupo solo irradiado sin aplicación de ALA88. En estos ratones se observó también una discreta necrosis en el área irradiada, acompañada de daño vascular y un marcado proceso inflamatorio confirmado en el estudio histopatológico, que mostró edema acompañado de destrucción de fibras de colágeno, congestión vascular, espongiosis, infiltración de neutrófilos, entre otro muchos hallazgos, compatibles con este proceso y acompañado además de una notable disminución de los macrófagos, célula hospedera por excelencia del parásito y cuya disminución es directamente proporcional a la destrucción de los parásitos y al aumento de citosinas proinflamatorias como la IL-6. En este estudio además se demostró que, a diferencia de lo observado in vivo , en el modelo in vitro con células J774 no hubo una disminución significativa de estas células que almacenaron la cantidad suficiente del compuesto para ser destruidas, lo cual indica que efectivamente la disminución en la carga parasitaria está relacionada no solo con el daño directo sobre la célula blanco y el parásito, sino que forma parte de un complejo proceso que involucra la respuesta inmune, el sistema vascular y el tipo de órgano o tejido.
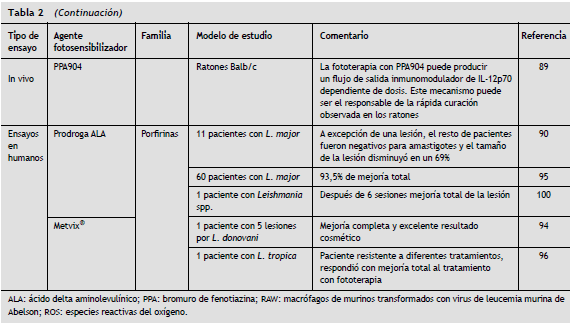
Otro estudio de este mismo autor89 evaluó el efecto de las fenotiazinas bajo condiciones similares a las descritas anteriormente y en el mismo modelo de infección. Se obtuvieron resultados que demostraron la eficacia de estos compuestos en los ratones infectados, con una inmunomodulación dependiente de la dosis. El resultado cosmético final fue favorable y por ello el autor propone la terapia fotodinámica como una alternativa terapéutica eficaz para el tratamiento de la leishmaniasis cutánea. In vitro se observó que el compuesto fue efectivo sobre los promastigotes a concentraciones de 0,093 µM, mientras que las J774 infectadas y tratadas con 1,25 µM de EtNBS fueron destruidas y liberaron parásitos aún vivos, debido posiblemente a una cantidad insuficiente del compuesto para la eliminación completa de los parásitos.
En cuanto a los estudios realizados en humanos, se ha demostrado que pacientes tratados con ALA90 y metvix®91-93 tienen una rápida y total curación de la lesión, con cicatrización completa y notable atenuación de la marca dejada por los tratamientos previos. Igualmente se ha comparado la efectividad de la fototerapia frente a los tratamientos convencionales actuales aceptados por la Organización Mundial de la Salud (OMS) tales como el antimonio pentavalente, la paramomicina, la anfotericina B y la miltefosina94-97 y frente a otros procedimientos como la crioterapia, la pentamidina y la termoterapia98-100, con resultados similares en cuanto a eficacia terapéutica, pero con una clara ventaja en cuanto al sorprendente efecto cosmético de la fototerapia.
En la tabla 2 se resume los estudios con fototerapia dirigidos al tratamiento de la leishmaniasis cutánea.
Perspectivas con la hipericina en fototerapia para el tratamiento de la leishmaniasis cutánea
Los datos actuales indican que la fototerapia es una alternativa terapéutica bien tolerada y una opción segura de tratamiento para la leishmaniasis cutánea, con eficacia superior a los tratamientos convencionales. La búsqueda de nuevos agentes fotosensibilizadores ha permitido extender la investigación al campo de las plantas fototóxicas, con moléculas bioactivas que muestran tener un importante potencial en fototerapia, entre las cuales resalta la hipericina.
Como se dijo antes, esta biomolécula presenta un rendimiento cuántico alto en su estado triplete y genera eficientemente oxígeno singlete y aniones superóxido 101-103. Diversos estudios han revelado la multifacética actividad fotodinámica de la hipericina, bien sea con la inducción de la peroxidación de membranas lipídicas56, aumento en la actividad superóxido dismutasa e incremento de los niveles de glutatión57,58, lo cual le otorga importantes propiedades antitumorales, antimicrobianas y específicamente leishmanicidas, por lo que se piensa en este metabolito de Hypericum perforatum como un agente promisorio contra el parásito al ser aplicado en los tejidos infectados104.
De acuerdo a todo lo anterior, se hace necesario realizar estudios tanto in vitro como in vivo , que estén dirigidos a validar el potencial terapéutico de la fotoactividad de la hipericina en leishmaniasis cutánea, con el fin de dirigir posteriores esfuerzos a la realización de evaluaciones clínicas que permitan postular esta molécula como un nuevo tratamiento en esta enfermedad.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
Agradecimientos
Al Instituto Tecnológico Metropolitano, la Universidad de Santander Sede Cúcuta y la Universidad de Caldas.
* Autor para correspondencia.
Correo electrónico: vivianataylor@gmail.com (V.M. Taylor O.).
0123-9392/$ - see front matter © 2013 ACIN. Publicado por Elsevier España, S.L. Todos los derechos reservados.
Bibliografía
1. WHO. Control of the leishmaniasis. Reports of a meeting of the WHO expert committee on the control of leishmaniasis. Geneva: WHO; 2010. [ Links ]
2. Gómez SE, Zambrano P. Informe del evento leishmaniasis hasta XIII período epidemiológico del año 2012. Vigilancia y control en Salud Pública. Santa Fe de Bogotá, Colombia: Instituto Nacional de Salud; 2012. [ Links ]
3. Gómez SE, Zambrano P. Informe del evento leishmaniasis hasta octavo período epidemiológico del año 2013. Vigilancia y control en Salud Pública. Santa Fe de Bogotá, Colombia: Instituto Nacional de Salud; 2013. [ Links ]
4. Robledo SM, Puerta JA, Muñoz DL, Guardo M, Vélez ID. Efficacy and tolerance of pentamidine for treatment of cutaneous leishmaniasis caused by L. (V) panamensis in Colombia. Biomédica. 2006;26:188-93. [ Links ]
5. Singh N, Kumar M, Singh RK. Leishmaniasis: Current status of available drugs and new potential drug targets. Asian Pac J of Trop Med. 2012;5:485-97. [ Links ]
6. García-Hernández R, Manzano JI, Castanys S, Gamarro F. Leishmania donovani develops resistance to drug combinations. PloS Negl Trop Dis . 2012;6:e1974. doi:10.1371/journal.pntd.0001974. Epub 2012 Dec 20. [ Links ]
7. Hotez PJ, Pecoul B. "Manifesto" for advancing the control and elimination of neglected tropical diseases. PloS Negl Trop Dis . 2010;4:1-7. [ Links ]
8. Seifert K. Structures, targets and recent approaches in antileishmanial drug discovery and development. Open Med Chem J. 2011;5:31-9. [ Links ]
9. Odonne G, Bourdy G, Castillo D, Estevez Y, Lancha-Tangoa A, Alban-Castillo J, et al. Ta´ta´, Huayani: perception of leishmaniasis and evaluation of medicinal plants used by the Chayahuita in Peru. Part II. J Ethnopharmacol. 2009;126:149-58. [ Links ]
10. Newman DJ, Cragg GM. Natural products as sources of new drugs over the last 25 years. J Nat Prod. 2007;70:461-77. [ Links ]
11. Rocha LG, Almeida JR, Macedo RO, Barbosa-Filho JM. A review of natural products with antileishmanial activity. Phytomedicine. 2005;12:514-35. [ Links ]
12. Da Silva DB, Tulli EC, Militao GC, Costa-Lotufo LV, Pessoa C, de Moraes MO, et al. The antitumoral, trypanocidal and antileishmanicidal activities of extract and alkaloids isolated from Duguetia furfuracea. Phytomedicine. 2009;16:1059-63. [ Links ]
13. Da Silva Filho AA, Resende DO, Fukui MJ, Santos FF, Pauletti PM, Cunha WR, et al. In vitro antileishmanial, antiplasmodial and cytotoxic activities of phenolics and triterpenoids from Baccharis dracuncufolia D.C. (Asteraceae). Fitoterapia. 2009;80:478-82. [ Links ]
14. Singh N, Kumar A, Gupta P, Chand K, Samant M, Rakesh M, et al. Evaluation of antileishmanial potential of Tinosporasinensis against experimental visceral leishmaniasis. Parasitol Res. 2008;102:561-5. [ Links ]
15. Rondon FC, Bevilaqua CM, Accioly MP, Morais SM, Andrade- Júnior HF, Carvalho CA, et al. In vitro efficacy of Coriandrum sativum, Lippia sidoides and Copaifera reticulata against Leishmania chagasi . Rev Bras Parasitol Vet. 2012;21:185-91. [ Links ]
16. Rondon FC, Bevilaqua CM, Accioly MP, Morais SM, Andrade- Junior HF, Machado LK, et al. In vitro effect of Aloe vera, Coriandrum sativum and Ricinus communis fractions on Leishmania infantum and on murine monocytic cells. Vet Parasitol. 2011;178:235-40. [ Links ]
17. Carneiro SM, Carvalho FA, Santana LC, Sousa AP, Neto JM, Chaves MH. The cytotoxic and antileishmanial activity of extracts and fractions of leaves and fruits of Azadirachta indica (A Juss.). Biol Res. 2012;45:111-6. [ Links ]
18. García M, Monzote L, Scull R, Herrera P. Activity of Cuban plants extracts against Leishmania amazonensis . ISRN Pharmacol. 2012;2012:104540. [ Links ]
19. García M, Monzote L, Montalvo AM, Scull R. Screening of medicinal plants against Leishmania amazonensis . Pharm Biol. 2010;48:1053-8. [ Links ]
20. Monzote L, García M, Montalvo AM, Scull R, Miranda M. Chemistry, cytotoxicity and antileishmanial activity of the essential oil from Piper auritum . Mem Inst Oswaldo Cruz. 2010;105:168-73. [ Links ]
21. Rios YK, Otero AC, Muñoz DL, Echeverry M, Robledo SM, Yepes MA. Actividad citotóxica y leishmanicida in vitro del aceite de manzanilla (Matricaria chamomilla). Rev Colomb Cienc Quím Farm, 2008;37:200-11. [ Links ]
22. Accioly MP, Bevilaqua CM, Rondon FC, de Morais SM, Machado LK, Almeida CA, et al. Leishmanicidal activity in vitro of Musa paradisiaca L. and Spondias mombin L. fractions. Vet Parasitol. 2012;187:79-84. [ Links ]
23. Kuroyanagi M, Murata M, Nakane T, Shirota O, Sekita S, Fuchino H, et al. Leishmanicidal active withanolides from a pakistani medicinal plant, Withania coagulans. Chem Pharm Bull (Tokyo). 2012;60:892-7. [ Links ]
24. Ramírez-Macías I, Marín C, Díaz JG, Rosales MJ, Gutiérrez- Sánchez R, Sánchez-Moreno M. Leishmanicidal activity of nine novel flavonoids from Delphinium staphisagria. Scientific World Journal. 2012;2012:2036-46. [ Links ]
25. Ghosal S, Deb A, Mishra P, Vishwakarma R. Leishmanicidal compounds from the fruits of Piper longum. Planta Med. 2012;78:906-8. [ Links ]
26. Robertson CA, Hawkins D, Abrahamse H. Photodynamic therapy (PDT): A short review on cellular mechanisms and cancer research applications for PDT. Photochem Photobiol B: Biol. 2009;96:1-8. [ Links ]
27. Moseley H. The scientific basis of PDT. Proc SPIE. 2003;5287:35-8. [ Links ]
28. O´Riordan K, Akilov OE, Hasan T. The potential for photodynamic therapy in the treatment of localized infections. Photodiagn Photodyn. 2005;2:247-62. [ Links ]
29. Akilov OE, O´Riordan K, Kosaka S, Hasan T. Photodynamic therapy against intracellular pathogens: Problems and potentials. Med Laser Ap. 2006;21:251-60. [ Links ]
30. Tan PJ, Appleton DR, Mustafa MR, Lee HB. Rapid identification of cyclic tetrapyrrolic photosensitisers for photodynamic therapy using on line hyphenated LC-PDA-MS coupled with photocytotoxicity assay. Phytochem Anal. 2012;23:52-9. [ Links ]
31. Bark KM, Heo EP, Han KD, Kim MB, Lee ST, Gil EM, et al. Evaluation of the phototoxic potential of plants used in oriental medicine. J Ethnopharmacol. 2010;127:11-8. [ Links ]
32. Bark KM, Sun YW, Yoon TJ, Kim TH. Phototoxicity of oriental medicinal plants: measurement and possible applications. Skinmed. 2011;9:294-300. [ Links ]
33. Conforti F, Menichini G, Zanfini L, Tundis R, Statti GA, Provenzano E, et al. Evaluation of phototoxic potencial of aerial components of the fig tree against melanoma. Cell Proliferation. 2012;45:279-85. [ Links ]
34. Har LW, Shaari K, Boon LH, Kamarulzaman FA, Ismail IS. Two new phloroglucinol derivatives and five photosensitizing pheophorbides from Syzygium polyanthum leaves (Salam). Nat Prod Commun. 2012;7:1033-6. [ Links ]
35. Chee CF, Lee HB, Ong HC, Ho AS. Photocytotoxic pheophorbide- related compounds from Aglaonema simplex . Chem Biodivers. 2005;2:1648-55. [ Links ]
36. Bui-Xuan NH, Tang PM, Wong CK, Fung KP. Photo-activated pheophorbide-a, an active component of Scutellaria barbata, enhances apoptosis via the suppression of ERK-mediated autophagy in the estrogen receptor-negative human breast adenocarcinoma cells MDA-MB-231. J Ethnopharmacol. 2010;131:95-103. [ Links ]
37. Tang PM, Zhang DM, Xuan NH, Tsui SK, Waye MM, Kong SK, et al. Photodynamic therapy inhibits P-glycoprotein mediated multidrug resistance via JNK activation in human hepatocellular carcinoma using the photosensitizer pheophorbide-a. Mol Cancer. 2009;8:56. [ Links ]
38. Tang PM, Chan JY, Zhang DM, Au SW, Fong WP, Kong SK, et al. Pheophorbide-a, an active component in Scutellaria barbata reverses P-glycoprotein-mediated multidrug resistance on a human hepatoma cell line R-HepG2. Cancer Biol Ther. 2007;6:504-9. [ Links ]
39. Comini LR, Fernandez IM, Rumie Vittar NB, Núñez Montoya SC, Cabrera JL, Rivarola VA. Photodynamic activity of anthraquinones isolated from Heterophyllaea pustulata Hook f. (Rubiaceae) on MCF-7c3 breast cancer cells. Phytomedicine. 2011;18:1093-5. [ Links ]
40. Akramiene D, Grazeliene G, Didziapetriene J, Kevelaitis E. Treatment of Lewis lung carcinoma by photodynamic therapy and glucan from barley. Medicina (Kaunas). 2009;45:480-5. [ Links ]
41. Karioti A, Bilia AR. Hypericins as potential leads for new therapeutics. Int J Mol Sci. 2010;11:562-94. [ Links ]
42. Klein S, Rister R. The Complete German Commission E Monographs: Therapeutic Guide to Herbal Medicine. Riggins C, editor. 1st ed. Austin (TX): The American Botanical Council; 1998. [ Links ]
43. WHO. World Health Organization monographs on selected medicinal plants. Geneva: WHO; 1999. [ Links ]
44. ESCOP Monographs. The European Scientific Cooperative on Phytotherapy. United Kingdom: ESCOP: 2003. [ Links ]
45. Miskovsky P. Hypericin – a new antiviral and antitumor photosensitizer: mechanism of action and interaction with biological macromolecules. Curr Drug Targets. 2002;3:55-84 [ Links ]
46. Jacobson J, Feinman L, Liebes L, Ostrow N, Koslowski V, Tobia A, et al. Pharmacokinetics, safety, and antiviral effects of hypericin, a derivative of St. John´s wort plant, in patients with chronic hepatitis C virus infection. Antimicrob Agents Chemother. 2001;45:517-24. [ Links ]
47. Fox E, Murphy RF, McCully CL, Adamson PC. Plasma pharmacokinetics and cerebrospinal fluid penetration of hypericin in nonhuman primates. Cancer Chemother. Pharmacol. 2001;47:41-4. [ Links ]
48. Kiesslich T, Krammer B. Cellular mechanisms and prospective >applications of hypericin in photodynamic therapy. Curr Med Chem. 2006;13:2189-204. [ Links ]
49. Alecu M, Ursaciuc F, Halalau G, Coman W, Merlevede E, de Witte P. Photodynamic treatment of basal cell carcinoma and squamous cell carcinoma with hypericin. Anticancer Res. 1998;18:4651-4. [ Links ]
50. Ali SM, Olivo M. Bio-distribution and subcellular localization of hypericin and its role in PDT induced apoptosis in cancer cells. Int J Oncol. 2002;21:531-40. [ Links ]
51. Kessel D, Luo Y, Deng Y, Chang CK. The role of subcellular localization in initiation of apoptosis by photodynamic therapy. Photochem Photobiol. 1997;65:422-5. [ Links ]
52. Moor AC. Signaling pathways in cell death and survival after photodynamic therapy. J Photochem Photobiol B: Biol. 2000;57:1-13. [ Links ]
53. Castano AP, Demidovaa TN, Hamblin MR. Mechanisms in photodynamic therapy: part two cellular signaling, cell metabolism. Modes of cell death. Photodiagn Photodyn. 2005;2:1-23. [ Links ]
54. English DS, Doyle RT, Petrich JW, Haydon PG. Subcellular distributions and excited state processes of hypericin in neurons. Photochem Photobiol. 1999;69:301-5. [ Links ]
55. Teasdale I, Waser M, Wilfert S, Falk H, Bruggemann O. Photoreactive, water-soluble conjugates of hypericin with polyphosphazenes. Monatsh Chem. 2012;143:355-60. [ Links ]
56. Chaloupka R, Obsil T, Plasek J, Sureau F. The effect of hypericin and hypocrellin-A on lipid membranes and membrane potential of 3T3 fibroblasts. Biochim Biophys Acta.1999;1418:39-47. [ Links ]
57. Hadjur C, Richards MJ, Parat MO, Jardon P, Favier A. Photodynamic effects of hypericin on lipid peroxidation and antioxidant status in melanoma cells. Photochem. Photobiol. 1996;64:375-81. [ Links ]
58. Miccoli L, Beurdeley-Thomas A, De Pinieux G, Sureau F, Oudard S, Dutrillaux B, et al. Light-induced photoactivation of hypericin affects the energy metabolism of human glioma cells by inhibiting hexokinase bound to mitochondria. Cancer Res.1998;58:5777-86. [ Links ]
59. Ho FY, Wu MH, Cheng BH, Chen YW, Shih MC. Lipid-mediated preferential localization of hypericin in lipid membranes. Biochim Biophys Acta. 2009;1788:1287-95. [ Links ]
60. emeláková M, Mike J, Jendzelovsky R, Fedorocko P. The proapoptotic and anti-invasive effects of hypericin-mediated photodynamic therapy are enhanced by hyperforin or aristoforina in HT-29 colon adenocarcinoma cell. Photochem Photobiol B: Biol. 2012;117:115-25. [ Links ]
61. Kawashima N, Nakajima N. Effect of photoactive pigment on photodynamic therapy for cancer cells. Prog Org Coat. 2011;72:34-9. [ Links ]
62. Nakajima N, Kawashima N. A basic study on Hypericin-PDT in vitro . Photodiagn Photodyn. 2012;9:196-203. [ Links ]
63. Gyenge E, Lüscher D, Forny P, Antonio M, Geisberger G, Walt H, et al. Photodynamic mechanisms induced by a combination of hypericin and a chlorin based-photosensitizer in head and neck squamous cell carcinoma cells. Photochem Photobiol. 2013;89:150-62. [ Links ]
64. Ferenc P, Solár P, Kleban J, Mike J, Fedorocko P. Downregulation of Bcl-2 and Akt induced by combination of photoactivated hypericin and genistein in human breast cancer cells. Photochem Photobiol B: Biol. 2010;98:25-34. [ Links ]
65. Kleban J, Mike J, Horváth V, Sacková V, Hofmanová J, Kozubík A, et al. Mechanisms involved in the cell cycle and apoptosis of HT-29 cells pre-treated with MK-886 prior to photodynamic therapy with hypericin. Photochem Photobiol B: Biol. 2008;93:108-18. [ Links ]
66. Thong P, Watt F, Ren MQ, Tan PH, Soo KC, Olivo M. Hypericinphotodynamic therapy (PDT) using an alternative treatment regime suitable for multi-fraction PDT. Photochem Photobiol B: Biol. 2006;82:1-8. [ Links ]
67. Zeisser-Labouébe M, Lange N, Gurny R, Delie F. Hypericin-loaded nanoparticles for the photodynamic treatment of ovarian cancer. Int J Pharm. 2006;326:174-81. [ Links ]
68. Du H, Olivo M. Hypericin photoactivation triggers down-regulation of matrix metalloproteinase-9 expression in well-differentiated human nasopharyngeal cancer cells. Cell Mol Life Sci. 2007;64:979-88. [ Links ]
69. Liu C, Kwan D, Saxton E, McFadden W. Hypericin and photodynamic therapy decreases human pancreatic cancer in vitro and in vivo. J Surg Res. 2000;93:137-43. [ Links ]
70. Bobrov N, Cavarga I, Longauer F, Rybarova S, Fedorocko P, Brezáni P, et al. Histomorphological changes in murine fibrosarcoma after hypericin-based photodynamic therapy. Phytomedicine. 2007;14:172-8. [ Links ]
71. Davids LM, Kacerovská D, Pizinger K, Kidson SH. Hypericin phototoxicity induces different modes of cell death in melanoma and human skin cells. J Photochem Photobiol B: Biol. 2008;91:67-76. [ Links ]
72. Rook A, Wood GS, Duvic M, Vonderheid E, Tobia A, Cabana B. A phase II placebo-controlled study of photodynamic therapy with topical hypericin and visible light irradiation in the treatment of cutaneous T-cell lymphoma and psoriasis. J Am Acad Dermatol. 2010;63:984-90. [ Links ]
73. Boiy A, De Witte P, Roelandts R. Topical treatment of disseminated superficial actinic porokeratosis with hypericinphotodynamic therapy: A case report. Photodiagn Photodyn. 2010;7:123-5. [ Links ]
74. Ritz R, Daniels R, Noell S, Feigl GC, Schmidt V, Bornemann A, et al. Hypericin for visualization of high grade gliomas: First clinical experience. Eur J Surg Oncol. 2012;38:e352-e360. [ Links ]
75. Olivo M, Fu Ch, Raghavan V, On Lau WK. New frontier in hypericin- mediated diagnosis of cancer with current optical technologies. Ann Biomed Eng. 2012;40:460-73. [ Links ]
76. Rezusta A, Lopez-Chicon P, Paz-Cristobal MP, Alemany-Ribes M, Royo-Diez D, Agut M, et al. In vitro fungicidal photodynamic effect of hypericin on Candida species. Photochem Photobiol. 2012;88:613-9. [ Links ]
77. Yow C, Tang HM, Chu E, Huang Z. Hypericin-mediated photodynamic antimicrobial effect on clinically isolated pathogens. Photochem Photobiol. 2012;88:626-32. [ Links ]
78. Escobar P, Hernández IP, Rueda CM, Martínez F, Páez E. Photodynamic activity of aluminum (III) and zinc (II) phthalocyanines in Leishmania promastigotes. Biomédica. 2006;26:49-56. [ Links ]
79. Gardner DM, Taylor V, Cedeño DL, Padhee S, Robledo SM, Jones MA, et al. Association of acenaphthoporphyrins with liposomes for the photodynamic treatment of leishmaniasis. Photochem Photobiol. 2010;86:645-52 [ Links ]
80. Taylor V, Cedeño DL, Muñoz DL, Jones MA, Las TD, Young AM, et al. In vitro and in vivo studies of the utility of dimethyl and diethyl carbaporphyrin ketals in treatment of cutaneous leishmaniasis. Antimicrob Agents Chemother. 2011;55:4755-64. [ Links ]
81. Hooker JD, Nguyen V, Taylor VM, Cedeño DL, Lash TD, Jones MA, et al. New application for expanded porphyrins: Sapphyrin and heterosapphyrins as inhibitors of Leishmania parasites. Photochem Photobiol. 2012;88:194-200. [ Links ]
82. Taylor VM, Cedeño DL, Robledo SM. Fototerapia para el tratamiento de la leishmaniasis cutánea. Infectio. 2011;15:277-88. [ Links ]
83. Sazgarnia A, Bahreyni-Toosi MH, Layegh P, Rajabi O. Liposomal zinc phthalocyanine as a potential agent for photodynamic therapy of leishmaniasis. Indian J Dermatol Venereol Leprol. 2010;76:417-8. [ Links ]
84. Hernández IP, Montanari J, Valdivieso W, Morilla MJ, Romero EL, Escobar P. In vitro phototoxicity of ultradeformable liposomes containing chloroaluminum phthalocyanine against New World Leishmania species. Photochem Photobiol B: Biol. 2012;117:157-63. [ Links ]
85. Montanari J, Maidana C, Esteva MI, Salomon C, Morilla JM, Romero EL. Sunlight triggered photodynamic ultradeformable liposomes against Leishmania braziliensis are also leishmanicidal in the dark. J Control Release. 2010;147:368-76. [ Links ]
86. Barbosa AF, Sangiorgi BB, Galdino, SL, Barral-Netto M, Pitta IR, Pinheiro AL. Photodynamic antimicrobial chemotherapy (PACT) using phenothiazine derivatives as photosensitizers against Leishmania braziliensis . Lasers Surg Med. 2012. doi:10.1002/lsm.22099. [ Links ]
87. Somenci L, Guerino CE, Kimura E, Politi MJ, Campana MV, Alessi SM, et al. Photodynamic therapy for American cutaneous leishmaniasis: The efficacy of methylene blue in hamsters experimentally infected with Leishmania (Leishmania) amazonensis . Exp Parasitol. 2011;128:353-6. [ Links ]
88. Akilov OE, Kosaka S, O´Riordan K, Hasan T. Parasiticidal effect of delta-aminolevulinic acid-based photodynamic therapy for cutaneous leishmaniasis is indirect and mediated through the killing of the host cells. Exp Dermatol. 2007;16:651-60. [ Links ]
89. Akilov OE, Kosaka S, O´Riordan,K, Hasan T. Photodynamic therapy for cutaneous leishmaniasis: the effectiveness of topical phenothiaziniums in parasite eradication and Th1 immune response stimulation. Photochem Photobiol Sci. 2007;6:1067-75. [ Links ]
90. Enk CD, Fritsch C, Jonas F, Nasereddin A, Ingber A, Jaffe CL, et al. Treatment of cutaneous leishmaniasis with photodynamic therapy. Arch Dermatol. 2003;139:432-4. [ Links ]
91. Baptista MS, Wainwright M. Photodynamic antimicrobial chemotherapy (P ACT) for the treatment of malaria, leishmaniasis and trypanosomiasis. Braz J Med Biol Res. 2011;44:1-10. [ Links ]
92. Kharkwal GB, Sharma SK, Huang YY, Dai T, Hamblin MR. Photodynamic therapy for infections: Clinical applications. Lasers Surg Med. 2011;43:755-67. [ Links ]
93. Gardlo K, Hanneken S, Ruzicka T, Neumann NJ. Photodynamic therapy of cutaneous leishmaniasis. A promising new therapeutic modality. Hautarzt. 2004;55:381-3. [ Links ]
94. Gardlo K, Horska Z, Enk CD, Rauch L, Megahed M, Ruzicka T, et al. Treatment of cutaneous leishmaniasis by photodynamic therapy. J Am Acad Dermatol. 2003;48:893-6. [ Links ]
95. Asilian A, Davami M. Comparison between the efficacy of photodynamic therapy and topical paromomycin in the treatment of Old World cutaneous leishmaniasis: A placebo-controlled, randomized clinical trial. Clin Exp Dermatol. 2006;31:634-7. [ Links ]
96. Sohl S, Kauer F, Paasch U, Simon JC, Wetzig T. Photodynamic treatment of cutaneous leishmaniasis. J Dtsch Dermatol Ges. 2007;5:128-30. [ Links ]
97. Van der Snoek EM, Robinson DJ, Van Hellemond JJ, Neumann HA. A review of photodynamic therapy in cutaneous leishmaniasis. J Eur Acad Dermatol Venereol. 2008;22:918-22. [ Links ]
98. Willard RJ, Jeffcoat AM, Benson PM, Walsh DS. Cutaneous leishmaniasis in soldiers from Fort Campbell, Kentucky, returning from Operation Iraqi Freedom highlights diagnostic and therapeutic options. J Am Acad Dermatol. 2005;52:977-87. [ Links ]
99. Lobo IM, Soares MB, Correia TM, De Freitas LA, Oliveira MI, Nakatani M, et al. Heat therapy for cutaneous leishmaniasis elicits a sys-temic cytokine response similar to that of antimonial (Glucantime) therapy. Trans R Soc Trop Med Hyg. 2006;100:642-9. [ Links ]
100. Fukamachi S, Nakamura M, Tokura Y. Successful treatment of cutaneous leishmaniasis by photodynamic therapy and cryotherapy. Eur J Dermatol. 2009;19:172-3. [ Links ]
101. Thomas C, Pardini RS. Oxygen dependence of hypericin induced phototoxicity to EMT6 mouse mammary carcinoma cells.Photochem Photobiol. 1992;55:831-7. [ Links ]
102. Hadjur C, Richard MJ, Parat MO, Favier A, Jardon P. Photodynamically-induced cytotoxicity of hypericin dye on human fibroblast cell line MRC5. J Photochem Photobiol B: Biol.1995;27:139-46. [ Links ]
103. Ehrenberg B, Anderson JL, Foote CS. Kinetics and yield of singlet oxygen photosensitized by hypericin in organic and biological media. Photochem Photobiol. 1998;68:135-40. [ Links ]
104. Alzate JF, Arias A, Moreno-Mateos D, Alvarez-Barrientos A,Jimenez-Ruiz A. Mitochondrial superoxide mediates heatinduced apoptotic-like death in Leishmania infantum . Mol Biochem Parasit. 1997;152:192-202. [ Links ]













