Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Infectio
versión impresa ISSN 0123-9392
Infect. vol.17 no.3 Bogotá jul./set. 2013
REVISIÓN
Participación de la vitamina D en la patogénesis de la infección por el virus de la inmunodeficiencia humana tipo 1
Wbeimar Aguilar-Jiménez a , Wildeman Zapata B. a,b y María Teresa Rugeles L. a, *
a Grupo Inmunovirología, Facultad de Medicina, Universidad de Antioquia UdeA, Medellín, Colombia.
b Grupo Infettare, Universidad Cooperativa de Colombia, Medellín, Colombia
Recibido el 16 de junio de 2013; aceptado el 6 de septiembre de 2013
Resumen
La vitamina D (VitD), además de su papel en el metabolismo mineral, tiene funciones inmunomoduladoras y podría participar activamente en la fisiopatogénesis de la infección por el VIH-1; sin embargo, la evidencia científica en este campo es limitada y controvertida.
La VitD tiene propiedades antiinflamatorias que podrían disminuir la hiperactivación inmunológica, reduciendo el daño asociado a este fenómeno; además, promueve la expresión de péptidos con actividad anti-VIH-1, sustentando su papel protector. En contraste, la VitD activa el promotor del VIH-1 y podría potenciar la replicación del virus; adicionalmente, algunas variantes alélicas en el gen del receptor de la VitD, que aumentan su función, se han asociado con susceptibilidad al VIH-1.
Esta revisión presenta evidencia científica sobre el efecto de la vía de la VitD en la patogénesis de la infección por el VIH-1, dada las implicaciones de este tópico en la identificación de nuevos blancos terapéuticos en esta infección.
© 2013 ACIN. Publicado por Elsevier España, S.L. Todos los derechos reservados.
PALABRAS CLAVE
Virus de la Inmunodeficiencia humana tipo 1; Vitamina D; Hiperactivación inmunológica; Péptidos Antimicrobianos
Vitamin D involvement in the pathogenesis of human immunodeficiency virus type 1
Abstract
Beyond its role in mineral metabolism, vitamin D (VitD) has immunomodulatory functions and can actively participate in the physiopathogenesis of HIV-1 infection; however, scientific evidence in this field is limited and controversial. VitD has anti-inflammatory properties that can reduce immune hyperactivation, decreasing the damage associated with this phenomenon. It also promotes the expression of antimicrobial peptides with anti-HIV-1 activity, supporting its protective role. In contrast, VitD activates the HIV-1 promoter and can increase viral replication. Furthermore, a number of allelic variants in the vitamin D receptor gene, which increase its function, have been associated with susceptibility to HIV-1 infection.
Given the implications of this topic for the identification of new therapeutic targets in HIV infection, this review presents scientific evidence on the effect of the VitD pathway in HIV-1 pathogenesis.
© 2013 ACIN. Published by Elsevier España, S.L. All rights reserved.
KEYWORDS:
Human immunodeficiency virus type 1; Vitamin D; Immune activation; Antimicrobial peptides
Introducción
La infección por el virus de la inmunodeficiencia humana tipo 1 (VIH-1) es uno de los principales problemas de salud pública que afecta a alrededor de 34 millones de personas en el mundo; se estimó que, en el 2011, ocurrieron alrededor de 2,4 millones de nuevas infecciones y 1,8 millones de muertes a causa del VIH-1 1. En Colombia, los datos epidemiológicos más recientes muestran que, entre 1985 y el 31 de diciembre de 2011, se han reportado un total de 75.620 casos de infección por el VIH-1 y aunque en los últimos años el sistema de vigilancia y registro de VIH-1 en Colombia ha mejorado, estas cifras conllevan un importante subregistro, de tal forma que la prevalencia estimada para el 2011 fue de 0,52%, con un cálculo aproximado de 152.620 personas con VIH-1. Además, se estimó que en ese mismo año 5.650 personas murieron a causa de esta infección 2.
La infección por el VIH-1 se caracteriza por una pérdida de linfocitos T CD4+ y un estado de hiperactivación inmune, que se establece desde la etapa inicial de la infección, promoviendo el desarrollo de una inmunodeficiencia severa (SIDA, síndrome de inmunodeficiencia adquirida) que se asocia con la aparición de infecciones oportunistas y procesos malignos, que finalmente conducen a la muerte del paciente 3.
Ciertamente, el gran componente inmunológico en la fisiopatogénesis de la infección por el VIH-1 sugiere que inmunomoduladores endógenos podrían tener un potente impacto en esta infección. En este sentido, la vitamina D (VitD), que además de participar en la regulación del metabolismo mineral tiene la capacidad de modular las respuestas inmunes, podría ser un buen candidato a estudiar; sin embargo, es poca y controvertida la evidencia de la participación de la VitD y los genes involucrados en su metabolismo sobre la infección por el VIH-1.
Basados en esto, se realizó una búsqueda en las bases de datos Pubmed, Medline y Ovid, usando y combinando los términos HIV-1, vitamin D, vitamin D pathway, vitamin D receptor, virus replication, disease progression, disease resistance con el fin de revisar la relación entre la vía de la VitD y la infección por el VIH-1.
Importancia y metabolismo de la vitamina D
La VitD es considerada una pro-hormona compleja con innumerables acciones en múltiples sistemas fisiológicos. A pesar del conocimiento de estas funciones, se ha subestimado la prevalencia de la deficiencia de la VitD, ignorando la gran cantidad de situaciones de riesgo con que se asocia 4 . El 10% de la VitD es obtenida de la dieta y el 90% de la acción de la luz UV-B sobre el 7-dihidrocolesterol de la piel 4 (90%).
Aunque se suele hablar de VitD en forma generalizada, se debe tener en cuenta que esta molécula sufre varias modificaciones estructurales sucesivas que finalmente conducen a la formación de un metabolito biológicamente activo; dicho estado activo se logra a través de dos hidroxilaciones secuenciales por la acción de varias enzimas hidroxilasas del citocromo P450. Primero, gracias a la acción de la 24-hidroxilasa CYP2R1 y en menor medida la CYP27A1 5,6, se produce la 25-hidroxivitamina D3 [25(OH) D3] (también conocida como calcidiol), molécula que se utiliza como indicador de los niveles de VitD en circulación 4. El siguiente paso en el proceso de bioactivación es llevado a cabo por la enzima 1-alfa-hidroxilasa (CYP27B1), que mediante la hidroxilación del calcidiol genera la forma activa u hormonal de la VitD, la 1,25-dihidroxivitamina D3 [1,25(OH) 2 D3], también conocida como calcitriol 7. Altos niveles de calcitriol promueven su propia inactivación catabólica a través de la enzima 24-hidroxilasa (CYP24A1), la cual es responsable de realizar una hidroxilación adicional a la VitD, permitiendo su excreción 7.
La interacción del calcitriol con su receptor (VDR, Vitamin D Receptor ) induce su translocación a núcleo, donde el VDR forma un heterodímero con el receptor X del ácido retinoico alfa (RXRA, retinoic X receptor alpha ) formando un complejo calcitriol-VDR-RXRA. Este complejo actúa como un factor de transcripción que reconoce y se une a elementos de respuesta a la vitamina D (VDRE, vitamin D response elements ), ubicados en las regiones promotoras de genes blanco 8, mediando el ensamble del complejo de iniciación de la transcripción. En forma alternativa, cuando el complejo calcitriol-VDR-RXRA se une a un VDRE inhibitorio, correpresores son reclutados y se produce una inhibición de la transcripción génica 8. Un resumen del proceso metabólico que sufre la VitD se presenta en la figura 1.
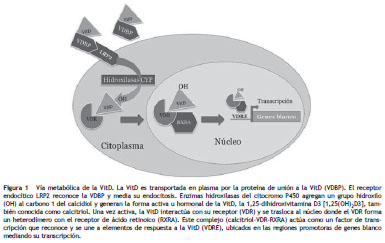
En resumen podemos afirmar que las acciones biológicas resultantes de la regulación transcripcional del complejo calcitriol-VDR-RXRA tienen efectos pleiotrópicos, regulando así cientos de genes 9, algunos involucrados en la homeostasis de la VitD y el calcio 9 , otros en la diferenciación y supresión de la proliferación celular 10 y otros tantos en la modulación de las respuestas inmunes innatas y adaptativas 11-13 .
La vitamina D: un potente inmunomodulador
"El hecho que los componentes de la vía metabólica de la VitD, en particular las enzimas hidroxilasas CYP2R1, CYP27A1, CYP27B1, CYP24A1 y el VDR, sean expresados y estén funcionalmente activos en las células del sistema inmune, principalmente las células presentadoras de antígeno (6,12) y los linfocitos T (14), sustenta fuertemente la función de la VitD en la modulación del sistema inmune.
La VitD puede tener efectos contrastantes con relación a su papel inmunomodulador. Puede potenciar la inmunidad innata, particularmente el reconocimiento de microorganismos como el Mycobacterium tuberculosis , a través de los receptores tipo Toll (TLR, Toll-Like Receptor ) expresados por los monocitos y macrófagos humanos lo cual lleva a la inducción de la expresión de los genes que codifican para el VDR y la CYP27B1 12. De esta manera se puede bioactivar la VitD e inducir la transcripción y expresión del péptido antimicrobiano catelicidina, molécula que se trasloca a los fagosomas, participando en la eliminación intracelular de la micobacteria 12,15.
En contraste, la VitD tiene un efecto inhibitorio marcado sobre las células T ayudadoras (Th, T helper cells ) de tipo 1, previniendo su activación y producción de citocinas 10,11,13. Por tanto, en un entorno de alta producción de VitD se verá alterado el balance Th1/Th2, favoreciendo una respuesta Th2.
Con base en esta evidencia, se ha propuesto que la VitD ayuda a mantener una tolerancia a lo propio, favorece la eliminación de agentes patógenos intracelulares y controla las respuestas inmunes exacerbadas 10,11.
La vitamina D en la infección por el virus de la inmunodeficiencia humana tipo 1: evidencias epidemiológicas y experimentales
Aun conociendo la importancia de la exposición a la luz solar en el metabolismo de la VitD, hay pocos reportes que relacionen la exposición a la luz solar con la infección por el VIH-1 que permitan evaluar su impacto en la infección.
Datos epidemiológicos de una cohorte multicéntrica de estudio del SIDA revelaron que la exposición a la luz solar no se asoció con variaciones en el recuento de linfocitos T CD4+ o en la progresión al SIDA 16. Resultados similares fueron encontrados por otros autores en población holandesa 17.
Se debe tener en cuenta que, aunque la luz del sol es la principal fuente de VitD, un bajo consumo de VitD en la dieta podría contribuir con su deficiencia. En una encuesta de 81 personas infectadas en Sudáfrica, el 64% tenían un consumo dietario menor de la asignación dietética recomendada 18, dando soporte a la hipótesis que, en esta población humana con alta prevalencia de la infección, ésta se acompaña con deficiencia de VitD. No obstante, este menor consumo dietario de VitD se ha visto también en países con menores prevalencias de VIH-1, como España 19.
Los estudios que han evaluado la participación de la VitD durante la infección por el VIH-1 presentan evidencias ambiguas. Los estudios iniciales de Coodley et al. (1993) mostraron que los niveles de VitD disminuyen durante la progresión de la enfermedad y estos bajos niveles en la VitD se correlacionan directamente con tiempos de supervivencia más cortos 20. Para inferir si la infección con el VIH-1 se asocia con deficiencia de VitD, son necesarios estudios que muestren comparaciones con individuos control no infectados. Sin embargo son pocos los estudios publicados que comparen individuos infectados y no infectados. Un estudio conducido en población alemana que buscaba la asociación entre densidad mineral ósea e infección por el VIH-1 encontró que las concentraciones de 1,25(OH) 2 D3 y 25(OH)D fueron significativamente reducidas entre los individuos infectados (19,4 ng/L y 37,3 g/L, respectivamente) en comparación con controles negativos 21 (47,3 ng/L y 61,5 g/L, respectivamente). Otros estudios, realizados también en población europea, han encontrado deficiencia de calcitriol pero no de calcidiol en individuos infectados con VIH-1 comparado con individuos control 22, sugiriendo que la deficiencia de calcitriol no es debida a baja disponibilidad de calcidiol, sino que podría estar relacionada con el proceso de bioactivación de la VitD 22. Los autores proponen que citocinas proinflamatorias como el factor de necrosis tumoral (TNF, Tumor Necrosis Factor )-alfa pueden inducir un defecto en la hidroxilación y activación de la VitD, al bloquear el estímulo de la hormona paratiroidea en la acción de la 1- α-hidroxilasa 22,23. El TNF-alfa está aumentado en individuos infectados debido al estado de hiperactivación inmune característico de esta infección y podría ser la causa de la deficiencia de VitD observada en ellos.
A pesar de que la deficiencia de VitD reportada en los individuos infectados podría deberse a la infección per se , se ha visto que los inhibidores de proteasa e inhibidores de la transcriptasa reversa no análogos de los nucleósidos incluidos en los esquemas antirretrovirales de gran actividad (HAART, highly active antiretroviral therapy ) disminuyen la función de las enzimas que participan en el metabolismo de la VitD 24,25, aspecto que hace difícil determinar el efecto directo del virus sobre los niveles de VitD en los individuos infectados, debido al uso frecuente de la terapia antirretroviral desde finales de los años 90.
El resultado de la suplementación con VitD en pacientes infectados por el VIH-1 se ha estudiado en varios ensayos clínicos tratando de mejorar el metabolismo óseo; aunque se ha observado una correlación positiva entre los niveles de VitD y la frecuencia de células T reguladoras después de la suplementación 26, no se encontraron diferencias significativas en parámetros inmunológicos entre los individuos en tratamiento y aquellos recibiendo un placebo, incluso después de un año de suplementación 26-28. Además, en esos individuos no fue posible estimar el efecto del tratamiento con VitD en la replicación viral, puesto que todos estaban en tratamiento antirretroviral 26-28.
El efecto de la VitD en la replicación del VIH-1 ha sido evaluado en líneas celulares y en cultivos primarios de monocitos, mostrando resultados contradictorios. El pre-tratamiento con VitD en la línea celular monoblastoide U937 antes de la infección potenció la replicación viral; sin embargo, cuando estas células se expusieron al calcitriol después de la infección, se notó una marcada inhibición de la replicación viral 29. Otros estudios mostraron que la incubación de estas células con VitD promovió su diferenciación hacia macrófagos, observándose un aumento de la replicación viral dependiente de la expresión del TNF-alfa 30,31. Adicionalmente, se ha reportado que no todas las células de esa línea celular son igualmente susceptibles a la infección por el VIH-1 32 y que el calcitriol puede aumentar la replicación del virus en algunas, pero no en todas las células. Se ha propuesto que esta variabilidad depende de la inducción de la expresión del receptor de quimiocinas con motivo C-X-C tipo 4 (CXCR4, C-X-C chemokine receptor type 4 ), por parte de la VitD 33.
Estudios in vitro de cultivos primarios de monocitos mostraron que el pre-tratamiento con calcitriol disminuye la infección productiva del VIH-1 34; también se encontró un efecto inhibidor de este compuesto sobre la replicación del VIH-1 en macrófagos derivados de monocitos 29. Además, un estudio reciente muestra que la VitD podría tener un efecto antiviral a través de la activación de la autofagia, mediado por la acción del receptor VDR y de la inducción de catelicidina en macrófagos humanos 35. Sin embargo, también se ha reportado un aumento en la replicación del VIH-1 después del tratamiento de monocitos con VitD 36.
Las diferencias entre estos estudios pueden deberse a la variabilidad metodológica, entre las cuales se destacan variaciones en los tipos celulares, la concentración de VitD, cepas virales, el tratamiento con VitD antes y/o después de la infección, adición de otros estímulos como TNF- α y el tiempo en que se mantienen los cultivos.
La vitamina D y genes relacionados con su función en la patogénesis de la infección por el virus de la inmunodeficiencia humana tipo 1
El efecto protector de la VitD ante la infección por el VIH-1 podría derivarse de su acción sobre la inmunidad innata. Se ha reportado que el tratamiento con la forma activa de la VitD sobre varios tipos celulares, incluyendo células epiteliales, induce la expresión de peptidos antimicrobianos como catelicidina, HBD-2 y HBD-3 12,15,37, los cuales tienen actividad anti-VIH-1 in vitro 38,39.
Es destacable que nuestro grupo reportó una alta expresión de RNAm de HBD-2 y HBD-3 en la mucosa oral de individuos expuestos sexualmente al VIH-1 pero que permanecen seronegativos (HESN) comparado con individuos sanos, sugiriendo que estos péptidos podrían proteger contra la transmisión del VIH-1 en mucosa oral, y probablemente en otras mucosas 40. Además, recientemente encontramos que estos niveles de ARNm de HBD-2 y HBD-3 se correlacionaron positivamente con la expresión del ARNm de VDR en la mucosa oral (Aguilar-Jiménez et al., 2013. Aceptado para publicación en PLos One), sugiriendo que la vitamina D y su receptor podrían inducir defensinas e influir en el fenotipo de resistencia observado en los individuos HESN.
Con respecto al efecto anti-VIH-1 de la catelicidina, la evidencia es controvertida 38,41; se ha propuesto que este compuesto inhibe la replicación del VIH-1 actuando directamente en las células blanco y no por una inhibición de los viriones per se 38. De hecho, la catelicidina podría ejercer su efecto anti-VIH-1 en el ambiente intracelular, como ocurre en la infección por M. tuberculosis 12,35,42.
De otro lado, se conoce que la infección por el VIH-1, desde la fase aguda, va acompañada de un estado de hiperactivación inmune que contribuye con la patogénesis y progresión de esta infección. En este sentido, la VitD podría repercutir positivamente en la resistencia a la infección por el VIH-1 favoreciendo el mantenimiento de un estado antiinflamatorio que puede ser mediado por la VitD a través de la inhibición selectiva del factor de transcripción NF-kB (nuclear factor kappa-light-chain-enhancer of activated B cells) y de las citocinas tipo Th1 10,11,13. Promoviendo propiedades tolerogénicas en las células dendríticas mieloides, y el aumento en células T reguladoras que controlarían la activación y, por ende, la replicación y diseminación viral 10,13. Dicho estado antiinflamatorio también podría promover la eliminación viral en el sitio de exposición, mediada por los interferones tipo I, los cuales no son afectados por la VitD como se ha mostrado en experimentos in vitro y en el modelo de infección por virus sincitial respiratorio 11.
Es de resaltar que, en un trabajo reciente, nuestro grupo observó mayores niveles de transcritos de IL-10 en células mononucleares de sangre periférica (CMSP) y en mucosa genital de los HESN comparado con los individuos sanos, y bajos niveles de ARNm de TNF- α en mucosa oral y genital de los mismos en comparación con los individuos infectados. También se observaron correlaciones positivas entre el ARNm de VDR y de IL-10 en las CMSP y en la mucosa genital de los individuos HESN (Aguilar-Jiménez et al., 2013. Aceptado para publicación en PLos One), apoyando la hipótesis que la VitD y su receptor podrían regular la inflamación y proteger contra la infección por el VIH-1 en individuos HESN.
Sin embargo, en un individuo ya infectado, un efecto negativo de la polarización de la respuesta de Th1 a Th2 y de este estado antiinflamatorio no puede ser descartado en esta infección 43,44. Además, algunos reportes sugieren una potenciación de la infección viral mediada por el VDR. Como se mencionó anteriormente, se ha observado que la VitD incrementa la replicación viral en monocitos, siendo este aumento proporcional al grado de afinidad de la VitD por el receptor intracelular VDR 36. De hecho, se ha observado que el complejo VitD/VDR activa el promotor LTR (long terminal repeat) del VIH-1 45.
Estas evidencias suponen el papel dual de la VitD durante la exposición y la infección al VIH-1, tal como lo resume la figura 2.
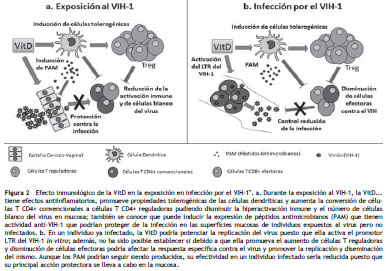
Adicionalmente, se han descrito algunas variantes alélicas en el gen que codifica para el VDR ubicadas en el promotor, en la región codificante y en las regiones 3' no traducidas (UTR, Untranslated Regions ) que tienen efectos funcionales en este gen 46 y que han sido asociadas con resistencia/susceptibilidad a la infección por el VIH-1 47,48. Por ejemplo, el SNP rs2228570 T/C (Fok- I ) en el exón 2 de este gen es una transición T/C (de ATG a ACG) en el primero de dos sitios potenciales de inicio de la traducción; este SNP explica algunas alteraciones funcionales en este gen 49 y se ha reportado la asociación del genotipo heterocigoto con rápida progresión al SIDA 48. El análisis haplotípico de variantes alélicas en el VDR , publicado por De la Torre et al., en una población de usuarios de drogas intravenosas (UDIV) que eran HESN, demostró una correlación de dos haplotipos con protección contra este virus: el haplotipo G-A en el promotor [rs11568820 G/A (Cdx)-rs4516035 (A1012G)] y un haplotipo en la región 3'UTR que contenía el alelo G en el SNP rs1544410 A/G 47 (BsmI). Debido a que estas variantes están relacionadas con una menor expresión y menor estabilidad del RNAm de VDR 46,50, los autores proponen que su asociación con resistencia a la infección por el VIH-1 podría estar fundamentada en que probablemente ellas generan un defecto en la señalización producida por la VitD, y dicho defecto podría conferir protección contra la infección por el VIH-1 47,50.
La evidencia presentada hasta el momento denota la controversia existente en el efecto de la VitD sobre la infección por el VIH-1; además, la introducción de la terapia HAART a finales de los años 90 adicionó un factor de confusión en el estudio de la relación directa entre la VitD y el virus y por lo tanto podría explicar la escasez de literatura reciente en este campo de investigación. Más aún, vale la pena precisar que estos estudios previos se han enfocado en aproximaciones fraccionadas basadas en los niveles séricos de la VitD y en variantes en el gen VDR en individuos infectados con el VIH-1, restándole importancia a otros genes con una participación activa en la regulación de la función de la VitD como las enzimas hidroxilasas que permiten su activación, las moléculas del sistema inmune como los receptores tipo Toll que potencian la acción de la VitD en las células, así como las posibles interacciones entre estos.
Estos estudios están siendo realizados en nuestro grupo con el fin de asociar moléculas de la vía de la VitD con el riesgo de adquirir esta infección y entender los posibles mecanismos de protección que podría tener la VitD y aplicar este conocimiento para el desarrollo de nuevas estrategias terapéuticas.
Conclusiones
Las investigaciones realizadas hasta la fecha no permiten establecer claramente el papel de la VitD y los genes involucrados en su metabolismo y función en la inmunopatogénesis de la infección por el VIH-1.
La evidencia in vitro de la VitD sobre la replicación viral muestra que sus efectos dependen de varios parámetros, como lo son el estado de maduración de las células, el tiempo de tratamiento y probablemente el genotipo individual para el VDR y otros genes que codifican proteínas involucradas en el metabolismo y función de la VitD como las enzimas hidroxilasas.
La VitD tiene efectos antiinflamatorios y aumenta la conversión de células T CD4+ convencionales a células T CD4+ reguladoras, pudiendo disminuir la hiperactivación inmune; también se conoce que puede inducir la expresión de péptidos antimicrobianos que tienen actividad anti-VIH-1 que podrían proteger de la infección en las superficies mucosas. Sin embargo, la VitD activa el promotor LTR del VIH-1 in vitro y podría potenciar la replicación del virus; además, no ha sido posible establecer si, debido a que promueve el aumento de células T reguladoras y disminución de células inflamatorias, ella podría afectar la respuesta específica contra el virus y promover la replicación y diseminación del mismo.
Desvelar el papel de la VitD en la infección por el VIH-1 y su relación con los mecanismos que subyacen a la hiperactivación inmunológica y respuesta inmune contra el virus en superficies mucosas podría ayudar a comprender mejor la patogénesis de la enfermedad causada por este virus y así promover su control con el desarrollo de estrategias terapéuticas que modulen de manera efectiva los genes involucrados en el metabolismo y función de la VitD.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
Agradecimientos
Este trabajo fue posible gracias a la financiación de COLCIENCIAS (código, 111549326091) y Estrategia sostenibilidad 2013-2014 de la Universidad deAntioquia Wbeimar Aguilar recibió financiación de COLCIENCIAS para realizar sus estudios de doctorado.
* Autor para correspondencia.
Correo electrónico: mtrugel@udea.edu.co (M.T. Rugeles L.).
0123-9392/$ - see front matter © 2013 ACIN. Publicado por Elsevier España, S.L. Todos los derechos reservados.
Bibliografía
1. UNAIDS. World AIDS Day Report. 2012 [consultado 6 Abr 2013]. Disponible en: http://www.unaids.org/en/media/unaids/contentassets/documents/epidemiology/2012/gr2012/20121120_UNAIDS_Global_Report_2012_with_annexes_en.pdf. [ Links ]
2. UNGASS. Informe mundial de avances en la lucha contra el Sida. Colombia 2012. 2012 [consultado 6 Feb 2013]. Disponible en: http://www.unaids.org/en/dataanalysis/knowyourresponse/countryprogressreports/2012countries/ce_CO_Narrative_Report[1].pdf. [ Links ]
3. Brenchley JM, Schacker TW, Ruff LE, Price DA, Taylor JH, Beilman GJ, et al. CD4+ T cell depletion during all stages of HIV disease occurs predominantly in the gastrointestinal tract. J Exp Med. 2004;200:749-59. [ Links ]
4. Holick MF, Chen TC. Vitamin D deficiency: a worldwide problem with health consequences. Am J Clin Nutr. 2008;87:1080S-6S. [ Links ]
5. Shinkyo R, Sakaki T, Kamakura M, Ohta M, Inouye K. Metabolism of vitamin D by human microsomal CYP2R1. Biochem Biophys Res Commun. 2004;324:451-7. [ Links ]
6. Gottfried E, Rehli M, Hahn J, Holler E, Andreesen R, Kreutz M. Monocyte-derived cells express CYP27A1 and convert vitamin D3 into its active metabolite. Biochem Biophys Res Commun. 2006;349:209-13. [ Links ]
7. Inouye K, Sakaki T. Enzymatic studies on the key enzymes of vitamin D metabolism; 1 alpha-hydroxylase (CYP27B1) and 24-hydroxylase (CYP24). Biotechnol Annu Rev. 2001;7:179-94. [ Links ]
8. Carlberg C, Seuter S. A genomic perspective on vitamin D signaling. Anticancer Res. 2009;29:3485-93. [ Links ]
9. Wang TT, Tavera-Mendoza LE, Laperriere D, Libby E, MacLeod NB, Nagai Y, et al. Large-scale in silico and microarray-based identification of direct 1,25-dihydroxyvitamin D3 target genes. Mol Endocrinol. 2005;19:2685-95. [ Links ]
10. Gauzzi MC, Purificato C, Donato K, Jin Y, Wang L, Daniel KC, et al. Suppressive effect of 1alpha,25-dihydroxyvitamin D3 on type I IFN-mediated monocyte differentiation into dendritic cells: impairment of functional activities and chemotaxis. J Immunol. 2005;174:270-6. [ Links ]
11. Hansdottir S, Monick MM, Lovan N, Powers L, Gerke A, Hunninghake GW. Vitamin D decreases respiratory syncytial virus induction of NF-kappaB-linked chemokines and cytokines in airway epithelium while maintaining the antiviral state. J Immunol. 2010;184:965-74. [ Links ]
12. Liu PT, Stenger S, Li H, Wenzel L, Tan BH, Krutzik SR, et al. Tolllike receptor triggering of a vitamin D-mediated human antimicrobial response. Science. 2006;311:1770-3. [ Links ]
13. Penna G, Amuchastegui S, Giarratana N, Daniel KC, Vulcano M, Sozzani S, et al. 1,25-Dihydroxyvitamin D3 selectively modulates tolerogenic properties in myeloid but not plasmacytoid dendritic cells. J Immunol. 2007;178:145-53. [ Links ]
14. Veldman CM, Cantorna MT, DeLuca HF. Expression of 1,25-dihydroxyvitamin D(3) receptor in the immune system. Arch Biochem Biophys. 2000;374:334-8. [ Links ]
15. Wang TT, Nestel FP, Bourdeau V, Nagai Y, Wang Q, Liao J, et al. Cutting edge: 1,25-dihydroxyvitamin D3 is a direct inducer of antimicrobial peptide gene expression. J Immunol. 2004;173:2909-12. [ Links ]
16. Saah AJ, Horn TD, Hoover DR, Chen C, Whitmore SE, Flynn C, et al. Solar ultraviolet radiation exposure does not appear to exacerbate HIV infection in homosexual men. The Multicenter AIDS Cohort Study. AIDS. 1997;11:1773-8. [ Links ]
17. Maas J, Termorshuizen F, Geskus RB, Goettsch W, Coutinho RA, Miedema F, et al. Amsterdam Cohort Study on HIV and AIDS: impact of exposure to UVR as estimated by means of a 2-year retrospective questionnaire on immune parameters in HIV positive males. Int J Hyg Environ Health. 2002;205:373-7. [ Links ]
18. Dannhauser A, van Staden AM, van der Ryst E, Nel M, Marais N, Erasmus E, et al. Nutritional status of HIV-1 seropositive patients in the Free State Province of South Africa: anthropometric and dietary profile. Eur J Clin Nutr. 1999;53:165-73. [ Links ]
19. de Luis DA, Bachiller P, Aller R, de Luis J, Izaola O, Terroba MC, et al. [Relation among micronutrient intakes with CD4 count in HIV infected patients]. Nutr Hosp. 2002;17:285-9. [ Links ]
20. Coodley GO, Coodley MK, Nelson HD, Loveless MO. Micronutrient concentrations in the HIV wasting syndrome. AIDS. 1993;7:1595-600. [ Links ]
21. Teichmann J, Stephan E, Lange U, Discher T, Friese G, Lohmeyer J, et al. Osteopenia in HIV-infected women prior to highly active antiretroviral therapy. J Infect. 2003;46:221-7. [ Links ]
22. Haug CJ, Aukrust P, Haug E, Morkrid L, Muller F, Froland SS. Severe deficiency of 1,25-dihydroxyvitamin D3 in human immunodeficiency virus infection: association with immunological hyperactivity and only minor changes in calcium homeostasis. J Clin Endocrinol Metab. 1998;83:3832-8. [ Links ]
23. Hanevold CD, Yamaguchi DT, Jordan SC. Tumor necrosis factor alpha modulates parathyroid hormone action in UMR-106-01 osteoblastic cells. J Bone Miner Res. 1993;8:1191-200. [ Links ]
24. Conesa-Botella A, Florence E, Lynen L, Colebunders R, Menten J, Moreno-Reyes R. Decrease of vitamin D concentration in patients with HIV infection on a non nucleoside reverse transcriptase inhibitor-containing regimen. AIDS Res Ther. 2010;7:40. [ Links ]
25. Van Den Bout-Van Den Beukel CJ, Fievez L, Michels M, Sweep FC, Hermus AR, Bosch ME, et al. Vitamin D deficiency among HIV type 1-infected individuals in the Netherlands: effects of antiretroviral therapy. AIDS Res Hum Retroviruses. 2008;24:1375-82. [ Links ]
26. Bang U, Kolte L, Hitz M, Dam Nielsen S, Schierbeck LL, Andersen O, et al. Correlation of increases in 1,25-dihydroxyvitamin D during vitamin D therapy with activation of CD4+ T lymphocytes in HIV-1-infected males. HIV Clin Trials. 2012;13:162-70. [ Links ]
27. Arpadi SM, McMahon D, Abrams EJ, Bamji M, Purswani M, Engelson ES, et al. Effect of bimonthly supplementation with oral cholecalciferol on serum 25-hydroxyvitamin D concentrations in HIV-infected children and adolescents. Pediatrics. 2009;123:e121-6. [ Links ]
28. McComsey GA, Kendall MA, Tebas P, Swindells S, Hogg E, Alston- Smith B, et al. Alendronate with calcium and vitamin D supplementation is safe and effective for the treatment of decreased bone mineral density in HIV. AIDS. 2007;21:2473-82. [ Links ]
29. Pauza CD, Kornbluth R, Emau P, Richman DD, Deftos LJ. Vitamin D3 compounds regulate human immunodeficiency virus type 1 replication in U937 monoblastoid cells and in monocyte-derived macrophages. J Leukoc Biol. 1993;53:157-64. [ Links ]
30. Goletti D, Kinter AL, Biswas P, Bende SM, Poli G, Fauci AS. Effect of cellular differentiation on cytokine-induced expression of human immunodeficiency virus in chronically infected promonocytic cells: dissociation of cellular differentiation and viral expression. J Virol. 1995;69:2540-6. [ Links ]
31. Locardi C, Petrini C, Boccoli G, Testa U, Dieffenbach C, Butto S, et al. Increased human immunodeficiency virus (HIV) expression in chronically infected U937 cells upon in vitro differentiation by hydroxyvitamin D3: roles of interferon and tumor necrosis factor in regulation of HIV production. J Virol. 1990;64:5874-82. [ Links ]
32. Boulerice F, Geleziunas R, Bour S, Li HL, D'Addario M, Roulston A, et al. Differential susceptibilities of U-937 cell clones to infection by human immunodeficiency virus type 1. J Virol. 1992;66:1183-7. [ Links ]
33. Biswas P, Mengozzi M, Mantelli B, Delfanti F, Brambilla A, Vicenzi E, et al. 1,25-Dihydroxyvitamin D3 upregulates functional CXCR4 human immunodeficiency virus type 1 coreceptors in U937 minus clones: NF-kappaB-independent enhancement of viral replication. J Virol. 1998;72:8380-3. [ Links ]
34. Connor RI, Rigby WF. 1 alpha,25-dihydroxyvitamin D3 inhibits productive infection of human monocytes by HIV-1. Biochem Biophys Res Commun. 1991;176:852-9. [ Links ]
35. Campbell GR, Spector SA. Hormonally active vitamin D3 (1{alpha},25-dihydroxycholecalciferol) triggers autophagy in human macrophages that inhibits HIV-1 infection. J Biol Chem. 2011;286:18890-902. [ Links ]
36. Skolnik PR, Jahn B, Wang MZ, Rota TR, Hirsch MS, Krane SM. Enhancement of human immunodeficiency virus 1 replication in monocytes by 1,25-dihydroxycholecalciferol. Proc Natl Acad Sci U S A. 1991;88:6632-6. [ Links ]
37. McMahon L, Schwartz K, Yilmaz O, Brown E, Ryan LK, Diamond G. Vitamin D-mediated induction of innate immunity in gingival epithelial cells. Infect Immun. 2011;79:2250-6. [ Links ]
38. Bergman P, Walter-Jallow L, Broliden K, Agerberth B, Soderlund J. The antimicrobial peptide LL-37 inhibits HIV-1 replication. Curr HIV Res. 2007;5:410-5. [ Links ]
39. Sun L, Finnegan CM, Kish-Catalone T, Blumenthal R, Garzino-Demo P, La Terra Maggiore GM, et al. Human beta-defensins suppress human immunodeficiency virus infection: potential role in mucosal protection. J Virol. 2005;79:14318-29. [ Links ]
40. Zapata W, Rodriguez B, Weber J, Estrada H, Quiñones-Mateu M, Zimermman P, et al. Increased Levels of Human Beta-Defensins mRNA in Sexually HIV-1 Exposed But Uninfected Individuals. Current HIV Research. 2008;6:531-8. [ Links ]
41. Levinson P, Kaul R, Kimani J, Ngugi E, Moses S, MacDonald KS, et al. Levels of innate immune factors in genital fluids: association of alpha defensins and LL-37 with genital infections and increased HIV acquisition. AIDS. 2009;23:309-17. [ Links ]
42. Yuk JM, Shin DM, Lee HM, Yang CS, Jin HS, Kim KK, et al. VitaminD3 induces autophagy in human monocytes/macrophages via cathelicidin. Cell Host Microbe. 2009;6:231-43. [ Links ]
43. Nilsson J, Boasso A, Velilla PA, Zhang R, Vaccari M, Franchini G, et al. HIV-1-driven regulatory T-cell accumulation in lymphoid tissues is associated with disease progression in HIV/AIDS. Blood. 2006;108:3808-17. [ Links ]
44. Osakwe CE, Bleotu C, Chifiriuc MC, Grancea C, Otelea D, Paraschiv S, et al. TH1/TH2 cytokine levels as an indicator for disease progression in human immunodeficiency virus type 1 infection and response to antiretroviral therapy. Roum Arch Microbiol Immunol. 2010;69:24-34. [ Links ]
45. Nevado J, Tenbaum SP, Castillo AI, Sanchez-Pacheco A, Aranda A. Activation of the human immunodeficiency virus type I long terminal repeat by 1 alpha,25-dihydroxyvitamin D3. J Mol Endocrinol. 2007;38:587-601. [ Links ]
46. Fang Y, van Meurs JB, d'Alesio A, Jhamai M, Zhao H, Rivadeneira F, et al. Promoter and 3'-untranslated-region haplotypes in the vitamin d receptor gene predispose to osteoporotic fracture: the rotterdam study. Am J Hum Genet. 2005;77:807-23. [ Links ]
47. de la Torre MS, Torres C, Nieto G, Vergara S, Carrero AJ, Macias J, et al. Vitamin D receptor gene haplotypes and susceptibility to HIV-1 infection in injection drug users. J Infect Dis. 2008;197:405-10. [ Links ]
48. Nieto G, Barber Y, Rubio MC, Rubio M, Fibla J. Association between AIDS disease progression rates and the Fok-I polymorphism of the VDR gene in a cohort of HIV-1 seropositive patients. J Steroid Biochem Mol Biol. 2004;89-90:199-207. [ Links ]
49. Ogunkolade BW, Boucher BJ, Prahl JM, Bustin SA, Burrin JM, Noonan K, et al. Vitamin D receptor (VDR) mRNA and VDR protein levels in relation to vitamin D status, insulin secretory capacity, and VDR genotype in Bangladeshi Asians. Diabetes. 2002;51:2294-300. [ Links ]
50. Torres C, Sanchez de la Torre M, Garcia-Moruja C, Carrero AJ, Trujillo Mdel M, Fibla J, et al. Immunophenotype of vitamin D receptor polymorphism associated to risk of HIV-1 infection and rate of disease progression. Curr HIV Res. 2010;8:487-92. [ Links ]













