Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Infectio
Print version ISSN 0123-9392
Infect. vol.17 no.3 Bogotá July/Sept. 2013
REPORTE DE CASO
Reporte de caso y revisión de la literatura de caso de paciente con meningoencefalitis por amebas de vida libre
María C. Vélez V. a , Ana L. Zapata S. b , Diana C. Ortiz M. b, *, Mónica Trujillo H. c , Andrea Restrepo G. c y Carlos Garcés S. c
a Servicio de Pediatría, Hospital General de Medellín, Medellín, Colombia
b Servicio de Pediatría, Hospital Pablo Tobón Uribe, Medellín, Colombia
c Servicio de Infectología pediátrica, Hospital Pablo Tobón Uribe, Medellín, Colombia +Recibido el 16 de septiembre de 2012; aceptado el 2 de junio de 2013
Resumen
Paciente de 14 años, proveniente de Apartadó (Antioquia), remitido al Hospital Pablo Tobón Uribe de Medellín por un cuadro febril agudo asociado a deterioro rápido del estado de conciencia, decantándose posteriormente como causa de su deterioro una ameba de vida libre (Naegleria fowleri) . Las amebas de vida libre son una causa etiológica poco común de meningitis, tienen un curso fulminante y requieren de un alto índice de sospecha para hacer un tratamiento oportuno.
© 2013 ACIN. Publicado por Elsevier España, S.L. Todos los derechos reservados.
PALABRAS CLAVE
Meningoencefalitis; Amebas de vida libre
Case report and literature review of a patient with meningoencephalitis from free-living amoebae
Abstract
A 14-year-old patient from Apartado (Antioquia, Colombia) was referred to Hospital Pablo Tobon Uribe in Medellin for acute febrile illness associated with headache and rapid loss of consciousness. The etiologic agent causing this deterioration was found to be a free-living amoeba ( Naegleria fowleri ). Free-living amoebae are a rare etiology for meningoencephalitis, have a fulminant course and require a high index of suspicion for early diagnosis.
© 2013 ACIN. Published by Elsevier España, S.L. All rights reserved.
KEYWORDS:
Meningoencephalitis; Free-living amoebae
Reporte de caso
Paciente de 14 años, quien ingresa al servicio de urgencias por 2 días de evolución de cefalea intensa, fiebre y alteración del estado de conciencia; no relata otros síntomas asociados.
Antecedentes personales: vacunación completa, vive solo con el hermano, es cabeza de familia. Un día antes de presentar los síntomas nadó en un charco de agua estancada con unos amigos.
En la evaluación inicial, paciente en malas condiciones generales con Glasgow 9/15, febril 38,5 ºC, FC 100 por minuto, FR 23 por minuto, hidratado al límite, pupilas isocóricas normorreactivas, cardiopulmonar normal, abdomen normal, ext. normales, piel sin lesiones. Se realizan paraclínicos, incluida punción lumbar con posterior traslado a la UCIP (tabla 1).

Se inició tratamiento con anfotericina B, rifampicina, trimetoprim sulfa y metronidazol, pero el paciente fallece a los 3 días.
Posteriormente, en el cultivo de líquido cefalorraquídeo se aisló una Naegleria fowleri como causa etiológica de la meningitis (fig. 1).
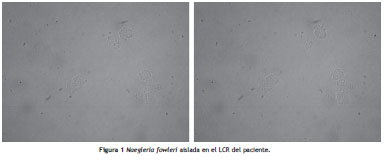
Revisión de la literatura
Las amebas de vida libre son protistas aerobios, eucariotas de varios géneros. La infección en los seres humanos con amebas de vida libre es un hecho poco frecuente que suele ser fatal, tanto en individuos sanos como en personas inmunocomprometidas 1,2.
A diferencia de otros protozoos patógenos, en estos organismos no se conocen vectores predisponentes y no hay estado portador humano 1.
Existen cuatro síndromes clínicos causados por las amebas de vida libre que infectan al hombre: 1) meningoencefalitis amebiana primaria (MAP); 2) encefalitis granulomatosa amebiana (EGA); 3) difusión de la enfermedad granulomatosa amebiana, y 4) queratitis amebiana 1 (QA).
La MAP es causada por Naegleria fowleri y ocurre más comúnmente en niños sanos y adultos jóvenes con exposición reciente en agua dulce. Constituye una enfermedad de forma aguda con un periodo de incubación muy breve. La Naegleria obtiene acceso al SNC por la invasión directa a través de la mucosa nasal y la lámina cribosa, pudiendo provocar una meningoencefalitis mortal en un plazo de 3-7 días 1,3.
La EGA causada por Acanthamoeba spp., B. mandrillaris y Sappinia es una infección subaguda o crónica que se disemina de forma hematógena de lesiones pulmonares o de la piel al sistema nervioso central (SNC), resultando en un déficit neurológico focal progresivo durante días o meses a una meningoencefalitis difusa y posteriormente la muerte, en personas inmunocomprometidas 1,4,5.
La enfermedad granulomatosa amebiana diseminada de la piel, los pulmones o los senos paranasales, pero sin infección del SNC, puede ser causada por Acanthamoeba y Balamuthia.
Por último, la Acanthamoeba spp. también puede causar una queratitis subaguda o crónica, la cual se asocia más con el uso de lentes de contacto o traumatismos corneales 1,6.
Naegleria
Es una ameba flagelada, la N. fowleri es la única especie patógena conocida en los seres humanos 4,5.
Su ciclo de vida se caracteriza por tres etapas: trofozoítos, flagelados y quistes. Los trofozoítos son la fase de reproducción del parásito y causa de enfermedad invasiva en humanos 1.
Acanthamoeba
Especies de Acanthamoeba reconocidas como patógeno para los seres humanos incluyen A. castellanii, polyphaga, A. culbertsoni, A. palestinensis, A. astronyxis, A. hatchetti, A. healyi, A. rhysodes, A. divionesis y A. griffini 4,5.
El ciclo de vida de la Acanthamoeba consiste en etapas de trofozoíto y quistes.
Los trofozoítos son la forma activa, se alimentan de bacterias y residuos del medio ambiente y permiten la reproducción, mientras que el quiste es la etapa inactiva pero resistente al medio ambiente y condiciones adversas 4,5,7.
Balamuthia
B. mandrillaris (previamente denominada como ameba Leptomyxida) es la única especie conocida de este género y fue aislada originalmente del cerebro de un mandril en 1986, el cual falleció en un zoológico de San Diego por una encefalitis 1- 3,7-9.
Sappinia
Sappinia diploidea es el patógeno en humanos más recientemente reconocido 1,4.
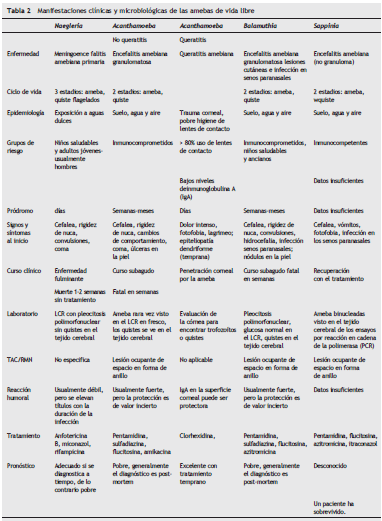
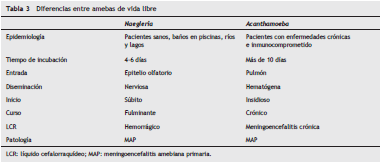
Epidemiología(tabla 2 y tabla 3)
Naegleria
N. fowleri se ha encontrado en todo el mundo en el suelo, ríos y las muestras de agua de sitios de recreo como lagos, lagunas, piscinas, estanques y canales de riego, la presencia en aguas dulces está directamente relacionada con la temperatura del agua. Es importante destacar que N. fowleri no se encuentra en el agua de mar. Los patógenos de N. fowleri son termofílicos y proliferan a temperaturas de hasta 45 ºC 1,6,10.
A pesar de la exposición de múltiples personas a aguas contaminadas con Naegleria pocos desarrollan MAP 1 .
Acanthamoeba spp .
Se ha aislado en el suelo, el agua y el aire en distintas localidades, humidificadores, desagües, aguas dulces, agua mineral embotellada, torres de enfriamiento de energía eléctrica y nuclear, centrales eléctricas, ventilación, calefacción y aire acondicionado, bañeras de hidromasaje, piscinas de hidroterapia, unidades dentales, máquinas de diálisis, lentes de contacto, secreciones pulmonares, frotis obtenidos de la mucosa nasofaríngea de pacientes con problemas respiratorios, seno maxilar, mandíbula, autoinjertos y muestras de heces 4.
La Acanthamoeba spp . tolera un rango amplio de osmolaridad, lo que le permite sobrevivir en agua destilada, los medios de cultivo de tejidos, el cuerpo de los mamíferos y el agua de mar 4,6,10.
A diferencia de la Naegleria , el crecimiento de la Acanthamoeba es inhibido por las temperaturas superiores de 35 ºC a 39 ºC 7.
Estudios serológicos han detectado anticuerpos séricos contra la Acanthamoeba en un 50% al 100% de algunas cohortes de personas sanas 1 . La EGA ocurre predominantemente en individuos inmunosuprimidos 1,4,5.
La QA se produce predominantemente en personas sanas con uso de lentes de contacto, traumatismo en la córnea o con el uso de algunas soluciones desinfectantes 1.
Balamuthia
Aunque la B. mandrillaris infecta a los animales y los seres humanos en todo el mundo, raras veces se ha aislado del suelo y de las fuentes de agua 1, puede ser transmitida por la inhalación de quistes aéreos o por diseminación hematógena de la piel al SNC o intraperitoneal 2,7,11.
En todo el mundo ha habido más de 150 casos reportados en humanos hasta la fecha, con una tasa de mortalidad muy alta 7-9. Aproximadamente 55 casos de estos han sido en Estados Unidos, con solo cuatro sobrevivientes 1.
Las infecciones se producen tanto en personas inmunocompetentes como en inmunocomprometidos 6,8,9,12,13 y la edad media de presentación de los casos es de 16 años (2-84 años).
Sappinia
El único caso humano de infección fue reportado en el año 2001 e involucró a un hombre previamente sano de 38 años de edad que desarrolló una meningoencefalitis crónica 4.
Patogénesis y hallazgos patológicos(tabla 2 y tabla 3)
Las amebas de vida libre ingresan a la cavidad nasal por inhalación o ingestión de agua contaminada con trofozoíos o quistes 5.
Naegleria
Se produce una meningoencefalitis difusa, que afecta a la cortical y la materia gris, la ameba penetra en el epitelio respiratorio, así como el plexo nervioso submucoso y la placa cribiforme hasta tener acceso al SNC 1,6.
La proteína nfa1 media el contacto entre seudópodos N. fowleri y las células diana, y parece ser un factor de virulencia importante para este organismo. Otros factores potenciales de virulencia incluyen la producción de óxido nítrico, proteínas formadoras de poros y el calcio mediado por la resistencia al complemento 1.
Acanthamoeba
La apariencia histológica de la EGA por Acanthamoeba spp. es la necrosis del parénquima cerebral y formación de granulomas, aunque la reacción tisular granulomatosa puede no estar presente en individuos inmunocomprometidos 1.
La localización perivascular de trofozoítos y quistes amebianos sugiere una diseminación hematógena de Acanthamoeba en el SNC 1,5.
El aspecto histológico de la QA es similar a la de las infecciones por Acanthamoeba de otros órganos. Tanto los quistes y trofozoítos amebianos se encuentran dentro de la córnea 1.
La infección por Acanthamoeba comienza con trofozoítos utilizando una proteína manosa para adherirse a una glicoproteína de manosa en el epitelio corneal. Estas glicoproteínas manosas a menudo se aumentan después de un traumatismo corneal y con el uso de lentes de contacto. Después de la adhesión, la Acanthamoeba media la muerte celular de la córnea por una variedad de mecanismos, incluyendo la fagocitosis, inducción de la apoptosis y citólisis directa 1.
Varias bacterias, como Legionella spp., Chlamydia spp., Pseudomonas aeruginosa y Burkholderia spp., pueden sobrevivir intracelularmente en la ameba, lo que las puede hacer resistentes al manejo antibiótico 1.
Balamuthia y Sappinia
En la balamutiasis, la histopatología de las lesiones en el parénquima cerebral o de las meninges puede variar de una respuesta inmune neutrofílica aguda principalmente a una respuesta granulomatosa crónica 1.
Las lesiones macroscópicas son de tipo necrótico, hemorrágicas, múltiples, intraparenquimatosas 3.
Manifestaciones clínicas(tabla 2 y tabla 3)
Naegleria
La MAP es rápidamente progresiva y casi siempre fatal, suele presentarse en niños sanos y adultos jóvenes, la aparición de los síntomas ocurre generalmente dos a cinco días después de la exposición de forma recreativa en aguas dulces, el periodo de incubación es hasta de dos semanas 1,5,12,14 (2-15 días).
Tempranamente en la enfermedad y de acuerdo con la participación de los nervios olfatorios, el paciente puede notar cambios en el sabor o el olor, seguido por la aparición repentina de fiebre, anorexia, náuseas y vómitos.
Los pacientes pueden progresar rápidamente hasta el coma, y la muerte en una semana después de la aparición de la enfermedad ocurre en el 95% de los casos 1,6. La causa en la mayoría de los pacientes se relaciona con el marcado aumento de la presión intracraneana debido al edema cerebral 6.
Acanthamoeba
En contraste con la MAP, la EGA por Acanthamoeba spp. es una enfermedad de individuos inmunosuprimidos y debilitados, tiene un inicio insidioso y se presenta con déficit neurológicos focales, y la progresión de las manifestaciones se observa después de una semana a meses de la exposición 13,14.
La duración de la enfermedad desde la presentación hasta la muerte es de 7 a 120 días 1 (media de 39 días).
Las lesiones cutáneas pueden ser ulcerosas, abscesos nodulares o subcutáneos, en las biopsias se demuestran granulomas amebianos y en ocasiones se presentan sin compromiso del SNC, sobre todo en pacientes con SIDA 14.
La QA es una infección generalmente unilateral, amenaza la vista y lleva a la ulceración de la córnea, ceguera y la enucleación si no se trata rápidamente. Con frecuencia se diagnostica erróneamente como queratitis herpética, bacteriana o fúngica, dando lugar a un retraso en el tratamiento definitivo 1,4.
Los síntomas comienzan con una sensación de cuerpo extraño en el ojo afectado de forma unilateral, seguido de dolor intenso, edema bipalpebral, ojo rojo, fotofobia, epifora, blefaroespasmo, conjuntivitis y visión borrosa 4,7.
Balamuthia y Sappinia
La Balamuthia puede causar enfermedades en los inmunocompetentes e inmunocomprometidos. La meningoencefalitis granulomatosa subaguda o crónica es la presentación clínica más frecuente, lo que resulta en la muerte en una semana a varios meses después del inicio de los síntomas neurológicos 10.
Los signos y síntomas incluyen fiebre, cefalea, náuseas, vómitos, convulsiones, signos neurológicos focales, cambios de personalidad, hipertensión endocraneana, convulsiones y coma 8, además de hemiparesias, papiledema, inflamación meníngea, afasias, ataxia, parálisis de nervios craneales 3,10,11(principalmente III-VI par).
Los pacientes con balamutiasis a menudo tienen otras enfermedades concomitantes, como diabetes, SIDA, insuficiencia renal, alcoholismo crónico y el antecedente de uso de drogas intravenosas 1,13.
Solo un caso de infección humana por Sappinia se ha informado a nivel mundial, por lo que no está claro si las manifestaciones clínicas observadas en este paciente se reproducirán en las infecciones futuras. Este paciente era un hombre previamente sano, que tenía un antecedente de sinusitis y posteriormente presentó una masa del lóbulo temporal izquierdo, la masa extirpada mostró una inflamación necrosante hemorrágica, el paciente sobrevivió 1,4.
Naegleria
La MAP debería incluirse en el diagnóstico diferencial de los niños y jóvenes adultos con sospecha de meningitis o meningoencefalitis bacteriana con exposición reciente a los lugares de agua dulce 1.
La presión del LCR puede ser elevada, es hemorrágico, especialmente de forma tardía en el curso de la enfermedad. El conteo celular en el LCR puede ser bajo al inicio de la enfermedad, pero más tarde los glóbulos blancos van desde 400-26.000, con predominio de neutrófilos. El nivel de glucosa en LCR es normal o bajo, hiperproteinorraquia y con ausencia de bacterias 1,5,14.
Los trofozoítos de Naegleria son generalmente destruidos por el procedimiento de fijación para la tinción de Gram, por lo cual se debe buscar un montaje húmedo para identificar microscópicamente los trofozoítos móviles 1,14.
Las herramientas de diagnóstico más recientes para las infecciones por Naegleria incluyen métodos moleculares como los anticuerpos monoclonales y la reacción en cadena de polimerasa 1.
Acanthamoeba
La biopsia cerebral es el método diagnóstico más confiable porque la Acanthamoeba spp. rara vez se ha aislado en el LCR 1, se pueden observar trofozoítos y quistes en los cortes del encéfalo o raspados corneales 14.
El diagnóstico diferencial en estos pacientes es muy amplio e incluye la toxoplasmosis, el linfoma primario del SNC, la tuberculosis, la neurocisticercosis, nocardiosis, aspergilosis, absceso cerebral bacteriano y secundario a una EGA por Balamuthia 1.
Las infecciones en la piel están a menudo presentes en pacientes con la EGA. Por lo tanto, se deben realizar biopsias de los nódulos en la piel o úlceras 1.
El diagnóstico de la QA se basa en una alta sospecha clínica y la demostración de Acanthamoeba en el tejido corneal o muestras de biopsias, mediante un examen histopatológico, el cultivo, o los mecanismos moleculares como la PCR o ADN 1,4.
El estudio corneal inicial, la tinción de Gram y los cultivos se pueden confundir debido a que muchos casos están asociados a coinfecciones con Staphylococcus epidermidis , Staphylococcus aureus, Streptococcus ß-hemolítico, o Propionibacterium 1.
Tratamiento (tabla 2)
Naegleria
El tratamiento óptimo y la duración de este para la MAP no ha sido bien definido y pocos pacientes han sobrevivido a esta enfermedad 5.
La anfotericina B es la piedra angular de la terapia de la MAP por Naegleria . Muchos de los pacientes que han sobrevivido y han tenido bien documentada la MAP recibieron altas dosis sistémica e intratecal de anfotericina B. Otros medicamentos adicionales utilizados en los pacientes que se han recuperado de la MAP incluyen miconazol sistémico e intratecal, fluconazol, rifampicina, sulfas y macrólidos, estos últimos parecen ser menos eficaces 1,14.
Los pacientes con sospecha de MAP deben recibir altas dosis de anfotericina B como parte de su régimen empírico anti-infeccioso; la anfotericina intratecal puede tener un papel adicional en los casos confirmados o sospechosos.
Acanthamoeba (encefalitis granulomatosa amebiana y enfermedad diseminada )
Los datos son limitados con respecto al tratamiento de la EGA 4.
Entre los casos de los pacientes tratados con éxito por GAE y la enfermedad diseminada por Acanthamoeba , todos excepto dos fueron dados por una combinación de antimicrobianos que incluyen el trimetoprima-sulfametoxazol, flucitosina y sulfadiazina; la penicilina G y cloramfenicol; sulfadiacina pirimetamina y fluconazol entre otros 1,4,14.
Queratitis por Acanthamoeba
El tratamiento de la QA ha sido notablemente más exitoso que el de la EGA o MAP, con tasas de éxito que van desde 75% a 84%.
La clorhexidina tópica (0,02%) como agentes catiónicos antisépticos y polihexametileno biguanida (PHMB, 0,02%), neomicina-polimixina B-gramicidina, son el pilar del tratamiento de la QA 1,5,14.
Balamuthia
En Estados Unidos, cuatro supervivientes han sido reportados.
Tres de los pacientes que sobrevivieron fueron tratados con flucitosina, pentamidina, sulfadiazina, fluconazol y un macrólido (azitromicina o claritromicina); el régimen de tratamiento del cuarto paciente es desconocido 1,8. No existen reportes respecto a la duración del tratamiento 8.
Sappinia
El único paciente con una infección por Sappinia fue tratado con azitromicina, pentamidina, itraconazol y flucitosina y sobrevivió 1.
Prevención
Dada la naturaleza ubicua de la Acanthamoeba y B. mandrillaris , los esfuerzos de prevención primaria probablemente serán difíciles. La MAP se produce tan raramente que la vigilancia activa de N. fowleri en zonas de baño público probablemente no se justifica como una medida de salud pública 1.
N. fowleri es sensible al cloro y puede ser controlado en las piscinas mediante la cloración adecuada 1,4.
La QA asociada con el uso de lentes de contacto es generalmente prevenible mediante medidas de higiene de las lentes de contacto.
Conclusiones
La encefalitis causada por las amebas de vida libre es relativamente rara 4.
La clínica de esta entidad es a menudo confundida con la expresada por las meningoencefalitis de origen viral o bacteriano y en la mayoría de los casos el diagnóstico se realiza post-mortem. Al sospecharse es imperativo examinar el líquido cefalorraquídeo en fresco, para evidenciar la presencia de amebas móviles 6,13.
El pronóstico de los pacientes con enfermedad neurológica causada por amebas de vida libre es generalmente malo, hasta ahora pocos pacientes han sobrevivido a la enfermedad 13.
* Autor para correspondencia.
Correo electrónico: dianacortizm@gmail.com (D.C. Ortiz M.).
0123-9392/$ - see front matter © 2013 ACIN. Publicado por Elsevier España, S.L. Todos los derechos reservados.
Bibliografía
1. Koshy AA, Blackburn BG, Singh U. Free living amebas. Mandell, Douglas, and Bennett's principles and practice of infectious diseases, 7th ed. Cap. 274. Filadelfia: Churchill Livingstone, Elsevier; 2009. p. 3427-36. [ Links ]
2. Cuevas M, Smoje G, Jofré L, Ledermann W, Noemí I, Berwart F, et al. Meningoencefalitis granulomatosa por Balamuthia mandrillaris : reporte de un caso y revisión de la literatura. Rev Chil Infect. 2006;23:237-42. [ Links ]
3. Campos P, Cabrera J, Gotuzzo E, Guillén D. Compromiso neurológico en amibiasis de vida libre. Rev Neurol. 1999;29:316-8. [ Links ]
4. Visvesvara GS, Moura H, Schuster FL. Pathogenic and opportunistic free-livingamoebae: Acanthamoeba spp., Balamuthia mandrillaris, Naegleria fowleri, and Sappinia diploidea . Federation of European Microbiological Societies Immunol Med Microbiol. 2007;50:1-26. [ Links ]
5. Weisse ME, Arnoff SC. Primary amebic meningoencephalitis. 18th ed. Chapter 277. Kliegman: Nelson textbook of pediatrics; 2007 [ Links ]
6. Petit F, Vilchez V, Torres G, Molina O, Dorfman S, Mora E, et al. Meningoencefalitis amebiana primaria. Comunicación de dos nuevos casos Venezolanos. Arq Neuropsiquiatr. 2006;64:1043-6. [ Links ]
7. Jercic MI. Amebas de vida libre género Acanthamoeba. Retrato microbiológico. Rev Chil Infect. 2007;24:491-2. [ Links ]
8. Cary LC, Maul E, Potter C, Wong P, Nelson PT, Given II C, et al. Balamuthia mandrillaris Meningoencephalitis: Survival of a pediatric patient. Pediatrics. 2010;125:699-703. [ Links ]
9. Glaser C, Schuster F, Yagi S, Gavali S, Bollen A, Raghavan R, et al. Balamuthia amebic encephalitis California, 1999-2007. Morbidity and mortality weekly report of the center for disease control and prevention (CDC). 2008;57:768-71. [ Links ]
10. Schuster FL, Honarmand S, Visvesvara GS, Glaser CA. Detection of antibodies against free-living amoebae Balamuthia mandrillaris and Acanthamoeba species in a population of patients with encephalitis. CID. 2006;42:1260-5. [ Links ]
11. Tavares M, Correia da Costa JM, Stirling Carpenter S, Santos LA, Caldas A, Aguiar A, et al. Diagnosis of first case of Balamuthia amoebic encephalitis in Portugal by immunofluorescence and PCR. JCM. 2006;44:2660-3. [ Links ]
12. Deetz TR, Sawyer MH, Billman G, Schuster FL, Govinda S. Visvesvara GS. Successful treatment of Balamuthia amoebic encephalitis: Presentation of 2 cases. CID. 2003;37:1304-12. [ Links ]
13. Rodríguez R, Méndez O, Molinaa O, Luzardo G, Martínez AJ, Visvesvara GS, et al. Infección del sistema nervioso central por amebas de vida libre: comunicación de tres nuevos casos venezolanos. Rev Neurol. 1998;26:1005-8. [ Links ]
14. Pickering LK. Red book – enfermedades infecciosas en pediatría. Meningoencefalitis y queratitis amebiana. Edición 27. Sección 3. Buenos Aires: Editorial Médica Panamericana; 2007. p. 224-6. [ Links ]













