Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Infectio
versión impresa ISSN 0123-9392
Infect. vol.17 no.3 Bogotá jul./set. 2013
REPORTE DE CASO
Encefalitis rábica humana secundaria a mordedura por gato infectado por un virus rábico de origen silvestre
Marlon Mauricio Bustos Claro, Albert Alejandro Ávila Álvarez, Elkin José Beltrán Carrascal, Leonar Giovanni Aguiar Martínez, Eugenio Meek Benigni, Andrés Felipe Prieto Beltrán y Juan Alejandro Méndez Ayala
Pontificia Universidad Javeriana, Hospital Universitario San Ignacio, Bogotá, D.C., Colombia
Recibido el 16 de septiembre de 2012; aceptado el 2 de junio de 2013
Resumen
La rabia es una enfermedad viral zoonótica, producida por un virus del genero Lyssavirus de la Familia Rhabdoviridae, cuya principal fuente de transmisión es la mordedura de animales a humanos. Es una enfermedad fatal y se han descrito casos por ciclos urbanos y rurales. El caso que reportamos es el de una joven de 22 años, quien ingresa por un cuadro de dolor de características neuropáticas en el miembro superior derecho, con antecedente de mordedura por un gato de varios meses atrás, hospitalizada por el servicio de Neurología por sospecha de lesión de plejo braquial, con resonancia de columna cervical y líquido cefalorraquídeo (LCR) normales, quien posteriormente presenta deterioro clínico tórpido a un proceso encefalopático que en pocos días la llevó a la muerte. Se confirmó que la paciente presentó una encefalitis por un virus de rabia.
Expondremos cómo fue el manejo de la paciente y todos los nexos epidemiológicos.
© 2013 ACIN. Publicado por Elsevier España, S.L. Todos los derechos reservados.
PALABRAS CLAVE
Rabia; Encefalitis; Lyssavirus; Zoonosis; Colombia
Encephalitis Due to Rabies Secondary to the Bite of a Cat Infected With a Rabies Virus of Silvester Origen
Abstract
Rabies is a zoonotic viral disease, caused by a virus of the genus Lyssavirus of the Rhabdoviridae family. Its main source is transmission from animals to humans bite. The disease is fatal and has been reported to occur in rural and urban cycles. This reported case is a 22-year old, who was admitted with symptoms of neuropathic pain in the right arm, with a history of being bitten by a cat a few months earlier. The patient was hospitalized in the Neurology Department for suspected brachial plexopathy, and normal spinal MRI and cerebrospinal fluid (CSF) were found. The patient subsequently presented encephalopathic decline that resulted in death within a few days. It was confirmed that the patient had encephalitis due to the rabies virus. We present the management of the patient and all epidemiological links.
© 2013 ACIN. Published by Elsevier España, S.L. All rights reserved.
KEYWORDS:
Rabies; Encephalitis; Lyssavirus; Zoonoses; Colombia
Introducción
La rabia está presente en todos los continentes y es endémica en la mayoría de los países africanos y asiáticos 1. Es una grave enfermedad viral zoonótica transmitida por un virus ARN neurotrópico perteneciente al género Lyssavirus de la familia Rhabdoviridae 1. El género está compuesto hasta ahora por 12 especies de lyssavirus: el virus de la rabia clásico y los virus relacionados con el virus de la rabia, incluyendo el virus del murciélago Lagos, el virus Mokola, virus Duvenhage, Lyssavirus de murciélagos europeos 1 y 2, Lyssavirus del murciélago australiano, virus Aravan, virus Khujand, virus Irkut, virus del murciélago caucásico del oeste, virus Shimoni y el virus Bokelho 1,2. La enfermedad puede desarrollarse por cualquiera de estos virus. En la mayoría de los casos reportados el responsable es el virus de la rabia clásico, el cual tiene distribución mundial. En América, los murciélagos son reservorio únicamente del virus de la rabia clásico, mientras que en el resto del mundo son reservorio para los demás Lyssavirus 2.
El virus es casi siempre fatal después de la aparición de síntomas neurológicos 3. Se estima que 55.000 casos de muerte por rabia se presentan cada año en los seres humanos en todo el mundo, alrededor del 56% se producen en Asia y un 44% en África, de estos la mayoría de los casos son por mordedura de perros infectados 3. El período de incubación es variable y usualmente está en un rango de 30 a 90 días, pero existen reportados casos extremos desde 7 días hasta 6 años 4,5.
La rabia en Suramérica presenta dos ciclos de transmisión: urbana y silvestre. En el ciclo urbano el perro es el reservorio principal, y en el ciclo silvestre existen varias especies potencialmente transmisores de rabia en donde se incluyen los murciélagos y los zorros 6. En Colombia las principales fuentes de infección en el ciclo urbano son los perros y los gatos, donde el principal ciclo de transmisión es perro a perro. En cambio en el ciclo silvestre, el murciélago es el agente principal de transmisión 6. El virus implicado en la transmisión perro a perro y perro a zorro es el virus de la rabia clásico variante 2 (70% de los casos de rabia canina) 6. La transmisión silvestre se da principalmente por murciélagos y zorros, donde se ha visto una gran variabilidad en la clase de virus: variante 3 (murciélago hematófago), variante 4 (murciélago insectívoro), variante 5 (murciélago hematófago) y variante 8 (zorrillo) 6,7.
La eliminación del virus en su ciclo urbano es factible si se toman medidas preventivas para evitar las fuentes de infección para los seres humanos 7. En Colombia, 11.031 casos de rabia urbana fueron reportados entre enero del año 1992 y diciembre del año 2005, de los cuales 51 correspondieron a rabia humana 8, y para el período 2005 a 2010 se han confirmado al Sistema Nacional de Vigilancia en Salud Pública (SIVIGILA) 16 casos de rabia humana.
Caso clínico
Se trata de una paciente de 22 años de edad previamente sana quien consulta al servicio de urgencias por presentar un cuadro de 8 días de cefalea hemicraneana, tipo pulsátil, con náuseas y fotofobia, que empeoraba con la actividad y mejoraba con el reposo. También refería dolor en el miembro superior derecho que inició primero en la mano y luego ascendió comprometiendo toda la extremidad de forma simétrica. Describía que el dolor empeoraba con el movimiento y en las horas previas lo asocia a presencia de parestesias y disestesias. Inicialmente fue valorada por el servicio de Neurología, quienes decidieron hospitalizarla con diagnóstico de probable plexitis braquial. Se le realizó punción lumbar e imágenes de columna cervical con resultados normales, por lo que iniciaron manejo con gabapentin para el dolor. Durante los días de estancia, tuvo vigilancia neurológica estricta, llamó la atención que, 2 días previos al egreso, presentó un episodio de parasomnia, con sensación de sueños vívidos, pero se consideró efecto adverso de medicación. Después de 7 días de hospitalización y resolución completa de su cuadro clínico, se consideró dar egreso.
Una semana después presentó fiebre, disfagia, disartria, dificultad para deglutir, hiporexia, sialorrea, hemiparesia derecha y espasmos musculares generalizados. El cuadro progresó rápidamente en cuestión de horas a un estado de coma, con postura de decorticación, con importante sialorrea y espasmos severos a nivel cervical y de musculatura orofaríngea. Presentaba rigidez nucal con respuestas plantares extensoras bilaterales, por lo que se sospechó un proceso encefálico de tipo infeccioso. Se decidió realizar intubación y ventilación mecánica en sala de reanimación de urgencias. La tomografía computarizada de cerebro era normal, el estudio citoquímico del líquido cefalorraquídeo no mostró anormalidades. Dada la sospecha clínica se decide realizar interrogatorio dirigido con los familiares para investigar antecedentes que impliquen potencial exposición a la rabia, y su familia confirmó que la paciente había sufrido una mordedura por un gato en la mano derecha 3 meses antes, pero no había consultado a un centro médico por este motivo. Además, la abuela también había sido mordida por el mismo gato, quien falleció 30 días antes al parecer por un cuadro polineuropático y síntomas de tallo, con diagnóstico final de síndrome de Guillain-Barré. El gato pertenecía a la familia y estaba vacunado contra la rabia, pero se dedicaba a cazar murciélagos.
Se inició el protocolo de Milwaukee el mismo día ante la alta probabilidad clínica (7 días después del inicio de los síntomas), el cual consiste en inducir un coma terapéutico con infusiones de ketamina y midazolam más terapia antiviral con amantadina y aciclovir 9. Los anticuerpos antirrábicos en suero y las improntas de córnea para rabia fueron negativos.
La sedación se detuvo al tercer día después del inicio del protocolo de Milwaukee, porque la paciente presentó episodios de hipotermia con bradicardia e hipotensión. Se solicitó una tomografía cerebral simple, la cual mostró marcado edema cerebral difuso y hemorragia subaracnoidea asociada (fig. 1A). Herniaciones transtentorial ascendente y amigdalina cerebelosa bilateral. Posteriormente la paciente presenta fibrilación ventricular y asistolia, motivo por el cual fallece.
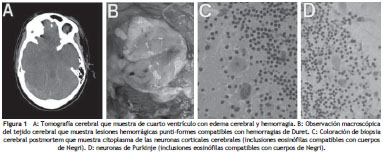
Durante la necropsia se identificaron surcos de presión en el uncus del hipocampo y en las amígdalas cerebelosas, en las cuales se evidenció encefalomalacia y hemorragia. A nivel del mesencéfalo fueron evidentes lesiones hemorrágicas puntiformes compatibles con hemorragias de Duret (fig. 1B).
Al examen microscópico, los cortes de cerebro mostraron congestión vascular importante con presencia focal de manguitos perivasculares y presencia de nódulos gliales y gliosis con edema del parénquima cerebral. Existían cambios focales de neuronofagia. Se identificaron a nivel del citoplasma de las neuronas corticales cerebrales, en hipocampo y en las neuronas de Purkinje, inclusiones eosinófilas compatibles con cuerpos de Negri (fig. 1C y 1D). Con los hallazgos anatomo-patológicos se confirmó el diagnóstico de encefalitis rábica y se consideró como causa primaria de muerte la herniación cerebral secundaria a hipertensión endocraneana. La inmunofluorescencia directa (IFD) fue positiva para el virus de la rabia y la prueba biológica en ratones también fue positiva. Se identificó la variante antigénica 4, la cual está asociada a murciélagos insectívoros. En este caso la cadena de transmisión murciélago-gato-humano fue desencadenada por el gato, que tenía hábitos de cazador de murciélagos.
La investigación de salud pública encontró que ocho trabajadores de la salud en el hospital habían estado expuestos, ya sea a través de las membranas mucosas o piel no intacta con fluidos infecciosos, tales como la saliva, el líquido cefalorraquídeo o las lágrimas. Los ocho recibieron terapia de profilaxis post-exposición con una dosis única por vía intramuscular (40 UI/kg) de globulina humana inmune a la rabia. Además, identificaron 32 contactos sociales (compañeros de estudio y amigos) clasificados como exposición grave, recibiendo tratamiento completo post-exposición (globulina humana inmune a la rabia y las 5 dosis de la vacuna), sin efectos adversos notificados.
Conclusión
La rabia sigue siendo un problema importante de salud pública. Existe la necesidad de una vigilancia continua, educación de los profesionales de la salud y prevención temprana con profilaxis posterior a la exposición rábica cuando esté indicada. Estas medidas han demostrado ser eficaces en la prevención de rabia humana 10,11. Se debe insistir en la vacunación en nuestro medio de todo animal doméstico que pueda estar en contacto con murciélagos, ya que la expansión de las grandes ciudades los pone más en contacto con el ciclo rural del virus, por lo que se debe educar a los dueños de los animales domésticos en evitar el contacto con murciélagos 12,13. Además, deben hacerse campañas educativas sobre los murciélagos insectívoros que generalmente existen en las ciudades, y estar atentos a cambios en el comportamiento de estos, tales como vuelos diurnos o encontrarlos en el suelo y con comportamientos agresivos, porque probablemente puedan estar infectados 14,15.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
Agradecimientos
Agradecemos al Ministerio de Salud y Protección Social y al laboratorio de virología del Instituto Nacional de Salud de Colombia por su valiosa colaboración en la elaboración de este artículo.
* Autor para correspondencia.
Correo electrónico: Albert.avila@javeriana.edu.co (A.A. Ávila Álvarez).
0123-9392/$ - see front matter © 2013 ACIN. Publicado por Elsevier España, S.L. Todos los derechos reservados.
Bibliografía
1. Gould AR, Hyatt AD, Lunt R, Kattenbelt JA, Hengstberger S, Blacksell SD. Characterisation of a novel lyssavirus isolated from Pteropid bats in Australia. Virus Res. 1998;54:165-87. [ Links ]
2. Calisher CH, Ellison JA. The other rabies viruses: The emergence and importance of lyssaviruses from bats and other vertebrates. Travel Med Infect Dis. 2012;10:69-79. [ Links ]
3. Knobel DL, Cleaveland S, Coleman PG, Fevre EM, Meltzer MI, Miranda ME, et al. Re-evaluating the burden of rabies in Africa and Asia. Bull World Health Organ. 2005;83:360-8. [ Links ]
4. Jackson AC. Update on rabies. Curr Opin Neurol. 2002;15:327-31. [ Links ]
5. Hemachudha T, Laothamatas J, Rupprecht CE. Human rabies: a disease of complex neuropathogenetic mechanisms and diagnostic challenges. Lancet Neurol. 2002;1:101-9. [ Links ]
6. Paez A, Nunez C, Garcia C, Boshell J. Molecular epidemiology of rabies epizootics in Colombia: evidence for human and dog rabies associated with bats. J Gen Virol. 2003;84(Pt 4):795-802. [ Links ]
7. Denduangboripant J, Wacharapluesadee S, Lumlertdacha B, Ruankaew N, Hoonsuwan W, Puanghat A, et al. Transmission dynamics of rabies virus in Thailand: implications for disease control. BMC Infect Dis. 2005;5:52. [ Links ]
8. Paez A, Velasco-Villa A, Rey G, Rupprecht CE. Molecular epidemiology of rabies in Colombia 1994-2005 based on partial nucleoprotein gene sequences. Virus Res. 2007;130:172-81. [ Links ]
9. Jackson AC. Current and future approaches to the therapy of human rabies. Antiviral Res. 2013;99:61-7. [ Links ]
10. Guía práctica para la atención de personas agredidas por un animal potencialmente transmisor de rabia. Grupo de Zoonosis. Bogotá: Instituto Nacional de Salud, Ministerio de la Protección Social; 2009. [ Links ]
11. Carreño J, Domínguez M. Mordedura humana y por animales. Guías para manejo de urgencias. 3.ª ed. Bogotá: Ministerio de la Protección Social de Colombia; 2009. p. 113-25. [ Links ]
12. Kuzmin IV, Rupprecht CE. 6-Bat Rabies. En: Jackson AC, Wunner WH, editores. Rabies. 2.ª ed. Oxford: Academic Press; 2007. p. 259-307. [ Links ]
13. Morikawa VM, Ribeiro J, Biondo AW, Fellini A, Bier D, Molento MB. Cat infected by a variant of bat rabies virus in a 29-year disease-free urban area of southern Brazil. Rev Soc Bras Med Trop. 2012;45:255-6. [ Links ]
14. Favic M, Yung PV, Pavletic BC, Ramirez VE, De Mattos C, De Mattos CA. Rol de los murciélagos insectívoros en la transmisión de la rabia en Chile. Archivos de medicina veterinaria. 157. [ Links ] [ Links ]













